바륨
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
바륨은 부드럽고 은백색을 띠는 알칼리 토금속으로, 공기 중에서 산화되어 금속 광택을 잃는다. 화학적으로 마그네슘, 칼슘, 스트론튬과 유사하지만 반응성이 더 크며, +2의 산화수 상태를 가진 화합물을 형성한다. 바륨은 진공관의 게터, 석유 시추액, 페인트 및 바니시, X선 조영제, 불꽃놀이 등에 사용된다. 바륨 화합물 중 수용성은 독성이 있으며, 칼륨 채널을 억제하여 신경계에 영향을 미칠 수 있다.
더 읽어볼만한 페이지
- 바륨 - 상부위장관조영술
상부위장관조영술은 X선을 이용하여 식도, 위, 십이지장 등 상부 위장관의 외형과 기능을 검사하는 방법으로, 바륨 조영제를 사용하여 식도 역류, 궤양, 종양, 위장관 운동 이상 등을 진단하며, 바륨 삼킴 검사, 바륨 식사 검사 등 다양한 종류가 있다. - 바륨 - 바륨 동위 원소
바륨은 원자 번호 56번의 화학 원소로, 자연 상태에서 7개의 안정 동위 원소와 여러 방사성 동위 원소 및 이성질핵을 가지며, 특히 바륨-138이 가장 풍부하고 방사성 동위 원소는 핵의학, 방사성 물질 분석, 그리고 핵분열 사고 시 환경 오염 지표 등으로 활용된다. - 알칼리 토금속 - 마그네슘
마그네슘은 엽록소 구성 성분으로 광합성에 기여하고, 인체 내 뼈 대사에 중요한 역할을 하며, 가볍고 강도가 높아 다양한 산업 분야에서 활용되는 금속 원소이다. - 알칼리 토금속 - 칼슘
칼슘은 석회에서 유래된 은백색 금속 원소로, 다양한 화합물을 형성하며 산업 및 생체 내에서 중요한 역할을 하고, 섭취량에 따라 건강에 영향을 미친다. - 환원제 - 아연
아연은 청회색 금속으로, 적당한 반응성을 지닌 환원제이며, 내식성이 뛰어나 도금에 사용되고, 합금의 주요 성분이며, 인체 필수 미량 원소이지만 과다 섭취 시 독성을 나타낸다. - 환원제 - 칼륨
칼륨은 은백색의 무른 알칼리 금속으로 반응성이 매우 높고 생물학적으로 중요한 전해질이며, 비료 생산을 비롯한 다양한 산업 분야에서 활용되지만 물과의 격렬한 반응 및 폭발성 과산화물 생성 가능성으로 취급 시 주의가 필요하며, 자연계에 세 가지 동위원소로 존재한다.
| 바륨 | |
|---|---|
| 기본 정보 | |
 | |
| 원소 이름 | 바륨 |
| 영어 이름 | Barium |
| 원소 기호 | Ba |
| 원자 번호 | 56 |
| 분류 | 알칼리 토금속 |
| 속하는 족 | 2 |
| 속하는 주기 | 6 |
| 블록 | s |
| 색상 | 은백색 |
| 표준 원자량 | 137.33 |
| 전자 배치 | Xe 6s2 |
| 껍질 당 전자 수 | 2, 8, 18, 18, 8, 2 |
| 상태 | 고체 |
| 물리적 성질 | |
| 밀도 | 3.51 g/cm3 |
| 액체 밀도 | 3.338 g/cm3 |
| 녹는점 | 999.4 K (726.2 °C) |
| 끓는점 | 1910 K (1637 °C) |
| 융해열 | 7.12 kJ/mol |
| 기화열 | 140.3 kJ/mol |
| 열용량 | 28.07 J/(mol·K) |
| 증기압 | 911 K: 1 Pa 1038 K: 10 Pa 1185 K: 100 Pa 1388 K: 1 kPa 1686 K: 10 kPa 2170 K: 100 kPa |
| 결정 구조 | 체심 입방정계 |
| 자기 정렬 | 상자성 |
| 전기 저항 | 332 nΩ·m (20 °C) |
| 열전도율 | 18.4 W/(m·K) |
| 열팽창 | 20.6 µm/(m·K) (25 °C) |
| 소리 속도 | 1620 m/s (막대, 20 °C) |
| 영률 | 13 GPa |
| 전단 탄성 계수 | 4.9 GPa |
| 부피 탄성 계수 | 9.6 GPa |
| 모스 경도 | 1.25 |
| 원자 정보 | |
| 산화 상태 | 2 (강염기성 산화물) |
| 전기 음성도 | 0.89 (폴링 척도) |
| 이온화 에너지 | 1차: 502.9 kJ/mol 2차: 965.2 kJ/mol 3차: 3600 kJ/mol |
| 원자 반지름 | 215 pm |
| 공유 반지름 | 215 ± 11 pm |
| 반데르발스 반지름 | 268 pm |
| 동위 원소 | |
| 동위 원소 | 질량수: 130, 존재비: 0.106%, 반감기: (0.5-2.7)x1021년, 붕괴 방식: εε, 붕괴 에너지: 2.620 MeV, 붕괴 생성물: Xe 질량수: 132, 존재비: 0.101%, 반감기: >3x1020년, 붕괴 방식: β+β+, 붕괴 에너지: 0.846 MeV, 붕괴 생성물: Xe 질량수: 133, 존재비: 인공, 반감기: 10.51년, 붕괴 방식: ε, 붕괴 에너지: 0.517 MeV, 붕괴 생성물: Cs 질량수: 134, 존재비: 2.417% 질량수: 135, 존재비: 6.592% 질량수: 136, 존재비: 7.854% 질량수: 137, 존재비: 11.23% 질량수: 138, 존재비: 71.7% |
| 기타 | CAS 등록 번호: 7440-39-3 |
2. 성질
단체 바륨은 은백색의 무른 금속이며, 다른 알칼리 토류 금속 원소와 유사한 성질을 나타내지만 칼슘이나 스트론튬에 비해 반응성이 높다. 화학적 성질은 +2가의 희토류 이온과도 유사하다.
바륨염은 독성이 있으며, 섭취하면 칼륨 채널을 바륨 이온이 저해하여 신경계에 영향을 미친다. 따라서 바륨염(바륨 화합물)은 한국의 독극물 및 마약류 관리에 관한 법률(지정령)에서 독극물로 지정되어 있다(금속 바륨은 지정되어 있지 않으며, 황산바륨 등 지정되지 않는 물질도 있다).
2. 1. 물리적 성질
바륨은 부드럽고 은백색의 금속이며, 초순수 상태에서는 약간 황금빛을 띤다.[1] 공기 중에서 산화되면서 빠르게 은백색이 사라지고, 산화물을 포함하는 암회색 층을 생성한다. 바륨은 중간 정도의 비중과 높은 전기 전도도를 갖지만, 정제하기 어려워 많은 성질들이 정확하게 측정되지 않았다.[1]상온 및 상압에서 바륨 금속은 체심 입방 구조를 가지며, 바륨-바륨 거리는 503 피코미터이다. 약 1.8/°C의 비율로 가열하면 팽창한다.[1] 모스 경도는 1.25로 부드러운 금속이다.[1] 녹는점은 727°C로, 더 가벼운 스트론튬 (777°C)과 더 무거운 라듐 (700°C)의 중간 값이다. 그러나 끓는점은 1900°C로 스트론튬 (1382°C)보다 높다.[2] 밀도(3.62 g/cm3) 또한 스트론튬 (2.36 g/cm3)과 라듐 (≈5 g/cm3)의 중간 값이다.[2]
바륨은 납과 비슷할 정도로 무르며, 금속 광택을 지니지만 공기 중에서는 산화되어 흰색 산화 피막으로 덮여 금속 광택이 사라진다.[37] 녹는점은 725~729 ℃, 끓는점은 1637~1898 ℃로 자료마다 다소 차이가 있다.[33][34][35][36] 밀도는 3.51 g/cm3로 경금속으로 분류된다.[37] 상온, 상압에서 안정적인 결정 구조는 체심입방구조(BCC)이며, 격자 상수 a는 5.01이다.[38]
염색 반응에서 바륨은 황록색 불꽃색을 나타낸다.[39] 주요 스펙트럼 선은 524.2 nm와 513.7 nm의 녹색 선이다.[38]
2. 2. 화학적 성질
바륨은 마그네슘, 칼슘, 스트론튬과 화학적으로 유사하지만 반응성이 더 크다. 바륨 화합물은 거의 항상 +2 산화 상태를 보인다. 바륨은 전기 양성이 큰 금속이므로, 칼코겐과의 반응은 매우 발열 반응적이다(에너지를 방출한다).[1] 상온에서 공기 중의 산소와 반응하기 때문에 금속 바륨은 종종 기름이나 불활성 기체 속에 보관된다.[1] 탄소, 질소, 인, 규소, 수소와 같은 비금속과의 반응은 가열하면 진행된다.[1] 물과 알코올과의 반응 또한 발열 반응이며 수소 기체를 방출한다.[1]: Ba + 2 ROH → Ba(OR)₂ + H₂↑ (R은 알킬기 또는 수소 원자)
바륨은 암모니아와 반응하여 전자화물 [Ba(NH₃)₆](e⁻)₂를 형성하는데, 실온 근처에서 아마이드 Ba(NH₂)₂를 생성한다.[3] 산에 의해 쉽게 부식되지만, 황산은 예외인데, 불용성 황산바륨이 표면에 형성되어 부동태화가 반응을 멈추게 한다.[4] 알루미늄, 아연, 납, 주석을 포함한 여러 다른 금속과 결합하여 금속간 화합물 상과 합금을 형성한다.[5]
단체 바륨은 은백색의 무른 금속이며, 다른 알칼리 토류 금속 원소와 유사한 성질을 나타내지만, 칼슘이나 스트론튬에 비해 반응성이 높다. +2가의 희토류 이온과도 유사한 성질을 보인다.
칼슘과 스트론튬과 유사하지만, 알칼리 토류 금속 원소의 전기음성도는 원자 번호가 커질수록 작아지는 경향이 있어 바륨은 칼슘이나 스트론튬보다 반응성이 더 크다.[44] 이러한 성질의 연속적인 변화로 인해 바륨의 염은 다른 알칼리 토류 금속의 염에 비해 수화물을 형성하기 쉽고, 물에 대한 용해도가 낮으며, 열적 안정성이 우수하다.[45]
2가 바륨 이온은 유로피움, 사마륨, 이테르븀 이온 등 2가 희토류 이온과 유사한 화학적 성질을 가지며, 이 때문에 바륨 광석에 이러한 원소가 포함되어 있는 경우가 있다.[46] 바륨 이온은 가시광선 영역에 스펙트럼을 가지지 않아 바륨 화합물은 모두 무색이며, 색깔은 음이온의 색깔이나 구조적 결함 때문에 나타난다.[52]
바륨의 전기화학적 전위는 수소보다 크기 때문에 물, 알코올과 격렬하게 반응하여 수소를 발생시킨다.[47]
:
공기 중에서 서서히 산화되어 백색의 산화 바륨을 형성하고, 이 산화물도 물과 격렬하게 반응하여 수산화 바륨이 된다. 수산화 바륨은 알칼리 토류 금속의 수산화물 중에서 물에 대한 용해도가 높고 강염기성이다.[48] 고온에서 탄소와 직접 반응하여 이온성 아세틸리드인 탄화 바륨을 생성하며, 이 탄화물은 가수분해에 의해 아세틸렌을 발생시킨다. 붕소, 규소, 비소, 황 등과도 직접 반응하여 이온성 화합물을 형성하지만, 이러한 화합물도 가수분해를 받기 쉽다. 옥소산과도 반응하여 황산 바륨이나 질산 바륨과 같은 화합물을 형성하고, 이러한 화합물은 물에 대한 용해도가 낮다.[49]
바륨의 과염소산염은 디에틸렌트리아민에 의해 착물을 형성하지만, 안정적으로 존재할 수 있는 것은 고체 상태일 뿐이며, 용액 중에서는 쉽게 해리된다.[50] 크라운 에테르와도 착물을 형성한다.[51] 액체 암모니아에 용해되어 청색 용액이 되고, 여기서 암모니아를 제거함으로써 바륨의 아민 착물을 얻을 수 있다.[52]
바륨염은 독성이 있으며, 섭취하면 칼륨 채널을 바륨 이온이 저해함으로써 신경계에 영향을 미친다. 따라서 바륨염(바륨 화합물)은 독극물 및 마약류 관리에 관한 법률(지정령)에서 독극물로 지정되어 있다(금속 바륨은 지정되어 있지 않으며, 황산바륨 등 지정되지 않는 물질도 있다).
2. 2. 1. 화합물
바륨 염은 일반적으로 고체 상태에서는 흰색이고 용액 상태에서는 무색이다.[6] 할로겐화물을 제외하고는 스트론튬 또는 칼슘 유사체보다 밀도가 높다. (표 참조, 비교를 위해 아연이 제시됨).
수산화바륨(중정석)은 연금술사들에게 알려져 있었으며, 그들은 탄산바륨을 가열하여 이를 생산했다. 수산화칼슘과 달리 수용액에서 CO2를 거의 흡수하지 않으므로 대기 변동에 민감하지 않다. 이러한 특성은 pH 장비를 교정하는 데 사용된다.
바륨 화합물은 녹색에서 연녹색의 불꽃을 내는데, 이는 바륨 화합물을 검출하는 효율적인 시험법이다. 이 색깔은 455.4, 493.4, 553.6 및 611.1 nm의 스펙트럼 선에서 비롯된다.[1]
유기바륨 화합물은 점점 더 발전하는 지식 분야이다. 최근에 발견된 것으로는 디알킬바륨과 알킬할로바륨이 있다.[1]
2. 3. 동위 원소
지구 지각에서 발견되는 바륨은 7가지의 원시 핵종(바륨-130, 132, 그리고 134부터 138까지)의 혼합물이다.[7] 바륨-130은 매우 느린 방사성 붕괴를 거쳐 이중 베타 플러스 붕괴에 의해 크세논-130으로 변환되며, 반감기는 (0.5–2.7)×1021년(우주의 나이의 약 1011배)이다. 자연 바륨에 대한 존재비는 약 0.1%이다.[7] 이론적으로 바륨-132는 유사하게 이중 베타 붕괴를 통해 크세논-132로 변환될 수 있지만, 이 붕괴는 아직 관측되지 않았다. 이러한 동위원소의 방사능은 매우 약하기 때문에 생명체에 위험을 초래하지 않는다.안정 동위원소 중 바륨-138은 모든 바륨의 71.7%를 차지하며, 다른 동위원소는 질량수가 감소함에 따라 존재비가 감소한다.[7]
총 40가지의 바륨 동위원소가 알려져 있으며, 질량은 114에서 153 사이이다. 가장 안정적인 인공 방사성 동위원소는 바륨-133이며, 반감기는 약 10.51년이다. 다른 5가지 동위원소의 반감기는 하루보다 길다. 바륨은 또한 10가지의 준안정 상태를 가지고 있으며, 그 중 바륨-133m1이 약 39시간의 반감기로 가장 안정적이다. 자연에서 산출되는 바륨은 일곱 가지 동위원소의 혼합물이며, 자연 존재비가 가장 큰 것은 138Ba의 71.7%이다. 바륨은 40가지의 동위원소가 알려져 있지만, 그 대부분은 반감기가 수 밀리초에서 수일 정도로 짧고 높은 방사능을 가진 방사성 동위원소이다. 예외적으로 10.51년이라는 비교적 긴 반감기를 가진 133Ba가 있다.[54]
3. 역사
초기 중세의 연금술사들은 일부 바륨 광물에 대해 알고 있었다. 바라이트(중정석) 광물의 매끄러운 조약돌 모양의 돌이 이탈리아 볼로냐 근처의 화산암에서 발견되어 "볼로냐 돌"이라고 불렸다.[9] 연금술사들은 빛에 노출된 후 수년 동안 빛을 발하기 때문에 이 돌에 매료되었다.[1]
1772년 칼 빌헬름 셸레(Carl Scheele)는 바라이트에 새로운 원소가 포함되어 있음을 밝혔지만, 바륨을 분리하지는 못하고 바륨 산화물만 분리했다. 요한 고틀리프 간(Johan Gottlieb Gahn)도 2년 후 비슷한 연구에서 바륨 산화물을 분리했다. 산화된 바륨은 처음에 기통 드 모르보(Guyton de Morveau)에 의해 "바로트(barote)"라고 불렸는데, 이 이름은 앙투안 라부아지에(Antoine Lavoisier)에 의해 프랑스어로 ''바라이트(baryte)'', 라틴어로 ''바리타(baryta)''로 변경되었다. 또한 18세기에 영국의 광물학자 윌리엄 위더링(William Withering)은 컴벌랜드의 납 광산에서 무거운 광물을 발견했는데, 이는 현재 위더라이트(witherite)로 알려져 있다.
바륨은 1808년 영국의 험프리 데이비 경(Sir Humphry Davy)에 의해 용융 바륨 염의 전기분해를 통해 처음으로 분리되었다.[8] 데이비 경은 칼슘과의 유추를 통해 바리타를 따서 "-ium" 접미사를 붙여 금속 원소임을 나타내는 "바륨"이라고 명명했다.[9] 로베르트 분젠(Robert Bunsen)과 어거스터스 매티센(Augustus Matthiessen)은 염화 바륨과 염화 암모늄의 용융 혼합물의 전기분해를 통해 순수한 바륨을 얻었다.[10][11]
브린 공정(Brin process)에서 순수 산소의 생산은 1880년대 바륨 과산화물의 대규모 응용 분야였지만, 1900년대 초 액화 공기의 전기분해와 분별 증류에 의해 대체되었다. 이 공정에서 산화 바륨은 500~600 °C에서 공기와 반응하여 과산화 바륨을 형성하고, 이는 700 °C 이상에서 산소를 방출하며 분해된다.[12][13]
:2 BaO + O2 ⇌ 2 BaO2
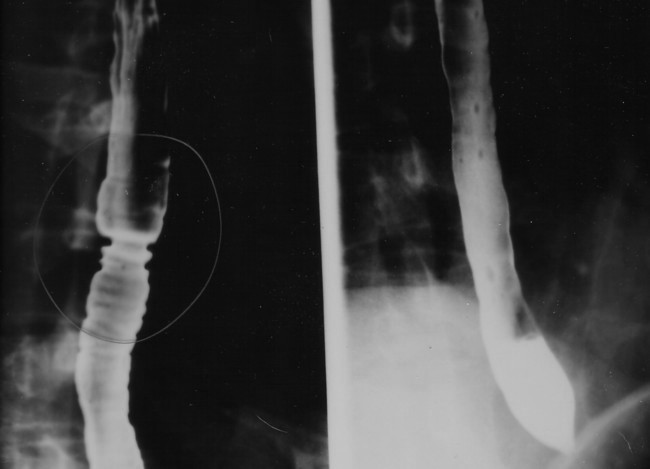
황산 바륨은 1908년에 소화기계의 의료 영상(X선 영상)에서 조영제로 처음 사용되었다.[14]
4. 존재 및 생산
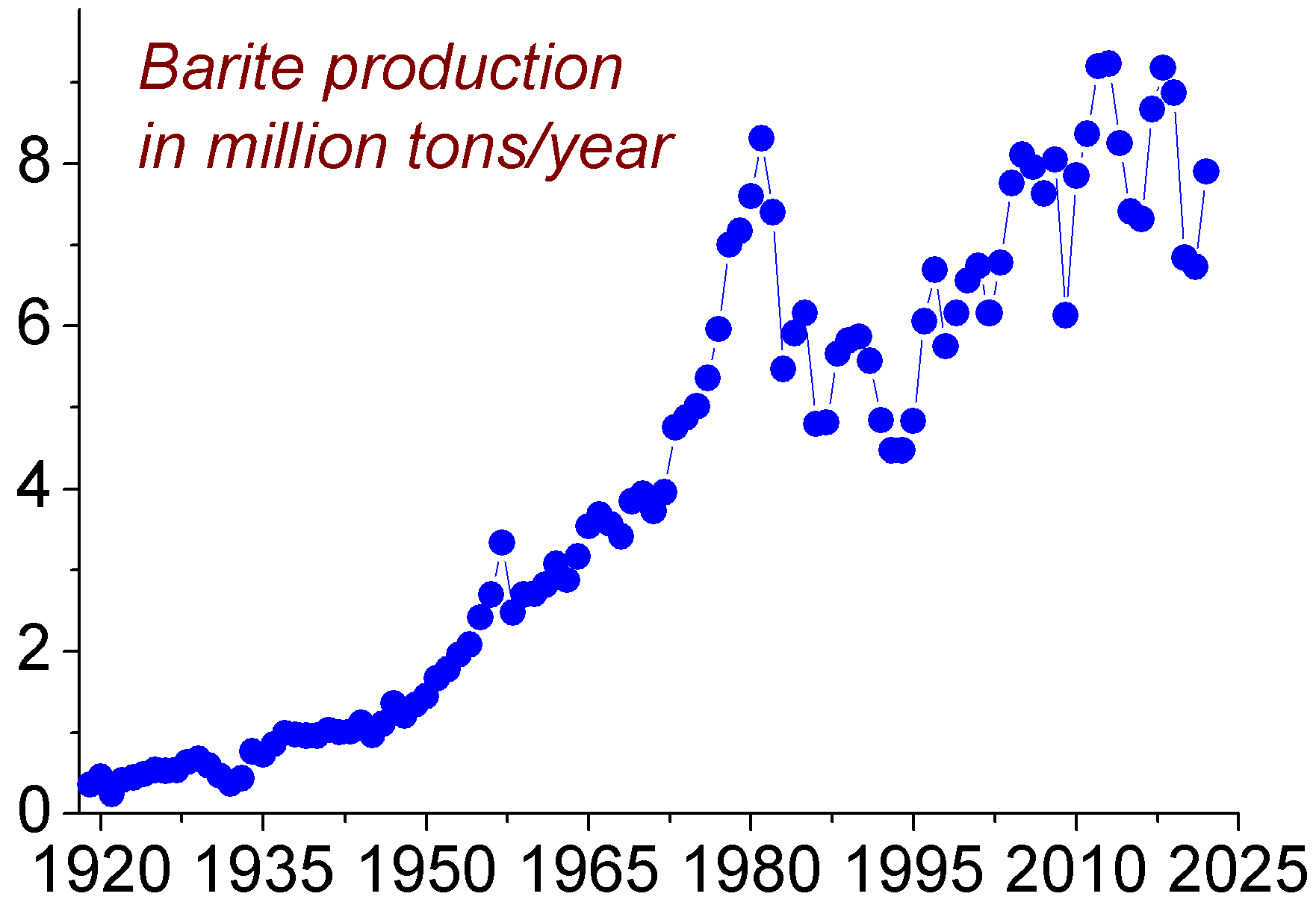
지구 지각에서 바륨의 존재 비율은 0.0425%이며, 바닷물에는 13μg/L 정도 존재한다. 바륨의 주요 상업적 공급원은 황산바륨 광물인 중정석(baryte, 또는 중석(重石))이다.[1] 중정석 매장량은 7억~20억 톤으로 추산된다. 1981년에는 830만 톤으로 최고 생산량을 기록했지만, 바륨 금속이나 화합물에 사용된 것은 7~8%에 불과했다.[1] 1990년대 후반 이후 중정석 생산량은 증가하여 1996년 560만 톤, 2005년 760만 톤, 2011년에는 780만 톤을 기록했다.
2011년 기준으로, 중국은 전 세계 생산량의 50% 이상을 차지했으며, 그 뒤를 이어 인도(14%), 모로코(8.3%), 미국(8.2%), 이란과 카자흐스탄(각각 2.6%), 터키(2.5%) 순이다.[15]
채굴된 광석은 세척, 파쇄, 분류 과정을 거쳐 석영과 분리된다. 석영이 광석에 깊이 침투했거나 철, 아연, 납 함량이 높으면 거품 부상법을 사용한다. 이렇게 생산된 중정석은 98%(질량 기준)의 순도를 가지며, 최소 95% 이상의 순도와 최소한의 철, 이산화규소 함량을 유지해야 한다.[1] 이후 탄소로 환원시켜 황화바륨을 얻는다.[1]
:BaSO4 + 2 C → BaS + 2 CO2
물에 녹는 황화바륨은 다른 화합물의 출발 물질이 된다. 황화바륨을 산소와 반응시키면 황산염, 질산과 반응시키면 질산염, 수용액 상태의 이산화탄소와 반응시키면 탄산염이 생성된다.[1] 질산염은 열분해하여 산화물을 얻을 수 있다.[1] 바륨 금속은 1100°C에서 알루미늄으로 환원시켜 생산하는데, 먼저 금속간 화합물 BaAl4가 생성된다.[1]
:3 BaO + 14 Al → 3 BaAl4 + Al2O3
BaAl4는 중간 생성물이며, 바륨 산화물과 반응하여 금속 바륨을 생성한다. 모든 바륨이 환원되는 것은 아니다.[1]
:8 BaO + BaAl4 → Ba↓ + 7 BaAl2O4
남은 산화바륨은 생성된 산화알루미늄과 반응한다.[1]
:BaO + Al2O3 → BaAl2O4
전체 반응식은 다음과 같다.[1]
:4 BaO + 2 Al → 3 Ba↓ + BaAl2O4
바륨 증기는 응축되어 아르곤 분위기에서 금형에 담긴다.[1] 이 방법으로 초고순도 바륨을 얻을 수 있다.[1] 일반적으로 판매되는 바륨은 약 99% 순도이며, 주요 불순물은 스트론튬과 칼슘(최대 0.8% 및 0.25%)이고, 기타 오염 물질은 0.1% 미만이다.[1]
1200°C에서 실리콘과의 유사한 반응은 바륨과 메타규산바륨을 생성한다.[1] 바륨은 용융 할로겐화물에 쉽게 용해되어 불순물이 생기기 때문에 전기분해는 사용되지 않는다.[1]
5. 용도
바륨은 금속 또는 알루미늄과 합금된 형태로 진공관(TV 브라운관)에서 원치 않는 기체를 제거하는 데(게터링) 사용된다.[1] 바륨은 낮은 증기압과 산소, 질소, 이산화탄소, 물에 대한 반응성 때문에 이러한 용도에 적합하며, 결정격자에 용해시켜 불활성 기체까지 부분적으로 제거할 수 있다. 하지만 LCD, LED, 플라즈마 TV의 인기 상승으로 이러한 용도는 점차 사라지고 있다.[1]
원소 상태의 바륨의 다른 용도는 부차적이며, 다음과 같은 용도가 있다.[1]
- 실루민(알루미늄-실리콘 합금)의 첨가제로서, 미세구조를 개선한다.
- 베어링 합금
- 크리프 저항을 높이기 위한 납-주석 땜납 합금
- 점화 플러그용 니켈 합금
- 강철과 주철에 대한 접종제 첨가제
- 고급 탈산강을 위한 칼슘, 망간, 실리콘 및 알루미늄과의 합금
황산바륨(BaSO4)은 석유 시추액으로서 유정에 중요한 역할을 한다.[2] 이 화합물의 침전물("blanc fixe", 프랑스어로 "영구 백색"이라는 뜻)은 페인트와 바니시에 사용되며; 잉크, 플라스틱, 고무의 충전제로; 종이 코팅 안료로; 그리고 나노입자로서 에폭시 수지와 같은 일부 고분자의 물리적 특성을 개선하는 데 사용된다.[1]
황산바륨은 독성이 낮고 약 4.5 g/cm3의 비교적 높은 밀도(따라서 X선에 대한 불투명도)를 가지고 있다. 이러한 이유로 소화기계의 X선 영상에서 조영제로 사용된다("바륨 밀" 및 "바륨 관장").[2] 리토폰은 황화물에 노출되어도 어두워지지 않는 우수한 피복력을 가진 영구 백색 안료이다.[20]
다른 바륨 화합물들은 Ba2+ 이온의 독성으로 인해 응용 분야가 제한적이다.
- 산화바륨은 형광등의 전극에 코팅되어 전자 방출을 용이하게 한다.
- 탄산바륨은 유리의 굴절률과 광택을 높이고[2] 브라운관(CRT) TV에서 X선 누출을 줄인다.[1]
- 질산바륨 형태의 바륨은 불꽃놀이에 노란색 또는 "사과" 녹색을 부여한다.[21] 선명한 녹색을 위해서는 염화바륨이 사용된다.
- 과산화바륨은 레일 용접을 위한 알루미늄 환원 반응(테르밋 반응)의 촉매이다. 또한 추적탄의 녹색 조명탄 및 표백제로도 사용된다.[22]
- 티탄산바륨은 유망한 전자 세라믹이다.[23]
- 플루오르화바륨은 0.15~12 마이크로미터의 넓은 투과율 범위 때문에 적외선 응용 분야의 광학에 사용된다.[24]
- YBCO는 액체 질소로 냉각되는 최초의 고온 초전도체로, 전이 온도가 질소의 끓는점()보다 높은 이다.[25]
- 페라이트는 전기적으로 비전도성이면서 페리자성이며, 일시적 또는 영구적으로 자화될 수 있다.
바륨의 가장 큰 용도는 유정이나 가스정을 시추하기 위한 시추용 진흙의 가중제이며, 중정석을 분쇄한 바라이트 분말이 사용된다.
6. 분석
바륨 화합물 용액에 황산을 넣으면 물에 녹지 않는 황산 바륨 흰색 앙금이 만들어진다. 이 방법으로 바륨을 정성 분석할 수 있으나, 같은 족 원소인 칼슘, 스트론튬이나 납 이온도 비슷한 앙금을 만들기 때문에 방해가 된다.[56]
아세트산 완충 용액에서 크로뮴산 바륨 노란색 앙금을 만드는 방법으로도 정성 분석할 수 있다. 이때 에틸렌디아민테트라아세트산(EDTA)과 염화 마그네슘을 넣어주면 다른 원소들이 EDTA와 착화합물을 형성하여 바륨 이외 원소의 수산화물 앙금 생성을 막을 수 있다.[57]
바륨은 불꽃 반응 실험에서 엷은 녹색을 띠지만, 구리, 망간, 텔루륨, 비스무트 등도 비슷한 불꽃색을 나타내므로 정성 분석에 사용하기는 어렵다.[58]
용액 중 바륨 농도의 정량 분석에는 황산바륨 또는 크롬산바륨 형태로 침전시켜 무게를 측정하는 중량 분석법이 있다.[59] 황산바륨을 사용하는 경우, 스트론튬이 불순물로 포함되면 원자흡광법 등으로 스트론튬 함량을 별도 측정하여 보정해야 한다.[61] 크롬산바륨을 황산 산성 용액에 용해시키고, 일정량의 황산철(II) 용액을 가한 후 과량의 황산철(II)을 과망간산칼륨 용액으로 역적정하는 용량 분석법으로도 정량 분석할 수 있다. 이는 크롬산의 산화 작용을 이용한 것이다.[60] 바륨 용액에 암모니아성 염화암모늄 완충 용액 및 마그네슘 용액을 가하고, 에리오크롬블랙 T를 지시약으로 하여 EDTA 용액으로 킬레이트 적정하는 방법도 사용되지만, 이 방법에서도 스트론튬의 분석값을 빼야 한다. EDTA 킬레이트 적정법은 한국산업규격(JIS)에서 바륨 정량 분석법 중 하나로 채택되어 있다.[61]
기기 분석법으로는 프레임리스 원자흡광법(AAS), ICP-AES, ICP-MS가 이용되며, AAS 흡수 파장은 553.6 nm, ICP-AES 발광 파장은 233.527 nm 및 455.403 nm가 사용된다.[62]
6. 1. 정성 분석
바륨을 포함한 용액에 황산을 넣으면 물에 녹지 않는 황산 바륨이 흰색 앙금으로 만들어진다. 이 방법으로 바륨을 쉽게 정성 분석할 수 있다. 그러나 이 방법은 같은 족 원소인 칼슘이나 스트론튬이 함께 있으면 바륨과 같이 황산염 앙금이 만들어지고, 납 이온도 황산납이라는 흰색 앙금을 만들기 때문에 정성 분석을 방해한다.[56]아세트산 완충 용액에서 크로뮴산 바륨의 노란색 앙금을 만드는 방법으로 바륨을 정성 분석할 수 있다. 이때 에틸렌디아민테트라아세트산(EDTA)과 염화 마그네슘을 넣어주면 다른 원소들이 EDTA와 착화합물을 형성하여, 바륨 이외의 원소가 수산화물 앙금이 되어 방해하는 것을 막을 수 있다.[57]
바륨은 불꽃 반응 실험에서 엷은 녹색을 띠지만, 구리, 망간, 텔루륨, 비스무트 등 많은 원소들이 비슷한 불꽃색을 나타내므로 정성 분석에 사용하기는 어렵다.[58]
6. 2. 정량 분석
용액 중 바륨 농도의 정량 분석 방법으로는 황산바륨 또는 크롬산바륨 형태로 바륨을 침전시켜 그 무게를 측정하는 중량 분석법이 있다.[59] 황산바륨을 사용하는 경우, 스트론튬이 불순물로 포함되어 있으면 스트론튬의 양도 분석값에 더해지므로, 원자흡광법 등으로 스트론튬 함량을 별도로 측정하여 분석값에서 빼야 한다.[61] 또한, 이렇게 얻은 크롬산바륨을 황산 산성 용액에 용해시키고, 일정량의 황산철(II) 용액을 가한 후 과량의 황산철(II)을 과망간산칼륨 용액으로 역적정하는 용량 분석법으로도 정량 분석할 수 있다. 이것은 크롬산의 작용으로 황산철(II)이 산화되는 반응을 이용한 것으로, 크롬산의 역적정과 같은 방법이다.[60] 바륨 용액에 암모니아성 염화암모늄 완충 용액 및 마그네슘 용액을 가하고, 에리오크롬블랙 T를 지시약으로 하여 EDTA 용액으로 킬레이트 적정하는 방법도 사용되지만, 이 방법에서도 황산바륨을 사용한 중량 분석법과 마찬가지로 스트론튬의 분석값을 빼야 한다. EDTA에 의한 킬레이트 적정법은 한국산업규격(JIS)에서 바륨의 정량 분석법 중 하나로 채택되어 있다.[61]기기 분석법으로는 프레임리스 원자흡광법(AAS), ICP-AES, ICP-MS가 이용되며, AAS의 흡수 파장은 553.6 nm, ICP-AES의 발광 파장은 233.527 nm 및 455.403 nm가 사용된다.[62]
7. 위험성
수용성 바륨 화합물은 독성이 있다. 소량의 바륨은 근육 흥분제로 작용하지만, 다량의 바륨은 신경계에 영향을 미쳐 부정맥, 떨림, 근력 저하, 불안, 호흡곤란, 마비 등을 일으킨다. 이는 바륨이 신경계의 적절한 기능에 매우 중요한 칼륨 채널을 억제하기 때문이다.[105] 또한, 바륨 화합물을 포함한 분진을 흡입하면 폐에 축적되어 baritosis|바륨증영어이라 불리는 양성 塵肺症을 일으킨다.[106][107] 그러나 황산바륨은 물이나 위산에 거의 용해되지 않기 때문에 경구 섭취가 가능하다.
다른 중금속과 달리 바륨은 일반적으로 생물농축되지 않는다고 여겨지지만,[108][109] 토마토나 콩 등 일부 식물에서 생물농축이 보고된 바 있다.[110] 환경 중의 바륨은 바이러스, 세균, 미생물 등에 영향을 미치며, 물벼룩에 대한 생식 장애 등이 보고되었다.[110]
이러한 독성 때문에, 일본에서는 독약 및 독극물 취급법 제2조 79항에 따라 황산바륨 및 바륨-4-(5-클로로-4-메틸-2-술포나토페닐아조)-3-히드록시-2-나프토에이트 이외의 바륨 화합물은 독극물로 지정되어 있다.[111]
참조
[1]
서적
Barium and Barium Compounds
2007
[2]
서적
CRC Handbook of Chemistry and Physics
https://archive.org/[...]
CRC Press
2004
[3]
서적
Greenwood&Earnshaw2nd
[4]
서적
Sulfuric Acid and Sulfur Trioxide
2000
[5]
서적
Intermetallic Chemistry
Elsevier
2008
[6]
서적
Qualitative analysis and the properties of ions in aqueous solution
Saunders
1990
[7]
논문
Atomic weights of the elements. Review 2000 (IUPAC Technical Report)
2003
[8]
논문
Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia
https://books.google[...]
1808
[9]
서적
The history and use of our earth's chemical elements: a reference guide
https://books.google[...]
Greenwood Publishing Group
2006
[10]
논문
Masthead
1855
[11]
논문
Notizen
https://zenodo.org/r[...]
1856
[12]
논문
The Origin of the Brin Process for the Manufacture of Oxygen
2009
[13]
서적
The development of modern chemistry
https://books.google[...]
Dover Publications
1984-04-01
[14]
논문
Some Observations on the History of the Use of Barium Salts in Medicine
1974
[15]
웹사이트
Barite
http://minerals.usgs[...]
[16]
웹사이트
Barium
https://www.mbari.or[...]
2020-11-24
[17]
논문
Barite in the ocean – occurrence, geochemistry and palaeoceanographic applications
2012
[18]
웹사이트
Graph
https://www.mbari.or[...]
2020-11-24
[19]
논문
Barium stable isotopes in the global ocean: Tracer of Ba inputs and utilization
https://doi.org/10.1[...]
2017
[20]
서적
Medicinal applications of coordination chemistry
https://archive.org/[...]
Royal Society of Chemistry
2007
[21]
서적
Chemistry of Fireworks
https://books.google[...]
Royal Society of Chemistry
2008
[22]
논문
Surfactant coatings for the stabilization of barium peroxide and lead dioxide in pyrotechnic compositions
1995
[23]
서적
Introduction to ferroic materials
CRC Press
2000
[24]
웹사이트
Crystran Ltd. Optical Component Materials
http://www.crystran.[...]
2010-12-29
[25]
논문
Superconductivity at 93 K in a New Mixed-Phase Y-Ba-Cu-O Compound System at Ambient Pressure
1987
[26]
논문
Biogenic barium and the detrital Ba/Al ratio: a comparison of their direct and indirect determination
2004
[27]
논문
Oceanic fronts control the distribution of dissolved barium in the Southern Ocean
https://ueaeprints.u[...]
2018-08-20
[28]
논문
Barium isotopes reveal role of ocean circulation on barium cycling in the Atlantic
https://research-inf[...]
2017-05-01
[29]
웹사이트
Barium 237094
https://www.sigmaald[...]
Sigma-Aldrich
2021-10-28
[30]
논문
A review of the health impacts of barium from natural and anthropogenic exposure
http://link.springer[...]
2014-08
[31]
논문
Baritosis: a benign pneumoconiosis
1976
[32]
서적
理科年表 第79冊
丸善
2005
[33]
웹사이트
ICSC-ref
2013-01-30
[34]
문서
コットン、ウィルキンソン (1987)
[35]
문서
Kresse et al. (1985)
[36]
서적
理科年表 第79冊
丸善
[37]
서적
(1959)
[38]
서적
(1959)
[39]
서적
(1959)
[40]
서적
(2004)
[41]
서적
(2004)
[42]
서적
(2004)
[43]
서적
(2004)
[44]
서적
(1959)
[45]
서적
(1987)
[46]
서적
(1987)
[47]
서적
(1959)
[48]
서적
(1959)
[49]
서적
(1987)
[50]
서적
(1987)
[51]
서적
(1987)
[52]
서적
(1987)
[53]
서적
Intermetallic Chemistry
Elsevier
[54]
서적
CRC Handbook of Chemistry and Physics, 85th Edition
CRC Press
[55]
웹사이트
標準線源 (09-04-03-02)
https://atomica.jaea[...]
高度情報科学技術研究機構 原子力百科事典
2012-01-15
[56]
서적
(1974)
[57]
서적
(1974)
[58]
서적
(1974)
[59]
서적
(1932)
[60]
서적
(1932)
[61]
간행물
日本工業規格
[62]
웹사이트
水道用薬品類の評価のための試験方法ガイドライン
https://www.mhlw.go.[...]
厚生労働省
2012-03-10
[63]
문서
ゲーテの『若きウェルテルの悩み』
[64]
서적
The history and use of our earth's chemical elements: a reference guide
https://books.google[...]
Greenwood Publishing Group
[65]
학술지
輝ける重い元素バリウム
https://www.natureas[...]
Nature
[66]
학술지
Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia
https://books.google[...]
[67]
서적
元素を知る事典: 先端材料への入門
海鳴社
[68]
학술지
Masthead
[69]
학술지
Notizen
[70]
학술지
The Origin of the Brin Process for the Manufacture of Oxygen
[71]
서적
The development of modern chemistry
https://books.google[...]
1984-04-01
[72]
학술지
Some Observations on the History of the Use of Barium Salts in Medicine
[73]
웹사이트
Barium: geological information
http://www.webelemen[...]
WebElements
2012-01-15
[74]
웹사이트
The Element Barium
http://education.jla[...]
Jefferson Lab.
2012-01-15
[75]
웹사이트
Alston Moor Cumbria, UK
http://www.rock-site[...]
Steetley Minerals
2012-01-15
[76]
서적
Industrial minerals
https://books.google[...]
[77]
웹사이트
我が国における鉱種別 需給/リサイクル/用途等 資料2.30 バリウム (Ba)
https://mric.jogmec.[...]
東北経済産業局
2013-01-08
[78]
서적
The Elements, in Handbook of Chemistry and Physics 81st edition
CRC press
[79]
서적
宝石の写真図鑑(地球自然ハンドブック)
日本ヴォーグ社
[80]
문서
Ullman 2007
[81]
웹사이트
31.バリウム
https://mric.jogmec.[...]
石油天然ガス・金属鉱物資源機構
2013-01-09
[82]
웹사이트
双日、メキシコにおける世界最大級のバライト鉱山へ出資〜石油・ガス採掘時の掘削泥水原料として需要拡大〜
http://www.sojitz.co[...]
双日
2013-01-09
[83]
웹사이트
BARITE
http://minerals.usgs[...]
미국 지질조사소
2013-01-08
[84]
문서
Ullman 2007
[85]
웹사이트
Toxicological Profile for Barium and Barium Compounds. Agency for Toxic Substances and Disease Registry
http://www.atsdr.cdc[...]
CDC
2007
[86]
문서
Ullman 2007
[87]
문서
Ullman 2007
[88]
문서
Ullman 2007
[89]
문서
Ullman 2007
[90]
서적
Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations
International Labour Organization
[91]
서적
Medicinal applications of coordination chemistry
https://books.google[...]
Royal Society of Chemistry
[92]
웹사이트
硫酸バリウム
http://www.jpo.go.jp[...]
특허청
2012-04-02
[93]
문서
Ullman 2007
[94]
웹사이트
SIDS 初期評価プロファイル 炭酸バリウム
http://www.jetoc.or.[...]
日本化学物質安全・情報センター
2013-01-25
[95]
학술지
ランプ寿命推定法を用いた長寿命蛍光ランプの開発
http://panasonic.co.[...]
[96]
보고서
디젤 자동차의 배기 흑연 방지에 관한 조사 연구 (제2보)
https://www.tokyokan[...]
東京都環境公社
[97]
서적
Chemistry of Fireworks
https://books.google[...]
Royal Society of Chemistry
[98]
학술지
Surfactant coatings for the stabilization of barium peroxide and lead dioxide in pyrotechnic compositions
[99]
학술지
新規チタン酸バリウム系強誘電体
http://www.netsu.org[...]
日本熱測定学会
2013-02-04
[100]
웹사이트
Crystran Ltd. Optical Component Materials
http://www.crystran.[...]
2010-12-29
[101]
서적
Chemistry, Society and Environment: A New History of British Chemical Industry
Royal Society of Chemistry
[102]
학술지
バリウムフェライト磁性体を用いた塗布型磁気記録媒体の高密度化研究
[103]
서적
現代無機材料科学
化学同人
[104]
웹사이트
緻密質ファインセラミックス
http://business.aten[...]
ティーイーピー株式会社
2013-01-25
[105]
서적
Handbook of inorganic chemicals
https://books.google[...]
[106]
논문
Baritosis: a benign pneumoconiosis
[107]
웹사이트
良性塵肺症
http://merckmanual.j[...]
メルクマニュアル
2012-01-18
[108]
웹사이트
Toxicity Profiles, Ecological Risk Assessment
http://www.epa.gov/r[...]
US EPA
2012-01-17
[109]
서적
Inorganic Contaminants of Surface Waters, Research and Monitoring Priorities
Springer-Verlag
[110]
웹사이트
環境保健クライテリア 107 バリウム
https://www.nihs.go.[...]
国立医薬品食品衛生研究所
2013-01-27
[111]
웹사이트
毒物及び劇物指定令(昭和40年政令第2号)
https://laws.e-gov.g[...]
総務省行政管理局
2020-01-09
[112]
웹사이트
化学物質を取り扱う事業者の方へ
https://www.meti.go.[...]
経済産業省
2013-01-27
[113]
웹사이트
海外の環境規制・環境産業の動向に関する調査報告書
http://www.meti.go.j[...]
三菱総合研究所
2013-01-27
[114]
웹사이트
シンガポールの排水基準について
http://www.dowa-ecoj[...]
DOWAエコジャーナル
2013-01-27
[115]
웹사이트
グリーン調達 欧州規格EN71-Part3に基づく玩具の溶出試験
http://www.shimadzu-[...]
島津テクノリサーチ
2013-01-26
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com