알데하이드 페레독신 산화환원효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
알데하이드 페레독신 산화환원효소(AOR)는 고세균에서 발견되는 효소로, 알데히드를 산화시키는 역할을 한다. AOR은 몰리브도프테린 보조 인자, 4Fe-4S 클러스터 및 옥소-텅스텐 중심을 특징으로 하며, 고온 및 환원 환경에서 최적의 활성을 보인다. AOR은 아미노산 및 포도당 대사에서 생성되는 알데히드를 산화시키며, 이 과정에서 텅스텐은 산화환원 반응에 관여한다. AOR의 활성 부위는 텅스텐, 몰리브도프테린, 철-황 클러스터로 구성되며, 효소의 구조는 세 개의 도메인으로 나뉜다. AOR은 알데히드의 카복실산으로의 산화를 촉매하며, 4Fe-4S 클러스터가 산화환원 당량을 제공한다.
더 읽어볼만한 페이지
- 구조가 알려지지 않은 효소 - 7베타-하이드록시스테로이드 탈수소효소 (NADP+)
7베타-하이드록시스테로이드 탈수소효소 (NADP+)는 스테로이드 호르몬 및 담즙산 대사에 관여하며, NADP+를 조효소로 사용하여 7β-하이드록시스테로이드를 산화시키는 효소로서, 장내 미생물에서 케노데옥시콜산 대사에 중요한 역할을 하고, 담석증과 같은 질환과 관련되어 의학적 연구 및 약물 개발의 표적이 된다. - 구조가 알려지지 않은 효소 - 글루쿠로노락톤 환원효소
글루쿠로노락톤 환원효소는 L-굴로노-1,4-락톤:NADP⁺ 1-산화환원효소로도 불리며, L-글루론산 락톤 환원효소, 글루쿠로노락토네 환원효소, GRL 환원효소, 글루쿠로노락톤 탈수소효소, 굴로노락톤 탈수소효소, GRase 등의 다양한 이름으로 알려진 효소이다.
| 알데하이드 페레독신 산화환원효소 | |
|---|---|
| 효소 정보 | |
| 이름 | 알데하이드 페레독신 산화환원효소 |
| EC 번호 | 1.2.7.5 |
| CAS 번호 | 138066-90-7 |
| 단백질 군 정보 (AFOR_N) | |
| 심볼 | AFOR_N |
| 이름 | AFOR_N |
 | |
| Pfam | PF02730 |
| InterPro | IPR013983 |
| SCOP | 1aor |
| 단백질 군 정보 (AFOR_C) | |
| 심볼 | AFOR_C |
| 이름 | AFOR_C |
| Pfam | PF01314 |
| InterPro | IPR001203 |
| SCOP | 1aor |
2. 분포
AOR 계열에는 고온성 고세균에서 분리된 AOR, 포름알데하이드 페레독신 산화환원효소(FOR), 글리세르알데히드 3-인산 페레독신 산화환원효소(GAPOR),[1] 클로스트리디아에서 발견되는 카르복실산 환원 효소,[3] ''Proteus vulgaris''에서 유래된 하이드록시카르복실레이트 바이올로젠 산화환원효소가 있으며, 이는 AOR 계열에서 유일하게 몰리브덴을 함유하고 있다.[4]
AOR은 최적 pH 8-9에서 고온 조건(약 80°C)에서 기능한다. 산소에 노출되면 활성의 대부분을 잃고 환원 환경인 세포질에서 작동하므로 산소에 민감하다. 따라서 산소 노출 또는 온도 감소는 촉매 특성의 비가역적 손실을 유발한다. AOR의 산소 민감성 때문에 효소의 정제는 무산소 환경에서 수행된다.[8]
AOR은 동종이량체이며, 각 67kDa 서브유닛은 1개의 텅스텐과 4-5개의 철 원자를 포함한다.[2] 두 서브유닛은 저스핀 철 중심에 의해 연결되며, 독립적으로 기능하는 것으로 여겨진다.[2]
AOR은 고온성 고세균인 피로코쿠스 푸리오수스에서 발견된다.[7] ''피로코쿠스'' ES-4 균주와 ''테르모코쿠스'' ES-1 균주는 기질 특이성이 다르며, AFO는 알데히드 기질의 더 넓은 크기 범위를 보인다.
3. 기능
AOR은 Entner-Doudoroff 경로(포도당 분해)에서 말토스를 첨가하면 활성이 증가하기 때문에 이 경로에서 역할을 하는 것으로 제안되었다.[2] 다른 제안으로는 탈아미노화된 2-케토산에서 나오는 아미노산 대사 알데히드 부산물의 산화에서의 역할이 있다. 알데히드 페레독신 산화환원효소의 주요 기질은 일반적인 아미노산과 포도당의 대사 산물인 아세트알데히드, 페닐아세트알데히드, 이소발레르알데히드이다.[8] 예를 들어, 아세트알데히드는 최대 22.0 μM-1s-1의 kcat/KM 값을 달성한다.[8] 실제로 Thermococcus strain ES1과 같은 일부 미생물은 아미노산만을 탄소원으로 사용하므로 알데히드 페레독신 산화환원효소를 사용하여 아미노산 탄소원을 대사한다.[8]
4. 구조
; 텅스텐-프테린
AOR의 활성 부위에 있는 텅스텐은 옥소/하이드록소 리간드와 두 개의 몰리브도프테린 보조 인자의 디티올렌 치환체에 결합된 왜곡된 사각 피라미드 기하학을 취한다.[2]
텅스텐은 단백질에 직접 결합하지 않으며,[9] 두 개의 몰리브도프테린 보조 인자가 결합한다.[9] 이는 많은 관련 효소에서 관찰되는 형태이다.[9] 보조 인자에 매달린 인산염 중심은 Mg2+에 결합하며, 이는 또한 Asn93과 Ala183에 의해 결합되어 팔면체 배위 구를 완성한다.[2][9] 프테린과 텅스텐 원자는 주로 아미노산 잔기와 프테린의 수소 결합 네트워크를 통해 AOR 효소에 연결된다.[2] 팔면체 기하학을 차지하는 두 개의 물 리간드는 프테린, 인산염 및 Mg2+와 수소 결합 네트워크에 참여한다.[9] [Fe4S4] 클러스터는 4개의 시스 리간드에 의해 결합되는 반면, 아미노 및 에테르 결합이 풍부한 프테린은 AOR 효소의 Asp-X-X-Gly-Leu-(Cys/Asp) 서열과 상호 작용한다.[2] Cys494 잔기는 [Fe4S4] 클러스터와도 수소 결합하며, 효소에서 텅스텐 부위와 [Fe4S4] 클러스터 부위를 연결함을 나타낸다.[2] 클러스터의 철 원자는 세 개의 다른 시스테인 리간드에 추가로 결합한다.[9] 페레독신 클러스터와 프테린 사이의 링커 아미노산 잔기인 Arg76은 프테린과 페레독신 모두에 수소 결합한다.[2] 이러한 수소 결합 상호 작용은 프테린 고리 시스템을 전자 전달체로 암시한다고 제안된다.[2] 프테린의 C=''O'' 중심은 Na+에 결합한다.[8] W=O 중심이 제안되었지만 결정학적으로 확인되지는 않았다.[9]
AOR은 도메인 1, 2 및 3의 세 가지 도메인으로 구성된다.[8] 도메인 1은 텅스텐에 결합된 프테린을 포함하며, 다른 두 도메인은 특정 기질이 채널을 통해 효소에 들어갈 수 있도록 텅스텐에서 단백질 표면까지(길이 15 앙스트롬) 채널을 제공한다.[8] 활성 부위에서 이 프테린 분자는 안장 모양(정상 평면에서 50도)으로 도메인 1에 "앉아" 있으며, 이는 또한 텅스텐-프테린 부위를 수용하기 위해 베타 시트를 갖는 형태를 취한다.[8]
4. 1. 철
AOR은 동종 이량체이며, 각 67kDa 서브유닛은 1개의 텅스텐과 4-5개의 철 원자를 포함한다.[2] 두 서브유닛은 저스핀 철 중심에 의해 연결된다.[2]
두 서브유닛 사이의 철 중심은 AOR에서 구조적 역할을 한다.[8] 철 금속 원자는 사면체 형태를 취하며, 리간드 배위는 두 개의 히스티딘과 글루탐산에서 나온다.[8] 이것은 단백질의 산화 환원 활성에 기능적인 역할을 하는 것으로 알려져 있지 않다.[8]
; Fe4S4 중심
AOR의 [Fe4S4] 클러스터는 다른 페레독신 분자와 몇 가지 측면에서 다르다.[2] EPR 측정은 이것이 일전자 셔틀 역할을 함을 확인한다.[2]
4. 2. Fe4S4 중심
AOR의 Fe4S4 클러스터는 다른 페레독신 분자와 몇 가지 측면에서 다르다.[2] EPR 측정은 이것이 일전자 셔틀 역할을 함을 확인한다.[2]
5. 반응 메커니즘
촉매 주기에서 W(VI)(텅스텐 "6가")는 알데하이드의 카복실산(또는 카복실레이트)으로의 산화와 함께 W(IV)로 변환된다.[2] W(V) 중간체는 EPR 분광법으로 감지할 수 있다.[2][8]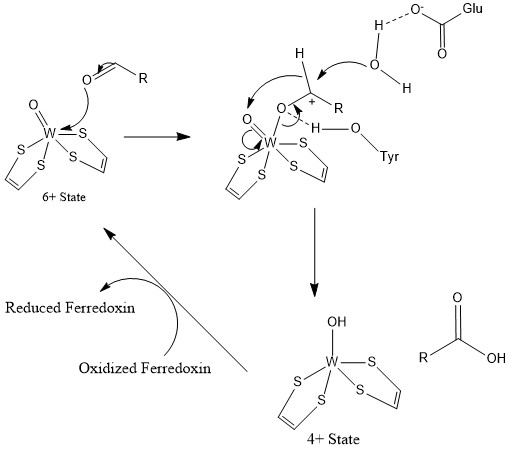
AOR의 일반적인 반응 메커니즘은 다음과 같다.[10]
:RCHO + H2O → RCO2H + 2H+ + 2 e−
산화환원 당량은 4Fe-4S 클러스터에 의해 제공된다.
티로신 잔기는 W 중심에 배위된 카보닐 산소 원자와의 수소 결합을 통해 알데하이드의 친전자성 중심을 활성화하는 것으로 제안되었다.[10] 활성 부위 근처의 글루탐산 잔기는 알데하이드 카보닐 중심에 대한 친핵성 공격을 위해 물 분자를 활성화한다.[10] 물의 친핵성 공격 후 수소화물은 옥소-텅스텐으로 전달된다.[10] 이후 W(VI)는 4Fe-4S 중심으로의 전자 전달에 의해 재생성된다.[10] 포름알데히드 페레독신 산화환원효소의 경우, Glu308 및 Tyr 416이 관여하는 반면, Glu313 및 His448이 AOR 활성 부위에 존재하는 것으로 나타났다.[9][10]
참조
[1]
논문
Molybdenum-cofactor-containing enzymes: structure and mechanism
https://authors.libr[...]
1997
[2]
논문
Tungsten in biological systems
1996-03
[3]
논문
Carboxylic acid reductase: a new tungsten enzyme catalyses the reduction of non-activated carboxylic acids to aldehydes
1989-09
[4]
논문
The (2R)-hydroxycarboxylate-viologen-oxidoreductase from Proteus vulgaris is a molybdenum-containing iron-sulphur protein
1994-06
[5]
논문
Glyceraldehyde-3-phosphate ferredoxin oxidoreductase, a novel tungsten-containing enzyme with a potential glycolytic role in the hyperthermophilic archaeon ''Pyrococcus furiosus''
1995-04
[6]
논문
Pyruvate ferredoxin oxidoreductase from the hyperthermophilic archaeon, Pyrococcus furiosus, functions as a CoA-dependent pyruvate decarboxylase
1997-09
[7]
논문
Bioinorganic chemistry of molybdenum and tungsten enzymes: A structural–functional modeling approach
2011-05
[8]
서적
Handbook of Metalloproteins: Aldehyde Ferredoxin Oxidoreductase
John Wiley & Sons, Ltd
2006-04-15
[9]
논문
Molybdenum-cofactor-containing enzymes: structure and mechanism
https://authors.libr[...]
1997
[10]
논문
The bioinorganic chemistry of tungsten
2009-02
[11]
논문
Bioinorganic chemistry of molybdenum and tungsten enzymes: A structural–functional modeling approach
2011-05
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
