제한효소 절편길이 다형성
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
제한 효소 절편길이 다형성(RFLP)은 제한 효소를 사용하여 DNA를 절단하고, 절단된 DNA 조각의 길이를 비교하여 개체 간의 유전적 차이를 분석하는 분자 생물학 기술이다. RFLP 분석은 DNA 절편을 전기 영동으로 분리하고, 서던 블롯을 통해 특정 DNA 서열과 혼성화하여 절편 길이를 확인하는 방식으로 진행된다. RFLP는 유전자 지도 작성, 유전 질환 진단, 법의학적 감정, 친자 확인, 유기체 식별, 유전적 다양성 및 재조합률 분석 등 다양한 분야에 활용되었으나, 분석 과정이 느리고 복잡하며 많은 양의 DNA가 필요하다는 단점으로 인해, 인간 게놈 프로젝트 이후 단일 염기 다형성(SNP) 분석 및 중합 효소 연쇄 반응(PCR) 기반 기술로 대체되는 추세이다.
더 읽어볼만한 페이지
- 생화학 검출 기법 - 펠링 용액
펠링 용액은 헤르만 폰 펠링이 발명한 알데히드와 환원당 검출 시약으로, 환원성 물질과 반응하여 산화 구리(I)의 적색 침전을 생성하며, 베네딕트 시약이 개발되었음에도 높은 반응 민감도를 유지한다. - 생화학 검출 기법 - LAMP법
LAMP법은 등온 핵산 증폭 기술로서, 2~3세트의 프라이머와 중합효소를 사용하여 60–65°C의 일정한 온도에서 특정 유전자를 증폭하여 검출하며, 현장 진단에 활용된다. - 유전학 - 우생학
우생학은 인간의 유전적 특질 개선을 목표로 19세기 후반 골턴에 의해 체계화되었으며, 긍정적·부정적 방식으로 전개되었으나, 나치 독일의 인종정책과 결부되어 비판받으며 쇠퇴하였지만, 현대 사회에서도 유전자 선별과 관련된 논쟁이 지속되고 있다. - 유전학 - 행동유전학
행동유전학은 행동에 영향을 주는 유전적 요인과 환경적 요인을 연구하는 학문으로, 프랜시스 골턴의 연구에서 시작되었으나 우생학 논란을 겪었으며, 가족 연구, 쌍둥이 연구 등을 통해 발전해 왔지만 사회적 논쟁과 방법론적 한계에 대한 비판도 존재한다. - 생물학 - 균근
균근은 식물 뿌리와 균류 사이의 공생체로, 식물에게 물과 영양분을 공급하고 식물은 광합성 산물을 제공하며, 농업, 산림 복원 등 다양한 분야에서 활용될 수 있다. - 생물학 - 생명
생명은 환경 속에서 자기 유지, 증진, 강화를 하는 특징으로 정의되나 논쟁적이며, 항상성 유지, 세포 구조, 물질대사, 성장, 적응, 자극 반응, 생식 능력을 포함하고, 자기 복제와 진화로 유지되는 열린 열역학계로 설명되며, 기원은 약 40억 년 전으로 추정되고, 진화와 멸종이 공존하며, 바이러스, 외계 생명체, 인공 생명 연구가 진행 중이다.
| 제한효소 절편길이 다형성 |
|---|
2. RFLP 분석
RFLP 분석은 DNA 샘플을 제한 효소로 처리하여 절단하고, 절단된 DNA 절편을 젤 전기영동으로 분리하여 크기별로 패턴을 확인하는 방식으로 진행된다.
2. 1. 원리
제한 효소를 사용하여 DNA 샘플을 절단하는 것이 제한효소 절편길이 다형성(RFLP) 검출을 위한 기본적인 기술이다. 제한 소화라고 알려진 과정에서 짧고, 특정 서열이 인식되는 곳이면 DNA 분자를 선택적으로 절단할 수 있다. 소화에 의해 생성된 DNA 절편은 아가로스 젤 전기 영동이라는 과정을 통해 길이별로 분리된 다음, 사우스 블롯 과정을 통해 막으로 옮겨진다. 그 후, 표지된 DNA 프로브로 막을 핵산 혼성화하면 프로브와 상보적인 절편의 길이를 결정한다. 검출된 절편의 길이가 개인 간에 다를 때, 이는 동일하지 않은 서열 상동성을 나타내며, 제한 절편 길이 다형성이 발생한다고 한다. 각 절편 길이는 실제로 코딩 영역을 포함하는지 여부와 관계없이 대립 유전자로 간주되며, 후속 유전자 분석에 사용될 수 있다.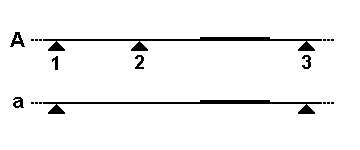
다음은 서던 블롯을 이용한 원리를 모식적으로 나타낸 것이다.
| 개체 A | |
|---|---|
| | | |
| 개체 B | |
|---|---|
| | |
| 서던 블롯 결과 ↓ |
|---|
상단: 어떤 생물종 2개체의 게놈 DNA와 제한 효소 SfaN I에 의한 절편 길이. 개체 B에는 b 위치에 제한 효소 인식 부위가 존재하지 않는다.
하단: 서던 블롯의 결과. 개체 A에서는 , 개체 B에서는 위치에 밴드가 보인다. (간략화를 위해 일배체 생물을 가정하고 있다)
2. 2. 과정
RFLP 분석은 다음과 같은 단계를 거친다.1. 제한 효소를 사용하여 DNA 샘플을 절단한다. 이 효소는 제한 소화라고 알려진 과정에서 짧고, 특정 서열이 인식되는 곳이면 DNA 분자를 선택적으로 절단할 수 있다.
2. 소화에 의해 생성된 DNA 절편은 아가로스 젤 전기 영동이라는 과정을 통해 길이별로 분리된 다음, 사우스 블롯 과정을 통해 막으로 옮겨진다.
3. 그 후, 표지된 DNA 프로브로 막을 핵산 혼성화하면 프로브와 상보적인 절편의 길이를 결정한다.
검출된 절편의 길이가 개인 간에 다를 때, 이는 동일하지 않은 서열 상동성을 나타내며, 제한 절편 길이 다형성이 발생한다고 한다. 각 절편 길이는 실제로 코딩 영역을 포함하는지 여부와 관계없이 대립 유전자로 간주되며, 후속 유전자 분석에 사용될 수 있다.
다음은 서던 블롯을 이용한 원리를 모식적으로 나타낸 것이다.
'''개체 A'''
| a | b | c | ||
| 2km | 1km | |||
| DNA | -- | -- | -- | |
| SfaN I | SfaN I | SfaN I | ||
프로브와 상보적인 영역
'''개체 B'''
| a | b | c | ||
| 3km | ||||
| DNA | -- | -- | -- | |
| SfaN I | SfaN I | |||
'''서던 블롯 결과'''
| 크기 마커 | 개체 A | 개체 B |
|---|---|---|
| 5km | _____ | |
| 4km | _____ | |
| 3km | _____ | ______ |
| 2km | _____ | ______ |
| 1km | _____ |
- 상단: 어떤 생물종 2개체의 게놈 DNA와 제한 효소 SfaN I에 의한 절편 길이.
- 개체 B에는 b 위치에 제한 효소 인식 부위가 존재하지 않는다.
- 프로브가 결합하는 영역.
- 하단: 서던 블롯의 결과. 개체 A에서는 2km, 개체 B에서는 3km 위치에 밴드가 보인다.
- (간략화를 위해 일배체 생물을 가정하고 있다)
2. 3. RFLP 발생 메커니즘
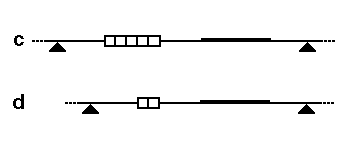
RFLP는 제한 효소 절편의 크기가 달라지는 현상으로, 다음과 같은 두 가지 주요 메커니즘으로 발생한다.- 제한 부위 변이: 첫 번째 그림에서 DNA 프로브(굵은 선)는 유전체의 작은 부분을 감지한다. 대립 유전자 ''A''에는 세 개의 인접한 제한 효소 절단 부위(삼각형)가 있지만, 가장 오른쪽 절편만 프로브에 의해 감지된다. 대립 유전자 ''a''에서는 제한 부위 2가 돌연변이로 손실되어, 프로브는 부위 1에서 3까지 연결된 더 큰 융합 절편을 감지한다.
- 가변 수 반복 서열(VNTR) 변이: 세 번째 그림에서 프로브와 제한 효소는 VNTR 세그먼트(그림의 상자)를 포함하는 유전체 영역을 감지한다. 대립 유전자 ''c''에는 VNTR에 5개의 반복 서열이 있어 프로브는 더 긴 절편을 감지한다. 대립 유전자 ''d''에는 VNTR에 2개의 반복 서열만 있어 프로브는 더 짧은 절편을 감지한다.
유전자 삽입, 유전자 결실, 염색체 전좌, 염색체 역위와 같은 다른 유전적 과정도 다형성을 유발할 수 있다.
다음은 서던 블롯을 이용한 RFLP 발생 원리를 모식적으로 나타낸 것이다.
'''개체 A'''
```
a b c
| 2 kb | 1 kb |
DNA -----------|---------------------|---------|-------
SfaN I SfaN I SfaN I
```
'''개체 B'''
```
a b c
| 3 kb |
DNA -----------|-------------------------------|-------
SfaN I SfaN I
```
프로브와 상보적인 영역은 위 그림과 같다.
'''서던 블롯 결과'''
```
5 kb _____
4 kb _____
3 kb _____ ______
2 kb _____ ______
1 kb _____
크기 개체 A 개체 B
마커
```
위 그림에서 개체 B는 b 위치에 제한 효소 인식 부위가 존재하지 않아 프로브가 결합하는 영역이 더 길다. 따라서 서던 블롯 결과, 개체 A에서는 2kb, 개체 B에서는 3kb 위치에 밴드가 나타난다.
3. 응용 분야
RFLP 기술은 유전체 지도 작성, 유전 질환 진단, 법의학 등 다양한 분야에서 활용된다. RFLP는 유전체 내에서 유전자 또는 DNA 마커의 상대적인 위치를 결정하는 데 사용될 수 있으며, 질병 유전자 탐색 초기 단계에서 질병과 연관된 RFLP 마커를 찾아 질병 유전자의 위치를 추정하는 데 사용되었다. RFLP 검사는 유전체 내 고유한 패턴을 분석하여 유기체를 식별하고 차별화하는 데 사용되며, 제한 효소 절단 부위 사이의 로커스에서 재조합률을 식별하는 데에도 사용된다.
3. 1. 유전체 지도 작성
RFLP는 유전체 내에서 유전자 또는 DNA 마커의 상대적인 위치를 결정하는 유전체 지도 작성에 활용될 수 있다. 질병 유전자 탐색 초기 단계에서 질병과 연관된 RFLP 마커를 찾아 질병 유전자의 위치를 추정하는 데 사용되었다. 연구자들은 특정 질병 유전자의 염색체 위치를 처음 결정하려 할 때, 질병에 걸린 가족 구성원들의 DNA를 분석하고, 질병의 유전 양상과 유사한 유전 양상을 보이는 RFLP 대립 유전자를 찾았다(유전자 연관 참조). 질병 유전자의 위치가 확인되면, 다른 가족들에 대한 RFLP 분석을 통해 질병 위험이 있는 사람 또는 돌연변이 유전자의 보인자일 가능성이 있는 사람을 밝혀낼 수 있었다.3. 2. 유전 질환 진단
연구자들은 특정 질병 유전자의 염색체 위치를 처음 결정하려 할 때, 질병에 걸린 가족 구성원들의 DNA를 분석하고, 질병의 유전 양상과 유사한 유전 양상을 보이는 RFLP 대립 유전자를 찾았다(유전자 연관 참조).[1] 질병 유전자 위치가 확인되면, 다른 가족들에 대한 RFLP 분석을 통해 질병 위험이 있는 사람 또는 돌연변이 유전자의 보인자일 가능성이 있는 사람을 밝혀낼 수 있었다.[1]3. 3. 법의학
RFLP 분석은 법의학 현장에서 회수된 샘플을 식별하거나, 친자 확인을 결정하는 데 사용된다. 또한 동물 개체군의 유전적 다양성 또는 번식 패턴을 특성화하는데 유용한 유전자 지문의 초기 방법의 기초가 되었다.3. 4. 기타
RFLP는 동물 개체군의 유전적 다양성 및 번식 패턴 특성화, 식물 품종 개량, 미생물 군집 분석 등 다양한 분야에서 활용된다. RFLP 변이 분석은 이전에는 유전자 지도 작성 및 유전 질환 분석에 필수적인 도구였다. 연구자들이 특정 질병 유전자의 염색체 위치를 처음 결정하려 할 때, 그들은 질병에 걸린 가족 구성원들의 DNA를 분석하고, 질병의 유전 양상과 유사한 유전 양상을 보이는 RFLP 대립 유전자를 찾았다(유전자 연관 참조). 질병 유전자 위치가 확인되면, 다른 가족들에 대한 RFLP 분석을 통해 질병 위험이 있는 사람 또는 돌연변이 유전자의 보인자일 가능성이 있는 사람을 밝혀낼 수 있었다. RFLP 검사는 유전체 내 고유한 패턴을 분석하여 유기체의 식별 및 차별화에 사용된다. 또한 제한 효소 절단 부위 사이의 로커스에서 재조합률을 식별하는 데에도 사용된다.RFLP 분석은 법의학 현장에서 회수된 샘플 식별, 친자 확인 결정, 동물 개체군의 유전적 다양성 또는 번식 패턴 특성화에 유용한 유전자 지문의 초기 방법의 기초가 되었다.
4. 한계 및 대체 기술
RFLP 분석은 시간이 오래 걸리고, 많은 양의 DNA 샘플이 필요하며, 복잡한 과정을 거쳐야 한다는 단점이 있다.[1] 이러한 한계 때문에, 중합 효소 연쇄 반응(PCR) 기반의 기술들이 RFLP를 대체하여 널리 사용되고 있다.
4. 1. 대체 기술
RFLP 분석 기술은 느리고 번거롭다. 많은 양의 DNA 샘플이 필요하며, 프로브 표지, DNA 단편화, 전기 영동, 블로팅, 혼성화, 세척 및 자동 방사선 촬영법을 포함한 전체 과정은 완료하는 데 최대 한 달이 걸릴 수 있다. 1985년에는 올리고뉴클레오티드 프로브를 사용하는 RFLP 방법의 제한된 버전이 보고되었다.[1] 인간 게놈 프로젝트의 결과로 인해 RFLP 매핑의 필요성은 크게 줄었으며, 해당 프로젝트에서 많은 단일 염기 다형성 (SNP)의 식별 (뿐만 아니라 많은 질병 유전자 및 돌연변이의 직접적인 식별)은 RFLP 질병 연관 분석의 필요성을 대체했다 (SNP 유전자형 분석 참조). VNTR 대립 유전자의 분석은 계속되지만, 현재는 일반적으로 중합 효소 연쇄 반응 (PCR) 방법을 통해 수행된다. 예를 들어, DNA 지문에 대한 표준 프로토콜에는 12개 이상의 VNTR 패널에 대한 PCR 분석이 포함된다.RFLP는 여전히 마커 보조 선택에 사용된다. 말단 제한 절편 길이 다형성(TRFLP 또는 T-RFLP)은 혼합 종 샘플에서 박테리아 커뮤니티를 특성화하기 위해 처음 개발된 기술이다. 이 기술은 토양 곰팡이를 포함한 다른 그룹에도 적용되었다. TRFLP는 형광 태그로 표지된 프라이머 쌍을 사용하여 DNA를 PCR 증폭하는 방식으로 작동한다. 그런 다음 PCR 산물을 RFLP 효소로 소화하고, DNA 시퀀서를 사용하여 생성된 패턴을 시각화한다. 결과는 TRFLP 프로파일에서 밴드 또는 피크를 단순히 세고 비교하거나, 하나 이상의 TRFLP 실행에서 밴드를 알려진 종의 데이터베이스와 일치시켜 분석한다. 밴드 매칭, 비교 및 TRFLP 프로파일의 데이터베이스화 프로세스를 자동화하기 위해 다양한 소프트웨어 도구가 개발되었다.[2]
이 기술은 일부 측면에서 온도 기울기 젤 전기 영동법 또는 변성 기울기 젤 전기 영동법 (TGGE 및 DGGE)과 유사하다.
RFLP와 직접 관련된 서열 변화는 PCR을 통해 더 빠르게 분석할 수도 있다. 변형된 제한 부위 전체로 증폭을 지시할 수 있으며, 생성물을 제한 효소로 소화할 수 있다. 이 방법을 분해된 증폭 다형성 서열 (CAPS)이라고 부른다. 또는, 증폭된 세그먼트는 종종 간단한 도트 블롯으로 수행될 수 있는 과정인 대립 유전자 특이적 올리고뉴클레오티드 (ASO) 프로브로 분석할 수 있다.
참조
[1]
논문
Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia
[2]
논문
A survey of tools for analysing DNA fingerprints
https://academic.oup[...]
2015-03-29
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com