염석
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
염석은 수용액에서 염의 농도 증가에 따라 단백질이나 다른 용질의 용해도가 감소하여 침전되는 현상을 의미한다. 이는 염 이온이 물 분자와 경쟁하여 단백질과 같은 용질 분자 간의 소수성 상호 작용을 증가시키기 때문이다. 염석은 단백질 정제, 식품 제조, 비누 제조 등 다양한 분야에서 활용되며, 단백질 혼합물에서 특정 단백질을 분리하거나 두부 제조와 같은 공정에 사용된다. 그러나 염석은 특정 단백질 외에 다른 오염 물질도 함께 침전시킬 수 있으며, 사용되는 이온의 종류에 따라 단백질의 용해도에 영향을 미치므로 주의가 필요하다.
더 읽어볼만한 페이지
- 분리 과정 - 승화 (화학)
승화는 고체가 액체 상태를 거치지 않고 기체로 직접 변하는 물리적 변화 과정으로, 드라이아이스나 요오드와 같은 물질에서 나타나며 동결건조, 지문 검출, 고순도 물질 정제 등에 활용된다. - 분리 과정 - 결정화
결정화는 용액에서 용질이 고체 결정 형태로 석출되는 과정으로, 핵생성과 결정 성장의 단계를 거치며, 온도, 용매, 과포화도 등의 요인에 의해 영향을 받는다. - 실험 기술 - 승화 (화학)
승화는 고체가 액체 상태를 거치지 않고 기체로 직접 변하는 물리적 변화 과정으로, 드라이아이스나 요오드와 같은 물질에서 나타나며 동결건조, 지문 검출, 고순도 물질 정제 등에 활용된다. - 실험 기술 - 중합효소 연쇄 반응
DNA 중합 효소를 사용하여 DNA 특정 부위를 복제 및 증폭하는 중합효소 연쇄 반응(PCR)은 유전체 연구, 분자생물학, 법의학, 의학 진단 등 다양한 분야에서 활용되는 기술로, 캐리 멀리스에 의해 고안되어 발전해왔다.
| 염석 | |
|---|---|
| 기본 정보 | |
| 다른 이름 | 염석(鹽析) |
| 정의 | 높은 염 농도에서 단백질 용해도가 감소하여 침전되는 현상 |
| 원리 | 염이 물 분자와 더 강하게 상호 작용하여 단백질 주변의 물 분자를 제거, 소수성 상호 작용 증가 |
| 관련 | 용해도 |
| 응용 | 단백질 정제, DNA 추출 |
| 메커니즘 | 높은 염 농도는 단백질 표면의 전하를 가려 단백질 간의 정전기적 반발력을 감소시키고, 단백질의 소수성 영역이 노출되어 단백질-단백질 상호작용을 증가시킴 |
| 사용되는 염 | 황산 암모늄, 염화 나트륨 |
| 역사 | 오래 전부터 알려진 현상으로, 단백질 분리 및 정제에 널리 사용됨 |
| 추가 설명 | 염석은 단백질의 용해도에 영향을 미치는 여러 요인 중 하나이며, pH, 온도 등 다른 요인과 함께 고려되어야 함 |
2. 원리
염석은 염 농도를 높여 단백질이나 저분자 유기화합물을 용액에서 분리하는 방법이다.
단백질 분자는 소수성 아미노산과 친수성 아미노산을 가지고 있다. 수용액에서 소수성 아미노산은 일반적으로 친수성 아미노산에 의해 보호된 소수성 영역을 만들고, 주위를 둘러싸는 물 분자와의 상호 작용(용매화와 수소 결합)에 의해 접힌다. 단백질 표면이 충분히 친수성이면 물에 용해된다.
염 농도가 높아지면 물 분자 일부는 염 이온에 끌어당겨지고, 단백질의 대전된 부분과 상호 작용할 수 있는 물 분자 양이 줄어든다. 그 결과, 단백질-단백질 상호 작용이 용매-용질 상호 작용보다 강해지고, 단백질 분자는 소수성 상호 작용으로 응집한다.
2. 1. 단백질의 염석
염화합물은 수용액에서 해리되는 특성을 가지고 있으며, 이 특성은 염석 효과에 이용된다. 염 농도가 증가하면 일부 물 분자는 염 이온에 의해 끌어당겨지며, 단백질의 하전 부분과 상호 작용할 수 있는 물 분자의 수가 감소한다.[3]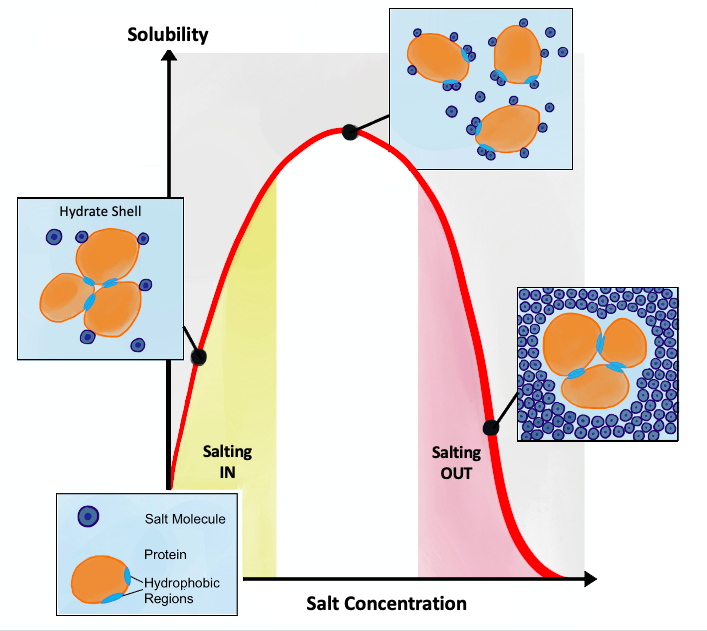
단백질 분자에는 소수성 아미노산과 친수성 아미노산이 있다. 수용액에서 단백질 접힘 후, 소수성 아미노산은 일반적으로 보호된 소수성 영역을 형성하는 반면, 친수성 아미노산은 용매화 분자와 상호 작용하여 단백질이 주변 물 분자와 수소 결합을 형성하도록 한다. 단백질 표면이 충분히 친수성이면 단백질을 물에 녹일 수 있다.[4]
용액에 염을 첨가하면 용매 분자와 염 이온 사이의 상호 작용이 더 빈번해진다. 결과적으로 단백질과 염 이온은 용매 분자와 상호 작용하기 위해 경쟁하며, 그 결과 단백질 분자와 상호 작용할 수 있는 용매 분자의 수가 이전보다 적어진다. 따라서 단백질-단백질 상호 작용이 용매-용질 상호 작용보다 강해지고 단백질 분자는 서로 소수성 상호 작용을 형성하여 응집한다.[5] 주어진 용매에서 해리된 후, 선택된 염의 음전하 원자는 용액에 존재하는 양전하 분자와의 상호 작용을 위해 경쟁하기 시작한다. 마찬가지로, 양전하 양이온은 용매의 음전하 분자와의 상호 작용을 위해 경쟁한다. 이 과정을 염석이라고 한다.
비누는 진한 염 용액에 의해 쉽게 침전되며, 염에 있는 금속 이온은 지방산과 반응하여 비누와 글리세린을 다시 형성한다. 글리세린을 비누로부터 분리하기 위해, 걸쭉한 비등 덩어리를 소금물(NaCl 용액)로 처리한다. 주전자 내용물은 불순한 비누의 응유된 덩어리인 상층과 글리세린이 용해된 수성 염 용액인 하층으로 염석(분리)된다. 폐액이라고 하는 약알칼리성 염 용액은 팬이나 주전자 바닥에서 추출되며, 이후 글리세린 회수를 위해 처리될 수 있다.
2. 2. 저분자 유기화합물의 염석
저분자 유기화합물의 경우 염석은 염류의 수화(水化)로 설명할 수 있다. 염류를 수용액에 넣으면 그 강한 수화력 때문에 물 분자가 수화수로 고정된다. 따라서 저분자 유기화합물의 수화에 필요한 물 분자의 양이 줄어들어 침전이 일어난다.이는 비누 제조에도 이용된다. 비누 용액에 식염(소금) 또는 수산화나트륨을 첨가하면 비누가 침전되어 상층에 떠오른다. 한 번의 염석으로는 정제가 불충분하기 때문에, 다시 물, 희석 식염수, 수산화나트륨 용액 등에 가열 용해시켜 순도를 높여 간다.
3. 응용
단백질 종류에 따라 침전되는 염 농도가 다르기 때문에, 여과나 원심분리로는 분리할 수 없는 단백질 분리에도 사용된다. 두부 제조 과정은 간수를 이용한 염석의 전형적인 예이다.
3. 1. 단백질 정제
단백질은 아미노산 조성이 다르기 때문에, 서로 다른 단백질 분자는 서로 다른 농도의 염 용액에서 침전된다.여러 농도의 염 용액에서 단백질의 용해도를 알고 있다면, 염석을 이용하여 단백질 용액 혼합물에서 원하지 않는 단백질을 제거할 수 있다. 여과 또는 원심분리를 통해 침전물을 제거한 후, 원하는 단백질이 불용성이 되는 수준으로 염 농도를 변경하여 원하는 단백질을 침전시킬 수 있다.[6]
단백질 정제에서 염석의 한 가지 단점은, 특정 단백질을 침전시키는 것 외에도 오염 물질도 함께 침전된다는 것이다. 따라서 더 순수한 단백질을 얻으려면 이온 교환 크로마토그래피와 같은 추가적인 정제 방법이 필요할 수 있다.[7] 단백질의 종류에 따라 침전되는 염 농도가 다르기 때문에, 여과나 원심분리로는 분리할 수 없는 단백질의 분리에도 사용할 수 있다. 두부 제조 과정은 간수를 이용한 염석의 전형적인 예이다.
3. 2. 식품 제조
단백질의 종류에 따라 침전되는 염 농도가 다르기 때문에, 여과나 원심분리로는 분리할 수 없는 단백질의 분리에도 사용할 수 있다. 두부 제조 과정은 간수를 이용한 염석의 전형적인 예이다.[1]3. 3. 비누 제조
비누 제조에는 염석이 이용된다. 비누 용액에 식염 또는 수산화나트륨을 첨가하면 비누가 침전되어 상층에 부유한다. 한 번의 염석으로는 정제가 불충분하기 때문에, 다시 물, 희석 식염수, 수산화나트륨 용액 등에 가열 용해시켜 순도를 높여 간다.4. 주의 사항
단백질 분자에는 소수성 아미노산과 친수성 아미노산이 있다. 수용액 중에서는 소수성 아미노산은 일반적으로 친수성 아미노산에 의해 보호된 소수성 영역을 만들고, 주위를 둘러싸는 물 분자와의 상호 작용(용매화와 수소 결합)에 의해 접힌다. 단백질의 표면이 충분히 친수성이라면 그 단백질은 물에 용해된다.
염 농도를 높였을 때 물 분자의 일부는 염의 이온에 의해 끌어당겨지고, 단백질의 대전된 부분과의 상호 작용에 할당되는 물 분자의 양이 감소한다. 그 결과, 단백질-단백질 상호 작용이 용매-용질 상호 작용보다 강해지고, 단백질 분자는 소수성 상호 작용에 의해 응집한다.
이온에 따라서는 농도가 증가함에 따라 단백질의 용해도를 증가시키는 경우가 있다. 또한, 단백질의 특성을 억제하는 이온도 있으므로, 단백질의 기능을 분석할 때는 다른 이온을 사용하거나 이온을 제거해야 할 필요가 있다.
참조
[1]
웹사이트
Make The Most of Antisolvent Crystallization
https://www.chemical[...]
PutmanMedia
2010
[2]
논문
Methods for extracting genomic DNA from whole blood samples: current perspectives
2020-12-04
[3]
논문
Mechanism of protein salting in and salting out by divalent cation salts: balance between hydration and salt binding
1984-12
[4]
논문
Water follows polar and nonpolar protein surface domains
2019-09-24
[5]
서적
Proteomic Profiling and Analytical Chemistry
[6]
논문
Protein Precipitation Using Ammonium Sulfate
1998-09
[7]
서적
Laboratory Methods in Enzymology: Protein Part C
[8]
서적
http://book.naver.co[...]
[9]
서적
http://book.naver.co[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com