염화 니켈(II)
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
염화 니켈(II)는 니켈 광석 제련 과정의 부산물로 생성되며, 금속 니켈을 염산에 녹이거나 산화 니켈(II) 또는 탄산 니켈(II)을 염산에 용해하여 제조할 수도 있다. 무수 염화 니켈(II)은 염화 카드뮴과 유사한 구조를 가지며, 다양한 리간드와 반응하여 배위 착물을 형성한다. 유기 합성에 루이스 산, 환원제, 촉매 등으로 사용되며, 섭취, 흡입, 피부 및 눈 접촉 시 자극적이며 장기간 노출 시 암 위험을 증가시킬 수 있다.
더 읽어볼만한 페이지
- 니켈 화합물 - 황산 니켈
황산 니켈은 니켈의 전기도금, 촉매, 안료의 전구체로 사용되며, 다양한 수화물 형태가 존재하고 가열 시 분해되며, 피부 알레르겐이자 인체 발암 물질로 분류된다. - 니켈 화합물 - 보조 인자 F430
보조 인자 F430은 메탄 생성 박테리아 내 니켈 함유 효소로서 메탄 생성 과정에서 메틸 그룹 전달 및 활성화에 중요한 역할을 하며, 콜핀 고리를 통해 니켈 이온과 결합하여 메틸-조효소 M 환원 효소의 활성 부위에서 작용하고, 메탄 생성 억제 및 친환경 에너지 기술 개발 분야에서 연구되고 있다. - 배위 화합물 - Alq3
트리스(8-히드록시퀴놀리네이트)알루미늄(Alq₃)은 자오면 및 안면 이성질체와 여러 다형체를 가지며, 유기 발광 다이오드(OLED)의 전자 수송층 물질로 널리 쓰이고 퀴놀린 고리의 치환기 변화를 통해 발광 특성 조절이 가능하다. - 배위 화합물 - 시스플라틴
시스플라틴은 cis-[Pt(NH3)2Cl2] 화학식을 가진 사각 평면형 배위 화합물로, DNA 복제 방해를 통해 암세포를 억제하는 항암제이며, 다양한 고형암 및 혈액암 치료에 사용된다. - 금속 할로젠화물 - 염화 칼륨
염화칼륨(KCl)은 칼륨 이온과 염화물 이온으로 이루어진 이온성 화합물로, 칼륨 비료, 화학 공업, 의학, 사형 집행 등 다양한 용도로 사용되며, 면심입방구조와 광학적 특성을 지니고, 캐나다, 러시아, 벨라루스 등에서 주로 생산된다. - 금속 할로젠화물 - 염화 나트륨
염화 나트륨은 염화물 이온과 나트륨 이온으로 구성된 백색 고체 이온 결정으로, 짠맛을 내며 융점은 800.4℃이고, 다양한 용도로 사용되며 겨울철 제설에도 활용되는 정염의 일종이다.
| 염화 니켈(II) - [화학 물질]에 관한 문서 | |
|---|---|
| 일반 정보 | |
 | |
 | |
| IUPAC 명칭 | 염화 니켈(II) |
| 다른 이름 | 염화 니켈 염화수소의 니켈(II) 염 |
| 식별 정보 | |
| CAS 등록번호 | 7718-54-9 |
| CAS 등록번호 (육수화물) | 7791-20-0 |
| ChEBI | 34887 |
| ChemSpider ID | 22796 |
| EINECS | 231-743-0 |
| KEGG | C14711 |
| PubChem | 24385 |
| RTECS | QR6480000 |
| UN 번호 | 3288 3077 |
| UNII | 696BNE976J |
| UNII (육수화물) | T8365BUD85 |
| SMILES (무수물) | [Ni+2].[Cl-].[Cl-] |
| SMILES (육수화물) | Cl[Ni-4](Cl)([OH2+])([OH2+])([OH2+])[OH2+].O.O |
| InChI | 1/2ClH.Ni/h2*1H;/q;;+2/p-2 |
| InChIKey | QMMRZOWCJAIUJA-NUQVWONBAR |
| 표준 InChI | 1S/2ClH.Ni/h2*1H;/q;;+2/p-2 |
| 표준 InChIKey | QMMRZOWCJAIUJA-UHFFFAOYSA-L |
| 물리화학적 성질 | |
| 화학식 | NiCl2 |
| 외형 | 황갈색 결정 (무수물) 조해성 (무수물) 녹색 결정 (육수화물) |
| 냄새 | 무취 |
| 밀도 | 3.55 g/cm3 (무수물) 1.92 g/cm3 (육수화물) |
| 몰 질량 | 129.5994 g/mol (무수물) 237.69 g/mol (육수화물) |
| 용해도 (무수물) | 67.5 g/100 mL (25 °C) 87.6 g/100 mL (100 °C) |
| 용해도 (육수화물) | 282.5 g/100 mL (25 °C) 578.5 g/100 mL (100 °C) |
| 다른 용매에 대한 용해도 | 하이드라진에 0.8 g/100 mL 에틸렌 글리콜, 에탄올, 수산화 암모늄에 용해 암모니아, 질산에 불용 |
| 녹는점 | 1001 °C (무수물) 140 °C (육수화물) |
| pKa (육수화물) | 4 |
| 자기 감수율 | +6145.0·10−6 cm3/mol |
| 구조 | |
| 배위 | 니켈에서 팔면체 |
| 결정 구조 | 단사정계 |
| 열화학 | |
| 표준 생성 엔탈피 | −316 kJ·mol−1 |
| 엔트로피 | 107 J·mol−1·K−1 |
| 위험성 | |
| 주요 위험 | 매우 유독함 (T+) 자극성 (Xi) 환경에 위험함 (N) 발암 물질 |
| NFPA 704 | 보건: 3 화재: 0 반응성: 0 |
| 신호어 | 위험 |
| 인화점 | 불연성 |
| LD50 | 105 mg/kg (쥐, 경구) |
| 관련 화합물 | |
| 다른 음이온 | 플루오린화 니켈(II) 브로민화 니켈(II) 아이오딘화 니켈(II) |
| 다른 양이온 | 염화 팔라듐(II) 염화 백금(II) 염화 백금(II,IV) 염화 백금(IV) |
| 다른 화합물 | 염화 코발트(II) 염화 구리(II) |
2. 생산 및 합성
염화 니켈은 니켈 광석 제련 과정에서 부산물로 생성된다. 염산(hydrochloric acid)을 사용하여 니켈 함유 광석을 로스팅하고 정제하여 얻은 니켈 매트 및 잔류물 추출 시 염화 니켈이 생성된다.[5] 염화 니켈 용액을 전기 분해하여 니켈 금속을 생산한다. 구리 염화물을 포함하는 다양한 반응과 같은 광석 농축물을 처리하는 과정에서도 염화 니켈을 얻을 수 있다.[5]
:NiS + 2 CuCl2 → NiCl2 + 2 CuCl + S
:NiO + 2 HCl → NiCl2 + H2O
구리 화합물인 염화구리 제조법과 유사하게, 금속 니켈을 산소 존재 하에서 염산에 녹이거나, 산화 니켈(II) 또는 탄산 니켈(II)을 염산에 녹여 제조할 수 있다. 니켈 광석 제련 과정에서 생기는 찌꺼기를 염산으로 녹여서 얻는 것이 가장 일반적인 염화 니켈(II) 제조법이다.
하지만 염화 니켈(II)은 가격이 저렴하고 보존성이 좋아 실험실에서 합성하는 경우는 드물다. 수화물을 염화 티오닐 존재 하, 또는 염화 수소 기류 중에서 가열하면 무수물을 얻을 수 있다. 단순 가열로는 무수물이 되지 않는다.
: NiCl2·6H2O + 6 SOCl2 → NiCl2 + 6SO2 + 12HCl
탈수 반응은 녹색에서 황색으로 색 변화를 통해 확인할 수 있다.[15]
2. 1. 실험실 제법
염화 니켈(II)는 저렴하고 보존 기간이 길어 실험실에서 직접 제조하는 경우는 드물다.[6] 황색의 이수화물(NiCl2·2H2O)은 육수화물을 66~133°C 사이에서 가열하여 생성된다.[6] 수화물은 염화 티오닐과 반응시키거나 염화 수소 기류 하에서 가열하면 무수 형태로 변환된다.[6]:NiCl2·6H2O + 6 SOCl2 → NiCl2 + 6SO2 + 12HCl
이 반응에서 탈수는 녹색에서 노란색으로 색상이 변화하면서 진행된다.[7][15] 단순히 수화물을 가열하는 것만으로는 무수 이염화물을 얻을 수 없다.[6]
헥사암민니켈 클로라이드를 조심스럽게 가열하여 코발트가 없는 순수한 염화 니켈(II) 화합물을 얻을 수 있다.[8]
:
금속 니켈을 산소 존재 하에서 염산에 녹이거나, 산화 니켈(II) 또는 탄산 니켈(II)을 염산에 녹여 제조할수도 있다.
3. 구조
무수 염화 니켈(II) (NiCl2)은 염화 카드뮴(CdCl₂) 구조를 가진다.[9] 각 Ni2+ 이온은 6개의 Cl− 이온과 배위 결합하며, 각 염화물 이온은 3개의 Ni(II) 중심과 결합한다.[9] NiCl2에서 Ni-Cl 결합은 "이온성 성질"을 갖는다. 옅은 노란색 브롬화 니켈(II)(NiBr2)와 검은색 요오드화 니켈(II)(NiI2)는 유사한 구조를 취하지만, 할로겐화물의 배열이 달라서 요오드화 카드뮴(CdI2) 모티프를 취한다.
반면에, 육수화물 NiCl2·6H2O는 분리된 ''트랜스''-[NiCl2(H2O)4] 분자로 구성되며, 이는 인접한 물 분자와 더 약하게 연결되어 있다. 6개의 물 분자 중 4개만 니켈에 결합되어 있고 나머지 2개는 결정수이다.[9] 염화 코발트(II) 육수화물도 유사한 구조를 갖는다.
이수화물 NiCl2·2H2O는 육수화물과 무수 형태 사이의 중간 구조를 취한다. 이는 NiCl2의 무한 사슬로 구성되어 있으며, 두 염화물 중심 모두 가교 리간드이다. 팔면체 중심의 트랜스 자리는 아쿠오 리간드로 채워져 있다.[10] 사수화물 NiCl2·4H2O도 알려져 있다.
4. 반응
염화 니켈(II) 용액은 가수분해로 인해 pH가 약 4 정도인 약산성을 띤다.
염화 니켈(II)은 다양한 리간드와 반응하여 배위 착물을 형성한다. H₂O영어 리간드는 암모니아, 아민류, 티오에테르류, 티올레이트류 및 유기 포스핀에 의해 빠르게 치환된다.[11][12]
일부 유도체에서 염화물은 배위권 내에 남아 있지만, 염기성이 강한 리간드로 치환될 수 있다. 대표적인 착물의 예시는 다음과 같다:
| 착물 | 색상 | 자성 | 기하학 |
|---|---|---|---|
| [Ni(NH3)6]Cl2 | 파란색/보라색 | 상자성 | 팔면체 |
| [Ni(en)3]2+ | 보라색 | 상자성 | 팔면체 |
| NiCl2(dppe) | 주황색 | 반자성 | 사각 평면 |
| [Ni(CN)4]2− | 무색 | 반자성 | 사각 평면 |
| [NiCl4]2− | 황록색 | 상자성 | 사면체 |
[Ni(NH3)6]Cl2는 자색, 상자성, 팔면체형이다.[17][18] NiCl2(Ph2PCH2CH2PPh2)는 오렌지색, 반자성, 평면4배위이다. [Ni(CN)4]2−는 무색, 반자성, 평면4배위이다. [NiCl4]2−는 청색, 상자성, 사면체형이다.
NiCl2는 아세틸아세토네이트 착물 Ni(acac)2(H2O)2와 벤젠에 용해되는 (Ni(acac)2)3의 전구체이며, 이는 유기니켈 화학에서 중요한 시약인 Ni(1,5-사이클로옥타디엔)2의 전구체이다. 또한, 염화 니켈(II)로부터 Ni(acac)2 를 합성할 수 있으며, 이것은 비스(1,5-시클로옥타디엔)니켈 Ni(cod)2의 전구체가 된다. Ni(cod)2는 유기 니켈 화합물의 화학에서 다양한 용도를 가진다.
물 제거제가 존재할 때, 수화된 염화 니켈(II)은 디메톡시에탄 (dme)과 반응하여 분자 착물 NiCl2(dme)2를 형성한다. 이 착물 내의 dme 리간드는 불안정하다.
염화 니켈 착물 중 어떤 종류는 용액 중에서 2종류의 구조의 평형 혼합물로서 존재한다. 이것은 니켈(II) 착체에서 보이는 특징적인 성질이다. 예를 들어 NiCl2(PPh3)2는 4배위이지만, 용액 중에서는 반자성의 평면4배위형과 상자성의 사면체형 구조 사이에서 평형이 보인다. 평면4배위 착체는 또 다른 배위자가 추가되어 5배위를 취할 수 있다.
4. 1. 배위 착물 형성
염화 니켈(II)은 다양한 리간드와 반응하여 배위 착물을 형성한다. H2O 리간드는 암모니아, 아민류, 티오에테르류, 티올레이트류 및 유기 포스핀에 의해 빠르게 치환된다.[11][12]일부 유도체에서 염화물은 배위권 내에 남아 있지만, 염기성이 강한 리간드로 치환될 수 있다. 대표적인 착물의 예시는 다음과 같다:
| 착물 | 색상 | 자성 | 기하학 |
|---|---|---|---|
| [Ni(NH3)6]Cl2 | 파란색/보라색 | 상자성 | 팔면체 |
| [Ni(en)3]2+ | 보라색 | 상자성 | 팔면체 |
| NiCl2(dppe) | 주황색 | 반자성 | 사각 평면 |
| [Ni(CN)4]2− | 무색 | 반자성 | 사각 평면 |
| [NiCl4]2− | 황록색 | 상자성 | 사면체 |
NiCl2는 아세틸아세토네이트 착물 Ni(acac)2(H2O)2와 벤젠에 용해되는 (Ni(acac)2)3의 전구체이며, 이는 유기니켈 화학에서 중요한 시약인 Ni(1,5-사이클로옥타디엔)2의 전구체이다. 또한, 염화 니켈(II)로부터 니켈(II) 아세틸아세토네이트 Ni(acac)2 를 합성할 수 있으며, 이것은 비스(1,5-시클로옥타디엔)니켈 Ni(cod)2의 전구체가 된다. Ni(cod)2는 유기 니켈 화합물의 화학에서 다양한 용도를 가진다.
물 제거제가 존재할 때, 수화된 염화 니켈(II)은 디메톡시에탄 (dme)과 반응하여 분자 착물 NiCl2(dme)2를 형성한다. 이 착물 내의 dme 리간드는 불안정하다.
염화 니켈 착물 중 어떤 종류는 용액 중에서 2종류의 구조의 평형 혼합물로서 존재한다. 이것은 니켈(II) 착체에서 보이는 특징적인 성질이다. 예를 들어 NiCl2(PPh3)2는 4배위이지만, 용액 중에서는 반자성의 평면4배위형과 상자성의 사면체형 구조 사이에서 평형이 보인다. 평면4배위 착체는 또 다른 배위자가 추가되어 5배위를 취할 수 있다.
5. 유기 합성에 응용
염화 니켈(II)와 그 수화물은 때때로 유기 합성에 유용하다.[13]
- 온화한 루이스 산으로서, 예를 들어 디엔올의 위치 선택적 이성질체화에 사용된다.
::
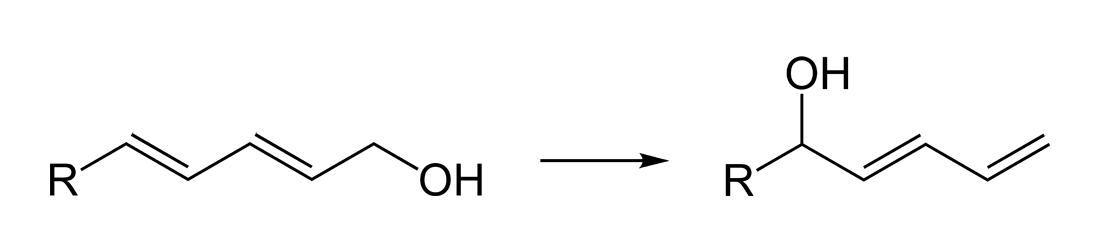
- CrCl2와 조합하여 알데히드와 비닐 요오드화물을 결합하여 알릴 알코올을 생성한다.
- LiAlH4의 존재 하에서 선택적 환원에 사용되며, 예를 들어 알켄을 알칸으로 변환하는 데 사용된다.
- 찰스 앨런 브라운의 니켈 붕소 촉매의 전구체로, NaBH4과의 반응을 통해 제조된다.
- 아주 미세한 Ni의 전구체로, 아연으로 환원하여 알데히드, 알켄, 그리고 니트로 방향족 화합물을 환원하는 데 사용된다. 이 시약은 또한 R = 아릴, 비닐일 때 2RX → R-R와 같은 동종 결합 반응을 촉진한다.
- 인산염과 방향족 탄화수소 요오드화물, ArI로부터 다이알킬 아릴포스포네이트를 만드는 촉매로 사용된다.
::ArI + P(OEt)3 → ArP(O)(OEt)2 + EtI
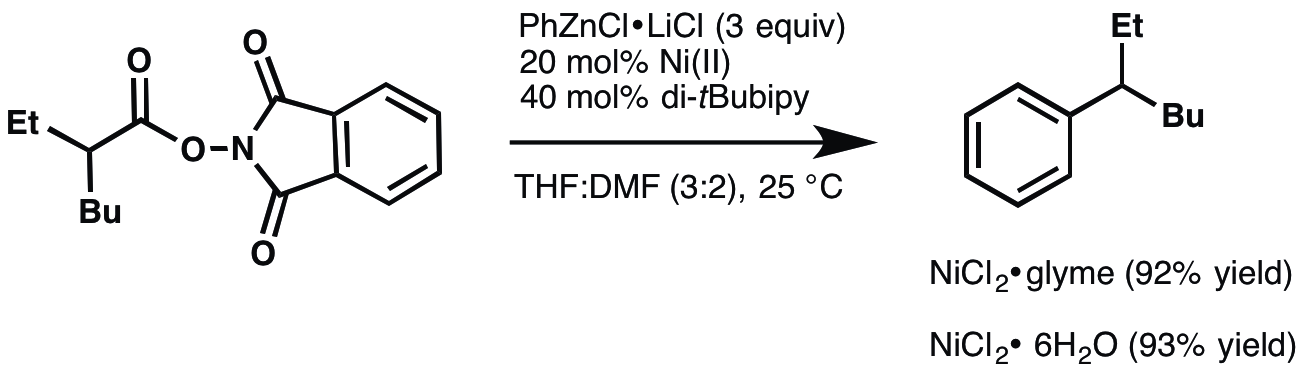
NiCl2-dme(또는 NiCl2-glyme)는 육수화물에 비해 용해도가 증가하여 사용된다.[14]
5. 1. 루이스 산
염화 니켈(II)과 그 수화물은 유기 합성에 유용하게 사용된다.[13]온화한 루이스 산으로서, 디엔올의 위치 선택적 이성질체화 반응 등에 사용된다.[13]
5. 2. 환원제
CrCl2와 조합하여 알데히드와 비닐 요오드화물을 결합하여 알릴 알코올을 생성한다.[13] LiAlH4의 존재 하에서 선택적 환원에 사용되며, 예를 들어 알켄을 알칸으로 변환하는 데 사용된다.[13]금속 아연으로 환원하여 활성 금속 니켈 분말을 제조하여 알데히드, 케톤, 방향족 니트로 화합물의 환원에 사용된다. 방향족 화합물이나 비닐 화합물의 호모 커플링에도 사용된다.[13]
5. 3. 촉매
염화 니켈(II)과 그 수화물은 유기 합성에 유용하게 사용된다.[13]- 온화한 루이스 산으로서, 예를 들어 디엔올의 위치 선택적 이성질체화에 사용된다.
::
- CrCl2와 조합하여 알데히드와 비닐 요오드화물을 결합하여 알릴 알코올을 생성한다.
- LiAlH4의 존재 하에서 선택적 환원에 사용되며, 예를 들어 알켄을 알칸으로 변환하는 데 사용된다.
- 찰스 앨런 브라운의 니켈 붕소 촉매의 전구체로, NaBH4과의 반응을 통해 제조된다.
- 아연으로 환원하여 알데히드, 알켄, 그리고 니트로 방향족 화합물을 환원하는 데 사용되는 미세 니켈의 전구체로 활용된다. 이 시약은 R = 아릴, 비닐일 때 2RX → R-R와 같은 동종 결합 반응을 촉진한다.
- 인산염과 방향족 탄화수소 요오드화물, ArI로부터 다이알킬 아릴포스포네이트를 만드는 촉매로 사용된다.
::ArI + P(OEt)3 → ArP(O)(OEt)2 + EtI
NiCl2-dme(또는 NiCl2-glyme)는 육수화물에 비해 용해도가 증가하여 사용된다.[14]
6. 안전성
염화 니켈(II)은 섭취, 흡입, 피부 접촉 및 눈 접촉 시 자극적이다.[4] 니켈 및 그 화합물에 대한 장기간 흡입 노출은 폐와 비강의 암 위험 증가와 관련이 있다.[4]
참조
[1]
서적
CRC Handbook of Chemistry and Physics, 84th Edition
CRC Press
[2]
서적
Chemical Principles 6th Ed.
Houghton Mifflin Company
[3]
간행물
Nickel metal and other compounds (as Ni)
[4]
논문
Evidence of carcinogenicity in humans of water-soluble nickel salts
2010
[5]
서적
Ullmann's Encyclopedia of Industrial Chemistry
2000
[6]
서적
Inorganic Syntheses
[7]
서적
Inorganic Syntheses
[8]
서적
Pure chemicals. Manual for laboratory preparation of inorganic substances
[9]
문서
Structural Inorganic Chemistry
Oxford Press
[10]
논문
An X-ray diffraction study on nickel(II) chloride dihydrate
[11]
서적
Tetrahalo Complexes of Dipositive Metals in the First Transition Series
[12]
논문
The Crystal and Molecular Structure of Tetraethylammonium Tetrachloronickelate(II)
[13]
문서
Nickel(II) Chloride
J. Wiley & Sons, New York
2001-04-15
[14]
논문
Practical Ni-Catalyzed Aryl–Alkyl Cross-Coupling of Secondary Redox-Active Esters
2016-02-24
[15]
문서
Anhydrous Metal Chlorides
[16]
문서
Structural Inorganic Chemistry
Oxford Press
[17]
문서
Tetrahalo complexes of dipositive metals in the first transition series
[18]
문서
The crystal and molecular structure of tetraethylammonium tetrachloronickelate(II)
[19]
서적
CRC Handbook of Chemistry and Physics, 84th Edition
CRC Press
[20]
서적
Chemical Principles 6th Ed.
https://archive.org/[...]
Houghton Mifflin Company
[21]
간행물
Nickel metal and other compounds (as Ni)
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com