헤메리트린
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
헤메리트린은 산소를 운반하는 단백질로, 대부분의 O2 운반체와 달리 산소를 과산화수소 형태로 유지하는 특징을 보인다. 이 단백질은 두 개의 철 원자를 포함하며, 철 원자는 글루탐산, 아스파르트산, 히스티딘 잔기에 의해 단백질에 결합한다. 헤메리트린은 헴을 포함하지 않으며, 헤모글로빈보다 산소 운반 효율이 낮지만, 일산화 탄소에 대한 친화력은 낮아 일산화 탄소에 대한 저항성을 가진다. 헤메리트린/HHE 양이온 결합 도메인은 다양한 단백질에서 발견되며, 철 외에 카드뮴과 같은 다른 금속에도 결합할 수 있다. 이 도메인은 세균에서 신호 전달 및 주화성에 관여하며, 낮은 산소 농도 환경에서 생존하는 데 중요한 역할을 한다.
더 읽어볼만한 페이지
- 호흡 색소 - 헤모시아닌
헤모시아닌은 연체동물과 절지동물의 혈액에서 산소 운반 역할을 하는 구리 함유 단백질이며, 헤모글로빈과 유사하게 산소를 운반하지만 분자 구조와 메커니즘에 차이가 있고, 촉매 활성 및 항암 효과에 대한 연구가 진행된다. - 금속단백질 - 광계
광계는 틸라코이드 막에 위치하며 빛 에너지를 화학 에너지로 전환하는 단백질 복합체로, 광수집 복합체에 둘러싸인 반응 중심을 가지며 물 분해를 통해 전자를 얻고 산소를 방출하는 광계 II와 NADPH를 생성하는 광계 I 두 가지 주요 유형으로 나뉜다. - 금속단백질 - 미오글로빈
미오글로빈은 근육 조직 내 산소 저장 단백질로, 헴기에 산소를 결합하며, 최초로 삼차 구조가 밝혀진 단백질이고, 헤모글로빈보다 산소 친화력이 높으며, 붉은 고기 색 결정, 대체육 활용, 근육 손상 진단 등과 관련된다. - 철 화합물 - 철-황 클러스터
철-황 클러스터는 철과 황 원자의 결합으로 이루어진 무기화합물로서, 생체 내 단백질의 구성요소로 중요한 역할을 하며, Fe:S 화학량론에 따라 다양한 형태로 존재하고 전자전달, 촉매작용 등에 필수적이며, 여러 분야에서 응용될 수 있다. - 철 화합물 - 시멘타이트
시멘타이트(Fe3C)는 탄소강과 주철에서 발견되는 금속간 화합물로, 철강의 상변태 속도와 기계적 성질에 영향을 미치며, 퀴리 온도에서 자성 변화를 보이고 높은 경도와 강도를 가진다.
| 헤메리트린 | |
|---|---|
| Hemerythrin-like family | |
| 기본 정보 | |
 | |
| PROSITE | PDOC00476 |
| Pfam | PF01814 |
| InterPro | IPR035938 |
| CATH | 1HMO |
| SCOP | 2HMZ |
| 그리스어 어원 | grc: αἷμα haîma: 혈액 |
| 그리스어 어원 | grc: ἐρυθρός erythrós: 빨간색 |
2. 구조 및 메커니즘
헤메리트린의 이산소 결합 메커니즘은 특이하다. 대부분의 산소 운반체는 이산소 착물을 형성하지만, 헤메리트린은 산소를 과산화수소(-OOH-) 형태로 유지한다. 산소 결합 부위는 두 개의 철 원자로 구성된 이핵 철 중심이다. 철 원자는 글루탐산과 아스파르트산의 카르복실레이트 측쇄와 다섯 개의 히스티딘 잔기를 통해 단백질에 결합한다.
헤메리트린은 전형적으로 13–14 kDa의 α-형과 β-형 서브유닛으로 구성된 동종팔합체 또는 이종팔합체로 존재하지만, 일부 종은 이량체, 삼량체 및 사량체 헤메리트린을 가지고 있다. 각 서브유닛은 이핵 철 중심을 결합하는 4개의 α-나선 구조를 가지고 있다. 헤메리트린은 크기가 크기 때문에 자유롭게 떠다니기보다는 혈액 내 세포 또는 "소체"에서 발견된다.
헤모글로빈과는 달리 대부분의 헤메리트린은 산소에 대한 협동 결합이 부족하여 헤모글로빈보다 효율이 약 1/4 정도 낮다. 하지만 일부 완족동물에서는 헤메리트린이 산소의 협동 결합을 보인다. 협동 결합은 서브유닛 간의 상호 작용에 의해 달성된다. 즉, 하나의 서브유닛의 산소화는 두 번째 유닛의 산소에 대한 친화력을 증가시킨다.
헤메리트린은 일산화 탄소(CO)에 대한 친화력이 헤모글로빈과는 달리 산소에 대한 친화력보다 실제로 낮다. 헤메리트린이 CO 중독에 대한 친화력이 낮은 것은 산소 결합에서 수소 결합의 역할, 즉 일반적으로 수소 결합에 관여하지 않는 CO 복합체와 호환되지 않는 경로 모드를 반영한다.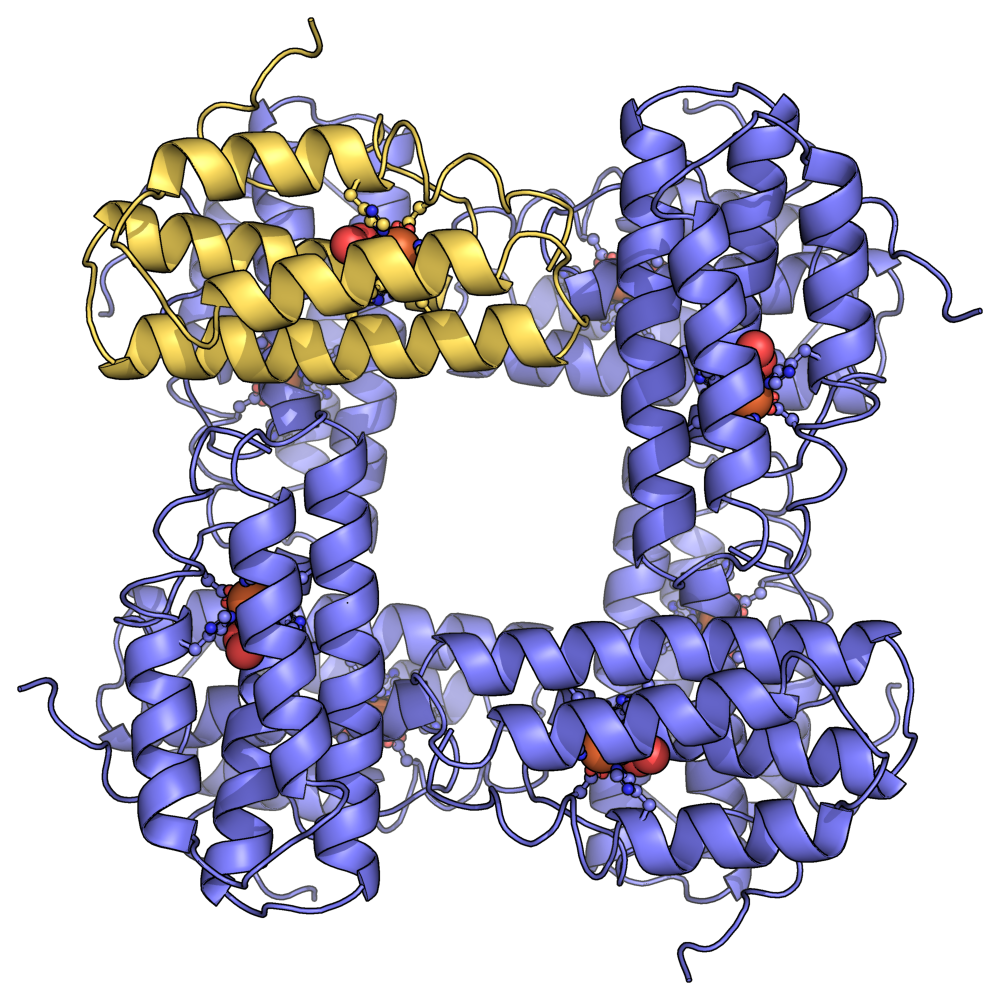
헤메리트린/HHE 양이온 결합 단백질 도메인은 헤메리트린, 미오헤메리트린 및 관련 단백질에서 중복된 도메인으로 나타난다. 이 도메인은 헤메리트린에서 철에 결합하지만, ''Nereis diversicolor'' 헤메리트린과 같은 관련 단백질에서는 카드뮴과 같은 다른 금속에 결합할 수 있다. 또한, ''Cupriavidus necator''의 NorA 단백질에서도 발견되는데, 이 단백질은 일산화 질소에 대한 반응 조절 단백질로, 금속 리간드에 대한 다른 구성을 제시한다. 헤메리트린/HHE 양이온 결합 도메인을 포함하는 ''Cryptococcus neoformans''(Filobasidiella neoformans)의 단백질 또한 일산화 질소 반응에 관여한다.[4] 이 도메인을 포함하는 ''황색포도상구균'' 단백질, 철-황 복합체 복구 단백질 ScdA는 생물체가 낮은 산소 농도의 환경에서 생존하도록 전환할 때 중요하다고 언급되었다; 아마도 이 단백질은 산소 저장 또는 제거 역할을 할 것이다.[5]
세균에서 발견되는 헤메리트린/HHE (H-HxxxE-HxxxH-HxxxxD) 단백질은 신호 전달 및 주화성에 관여한다. 더 멀리 관련된 것들로는 H-HxxxE-H-HxxxE 단백질 (E3 리가아제 포함)과 동물 F-box 단백질 (H-HExxE-H-HxxxE)이 있다.[6]
2. 1. 산소 결합 메커니즘
헤메리트린의 이산소 결합 메커니즘은 대부분의 O2 운반체와는 다르게 이산소 착물을 형성하지 않고, O2를 과산화수소(HO2 또는 -OOH−) 형태로 유지한다. O2 결합 부위는 한 쌍의 철 중심으로 구성되며, 철 원자는 글루탐산과 아스파르트산의 카르복실레이트 측쇄와 다섯 개의 히스티딘 잔기를 통해 단백질에 결합한다. 헤메리트린과 미오헤메리트린은 철 중심의 산화 및 배위 상태에 따라 다음과 같이 설명된다.| 상태 | 설명 |
|---|---|
| Fe2+—OH—Fe2+ | 데옥시 (환원) |
| Fe2+—OH—Fe3+ | 세미-메트 |
| Fe3+—O—Fe3+—OOH− | 옥시 (산화) |
| Fe3+—OH—Fe3+— (다른 리간드) | 메트 (산화) |
헤메리트린에 의한 O2 흡수는 이철 중심의 2전자 산화에 의해 과산화수소 (OOH−) 착물이 생성되면서 일어난다. O2 결합은 다음과 같이 진행된다.
1. 데옥시헤메리트린은 수산기(-OH)로 연결된 두 개의 고스핀 이가 철 이온(Fe2+)을 포함한다. 한 철은 6배위이고 다른 철은 5배위이다. 수산기는 브릿징 리간드 역할을 하며, O2 기질에 양성자를 제공한다.
2. 양성자 전달 결과로 옥시- 및 메트헤메리트린에서 단일 산소 원자(μ-옥소) 브릿지가 형성된다.
3. O2는 5배위 Fe2+ 중심의 빈 배위 부위에 결합한다.
4. 전자가 이가 철 이온에서 전달되어 결합된 과산화물(OOH−)을 가진 이핵 삼가 철(Fe3+, Fe3+) 중심이 생성된다.[2][3]
헤메리트린은 헴을 포함하지 않는데, 헤모글로빈, 헤모시아닌 등의 이름에 있는 "헴"은 철을 의미하는 것이 아니라 그리스어로 피를 나타내는 단어에서 유래했다.
헤메리트린의 산소 결합은 환원형 철 원자를 2전자 산화하여 과산화물 형태로 만든다. 산소 분자의 결합 방식은 다음과 같다.
일산화 탄소에 대한 헤메리트린의 친화성은 헤모글로빈과 달리 매우 작아, 헤메리트린을 가진 생물은 일산화 탄소에 대해 저항성이 있다. 이는 헤메리트린의 결합 방식 때문에 일산화 탄소와의 결합 상태가 안정적이지 않기 때문이다.
2. 2. 산화 환원 상태
헤메리트린의 이산소 결합 메커니즘은 대부분의 O2 운반체와 다르게 이산소 착물을 형성하지 않고, O2를 과산화수소(HO2 또는 -OOH-) 형태로 유지한다.[2][3] O2 결합 부위는 한 쌍의 철 중심으로 구성되며, 철 원자는 글루탐산과 아스파르트산의 카르복실레이트 측쇄와 다섯 개의 히스티딘 잔기를 통해 단백질에 결합한다. 헤메리트린과 미오헤메리트린은 철 중심의 산화 및 배위 상태에 따라 다음과 같이 설명된다.| 상태 | 설명 |
|---|---|
| Fe2+—OH—Fe2+ | 데옥시 (환원) |
| Fe2+—OH—Fe3+ | 세미-메트 |
| Fe3+—O—Fe3+—OOH− | 옥시 (산화) |
| Fe3+—OH—Fe3+— (다른 리간드) | 메트 (산화) |
헤메리트린에 의한 O2 흡수는 이철 중심(diferrous)의 2전자 산화에 의해 과산화수소(OOH−) 착물이 생성되면서 일어난다. O2 결합은 아래 그림에서 대략적으로 설명된다.
데옥시헤메리트린은 수산기('''A''')에 의해 연결된 두 개의 고스핀 이가 철 이온을 포함한다. 한 철은 6배위이고 다른 철은 5배위이다. 수산기는 브릿징 리간드 역할을 하면서 O2 기질에 대한 양성자 공여체 역할도 한다. 이 양성자 전달 결과 옥시- 및 메트헤메리트린에서 단일 산소 원자(μ-옥소) 브릿지가 형성된다. O2는 빈 배위 부위에서 5배위 Fe2+ 중심에 결합한다('''B'''). 그런 다음 전자가 이가 철 이온에서 전달되어 결합된 과산화물 ('''C''')을 가진 이핵 삼가 철(Fe3+,Fe3+) 중심이 생성된다.[2][3]
헤메리트린에는 이름과 달리 헴이 포함되어 있지 않다. 혈액 속에서 산소를 운반하는 헤모글로빈이나 헤모시아닌, 헤메리트린 등의 이름의 헴은 철을 의미하는 것이 아니라, 그리스어로 피를 나타내는 단어에서 유래되었다.
산소 결합 부위는 2개의 철 원자이다. 철 원자는 글루탐산이나 아스파르트산의 측쇄의 카르복실기나 5개의 히스티딘 잔기를 통해 단백질에 배위하고 있다. 헤메리트린과 미오헤메리트린은 철 중심의 산화 환원 상태에 따라 다음과 같이 표기되는 경우가 있다.
| 상태 | 설명 |
|---|---|
| 환원형 | |
| 반중간형 | |
| 산화형 | |
| 중간형 |
헤메리트린의 산소 결합은 환원형 철 원자를 2전자 산화하여 과산화물형으로 만듦으로써 일어난다. 산소 분자의 결합 방식은 다음과 같다.
헤메리트린은 전형적으로 각각 13–14 kDa의 α-형과 β-형 서브유닛으로 구성된 동종팔합체 또는 이종팔합체로 존재하지만, 일부 종은 이량체, 삼량체 및 사량체 헤메리트린을 가지고 있다. 각 서브유닛은 이핵 철 중심을 결합하는 4개의 α-나선 구조를 가지고 있다. 헤메리트린은 크기가 크기 때문에 자유롭게 떠다니기보다는 혈액 내 세포 또는 "소체"에서 발견된다.
헤메리트린/HHE 양이온 결합 단백질 도메인은 헤메리트린, 미오헤메리트린 및 관련 단백질에서 중복된 도메인으로 나타난다. 이 도메인은 헤메리트린에서 철에 결합하지만, ''Nereis diversicolor'' 헤메리트린과 같은 관련 단백질에서는 카드뮴과 같은 다른 금속에도 결합할 수 있다. ''Cupriavidus necator''의 NorA 단백질, ''Cryptococcus neoformans''(Filobasidiella neoformans)의 단백질, ''황색포도상구균'' 철-황 복합체 복구 단백질 ScdA에도 이 도메인이 존재하며, 이들은 일산화 질소 반응 조절, 낮은 산소 농도 환경 생존 전환, 산소 저장 또는 제거 등의 역할을 수행하는 것으로 추정된다.[4][5]
데옥시헤메리트린은 수산기로 연결된 2개의 제일철 이온을 가지고 있다(A). 하나의 철 이온은 6배위형, 다른 하나는 5배위형이다. 사이의 수산기는 산소 결합 후 과산화물에 수소를 공여하고, 하나의 산소 원자와 결합하여 산화-중간형 헤메리트린이 된다. 그 후 산소 분자가 5배위의 철 이온의 빈 부위와 결합한다(B). 마지막으로 전자가 제일철 이온에서 제이철의 철 중심으로 이동하여 과산화물이 결합한다(C).
3. 4차 구조와 협동성
헤모글로빈과는 달리 대부분의 헤메리트린은 산소에 대한 협동 결합이 부족하여 헤모글로빈보다 효율이 약 1/4 정도 낮다. 하지만 일부 완족동물에서는 헤메리트린이 O2의 협동 결합을 보인다. 협동 결합은 서브유닛 간의 상호 작용에 의해 달성된다. 즉, 하나의 서브유닛의 산소화는 두 번째 유닛의 산소에 대한 친화력을 증가시킨다.
헤메리트린은 일산화 탄소 (CO)에 대한 친화력이 헤모글로빈과는 달리 O2에 대한 친화력보다 실제로 낮다. 헤모글로빈은 CO에 대한 친화력이 매우 높다. 헤메리트린이 CO 중독에 대한 친화력이 낮은 것은 O2의 결합에서 수소 결합의 역할, 즉 일반적으로 수소 결합에 관여하지 않는 CO 복합체와 호환되지 않는 경로 모드를 반영한다.
4. 헤메리트린/HHE 양이온 결합 도메인
4. 1. 세균에서의 역할
헤메리트린/HHE 양이온 결합 단백질 도메인은 헤메리트린, 미오헤메리트린 및 관련 단백질에서 중복된 도메인으로 나타난다. 이 도메인은 헤메리트린에서 철에 결합하지만, ''Nereis diversicolor'' 헤메리트린과 같은 관련 단백질에서는 카드뮴과 같은 다른 금속에 결합할 수 있다. 또한, ''Cupriavidus necator''의 NorA 단백질에서도 발견되는데, 이 단백질은 일산화 질소에 대한 반응 조절 단백질로, 금속 리간드에 대한 다른 구성을 제시한다. 헤메리트린/HHE 양이온 결합 도메인을 포함하는 ''Cryptococcus neoformans''(Filobasidiella neoformans)의 단백질 또한 일산화 질소 반응에 관여한다.[4] ''황색포도상구균'' 단백질, 철-황 복합체 복구 단백질 ScdA는 생물체가 낮은 산소 농도의 환경에서 생존하도록 전환할 때 중요하다고 언급되었다. 아마도 이 단백질은 산소 저장 또는 제거 역할을 할 것이다.[5]
세균에서 발견되는 헤메리트린/HHE (H-HxxxE-HxxxH-HxxxxD) 단백질은 신호 전달 및 주화성에 관여한다. 더 멀리 관련된 것들로는 H-HxxxE-H-HxxxE 단백질 (E3 리가아제 포함)과 동물 F-box 단백질 (H-HExxE-H-HxxxE)이 있다.[6]
참조
[1]
논문
Immunological properties of oxygen transport proteins: hemoglobin, hemocyanin and hemerythrin
[2]
서적
"Dioxygen-binding Proteins" in Comprehensive Coordination Chemistry II
[3]
논문
How iron-containing proteins control dioxygen chemistry: a detailed atomic level description via accurate quantum chemical and mixed quantum mechanics/molecular mechanics calculations
[4]
논문
Exploration of whole-genome responses of the human AIDS-associated yeast pathogen Cryptococcus neoformans var grubii: nitric oxide stress and body temperature
2007-09
[5]
논문
Widespread Distribution in Pathogenic Bacteria of Di-Iron Proteins That Repair Oxidative and Nitrosative Damage to Iron-Sulfur Centers
[6]
논문
Structure, function and evolution of the hemerythrin-like domain superfamily: Hemerythrin-like Domain Superfamily
2018-04
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
