세륨
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
세륨은 은색을 띠는 란타넘족 금속 원소이다. 1803년 스웨덴의 화학자 옌스 야코브 베르셀리우스와 빌헬름 힌싱게르, 그리고 독일의 화학자 마르틴 하인리히 클라프로트에 의해 독립적으로 발견되었다. 세륨은 산화물 형태로 처음 분리되었으며, 세레스 소행성의 이름을 따서 명명되었다. 세륨은 +3과 +4의 산화 상태를 가지며, 다양한 화합물을 형성한다. 산업적으로는 연마제, 가스 맨틀, 발화성 합금, 촉매 등으로 사용되며, 유리, 안료, 형광체, 합금 등 다양한 분야에서 활용된다. 세륨은 생물학적 역할은 알려져 있지 않지만, 독성이 매우 강하지 않고, 일부 메탄영양 박테리아의 생존에 필수적인 보조인자 역할을 한다.
더 읽어볼만한 페이지
- 세륨 - 세륨 동위 원소
세륨 동위 원소는 원자 번호 58번인 세륨의 핵종으로, 질량수 119부터 157까지 다양한 동위 원소가 존재하며, 자연 상태에서는 136Ce, 138Ce, 140Ce, 142Ce의 4가지 동위 원소가 존재하고 140Ce이 가장 풍부하다. - 란타넘족 - 가돌리늄
가돌리늄은 은백색의 연성과 전성을 가진 희토류 원소로, 특정 온도에서 강자성 또는 강한 상자성을 띠어 MRI 조영제, 중성자 차폐물, 합금, 형광체 등 다양한 분야에 응용되며, 핀란드 화학자의 이름을 딴 원소이다. - 란타넘족 - 루테튬
루테튬은 원소 기호 Lu, 원자 번호 71을 갖는 희토류 원소로, 란타넘족 중 밀도, 녹는점, 경도가 가장 높고, 주로 +3의 산화 상태를 가지며, 안정 동위원소와 방사성 동위원소 형태로 존재하고, 제한적인 상업적 용도에도 불구하고 촉매, LED, PET, 연대 측정, 암 치료 등에 사용된다. - 환원제 - 아연
아연은 청회색 금속으로, 적당한 반응성을 지닌 환원제이며, 내식성이 뛰어나 도금에 사용되고, 합금의 주요 성분이며, 인체 필수 미량 원소이지만 과다 섭취 시 독성을 나타낸다. - 환원제 - 칼륨
칼륨은 은백색의 무른 알칼리 금속으로 반응성이 매우 높고 생물학적으로 중요한 전해질이며, 비료 생산을 비롯한 다양한 산업 분야에서 활용되지만 물과의 격렬한 반응 및 폭발성 과산화물 생성 가능성으로 취급 시 주의가 필요하며, 자연계에 세 가지 동위원소로 존재한다.
| 세륨 | |
|---|---|
| 기본 정보 | |
 | |
| 원소 이름 | 세륨 |
| 영어 이름 | cerium |
| 일본어 이름 | セリウム |
| 로마자 표기 | serium |
| 라틴어 이름 | cerium |
| 원소 기호 | Ce |
| 원자 번호 | 58 |
| 원자 질량 | 140.116 |
| 발견자 | 마르틴 하인리히 클라프로트 옌스 야코브 베르셀리우스 빌헬름 히싱어 |
| 발견 연도 | 1803년 |
| 첫 분리 | 칼 구스타프 모산데르 |
| 첫 분리 연도 | 1838년 |
| 명명 유래 | 농업의 로마 신 케레스의 이름을 딴 왜행성 세레스에서 유래 |
| CAS 등록 번호 | 7440-45-1 |
| 물리적 성질 | |
| 겉모습 | 은백색 |
| 표준 상태 | 고체 |
| 밀도 | β-Ce: 6.689 g/cm³ γ-Ce: 6.769 g/cm³ |
| 녹는점 | 1068 K (795 °C, 1463 °F) |
| 끓는점 | 3716 K (3443 °C, 6229 °F) |
| 융해열 | 5.46 kJ/mol |
| 기화열 | 398 kJ/mol |
| 열용량 | 26.94 J/(mol·K) |
| 증기압 | 1992 K (1 Pa) 2194 K (10 Pa) 2442 K (100 Pa) 2754 K (1 kPa) 3159 K (10 kPa) 3705 K (100 kPa) |
| 결정 구조 | β-Ce: 이중 육방 밀집 구조 γ-Ce: 면심 입방 구조 |
| 격자 상수 | β-Ce: a = 0.36811 nm, c = 1.1857 nm (20 °C) γ-Ce: a = 0.51612 nm (20 °C) |
| 전기 저항 | β-Ce, poly: 828 nΩ·m (실온) |
| 열전도율 | 11.3 W/(m·K) |
| 열팽창 계수 | β-Ce: 6.1 × 10⁻⁶/K γ-Ce: 6.1 × 10⁻⁶/K (20 °C) |
| 소리의 속도 | 2100 m/s (20 °C 막대) |
| 영률 | γ-Ce: 33.6 GPa |
| 전단 탄성 계수 | γ-Ce: 13.5 GPa |
| 부피 탄성 계수 | γ-Ce: 21.5 GPa |
| 포아송 비 | γ-Ce: 0.24 |
| 모스 굳기 | 2.5 |
| 비커스 굳기 | 210–470 |
| 브리넬 굳기 | 186–412 |
| 자기 정렬 | 상자성 |
| 자기 감수율 | β-Ce: +2450.0 × 10⁻⁶ (293 K) |
| 원자 성질 | |
| 전자 배치 | [Xe] 4f¹ 5d¹ 6s² |
| 전자 껍질 별 전자 수 | 2, 8, 18, 19, 9, 2 |
| 산화 상태 | 4, 3, 2 (약한 염기성 산화물) |
| 전기 음성도 | 1.12 (폴링 척도) |
| 이온화 에너지 | 534.4 kJ/mol (1차) 1050 kJ/mol (2차) 1949 kJ/mol (3차) |
| 원자 반지름 | 181.8 pm |
| 공유 반지름 | 204 ± 9 pm |
| 기타 | |
| 이전 원소 | 란타넘 |
| 다음 원소 | 프라세오디뮴 |
| 위 원소 | - |
| 아래 원소 | Th |
| 분류 | 란타넘족 |
| 주기 | 6 |
| 족 | 3 |
| 블록 | f |
| 동위 원소 | |
| 동위 원소 | 질량수 134: 인공 방사성 동위 원소, 반감기 3.16일, 붕괴 방식 ε, 붕괴 에너지 0.500 MeV, 붕괴 후 원소 La 질량수 136: 0.185%, 반감기 > 3.8×10¹⁶년, 붕괴 방식 β⁺β⁺, 붕괴 에너지 2.419 MeV, 붕괴 후 원소 Ba 질량수 138: 0.251%, 반감기 > 1.5×10¹⁴년, 붕괴 방식 β⁺β⁺, 붕괴 에너지 0.694 MeV, 붕괴 후 원소 Ba 질량수 139: 인공 방사성 동위 원소, 반감기 137.640일, 붕괴 방식 ε, 붕괴 에너지 0.278 MeV, 붕괴 후 원소 La 질량수 140: 88.450%, 안정 동위 원소, 중성자 수 82 질량수 141: 인공 방사성 동위 원소, 반감기 32.501일, 붕괴 방식 β⁻, 붕괴 에너지 0.581 MeV, 붕괴 후 원소 Pr 질량수 142: 11.114%, 반감기 > 5×10¹⁶년, 붕괴 방식 β⁻β⁻, 붕괴 에너지 1.417 MeV, 붕괴 후 원소 Nd 질량수 144: 인공 방사성 동위 원소, 반감기 284.893일, 붕괴 방식 β⁻, 붕괴 에너지 0.319 MeV, 붕괴 후 원소 Pr |
2. 역사
1803년 스웨덴의 화학자 옌스 야코브 베르셀리우스와 빌헬름 힌싱게르가 독자적으로 세륨을 발견하였다.[82][27] 이와 별도로 독일의 화학자 마르틴 하인리히 클라프도 독자적인 연구를 통해 세륨을 발견하였다.[82] 같은 해, 클라프로트는 같은 광산에서 신원소를 탐색한 결과, 신원소를 발견하고 그 성질에서 '노란색 토양'이라는 뜻으로 테르오크로이트/terre ochroitede라고 명명했다. 이후 학회에서 세륨(cerium)이라는 명칭이 채택되었다.[74] 세륨이라는 이름은 1801년 발견된 왜행성 세레스의 이름을 따 베르셀리우스가 이름 붙인 것이다.[82] 당시 세레스는 행성으로 간주되었다.[27] 이 소행성 자체는 농업, 곡물 작물, 다산 및 모성 관계의 로마 여신 세레스의 이름을 따서 명명되었다.[27]

세륨은 처음에 산화물 형태로 분리되었는데, 이것은 세리아(ceria)라고 명명되었으며, 이 용어는 여전히 사용되고 있다. 금속 자체는 당시의 제련 기술로는 분리하기에는 너무 전기 양성적이었는데, 이것은 일반적으로 희토류 금속의 특징이다. 빌헬름 히징어는 부유한 광산주이자 아마추어 과학자였으며 베르셀리우스의 후원자였다. 그는 바스트네스의 광산을 소유하고 관리했으며, 수년 동안 자신의 광산에 있는 풍부한 무거운 맥석(당시 "바스트네스의 텅스텐"이라고 불렸지만, 텅스텐을 포함하지 않았음)의 구성을 알아내려고 노력해 왔는데, 이것은 현재 세라이트로 알려져 있다.[28] 모산데르와 그의 가족은 베르셀리우스와 같은 집에서 수년 동안 함께 살았고, 모산데르는 베르셀리우스의 설득으로 세리아를 더 조사했을 것이다.[29][30][31][32]
2. 1. 발견
1803년 스웨덴의 화학자 옌스 야코브 베르셀리우스와 빌헬름 힌싱게르가 독자적으로 세륨을 발견하였다.[82][27] 이와 별도로 독일의 화학자 마르틴 하인리히 클라프도 독자적인 연구를 통해 세륨을 발견하였다.[82] 같은 해, 클라프로트는 같은 광산에서 신원소를 탐색한 결과, 신원소를 발견하고 그 성질에서 '노란색 토양'이라는 뜻으로 테르오크로이트(terre ochroite)라고 명명했다. 이후 학회에서 세륨(cerium)이라는 명칭이 채택되었다.[74] 세륨이라는 이름은 1801년 발견된 왜행성 세레스의 이름을 따 베르셀리우스가 이름 붙인 것이다.[82] 당시 세레스는 행성으로 간주되었다.[27] 이 소행성 자체는 농업, 곡물 작물, 다산 및 모성 관계의 로마 여신 세레스의 이름을 따서 명명되었다.[27]세륨은 처음에 산화물 형태로 분리되었는데, 이것은 세리아(ceria)라고 명명되었으며, 이 용어는 여전히 사용되고 있다. 금속 자체는 당시의 제련 기술로는 분리하기에는 너무 전기 양성적이었는데, 이것은 일반적으로 희토류 금속의 특징이다. 빌헬름 히징어는 부유한 광산주이자 아마추어 과학자였으며 베르셀리우스의 후원자였다. 그는 바스트네스의 광산을 소유하고 관리했으며, 수년 동안 자신의 광산에 있는 풍부한 무거운 맥석(당시 "바스트네스의 텅스텐"이라고 불렸지만, 텅스텐을 포함하지 않았음)의 구성을 알아내려고 노력해 왔는데, 이것은 현재 세라이트로 알려져 있다.[28] 모산데르와 그의 가족은 베르셀리우스와 같은 집에서 수년 동안 함께 살았고, 모산데르는 베르셀리우스의 설득으로 세리아를 더 조사했을 것이다.[29][30][31][32]
3. 성질
세륨은 광택이 있는 은색을 띠는 란타넘족 금속이다. 무르고 연성이 커 굽히거나 펴기 쉽다. 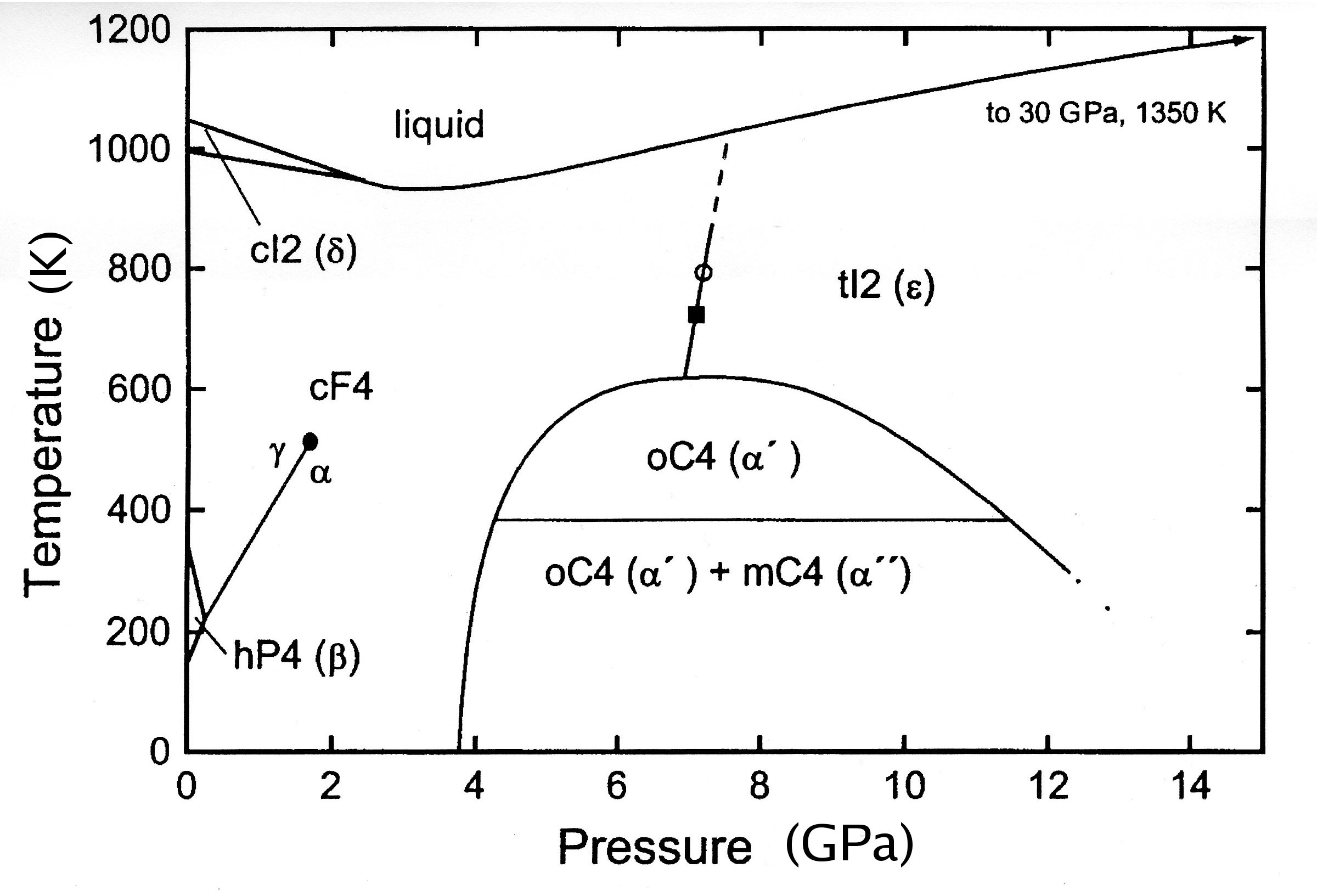
회색을 띤 은백색의 금속으로, 상온·상압에서 안정적인 결정 구조는 면심입방격자 구조(FCC, β형)이지만 730 ℃ 이상에서는 체심입방격자 구조(BCC)가 되고, 저온에서는 육방최밀충진 구조(HCP, α형), -150 ℃ 이하에서는 다시 면심입방격자 구조가 안정적으로 된다. 비중은 6.77, 융점은 804 ℃, 비점은 3,470 ℃이며, 융점과 비점의 차이가 큰 것이 특징이다.
공기 중에서 산화되기 쉽고, 점차 이산화세륨(CeO₂)(산화세륨(IV))이 된다. 가열하면 160 ℃에서 발화한다. 물에는 서서히 녹고(온수와 반응), 산(무기산)에는 잘 녹는다. 암모니아에도 녹는다. 원자가는 +3, +4(란타노이드 중 4가가 안정적인 것이 특징)이다.
모나자이트(모나즈석)나 세라이트(셀석)에 포함되어 있다. 가장 풍부한 희토류 원소이지만, 자원의 90% 이상을 중국이 생산하고 있다.
금속 세륨은 공기 중에서 서서히 변색되며, 150 °C에서 빠르게 연소하여 이산화세륨(IV)이 생성된다. 반응식은 다음과 같다.
:Ce + O2 → CeO2
세륨은 매우 전기적으로 양성이며, 냉수와는 서서히, 온수와는 빠르게 반응하여 수산화세륨(III)을 생성한다. 반응식은 다음과 같다.
:2Ce (s) + 6H2O (l) → 2Ce(OH)3 (aq) + 3H2 (g)
금속 세륨은 모든 할로겐과 반응한다. 반응식은 다음과 같다.
:2 Ce (s) + 3 F2 (g) → 2 CeF3 (s) [백색]
:2 Ce (s) + 3 Cl2 (g) → 2 CeCl3 (s) [백색]
:2 Ce (s) + 3 Br2 (g) → 2 CeBr3 (s) [백색]
:2 Ce (s) + 3 I2 (g) → 2 CeI3 (s) [황색]
세륨은 묽은 황산에 빠르게 녹아 무색의 Ce(III) 이온 용액을 생성한다. 이 이온은 [Ce(OH2)9]3+ 와 같은 착이온으로 존재한다.[75] 반응식은 다음과 같다.
:2 Ce(s) + 3H2SO4(aq) → 2Ce3+(aq) + 3SO42-(aq) + 3H2(g)
3. 1. 물리적 성질
세륨은 광택이 있는 은색을 띠는 란타넘족 금속이다. 무르고 연성이 커 굽히거나 펴기 쉽다. 세륨은 가변적인 전자 구조를 가지는데, 4f 전자의 에너지는 금속 상태에서 비편재화된 바깥쪽 5d 및 6s 전자의 에너지와 거의 같다. 이러한 전자 준위의 상대적인 점유율을 변경하는 데는 약간의 에너지만 필요하며, 이로 인해 이중 원자가 상태가 발생한다.[7] 고압 상(α-세륨)에서 4f 전자는 저압 상(γ-세륨)의 국재화된 4f 전자와는 달리 비편재화되고 이동한다.[7] 냉각 또는 압축될 때 원자가가 약 3에서 4로 변하는 것으로 보인다.[8]표준압력에서 존재하는 것으로 알려진 세륨의 동소체는 네 가지이며, α에서 δ까지의 일반적인 기호로 표시된다.[11]
- 고온 형태인 δ-세륨은 체심입방구조(BCC) 결정구조를 가지며 726 °C 이상에서 존재한다.
- 726 °C에서 약 실온까지의 안정적인 형태는 면심입방구조(FCC) 결정구조를 가진 γ-세륨이다.
- 이중육방밀집(DHCP) 형태인 β-세륨은 약 실온에서 −150 °C까지의 평형 구조이다.
- 면심입방구조(FCC) 형태인 α-세륨은 약 −150 °C 이하에서 안정적이며, 밀도는 8.16 g/cm³이다.
- 고압에서만 나타나는 다른 고체 상은 상도에 표시되어 있다.
- γ형과 β형은 모두 실온에서 상당히 안정적이지만, 평형 변태 온도는 75 °C로 추정된다.[11]
저온에서 세륨의 거동은 느린 변태 속도로 인해 복잡해진다. 변태 온도는 상당한 히스테리시스의 영향을 받으며, 여기에 제시된 값은 근사값이다. −15 °C 이하로 냉각되면 γ-세륨이 β-세륨으로 변하기 시작하지만, 이 변태는 부피 증가를 수반하며, β형이 더 많이 생성됨에 따라 내부 응력이 증가하여 추가 변태가 억제된다.[11] 약 −160 °C 이하로 냉각되면 α-세륨의 형성이 시작되지만, 이는 남아 있는 γ-세륨으로부터만 이루어진다. β-세륨은 응력이나 변형이 없는 경우에는 α-세륨으로 거의 변태되지 않는다.[11] 대기압에서 액체 세륨은 녹는점에서 고체 형태보다 밀도가 높다.[4][12][13] 회색을 띤 은백색의 금속으로, 상온·상압에서 안정적인 결정 구조는 면심입방격자 구조(FCC, β형)이지만 730 ℃ 이상에서는 체심입방격자 구조(BCC)가 되고, 저온에서는 육방최밀충진 구조(HCP, α형), -150 ℃ 이하에서는 다시 면심입방격자 구조가 안정적으로 된다. 비중은 6.77, 융점은 804 ℃, 비점은 3,470 ℃이며, 융점과 비점의 차이가 큰 것이 특징이다.
모나자이트(모나즈석)나 세라이트(셀석)에 포함되어 있다.
3. 2. 화학적 성질
세륨은 광택이 있는 은색을 띠는 란타넘족 금속이다. 무르고 연성이 커 굽히거나 펴기 쉽다. 공기 중에서 쉽게 산화하여 산화세륨이 되며, 150 °C에서 빠르게 연소하여 이산화세륨(IV)이 생성된다.[9][10] 반응식은 다음과 같다.:Ce + O2 → CeO2
할로젠과 반응하여 화합물을 만든다. 반응식은 다음과 같다.
:2 Ce (s) + 3 F2 (g) → 2 CeF3 (s) [백색]
:2 Ce (s) + 3 Cl2 (g) → 2 CeCl3 (s) [백색]
:2 Ce (s) + 3 Br2 (g) → 2 CeBr3 (s) [백색]
:2 Ce (s) + 3 I2 (g) → 2 CeI3 (s) [황색]
세륨은 황산 수용액에 녹아 수산화세륨기([Ce(OH2)9]3+)를 이룬다.[80][75] 반응식은 다음과 같다.
:2 Ce (s) + 3 H2SO4 (aq) → 2 Ce3+ (aq) + 3SO2-/4 (aq) + 3 H2 (g)
다른 란타넘족 원소들과 마찬가지로 세륨 금속은 좋은 환원제이며, Ce³⁺/Ce 쌍에 대한 표준 환원 전위는 ''E'' = −2.34 V이다. 공기 중에서 변색되어 부동태화 산화물 층을 형성하는데, 이는 철의 녹과 유사하다. 몇 센티미터 크기의 세륨 금속 샘플은 약 1년 만에 완전히 부식된다. 금속 세륨은 높은 전기음성도를 가지며, 물과 반응한다. 차가운 물과의 반응은 느리지만 온도가 높아짐에 따라 속도가 빨라지며, 수산화세륨(III)과 수소 기체를 생성한다.[10]
:
4. 동위 원소
자연계에 존재하는 세륨은 136Ce (0.19%), 138Ce (0.25%), 140Ce (88.4%), 142Ce (11.1%)의 네 가지 동위 원소로 구성되어 있다. 이들은 모두 관측상 안정하지만, 136Ce와 138Ce는 이중 전자 포획을 통해 바륨 동위 원소로, 142Ce는 이중 베타 붕괴를 통해 142Nd로 붕괴될 것으로 예상된다. 140Ce는 이론적으로 유일한 안정 동위 원소이다. 그러나 이러한 붕괴는 아직 관측되지 않았으며, 실험적으로 측정된 반감기의 하한값은 다음과 같다.
:136Ce: >3.8×1016 y
:138Ce: >5.7×1016 y
:142Ce: >5.0×1016 y144Ce(반감기 284.9일), 139Ce(반감기 137.6일), 141Ce(반감기 32.5일) 이외의 세륨 동위 원소는 모두 인공적이며, 반감기가 4일 미만이다. 140Ce부터 144Ce까지의 동위원소는 우라늄의 핵분열 생성물로 나타난다. 140Ce보다 가벼운 동위원소는 전자 포획을 통해 란타넘의 동위원소가 되고, 무거운 동위원소는 베타 붕괴를 통해 프라세오디뮴의 동위원소가 된다.136Ce와 138Ce는 s-과정과 r-과정에서 생성될 수 없어 희귀하다. 이러한 핵은 p-핵이라고 불리며, 양성자 포획과 광붕괴를 통해 형성되는 것으로 추측된다. 140Ce는 s-과정과 r-과정 모두에서 생성될 수 있어 가장 일반적인 세륨 동위 원소이며, 142Ce는 r-과정에서만 생성될 수 있다. 140Ce는 닫힌 중성자 껍질(82개의 중성자)을 가진 마법핵이기에 안정성이 높다.
5. 화합물
세륨은 주로 +3 (Ce(III)) 및 +4 (Ce(IV))의 두 가지 산화 상태를 가진다. 세륨(IV) 수용액은 세륨(III) 수용액에 강한 산화제인 과황산염(과황산염)이나 비스무트산염(비스무트산염)을 반응시켜 제조할 수 있다. ''E''(Ce/Ce)의 값은 조건에 따라 크게 달라지지만, +1.72 V가 대표적인 값이다. 세륨은 +4 산화 상태에서 중요한 수용액 및 배위 화학을 갖는 유일한 란타넘족 원소이다.
세륨은 산화물과 할로젠화수소의 반응을 통해 네 가지 삼할로겐화물 CeX₃(X = F, Cl, Br, I)를 모두 생성한다. 무수 할로겐화물은 옅은 색을 띠는 상자성의 조해성 고체이며, 수화되면 삼할로겐화물은 수화 착물 [Ce(H₂O)₈₋₉]³⁺을 포함하는 착물로 전환된다. 대부분의 란타넘족 원소와 달리 세륨은 백색 고체인 사플루오르화물을 형성하며, 금속적 성질을 갖는 청동색 이요오드화물도 형성한다. 플루오르화물은 Ce(IV) 유도체 CeF₈⁴⁻ 및 CeF₆²⁻를 생성하고, 염화물은 주황색 CeCl₆²⁻를 생성한다.
세륨(IV) 산화물(ceria)은 플루오라이트 구조를 가지며, 비화학량론적 화합물 CeO (x는 약 0.2)이다. 세리아는 수소 기체로 세륨(III) 산화물로 환원된다. 칼코겐화물에는 삼가 CeZ (Z = S, Se, Te) 및 일칼코겐화물 CeZ (CeZe로 더 잘 나타낼 수 있음) 등이 있다.
질산세륨암모늄(CAN, (NH)[Ce(NO3)6])은 실험실에서 가장 흔하게 사용되는 세륨 화합물이다. CAN은 유기 합성에서 기준 시약[16] 및 촉매[17]로 사용되는 산화제이며,[17] 일전자 산화환원 반응을 통해 작용한다.[17] CAN은 정량 분석을 위한 일차 표준물질이며,[4][18] 황산세륨(IV)과 같은 세륨(IV) 염은 세륨측정 적정에서 용량 분석을 위한 표준 시약으로 자주 사용된다.[19]
리간드-금속 전하 이동으로 인해 수용액 상태의 세륨(IV) 이온은 주황색을 띤 노란색이다.[21] 세륨(IV)는 물에서 준안정적이며[22] 강한 산화제로, 염산을 산화시켜 염소 기체를 생성한다. 벨루소프-자보틴스키 반응에서 세륨은 +4와 +3 산화 상태 사이를 진동하여 반응을 촉매한다.[23]
세륨(IV)염은 적황색 또는 황색이며, 세륨(III)염은 보통 백색 또는 무색이다. 두 가지 모두 자외선을 매우 잘 흡수한다. 세륨(III)는 무색 유리를 만드는 데 사용되며, 거의 완벽하게 자외선을 흡수한다.
세륨의 산화수는 +2, +3, +4가 가능하다. +2 상태는 드물며, CeH2, CeI2, CeS 등에서 볼 수 있다.[76] 산화세륨(IV) (CeO2)는 보석 세공용 연마제(jeweller's rouge)로 사용된다. 적정에 사용되는 산화제는 황산세륨암모늄(IV) ((NH4)2Ce(SO4)3)과 질산세륨암모늄(IV) ((NH4)2Ce(NO3)6)(CAN)이다. 염화세륨(III) CeCl3는 유기화학에서 카르보닐 화합물의 반응에 사용된다.
기타 세륨 화합물은 다음과 같다.
- CeAl3
- CeCu6
- CeCu2Si2
- CeRu2Si2
- 산화세륨(III) (Ce2O3)
- 산화세륨(IV) (CeO2)
- 염화세륨(III) 7수화물 (CeCl3・7H2O)
- 불화세륨(III) (CeF3)
- 황산세륨(III) 8수화물 (Ce2(SO4)3・8H2O)
- 황산세륨(IV) 4수화물 (Ce(SO4)2・4H2O)
- 질산세륨(III)암모늄 4수화물, 펜타니트라토세륨(III)산 암모늄 ((NH4)2[Ce(NO3)5]・4H2O)
- 질산세륨(IV)암모늄, 헥사니트라토세륨(IV)산 암모늄 ((NH4)2[Ce(NO3)6])
- 질산세륨(III) 6수화물 (Ce(NO3)3・6H2O)
- 수산화세륨(IV) n수화물 (Ce(OH)4・nH2O)
- 탄산세륨(III) 8수화물 (Ce2(CO3)3・8H2O)
- 과염소산세륨(III) 8수화물 (Ce(ClO4)3・8H2O)
- 브롬화세륨(III) 6수화물 (CeBr3・6H2O)
- 육붕화세륨 (CeB6)
- 이규화세륨 (CeSi2)
- 황화세륨(III) (Ce2S3)
- 요오드화세륨(III) 9수화물 (CeI3・9H2O)
- 옥살산세륨(III) 9수화물 (Ce2(C2O4)3•9H2O)
- 아세트산세륨(III) 1수화물 (Ce(CH3COO)3・H2O)
6. 산업 및 응용

세륨은 주로 두 가지 용도로 사용되는데, 둘 다 CeO2를 사용한다. 산업적으로 세리아는 연마제, 특히 화학적 기계적 평탄화(CMP)에 사용된다.[43] 세륨은 또한 방사성 동족체인 토리아의 대체물로 사용되어 왔는데, 예를 들어 가스 텅스텐 아크 용접에 사용되는 전극 제조에 사용되며, 여기서 세륨은 합금 원소로 아크 안정성과 시동 용이성을 향상시키고 소모량을 감소시킨다.[44] 산화세륨은 세리아라고 불리며 산화알미늄, 이산화규소 등과 함께 사용하여 법랑의 유탁제로 사용된다. 도자기의 유약으로는 잘 쓰이지 않으나 흰색 유약을 만들기 위해 쓰이기도 한다.[81]
최초로 세륨이 사용된 것은 오스트리아 화학자 칼 아우어 폰 벨스바흐가 발명한 가스 맨틀이었다. 1885년 그는 이전에 마그네슘, 란타넘, 이트륨 산화물 혼합물을 실험했지만, 이들은 녹색조의 빛을 내었고 성공적이지 못했다.[45] 6년 후, 그는 순수한 토륨 산화물이 훨씬 더 나은(하지만 푸른색) 빛을 내고, 세륨 이산화물과 섞으면 밝은 흰색 빛을 낸다는 것을 발견했다.[46] 세륨 이산화물은 토륨 산화물의 연소 촉매 역할도 한다.
이는 폰 벨스바흐와 그의 발명품에 상업적 성공을 가져다주었고, 토륨에 대한 수요를 크게 증가시켰다. 토륨 생산 과정에서 많은 양의 란타넘족 원소가 부산물로 동시에 추출되었다. 이들에 대한 용도가 곧 발견되었는데, 특히 50% 세륨, 25% 란타넘, 나머지는 다른 란타넘족 원소로 구성된 "미쉬메탈"이라는 발화성 합금이 라이터 부싯돌로 널리 사용되었다. 일반적으로 철을 첨가하여 페로세륨 합금을 만드는데, 이 또한 폰 벨스바흐가 발명했다.[47] 란타넘족 원소들의 화학적 유사성 때문에, 강에 미쉬메탈을 첨가하여 기계적 성질을 개선하는 첨가제로 사용하거나, 석유의 분해 촉매로 사용하는 등의 응용 분야에서는 일반적으로 화학적 분리가 필요하지 않다. 세륨의 이러한 특성은 작가 프리모 레비가 아우슈비츠 강제 수용소에서 페로세륨 합금을 구해 식량과 교환하는 데 도움이 되어 그의 목숨을 구했다.[48]
안료의 광 안정성은 세륨을 첨가함으로써 향상될 수 있는데, 이는 안료에 내광성을 부여하고 투명한 고분자의 햇빛에 의한 변색을 방지하기 때문이다.[49] 독립적으로 무기 안료로 사용되는 세륨 화합물의 예로는 선명한 붉은색을 띠는 황화세륨(III)(황화세륨 적색)이 있으며, 매우 높은 온도까지 화학적으로 불활성을 유지한다. 이 안료는 내광성이지만 독성이 있는 셀레늄화 카드뮴계 안료에 대한 안전한 대안이다.[28] 구형 브라운관 텔레비전 유리판에 산화세륨을 첨가하는 것은 유익했는데, 이는 작동 중 지속적인 전자 충격으로 인한 F 중심 결함 생성으로 인한 변색 효과를 억제하기 때문이다. 세륨은 또한 CRT TV 화면, 형광등, 그리고 후대의 백색 발광 다이오드에 사용되는 형광체의 도펀트로서 필수적인 구성 요소이다.[50][51] 가장 일반적으로 사용되는 예는 녹색에서 황록색 빛(550–530 nm)을 방출하고 섬광체로도 작용하는 세륨(III)이 도핑된 이트륨 알루미늄 가닛(Ce:YAG)이다.[52]
세륨염, 예를 들어 황화세륨(III)(Ce₂S₃) 및 Ce₃S₄는 맨해튼 계획 당시 플루토늄 금속 주조 시 고온 및 강한 환원 조건을 견딜 수 있는 고급 내화 재료로서 도가니 제작에 고려되었다.[33][34] 바람직한 특성에도 불구하고, 이러한 황화물은 합성상의 실질적인 문제로 인해 널리 채택되지 않았다.[33] 세륨은 주조 가능한 공정용융점 알루미늄 합금을 만들기 위해 알루미늄의 합금 원소로 사용되는데, 이 합금은 6~16 wt.%의 세륨을 포함하며, 여기에 Mg, Ni, Fe, Mn과 같은 다른 원소를 추가할 수 있다. 이러한 Al-Ce 합금은 우수한 고온 강도를 가지며 자동차 응용 분야(예: 실린더 헤드)에 적합하다.[53] 세륨의 다른 합금으로는 핵연료로 사용되어 온 Pu-Ce 및 Pu-Ce-Co 플루토늄 합금이 있다.[54]
자동차 분야에서 세륨 세스퀴옥사이드(Ce₂O₃)의 다른 용도로는 자동차 배기가스에서 CO와 NOx 배출가스의 산화를 위한 촉매 변환기가 있다.[55][56]
산화물은 연마제로 사용되는 외에, 유리 첨가제, 제강 원료, 촉매로도 사용된다. 화학 반응에서 산화제로서의 용도는 사용량은 적지만 매우 중요하다.
1960년대부터 광물(바스트네사이트) 산화물이 사용되어, 광학렌즈연마에 필수적인 것이 되었다. 단순히 경도가 높을 뿐만 아니라, 산화세륨과 플루오린이 유리와 화학 반응을 일으키는 화학기계연마(CMP)가 발생하는 것이 특징으로, 액정 패널이나 수정·석영 등 규산계 보석 연마에 이용된다. 다른 희토류를 추출 제거한 고순도 산화세륨이 포토마스크, 하드디스크 등의 유리 기판, 다층화 집적회로의 층간 절연막 평활화에 사용되고 있다. 라이터용 발화석으로 세륨과 철의 합금(페로세륨)이 사용되고 있다(발화합금). 마찰에 의해 불꽃을 발생시킨다. 산화세륨은 굴절률이 크고 자외선을 잘 흡수·차폐하기 때문에, 선글라스 등 자외선 차단(UV컷) 유리나 화장품에 사용된다. 푸른 형광을 발하기 때문에, 브라운관에 이용되어 왔다. 1997년, YAG에 세륨을 첨가한 황색 형광체를 청색 발광 다이오드의 보색으로 함으로써, 백색 LED등이 처음으로 상품화되었다. 또한, 축광 재료로도 사용된다. 플루오린과의 화합물인 플루오르화세륨(CeF3)은 방사선 검출을 위한 섬광체 재료로 사용된다. 산화세륨이 황색 계열 안료의 성분으로 사용되는 외에, 유리에 첨가하여 옅은 황색으로 발색시키는 착색제, 산화 분위기로 하여 철분에 의한 착색을 없애는 탈색제로 이용된다. X선 CT(컴퓨터 단층 촬영법)에 의한 미세 혈관 조영 장치의 양극에 사용된다.[77]
금속간 화합물의 CeCo5가 자성 재료로 이용된다. 페로세륨으로서 스테인리스강 등의 황이나 산소 원자에 의한 환원 작용을, 산화 작용으로 억제한다. 부식 방지용 억제제로서, 항공기용·고강도 알루미늄 합금에 첨가되는 외에, 마그네슘 합금에도 3-4% 첨가된다. 황화세륨에 의한 기능성, 내열 도가니 제품의 제조. 교류 아크용으로 세륨이 들어간 텅스텐 전극봉(통칭 세리탄)이 중용되고 있다. 산화물의 산소 저장 능력이 높기 때문에, 자동차 배기 가스용 삼원 촉매에, 조촉매로서 첨가되고 있다. 저항형 기중 산소 농도 센서로서 배기 가스 중의 산소 농도를 측정하여, 엔진의 연소 효율 개선을 위해 공연비 제어에 사용된다. 사마리아 도프트 세리아(SDC)나 가돌리니아 도프트 세리아(GDC)는 산소 이온 전도체로서 고체 산화물 연료 전지(SOFC)에 사용된다. 질산세륨이, 발광체인 가스 맨틀 제조에 사용되었다. 이것이 공업적 이용의 첫 번째 예이다. 그 후에도 발광 재료로서 이용되고 있다. 옥살산세륨이, 진정·진토 작용을 가지는 것으로 의약품에 사용된다. 또한, 항혈액 응고 작용이 있어, 혈전 방지 등에 유용하다는 연구가 있다. 4가의 세륨 이온은 3가가 될 때, 강한 산화성을 나타낸다. 이 때문에, 질산세륨암모늄이 유기 합성 화학이나 습식 식각에 이용되고 있다. 또한, 유기 세륨 친핵 시약이나 비소 흡착제에도 이용된다. 세륨의 화합물에는 헤비 페르미온(heavy fermion)으로서 주목받고 있는 것이 있다. →CeIrIn5. CeCu2Si2(초전도체이기도 하다). CeRu2Si2나 CeCu6는, 근접 효과에 의해 극저온까지 자기 질서를 나타내지 않는다.
7. 생산
세륨은 란타넘족 원소 중 가장 풍부하며, 지구 지각의 68ppm(백만분의 68)을 차지한다.[35] 이는 구리와 비슷한 수준이며, 납(13ppm)이나 주석(2.1ppm)보다 더 풍부하다. 세륨은 희토류 원소 중 하나이지만, 실제로는 희귀하지 않다. 토양 내 세륨 함량은 2~150ppm이며, 평균 50ppm이다. 해수에는 1.5ppt(조분의 1.5)의 세륨이 포함되어 있다.[28]
세륨은 다양한 광물에서 발견되지만, 가장 중요한 상업적 공급원은 모나자이트와 바스트네사이트 그룹의 광물이다. 이 광물들은 란타넘족 원소 함량의 약 절반을 차지한다. 모나자이트-(Ce)는 모나자이트 중 가장 일반적이며, 바스트네사이트-(Ce)는 바스트네사이트 중 가장 중요하다.[36][37][38][39] 세륨은 수용액에서 안정적인 +4 산화 상태를 가질 수 있는 유일한 란타넘족 원소이기 때문에 광물에서 추출하기 가장 쉽다.[13] 세륨(IV)은 자체 광물인 세리아나이트-(Ce)[41][38][36] 등을 형성할 수 있다.[42]
바스트네사이트(LnCOF)에서 세륨을 추출하는 과정은 비교적 간단하다. 묽은 염산으로 탄산칼슘 불순물을 제거하고, 공기 중에서 가열하여 산화시킨다. 세륨은 이산화세륨(CeO)으로 산화되어 물에 불용성이 되며, 0.5M 염산으로 용출하여 다른 란타넘족 원소와 분리할 수 있다.[13]
모나자이트( )는 토륨과 모든 희토류 원소를 포함하는 경우가 많아 추출 과정이 더 복잡하다. 전자기 분리 후 뜨거운 진한 황산으로 처리하여 희토류 원소의 수용성 황산염을 생성한다. 산성 여과액을 수산화나트륨으로 부분 중화하여 토륨을 제거하고, 옥살산암모늄으로 처리하여 희토류 원소를 불용성 옥살레이트로 전환한다. 옥살레이트는 어닐링(annealing)을 통해 산화물로 전환되며, 산화세륨은 질산에 불용성이므로 침전된다.[13]
희토류 자원은 중국, 구소련, 미국, 서호주, 인도 등에 매장되어 있으며, 일본에서도 소량 산출된다. 광물로는 바스트네사이트(Ce,La)(CO3)F, 모나자이트(Ce, La, Nd, Th)PO4가 주를 이루며, 각각 산화세륨이 약 50%로 가장 많이 포함되어 있다. 산출량의 약 90%는 중국 내륙부의 복합 광석에서 정제된 것이며, 미국, 구소련, 인도 등이 그 뒤를 잇는다. 프랑스, 타이완 등은 중간 제품 수출국이다.
세륨은 사용량이 적음에도 불구하고 다른 희토류와 함께 부산물로 많이 생산되어 재고량이 네오디뮴이나 디스프로슘 등의 생산을 압박하기도 한다. 그러나 최근 알루미늄 재료의 내열성 개선에 세륨과의 합금이 유망하다는 전망이 제시되어 세륨 과잉 구조 개선에 기여할 수 있을 것으로 기대된다.[78]
일반적인 연마제로는 미국산 바스트네사이트를 산화, 분쇄, 분급한 것을 사용한다. 그 외에도 로스팅(焙焼)한 바스트네사이트를 염산으로 침출하거나, 모나자이트를 알칼리 제련하는 방식으로 산화세륨 등의 화합물을 제조하여 사용한다. 금속 세륨은 용융 전해나 금속 칼슘 환원을 통해 얻을 수 있다. 페로세륨(Ferrocerium)은 주로 미국에서 생산되어 철강 첨가제 용도로 수입된다.
8. 생물학적 역할 및 안전성
초기 란타넘족 원소들은 화산 머드팟에 서식하는 ''Methylacidiphilum fumariolicum''과 같은 메탄영양 박테리아의 생존에 필수적이며, 메탄올 탈수소효소에 필수적인 보조인자 역할을 하는 것으로 밝혀졌다. 란타넘, 세륨, 프라세오디뮴, 네오디뮴은 이들 박테리아에서 거의 동일한 효과를 나타낸다.[58][59][66] 세륨은 다른 생물체에서 생물학적 역할이 알려져 있지 않지만, 독성이 매우 강하지 않고 먹이 사슬에 눈에 띄게 축적되지 않는다.[60][61][62] 인산염 광물에 칼슘과 함께 존재하고 뼈는 주로 인산칼슘으로 구성되어 있어 소량의 세륨이 뼈에 축적될 수 있지만, 위험하다고 여겨지지 않는다.[63] 질산세륨은 3도 화상에 대한 효과적인 국소 항균 치료제이지만,[28][64] 고용량은 세륨 중독과 메트헤모글로빈혈증을 유발할 수 있다.[65]
세륨은 강력한 환원제로, 65~80 °C에서 공기 중에서 자연 발화하며 연소시 유독한 연기를 발생시킨다.[28] 세륨은 물과 반응하여 수소 기체를 생성하므로 세륨 화재는 D급 건조 분말 소화제를 사용하여 진화해야 한다.[68] 세륨에 노출된 작업자들은 가려움증, 열에 대한 민감성, 피부 병변을 경험했으며, 다량의 세륨을 주사한 동물은 심혈관계 붕괴로 사망했다. 세륨은 세포막을 손상시켜 수생 생물에 더 위험하며, 물에 잘 용해되지 않아 환경 오염을 일으킬 수 있다.[28]
직업안전보건청(OSHA)은 산화세륨을 유해 물질로 규제하지 않지만,[69] 러시아에서는 작업장 노출 한계가 5 mg/m3이다.[67] 원소 상태의 세륨은 OSHA 또는 미국 정부 산업 위생 전문가 협의회에 의해 설정된 작업장 노출 한계가 없지만, 가연성 고체로 분류되어 화학물질의 분류 및 표시에 관한 세계적으로 조화된 시스템에 따라 규제된다.[70] 세륨 화합물에 대한 독성 보고서에서는 세포독성[67]과 작업자의 폐 간질성 섬유증에 대한 기여를 언급했다.[71]
참조
[1]
서적
Selected Values of the Crystallographic Properties of Elements
ASM International
2018
[2]
서적
CRC Handbook of Chemistry and Physics
https://web.archive.[...]
CRC Press
[3]
서적
CRC, Handbook of Chemistry and Physics
Chemical Rubber Company Publishing
[4]
서적
CRC Handbook of Chemistry and Physics
CRC Press
[5]
학술지
The Loose Connection between Electron Configuration and the Chemical Behavior of the Heavy Elements (Transuranics)
1973
[6]
서적
[7]
학술지
Theoretical studies of the high pressure phases in cerium
https://link.aps.org[...]
1991-10-14
[8]
학술지
Cerium; Crystal Structure and Position in The Periodic Table
2014-09-17
[9]
서적
The Elements
Black Dog & Leventhal Pub
2010
[10]
웹사이트
Chemical reactions of Cerium
https://www.webeleme[...]
Webelements
2016-07-09
[11]
학술지
Preparation of single phase β and α cerium samples for low temperature measurements
[12]
학술지
Lattice and spin dynamics of γ-Ce
1979
[13]
서적
Handbook of Inorganic Chemical Compounds
https://books.google[...]
McGraw-Hill
2003
[14]
학술지
Experimental searches for rare alpha and beta decays
2019
[15]
학술지
Abundance of the Elements in the Solar System
https://pubs.giss.na[...]
[16]
학술지
Cerium(IV) Ammonium Nitrate: A Versatile Single-Electron Oxidant
[17]
학술지
Cerium(IV) Ammonium Nitrate as a Catalyst in Organic Synthesis
[18]
서적
Extractive metallurgy of rare earths
https://books.google[...]
CRC Press
2004
[19]
서적
Handbook on the Physics and Chemistry of Rare Earths, Volume 36
Elsevier
[20]
서적
Chemistry: Principles and Practice
https://books.google[...]
Cengage Learning
2009-01-02
[21]
서적
Encyclopedia of Inorganic and Bioinorganic Chemistry
[22]
서적
[23]
학술지
Периодически действующая реакция и ее механизм
[24]
학술지
Cerium under the lens
2013-03-20
[25]
학술지
Molecular compounds of "new" divalent lanthanides
2004
[26]
학술지
Aspects of non-classical organolanthanide chemistry
2002
[27]
웹사이트
Visual Elements: Cerium
http://www.rsc.org/p[...]
Royal Society of Chemistry
2012-12-31
[28]
서적
Nature's Building Blocks: An A-Z Guide to the Elements
https://books.google[...]
Oxford University Press
2011
[29]
서적
The discovery of the elements
https://archive.org/[...]
Journal of Chemical Education
1956
[30]
학술지
The Discovery of the Elements: XI. Some Elements Isolated with the Aid of Potassium and Sodium: Zirconium, Titanium, Cerium and Thorium
1932
[31]
학술지
Rediscovery of the elements: The Rare Earths–The Beginnings
http://www.chem.unt.[...]
2015
[32]
학술지
Rediscovery of the elements: The Rare Earths–The Confusing Years
http://www.chem.unt.[...]
2015
[33]
학술지
Synthesis and Sintering of Cerium(III) Sulfide Powders
http://doi.wiley.com[...]
1998-01-21
[34]
서적
Manhattan District History
https://www.osti.gov[...]
United States Army Corps of Engineers
[35]
서적
Nature's Building Blocks: An A-Z Guide to the Elements
https://books.google[...]
Oxford University Press
2003
[36]
논문
The use of suffixes in mineral names
https://web.archive.[...]
2019-12-07
[37]
웹사이트
Monazite-(Ce): Mineral information, data and localities.
https://www.mindat.o[...]
[38]
웹사이트
CNMNC
https://web.archive.[...]
2018-10-06
[39]
웹사이트
Bastnäsite-(Ce): Mineral information, data and localities.
https://www.mindat.o[...]
[40]
논문
Melt inclusions in zircon
[41]
웹사이트
Cerianite-(Ce): Mineral information, data and localities
https://www.mindat.o[...]
[42]
논문
Cerianite CeO2: a new rare-earth oxide mineral
[43]
간행물
Cerium Mischmetal, Cerium Alloys, and Cerium Compounds
[44]
서적
AWS D10.11M/D10.11 - An American National Standard - Guide for Root Pass Welding of Pipe Without Backing
American Welding Society
2007
[45]
백과사전
[46]
서적
The Chemistry of the Actinide and Transactinide Elements
https://web.archive.[...]
Springer
2006
[47]
간행물
Cerium Mischmetal, Cerium Alloys, and Cerium Compounds
Wiley-VCH, Weinheim
[48]
뉴스
Book Of A Lifetime: The Periodic Table, By Primo Levi
https://www.independ[...]
2016-10-25
[49]
논문
Effect of CeO2 and Sb2O3 on the phase transformation and optical properties of photostable titanium dioxide
2011-04-01
[50]
웹사이트
Cerium dioxide
http://www.nanoparti[...]
2011-02-02
[51]
서적
Catalysis by ceria and related materials
https://books.google[...]
Imperial College Press
2002
[52]
논문
Sol–gel synthesis and photoluminescent properties of cerium-ion doped yttrium aluminium garnet powders
https://pubs.rsc.org[...]
2002-01-01
[53]
논문
Cerium-Based, Intermetallic-Strengthened Aluminum Casting Alloy: High-Volume Co-product Development
2016
[54]
보고서
PREPARATION OF TERNARY PLUTONIUM ALLOYS FOR CORE TEST FACILITY PROGRAM
https://www.osti.gov[...]
Los Alamos National Lab. (LANL), Los Alamos, NM (United States)
1964-11-01
[55]
보고서
Potential for Recovery of Cerium Contained in Automotive Catalytic Converters
https://purl.fdlp.go[...]
U.S. Department of the Interior, U.S. Geological Survey
2013
[56]
웹사이트
Argonne's deNOx Catalyst Begins Extensive Diesel Engine Exhaust Testing
https://web.archive.[...]
Argonne National Laboratory
2014-06-02
[57]
웹사이트
Cerium GF39030353
https://www.sigmaald[...]
2021-12-22
[58]
논문
Rare earth metals are essential for methanotrophic life in volcanic mudpots
https://repository.u[...]
2013
[59]
논문
Neodymium cations Nd3+ were transported to the interior of ''Euglena gracilis'' 277
2000-04
[60]
논문
Particle-Size Dependent Accumulation and Trophic Transfer of Cerium Oxide through a Terrestrial Food Chain
https://pubs.acs.org[...]
2014-11-18
[61]
논문
Cerium Biomagnification in a Terrestrial Food Chain: Influence of Particle Size and Growth Stage
https://pubs.acs.org[...]
2016-07-05
[62]
서적
Impact of Nanomaterials on the Aquatic Food Chain
https://doi.org/10.1[...]
Springer International Publishing
2023-08-12
[63]
논문
Pharmacological properties of cerium compunds
http://link.springer[...]
Springer Berlin Heidelberg
2023-08-05
[64]
논문
Topical antimicrobials for burn wound infections
2010
[65]
논문
Methemoglobinemia by cerium nitrate poisoning
2007
[66]
논문
Rare earth metals are essential for methanotrophic life in volcanic mudpots
https://repository.u[...]
2013
[67]
논문
Toxicological Evaluations of Rare Earths and Their Health Impacts to Workers: A Literature Review
2013-03
[68]
서적
The Science of Rare Earth Elements: Concepts and Applications
https://books.google[...]
CRC Press
2022-12-30
[69]
웹사이트
Cerium(IV) oxide, REacton Safety Data Sheet
https://www.fishersc[...]
2024-08-27
[70]
웹사이트
Cerium Safety Data Sheet
https://www.ameslab.[...]
2024-08-27
[71]
보고서
Toxicological Review of Cerium Oxide and Cerium Compounds
https://iris.epa.gov[...]
Environmental Protection Agency
2009-09-00
[72]
웹사이트
Ground levels and ionization energies for the neutral atoms
https://www.nist.gov[...]
[73]
서적
Magnetic susceptibility of the elements and inorganic compounds
http://www-d0.fnal.g[...]
CRC press
[74]
서적
元素111の新知識
講談社
1998-00-00
[75]
웹사이트
Chemical reactions of Cerium
http://www.webelemen[...]
Webelements
2009-06-06
[76]
서적
Handbook of Inorganic Chemical Compounds
https://books.google[...]
McGraw-Hill
2009-06-06
[77]
간행물
セリウムを陽極に用いた微小血管造影法
https://doi.org/10.1[...]
2012-00-00
[78]
웹사이트
300℃を超える耐熱性のアルミニウム・セリウム合金――アメリカのレアアース生産を加速させる可能性も
https://engineer.fab[...]
[79]
서적
따따따 화학닷컴(놀라운 생활 속 화학이야기)
맑은 창
2008-00-00
[80]
웹사이트
Chemical reactions of Cerium
https://www.webeleme[...]
[81]
서적
유약과 그 안료
대광서림
2007-00-00
[82]
서적
천재들의 과학노트 2. 화학
일출봉
2007-00-00
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
