수소화효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
수소화효소는 수소 분자를 산화하거나 생성하는 반응을 촉매하는 효소의 총칭이다. 이들은 [NiFe], [FeFe], [Fe]의 세 가지 주요 유형으로 분류되며, 각 유형은 활성 부위의 금속 원소와 구조가 다르다. [NiFe] 수소화효소는 이종이량체 단백질로, 다양한 환경에서 발견되며, H2 산화에 더 활성적이다. [FeFe] 수소화효소는 H2 생성에 더 특화되어 있으며, H-클러스터라는 활성 부위를 갖는다. [Fe] 수소화효소는 메탄 생성 고세균에서 발견되며, 다른 두 종류와는 다른 메커니즘으로 작동한다. 수소화효소는 생물학적 에너지 생산, 생물정화, 바이오 연료 전지 등 다양한 분야에 응용될 수 있으며, 특히 수소 생산을 위한 생물학적 촉매로서의 잠재력이 높다.
더 읽어볼만한 페이지
- 철-황 단백질 - 페레독신
페레독신은 철-황 클러스터를 포함하며, 광합성, 수소 생산 등 다양한 생리적 역할에 관여하는 단백질이다. - 철-황 단백질 - 사이토크롬 b6f 복합체
사이토크롬 b6f 복합체는 광합성에서 광계 II와 광계 I 사이의 전자 및 에너지 전달을 매개하고 틸라코이드 막을 가로질러 양성자를 수송하여 ATP 합성을 촉진하는 단백질 복합체로서, 순환적 광인산화에도 중요한 역할을 하며 사이토크롬 bc1 복합체와 구조적 유사성을 갖는 8개의 소단위체로 구성된 이량체이다. - EC 1.2.1 - 폼산 탈수소효소
폼산 탈수소효소는 폼산을 이산화탄소로 산화시키는 효소로, NAD 의존성과 사이토크롬 의존성 효소로 나뉘며 메틸영양생물과 혐기성 대사에서 중요하고 몰리브도프테린, 몰리브데넘, 셀레늄을 필요로 하며 전자 전달을 수행한다. - EC 1.2.1 - 글리세르알데하이드 3-인산 탈수소효소
글리세르알데하이드 3-인산 탈수소효소는 해당과정에서 글리세르알데하이드 3-인산을 1,3-비스포스포글리세르산으로 전환하는 효소이며, 산화 스트레스, 세포 부착 등 다양한 생물학적 과정에 관여하고, 암과 같은 질병과 관련되어 있다.
| 수소화효소 |
|---|
2. 역사
수소화효소는 1930년대에 처음 발견되었다. 수소의 산화 환원 반응을 촉매하는 이 효소군은 많은 연구자들의 관심을 모았다. 수소화효소에 의한 촉매 작용 메커니즘은 과학자들이 수소 분자를 생산하는 깨끗한 생물학적 에너지원(조류 등)을 설계할 때 도움을 줄 것으로 기대된다.[44] 2014년에는 아소 산에서 연료 전지의 백금보다 637배의 활성을 보이는 수소 효소 수소화효소 S-77이 발견되어, 연료 전지의 양극 촉매로 개발되었다.[45]
수소화효소는 활성 부위에 포함된 금속에 따라 세 가지 주요 유형으로 분류된다.[2]
3. 구조적 분류
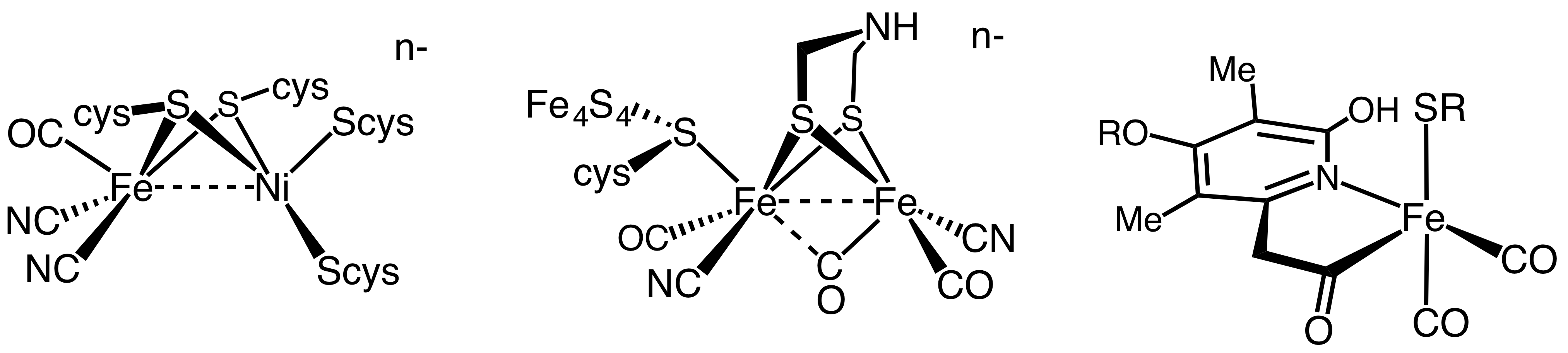
[NiFe] 및 [FeFe] 수소화효소는 활성 부위와 단백질 내부에 묻혀 있는 Fe-S 클러스터를 가진다는 공통점이 있다. 활성 부위는 금속 클러스터로 구성되어 있으며, 이 부분에서 촉매 작용이 일어난다. 금속 클러스터는 일산화 탄소(CO) 및 시안(CN⁻) 리간드에 의해 배위되어 안정화된다.[3]
[Fe] 수소화효소는 다른 두 종류와 달리, 일부 수소 영양성 메탄 생성 고세균에서만 발견된다. 또한, 전자가 활성 부위에 전달되는 방식이 다른 효소들과 근본적으로 다르다. [NiFe] 및 [FeFe] 수소화효소에서는 전자가 금속 유기 클러스터를 통해 전달되는 반면, [Fe] 수소화효소에서는 전자가 활성 부위에 직접 전달된다.
3. 1. [NiFe] 수소화효소
[NiFe] 수소화효소는 작은(S) 서브유닛과 큰(L) 서브유닛으로 구성된 이종이량체 단백질이다. 작은 서브유닛은 3개의 철-황 클러스터를 포함하고, 큰 서브유닛은 활성 부위인 니켈-철 중심을 포함한다.[4][38] 이 중심은 분자 터널을 통해 용매와 연결되어 있다. 일부 [NiFe] 수소화효소에서는 니켈에 결합된 시스테인 잔기 중 하나가 셀레노시스테인으로 대체되기도 한다. [NiFe] 및 [NiFeSe] 수소화효소는 서열 유사성을 바탕으로 하나의 슈퍼패밀리로 간주된다.
주변질, 세포질, 세포질 막 결합 등 다양한 [NiFe] 수소화효소가 발견되었다. 격리된 [NiFe] 수소화효소는 H2 발생과 흡수를 모두 촉매하며, 사이토크롬 ''c''3과 같은 낮은 전위의 다중 혈색소 사이토크롬은 산화 상태에 따라 전자 공여체 또는 수용체로 작용한다.[4] 일반적으로 [NiFe] 수소화효소는 H2 산화에 더 활성적이다.[5]
[FeFe] 수소화효소와 달리, 일부 [NiFe] 수소화효소는 분자 산소(O2)에 의해 비활성화되지 않는 내성을 가지는 경우가 있다. 예를 들어 ''Ralstonia eutropha''와 같은 Knallgas-세균의 수소화효소는 산소 내성이 있는 것으로 밝혀졌다.[4][6] ''Ralstonia eutropha'' H16에서 유래된 가용성 [NiFe] 수소화효소는 이영양생물 성장 배지에서 생산될 수 있다.[7][8] 이러한 발견은 수소화효소를 물 분해를 통한 분자 수소의 광합성 생산에 활용할 수 있다는 가능성을 제시한다.
Huc 또는 Hyd1 (시아노박테리아형 흡수 수소화효소)는 수소에 대한 매우 높은 친화도를 가지면서도 산소에 민감하지 않은 [NiFe] 수소화효소이다.[9] 수소는 산소 분자가 들어갈 수 없는 효소의 좁은 채널을 통과할 수 있다. 이는 ''Mycobacterium smegmatis''와 같은 박테리아가 다른 자원이 부족할 때 대기 중의 소량의 수소를 에너지원으로 활용할 수 있도록 돕는다.[10][11]
3. 2. [FeFe] 수소화효소
다이아이언 중심과 가교 디티올레이트 보조 인자를 포함하는 수소화효소를 [FeFe] 수소화효소라고 부른다.[12] [FeFe] 수소화효소는 세포질, 주변질, 엽록체 등에서 발견되며, 일반적으로 분자 수소 생성에 더 활발하다. ''Clostridium pasteurianum''에서 유래한 [FeFe] 수소화효소의 경우 10,000 s−1 정도의 턴오버 빈도(TOF)가 문헌에 보고되었다.[13] 이는 H2의 지속 가능한 생산을 위한 [FeFe] 수소화효소 사용에 초점을 맞춘 연구를 이끌었다.[14]
[FeFe] 수소화효소의 활성 부위는 H-클러스터로 알려져 있다. H-클러스터는 시스테인 유래 티올에 의해 저가의 다이아이언 보조 인자에 연결된 [4Fe4S] 입방체 구조로 구성되어 있다. 다이아이언 보조 인자는 가교 아자-디티올레이트 리간드(-SCH2-NH-CH2S-, adt)에 의해 연결된 두 개의 철 원자를 포함하며, 철 원자는 카보닐 및 시안화물 리간드에 의해 배위된다.[15]
[FeFe]-수소화효소는 네 개의 서로 다른 계통 발생 그룹 A-D로 나눌 수 있다.[16] 그룹 A는 전형적인 분기형 [FeFe]-수소화효소로 구성된다. 자연에서 전형적인 [FeFe]-수소화효소는 페레독신을 산화 환원 파트너로 사용하여 수소 턴오버 수를 수행하는 반면, 분기형 유형은 페레독신과 NAD(H)를 전자 공여체 또는 수용체로 모두 사용하여 동일한 반응을 수행한다.[17] 에너지를 보존하기 위해 혐기성 박테리아는 전자 분기를 사용하여 발열 과정과 흡열 반응의 산화 환원 반응을 결합하여 열역학적 장벽을 우회한다. 그룹 A는 ''Chlamydomonas reinhardtii''(''Cr''HydA1),[18] Desulfovibrio desulfuricans(''Dd''HydAB 또는 ''Dd''H),[19] ''Clostridium pasteurianum'' 및 ''Clostridium acetobutylicum''(각각 ''Cp''HydA1 및 ''Ca''HydA1, ''Cp''I 및 ''Ca''I로 지칭)과 같은 가장 잘 특징지어지고 촉매적으로 가장 활성인 효소를 포함한다.[20] 그룹 B의 대표적인 예는 아직 특징지어지지 않았지만, 그룹 A [FeFe]-수소화효소와 H-클러스터 주변에서 유사한 아미노산 구조적 모티프를 공유하더라도 계통 발생학적으로 뚜렷하다. 그룹 C는 Per-Arnt-Sim 도메인의 존재를 기반으로 "감각"으로 분류되었다.[21][22] 그룹 C [FeFe]-수소화효소의 한 예는 ''Thermotoga maritima''(''Tm''HydS)에서 유래한 것으로, 그룹 A 효소에 비해 미미한 촉매 속도와 수소(H2)에 대한 높은 민감도를 보인다.[23] 그룹 D의 밀접하게 관련된 하위 부류는 박테리아 유전자에서 유사한 위치를 가지며 그룹 E의 하위 부류와 유사한 도메인 구조를 공유하지만 PAS 도메인이 없다.[16][21] 그룹 D 내에서 ''Thermoanaerobacter mathranii''(''Tam''HydS로 지칭)에서 유래한 [FeFe]-수소화효소가 특징지어졌다.[24]
3. 3. [Fe] 수소화효소
5,10-메테닐테트라하이드로메탄테린 수소화효소(EC [http://enzyme.expasy.org/EC/1.12.98.2 1.12.98.2])는 메탄 생성 세균에서 발견되며, 니켈이나 철-황 클러스터는 없지만, X선 회절법으로 최근 특성화된 철 함유 보조 인자를 가지고 있다.[25]
다른 두 종류와 달리, [Fe]-only 수소화효소는 일부 수소 영양성 메탄 생성 고세균에서만 발견된다. 또한 산화 환원 파트너와 전자가 활성 부위에 전달되는 방식 측면에서 근본적으로 다른 효소 메커니즘을 특징으로 한다. [NiFe] 및 [FeFe] 수소화효소에서는 전자가 긴 거리를 구성하는 일련의 금속 유기 클러스터를 통해 이동하며, 활성 부위 구조는 전체 과정에서 변경되지 않는다. 그러나 [Fe]-only 수소화효소에서는 전자가 짧은 거리를 통해 활성 부위에 직접 전달된다. 보조 인자인 메테닐-H4MPT+는 이 과정에서 H2로부터 수소화물을 직접 받아들인다. [Fe]-only 수소화효소는 또한 H2-형성 메틸렌테트라하이드로메탄테린(methylene-H4MPT) 탈수소 효소라고도 알려져 있는데, 그 기능은 메테닐-H4MPT+를 메틸렌-H4MPT로 가역적으로 환원시키는 것이다.[26] 메테닐-H4MPT+의 수소화 반응은 다른 두 종류의 수소화효소에서 일어나는 H2 산화/생성 대신 발생한다. 촉매 작용의 정확한 메커니즘은 아직 연구 중이지만, 최근 연구 결과에 따르면 분자 수소가 먼저 Fe(II)에 의해 이질적으로 절단된 후, 수소화물이 수용체의 탄소 양이온으로 전달되는 것으로 나타났다.[27]
4. 촉매 메커니즘
수소화효소 내에서 양성자가 수소 분자로 전환되는 분자 메커니즘은 활발히 연구되고 있다. 아미노산 및/또는 리간드의 역할을 밝히기 위해 돌연변이 유발을 사용하여 기질의 분자 내 수송과 같은 촉매 작용의 여러 단계를 연구하는 방법이 널리 사용된다.[28] 예를 들어, Cornish 등은 돌연변이 유발 연구를 통해 활성 부위와 단백질 표면을 연결하는 추정 채널을 따라 위치한 4개의 아미노산이 ''Clostridium pasteurianum''(CpI)에서 유래한 [FeFe] 수소화효소의 효소 기능에 중요하다는 것을 발견했다.[28] 계산 분석 및 시뮬레이션에 의존할 수도 있다. Nilsson Lill과 Siegbahn은 최근 [NiFe] 수소화효소가 H2 분해를 촉매하는 메커니즘을 연구하는 데 이 접근 방식을 사용했다.[29] 이 두 가지 접근 방식은 상호 보완적이며 서로에게 도움이 될 수 있다. 실제로 Cao와 Hall은 [FeFe] 수소화효소의 활성 부위 내에서 수소 분자가 어떻게 산화되거나 생성되는지를 설명하는 모델을 개발하기 위해 두 가지 접근 방식을 결합했다.[30] 메커니즘에 대한 이해를 완성하기 위해 더 많은 연구와 실험 데이터가 필요하지만, 이러한 발견을 통해 과학자들은 수소화효소의 활성 부위를 모방한 인공 촉매를 구축하는 데 지식을 적용할 수 있게 되었다.[31]
5. 생물학적 기능
수소화효소는 초기 지구 대기에 수소가 풍부했던 환경에서 수소로부터 에너지를 생성하기 위해 진화했을 것으로 추정된다. 미생물이 수소 환경에서 증식하거나, 수소 기반 생태계를 구축하는 데 도움을 줄 수 있다.[32] 광합성이 불가능한 심해와 같은 환경에서 수소 기반 미생물 군집이 발견되기도 한다.
최근 연구에 따르면 수소화효소는 다음과 같은 다양한 생물학적 기능을 수행한다.
6. 응용
1930년대에 수소화효소가 발견된 이후,[35] 무기화학자들은 다양한 수소화효소 모방체를 합성하는 등 많은 관심을 보였다. ''Ralstonia eutropha'' H16에서 추출한 가용성 [NiFe] 수소화효소는 H2 산화를 선호하고 상대적으로 산소에 대한 내성이 있어 H2 기반 바이오 연료 적용에 유망하다.[7][8] 수소화효소의 촉매 메커니즘을 이해하면 과학자들이 수소를 생산하는 조류와 같은 청정 생물 에너지원을 설계하는 데 도움이 될 수 있다.[36]
6. 1. 생물학적 수소 생산
수소화효소는 낮은 과전압과 높은 촉매 활성으로 인해 태양광을 이용한 물 분해 및 수소 생산 시스템에 적용될 가능성이 높다.[37] 특히 [FeFe] 수소화효소는 높은 TOF(9000 s−1 이상)를 가지지만, O₂에 민감하다는 단점이 있다.[6][FeFe] 수소화효소의 낮은 과전압과 높은 촉매 활성은 높은 O₂ 감수성을 동반한다. O₂는 물 분해 반응의 부산물이므로, 태양 H₂ 생산에 사용하기 위해서는 O₂ 내성을 갖도록 설계해야 한다. 전 세계의 다양한 연구 그룹들은 수소화효소의 O₂ 불활성화와 관련된 메커니즘을 이해하는 데 집중해 왔다.[38][39] Stripp 등은 단백질 필름 전기화학을 사용하여 O₂가 먼저 [FeFe] 수소화효소의 활성 부위에서 반응성 종으로 전환된 다음, [4Fe-4S] 도메인에 손상을 입힌다는 것을 발견했다.[40] Cohen 등은 분자 역학 시뮬레이션 접근 방식을 통해 산소가 단백질 내부에 묻혀 있는 활성 부위에 어떻게 도달하는지 조사했다. 그들의 결과는 O₂가 동적 운동 중 공동의 확대와 상호 연결에 의해 형성된 주로 두 개의 경로를 통해 확산된다는 것을 나타낸다.[41] 이러한 연구들은 불활성화가 O₂의 활성 부위로의 확산과 활성 부위의 파괴적인 변형이라는 두 가지 현상에 의해 지배된다는 것을 시사한다.
이러한 발견에도 불구하고, 수소화효소의 산소 내성을 설계하기 위한 연구가 여전히 진행 중이다. 연구자들은 산소 내성 [NiFe] 수소화효소를 발견했지만, 이들은 수소 흡수에만 효율적이고 생산에는 효율적이지 않다.[21] Bingham 등이 ''Clostridium pasteurianum''에서 [FeFe] 수소화효소를 설계하는 데 성공한 것도 H₂ 소비에 대한 활성 유지(산소 노출 동안)에만 국한되었다.[42]
6. 2. 수소화효소 기반 바이오 연료 전지
수소화효소 기반 바이오 연료 전지에서는 수소화효소 효소가 양극에서 H₂ 산화를 일으킨다.[8][4][43]수소화효소가 촉매하는 양방향 또는 가역 반응을 통해 재생 에너지원을 연료로 포집하고 저장하여 필요에 따라 사용할 수 있다. 이는 낮은 에너지 수요 기간 동안 태양열, 풍력, 수열과 같은 재생 에너지원에서 얻은 전기를 H₂로 화학적으로 저장하여 입증할 수 있다. 에너지가 필요할 때 H₂를 산화시켜 전기를 생산할 수 있다.[43]
이는 필요 시 사용 가능한 연료로서 재생 에너지의 포집 및 저장 기술 개발에 대한 과제의 한 가지 해결책이다. H₂로부터 전기를 생산하는 것은 백금 촉매와 유사한 기능을 가지면서 촉매 독성이 없고 매우 효율적이다. H₂/O₂ 연료 전지의 경우, 생성물이 물이기 때문에 온실 가스 배출이 없다.[43]
7. 생화학적 분류
Enzyme Commission number|효소 위원회 번호영어 (EC 번호)에 따라 다양한 종류의 수소화효소가 분류된다.
| EC 번호 | 이름 | 반응 |
|---|---|---|
| [http://enzyme.expasy.org/EC/1.12.1.2 1.12.1.2] | 수소 탈수소 효소 (수소:NAD+ 산화환원효소) | H2 + NAD+ H+ + NADH |
| [http://enzyme.expasy.org/EC/1.12.1.3 1.12.1.3] | 수소 탈수소효소 (NADP) (수소:NADP+ 산화환원효소) | H2 + NADP+ H+ + NADPH |
| [http://enzyme.expasy.org/EC/1.12.2.1 1.12.2.1] | 사이토크롬-c3 수소화효소 (수소:페리사이토크롬-c3 산화환원효소) | 2H2 + 페리사이토크롬 c3 4H+ + 페로사이토크롬 c3 |
| [http://enzyme.expasy.org/EC/1.12.5.1 1.12.5.1] | 수소:퀴논 산화환원 효소 | H2 + 메나퀴논 메나퀴놀 |
| [http://enzyme.expasy.org/EC/1.12.7.2 1.12.7.2] | 페레독신 수소화 효소 (수소:페레독신 산화환원효소) | H2 + 산화된 페레독신 2H+ + 환원된 페레독신 |
| [http://enzyme.expasy.org/EC/1.12.98.1 1.12.98.1] | 조효소 F420 수소화효소 (수소:조효소 F420 산화환원효소) | H2 + 조효소 F420 환원된 조효소 F420 |
| [http://enzyme.expasy.org/EC/1.12.99.6 1.12.99.6] | 수소화효소 (수용체) (수소:수용체 산화환원효소) | H2 + A AH2 |
| [http://enzyme.expasy.org/EC/1.12.98.2 1.12.98.2] | 5,10-메테닐테트라하이드로메탄프테린 수소화효소 (수소:5,10-메테닐테트라하이드로메탄프테린 산화환원효소) | H2 + 5,10-메테닐테트라하이드로메탄프테린 H+ + 5,10-메틸렌테트라하이드로메탄프테린 |
| [http://enzyme.expasy.org/EC/1.12.98.3 1.12.98.3] | 메타노사르시나-페나진 수소화효소 [수소:2-(2,3-다이하이드로펜타프레닐옥시)페나진 산화환원효소] | H2 + 2-(2,3-다이하이드로펜타프레닐옥시)페나진 2-다이하이드로펜타프레닐옥시페나진 |
참조
[1]
논문
Classification and phylogeny of hydrogenases
2001-08-01
[2]
논문
Hydrogenases
2014-04-01
[3]
논문
Structure/function relationships of [NiFe]- and [FeFe]-hydrogenases
2007-10-01
[4]
논문
Fundamentals and electrochemical applications of [Ni–Fe]-uptake hydrogenases
2013-05-14
[5]
논문
A soil actinobacterium scavenges atmospheric H2 using two membrane-associated, oxygen-dependent [NiFe] hydrogenases
2014-03-01
[6]
논문
[NiFe]-hydrogenases of Ralstonia eutropha H16: modular enzymes for oxygen-tolerant biological hydrogen oxidation
[7]
논문
An analysis of the changes in soluble hydrogenase and global gene expression in Cupriavidus necator (Ralstonia eutropha) H16 grown in heterotrophic diauxic batch culture
2015-03-01
[8]
논문
Production and purification of a soluble hydrogenase from Ralstonia eutropha H16 for potential hydrogen fuel cell applications
2016-01-01
[9]
논문
Two uptake hydrogenases differentially interact with the aerobic respiratory chain during mycobacterial growth and persistence
2019-12-01
[10]
논문
Structural basis for bacterial energy extraction from atmospheric hydrogen
2023-03-01
[11]
논문
Soil bacteria enzyme generates electricity from hydrogen in the air
https://www.newscien[...]
2023-03-08
[12]
논문
Biomimetic assembly and activation of [FeFe]-hydrogenases
2013-07-01
[13]
논문
Catalytic turnover of [FeFe]-hydrogenase based on single-molecule imaging
2012-01-01
[14]
논문
Generation of hydrogen from NADPH using an [FeFe] hydrogenase
[15]
논문
Monitoring H-cluster assembly using a semi-synthetic HydF protein
2019-05-01
[16]
논문
Current State of [FeFe]-Hydrogenase Research: Biodiversity and Spectroscopic Investigations
2020-05-28
[17]
논문
Complex Multimeric [FeFe] Hydrogenases: Biochemistry, Physiology and New Opportunities for the Hydrogen Economy
2018-12-04
[18]
논문
Isolation, characterization and N-terminal amino acid sequence of hydrogenase from the green alga Chlamydomonas reinhardtii
1993-06-01
[19]
논문
Purification and properties of the periplasmic hydrogenase from Desulfovibrio desulfuricans
1980-10-01
[20]
논문
Purification and properties of hydrogenase, an iron sulfur protein, from Clostridium pasteurianum W5
1971-03-01
[21]
논문
The surprising diversity of clostridial hydrogenases: a comparative genomic perspective
2010-06-01
[22]
논문
Genomic and metagenomic surveys of hydrogenase distribution indicate H2 is a widely utilised energy source for microbial growth and survival
2016-03-01
[23]
논문
Unique Spectroscopic Properties of the H-Cluster in a Putative Sensory [FeFe] Hydrogenase
2018-01-01
[24]
논문
Characterization of a putative sensory [FeFe]-hydrogenase provides new insight into the role of the active site architecture
2020-09-01
[25]
논문
The crystal structure of [Fe]-hydrogenase reveals the geometry of the active site
2008-07-01
[26]
논문
The iron-site structure of [Fe]-hydrogenase and model systems: an X-ray absorption near edge spectroscopy study
2010-03-01
[27]
논문
Iron-chromophore circular dichroism of [Fe]-hydrogenase: the conformational change required for H2 activation
2010-12-01
[28]
논문
Mechanism of proton transfer in [FeFe]-hydrogenase from Clostridium pasteurianum
2011-11-01
[29]
논문
An autocatalytic mechanism for NiFe-hydrogenase: reduction to Ni(I) followed by oxidative addition
2009-02-01
[30]
논문
Modeling the active sites in metalloenzymes. 3. Density functional calculations on models for [Fe]-hydrogenase: structures and vibrational frequencies of the observed redox forms and the reaction mechanism at the Diiron Active Center
2001-04-01
[31]
논문
Synthesis of the H-cluster framework of iron-only hydrogenase
2005-02-01
[32]
논문
Occurrence, classification, and biological function of hydrogenases: an overview
2007-10-01
[33]
논문
Biological hydrogen production: not so elementary
1998-12-01
[34]
논문
Hydrogenases: hydrogen-activating enzymes
2002-03-01
[35]
논문
Biochemistry of methanogenesis: a tribute to Marjory Stephenson. 1998 Marjory Stephenson Prize Lecture
1998-09-01
[36]
저널
A novel type of iron hydrogenase in the green alga Scenedesmus obliquus is linked to the photosynthetic electron transport chain
2001-03-00
[37]
저널
Biomimetic hydrogen evolution: MoS2 nanoparticles as catalyst for hydrogen evolution
2005-04-00
[38]
저널
Relating diffusion along the substrate tunnel and oxygen sensitivity in hydrogenase
2010-01-00
[39]
저널
A unique iron-sulfur cluster is crucial for oxygen tolerance of a [NiFe]-hydrogenase
2011-05-00
[40]
저널
How oxygen attacks [FeFe] hydrogenases from photosynthetic organisms
2009-10-00
[41]
저널
Finding gas diffusion pathways in proteins: application to O2 and H2 transport in CpI [FeFe]-hydrogenase and the role of packing defects
2005-09-00
[42]
저널
Evolution of an [FeFe] hydrogenase with decreased oxygen sensitivity
[43]
저널
Hydrogenases
2014-04-00
[44]
웹사이트
Mutant Algae Is Hydrogen Factory
http://www.wired.com[...]
[45]
웹사이트
燃料電池の白金電極を超える水素酵素「S–77」電極の開発に成功
http://web.cstm.kyus[...]
[46]
저널
Classification and phylogeny of hydrogenases
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com