이온
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
이온은 원자 또는 분자가 전자를 잃거나 얻어 전하를 띠는 입자를 의미하며, 1834년 마이클 패러데이에 의해 처음 사용되었다. 이온은 양이온과 음이온으로 나뉘며, 이온의 이동 현상은 이온 음료의 대중화와 함께 널리 알려졌다. 이온은 다양한 장치와 기술에 활용되며, 특히 이온 결합을 통해 이온 화합물을 형성한다. 또한, '이온'은 다양한 분야에서 사용되는 용어이며, 여러 인물, 기업, 작품 등의 이름으로도 사용된다.
더 읽어볼만한 페이지
- 전하 운반자 - 캐리어 생성 및 재결합
캐리어 생성 및 재결합은 반도체 내에서 전자의 이동과 관련된 현상으로, 밴드 구조에 따라 특성이 달라지며, Shockley-Read-Hall, 방사, 오제 재결합 등 다양한 과정을 통해 발생하여 반도체 소자의 성능에 영향을 미친다. - 전하 운반자 - 전자
전자는 음전하를 띤 기본 입자로서 원자의 구성 요소이며 파동-입자 이중성을 가지고 양자역학으로 설명되며 전자기력, 약한 힘과 상호 작용하여 전자 현미경, 자유전자레이저, 반도체 기술 등에 활용된다. - 이온 - 이온 빔
이온 빔은 전하를 띤 입자들의 좁은 흐름으로, 전류 밀도와 에너지로 측정되며, 격자형 또는 격자 없는 이온 소스를 통해 생성되어 다양한 과학 및 기술 분야에서 활용된다. - 이온 - 이온원
이온원은 원자나 분자를 이온화하여 이온 빔이나 플라즈마를 만드는 장치로, 전자, 광자, 레이저 등 다양한 방법으로 이온화를 유도하며 질량 분석법, 입자 가속기 등 여러 분야에 응용된다. - 화학 결합 - 원자가 전자
원자가 전자는 원자의 최외각 전자껍질에 존재하며 화학적 성질을 결정하는 데 중요한 역할을 하고, 주족 원소는 최외각 전자껍질의 전자로 정의되지만 전이 원소는 (n-1)d 궤도의 전자도 포함하며, 주기율표 족에 따라 예측 가능하지만 예외도 존재하고, 화학 결합, 산화 상태, 전기 전도도에 영향을 미친다. - 화학 결합 - 파울리 배타 원리
파울리 배타 원리는 1925년 볼프강 파울리가 제시한 양자역학 원리로, 동일한 페르미온은 동일한 양자 상태에 존재할 수 없으며, 원자의 전자 배치, 화학 결합, 천체 특성 등을 설명하는 데 중요한 역할을 한다.
| 이온 | |
|---|---|
| 지도 정보 | |
| 기본 정보 | |
| 정의 | 순전하를 띤 원자, 분자 또는 입자 |
| 형성 과정 | 원자나 분자가 전자를 얻거나 잃어서 형성됨 |
| 종류 | |
| 양이온 | 전자를 잃어 양전하를 띤 이온 예: H+, Na+ |
| 음이온 | 전자를 얻어 음전하를 띤 이온 예: Cl−, O2− |
| 관련 개념 | |
| 전기 중성 | 전하를 띠지 않은 상태 |
| 전해질 | 이온을 포함하여 전류를 전달하는 물질 |
| 플라스마 | 이온화된 기체 |
| 응용 분야 | |
| 생물학 | 세포 기능 및 생체 신호 전달 |
| 화학 | 다양한 화학 반응 및 화합물 형성 |
| 산업 | 반도체 제조 전지 전기 도금 폐수 처리 |
| 기타 | |
| 발견 | 19세기 마이클 패러데이 |
| 중요성 | 생명체의 필수적인 구성 요소 자연 및 기술 분야의 다양한 현상에 중요하게 작용 |
2. 이온의 역사
"이온(ion)"이라는 용어는 1834년 영국의 과학자 마이클 패러데이가 처음 도입하였다. 그는 수용액을 통해 전류가 흐를 때, 한 전극에서 다른 전극으로 이동하는 물질을 설명하기 위해 이 용어를 사용했다.[7][8] 패러데이는 이 물질의 성질을 정확히 알지 못했지만, 한 전극에서 금속이 용해되어 용액으로 들어가고 다른 전극에서는 용액에서 새로운 금속이 생성되는 것을 보고, 어떤 종류의 물질이 전류를 통해 용액 속을 이동한다는 것을 알았다.
1884년 스반테 아레니우스는 고체 결정질 염이 용해될 때 쌍을 이룬 대전 입자로 해리되는 현상을 설명하는 논문을 발표했고, 이 공로로 1903년 노벨 화학상을 수상했다.[9] 아레니우스는 염이 용액을 형성할 때 패러데이의 이온으로 해리되며, 전류가 없더라도 이온이 형성된다고 주장했다.[10][11][12]
대한민국에서는 1980년대 이후 이온 음료가 대중화되면서 이온이라는 용어가 널리 알려지게 되었다.
2. 1. 이온 명명법
"이온(ion)"이라는 단어는 "가다"라는 뜻의 그리스어 ἰέναι (ienai)의 중성 현재 분사에서 유래되었다.[6] 양이온(cation)은 아래로 이동하는 것(κάτω, kato, "아래"라는 뜻)을, 음이온(anion)은 위로 이동하는 것(ἄνω, ano, "위"라는 뜻)을 의미한다. 이온들이 서로 반대 전하의 전극으로 이동하기 때문에 이러한 이름이 붙었다.[6] 이 용어는 1834년 영국의 물리학자이자 화학자인 마이클 패러데이가 윌리엄 휴얼의 제안에 따라 도입하였다.[6] 패러데이는 "양극"과 "음극"이라는 단어도 만들었다.[6]
음이온(-)과 양이온(+)은 이온의 순 전하를 나타낸다. 양성자보다 전자가 더 많아 순 음전하를 갖는 이온을 음이온이라고 하며, "음이온(-)" 표시는 음전하를 나타낸다. 양이온의 경우는 정반대이다. 양성자보다 전자가 적어 순 양전하를 갖기 때문에 "양이온(+)"으로 표시된다.
- 음이온 (anion|애니언영어) : 그리스어 ἄνω (''ánō'')에서 유래, "위쪽"을 의미하며,[13] 전자보다 양성자가 적어 순 음전하를 갖는 이온이다.[14]
- 양이온 (cation|캐타이언영어) : 그리스어 κάτω (''kátō'')에서 유래, "아래쪽"을 의미하며,[15] 전자보다 양성자가 많아 양전하를 갖는 이온이다.[16]

이온의 화학식을 쓸 때, 그 순수 전하는 분자 또는 원자의 화학 구조 바로 뒤에 위첨자로 표기한다. 순수 전하는 크기를 ''먼저'' 그리고 부호를 표기한다. 즉, 2가 양이온은 '''+2'''가 아닌 '''2+'''로 표기한다. 그러나 단일 전하를 띤 분자 또는 원자의 경우에는 전하의 크기를 생략한다.

3. 이온의 특성
기체 상태의 이온은 반응성이 매우 커서 반대 전하의 이온과 빠르게 결합하여 중성 분자나 이온성 염을 만든다. 액체나 고체 상태에서는 이온이 용매(예: 물)와 상호작용하여 더 안정된 "용매화된 이온"을 형성하는데, 이는 이온들이 서로 멀어지고 액체와 상호작용하면서 나타나는 에너지와 엔트로피 변화 때문이다. 이러한 안정화된 이온은 저온 환경에서 더 흔하게 발견되며, 바닷물 속의 이온이 대표적인 예시이다.[14]
이온은 전하를 띠고 있기 때문에 반대 전하에는 끌리고 같은 전하에는 밀려난다. 이온이 움직일 때 자기장에 의해 궤도가 휘어질 수 있다.[14]
전자는 질량이 작고 물질파로서 공간을 차지하는 특성 때문에 원자와 분자의 크기를 결정한다. 따라서 음이온은 전자가 많아 서로 밀어내기 때문에 원래 원자나 분자보다 크기가 크다. 반면 양이온은 전자가 적어 전자 구름의 크기가 작아지므로 원래 원자나 분자보다 크기가 작다. 특히 수소 양이온은 전자가 없어 양성자 하나로만 구성되어 매우 작다.[14]
이온은 자연에서 흔히 발견되며, 태양의 빛이나 지구의 전리층 등 다양한 현상을 일으킨다. 이온 상태의 원자는 중성 원자와 다른 색을 나타낼 수 있는데, 금속 이온에 의한 빛 흡수는 보석의 색깔을 만드는 원인이 된다. 무기 화학과 유기 화학(생화학 포함)에서 물과 이온의 상호작용은 시스템의 특성을 이해하는 데 중요하며, ATP의 분해는 생물학적 시스템의 많은 반응에 에너지를 제공하는 대표적인 예시이다.
3. 1. 음이온과 양이온
'''음이온'''(-)은 전자보다 양성자가 적어 순 음전하를 갖는 이온이다(전자는 음전하를 띠고 양성자는 양전하를 띠므로).[14] '''양이온'''(+)(은 전자보다 양성자가 많아 양전하를 갖는 이온이다.[16]양이온과 음이온은 이온 반지름으로 측정되며 크기가 다르다. "양이온은 작고, 대부분 반지름이 10−10m(pm) 미만이다. 그러나 대부분의 음이온은 크며, 가장 일반적인 지구상의 음이온인 산소도 그렇다. 이 사실로부터 결정의 대부분의 공간은 음이온이 차지하고 양이온은 그 사이 공간에 들어맞는다는 것을 알 수 있다."[18]
음이온(-)과 양이온(+)은 이온의 순 전하를 나타낸다. 양성자보다 전자가 더 많아 순 음전하를 갖는 이온을 음이온이라고 하며, "음이온(-)" 표시는 음전하를 나타낸다. 양이온의 경우는 정반대이다. 양성자보다 전자가 적어 순 양전하를 갖기 때문에 "양이온(+)"으로 표시된다.
양성자의 전하량은 전자의 전하량과 크기가 같으므로, 이온의 순 전하는 이온 내 양성자 수에서 전자 수를 뺀 것과 같다.
다중 전하를 갖는 이온에 대해 사용되는 추가적인 이름이 있다. 예를 들어, -2 전하를 갖는 이온은 이중 음이온으로 알려져 있으며, +2 전하를 갖는 이온은 이중 양이온으로 알려져 있다. 양쪽이온은 분자 내 서로 다른 위치에 양전하와 음전하를 갖는 중성 분자이다.[17]
4. 이온의 형성
이온은 원자 또는 분자가 전자를 주고받아 전하를 띤 것을 말한다.[1] 원자가 전자를 잃으면 양이온, 전자를 얻으면 음이온이 된다. 이온의 형성은 단원자 이온과 다원자 이온의 형성으로 나눌 수 있다.
단원자 이온은 원자가 바깥쪽 껍질의 전자를 얻거나 잃어 형성되며, 이 과정을 이온화라고 한다. 나트륨은 전자를 잃고 양이온이 되기 쉽고, 염소는 전자를 얻고 음이온이 되기 쉽다. 이들은 이온 결합을 통해 염화나트륨을 형성한다.
다원자 이온은 H+ 이온을 얻거나 잃어 형성된다. 암모니아는 H+를 받아 암모늄 이온을 형성한다. 다원자 이온 형성에는 각 원자의 전자 친화도가 중요한 역할을 한다. 예를 들어, 질산 이온은 산소의 전자 친화도가 질소보다 커서 음이온이 된다.
4. 1. 단원자 이온의 형성
단원자 이온은 원자가 가장 바깥쪽 껍질의 전자를 얻거나 잃을 때 형성된다. 안쪽 껍질의 전자는 양전하를 띤 원자핵과 묶여있으며 화학반응에 관여하지 않는다. 이렇게 원자가 전자를 얻거나 잃는 과정을 이온화라고 한다. 원자는 강한 방사선을 쬐는 것으로도 이온화될 수 있지만, 화학에서 일반적인 이온화는 원자나 분자 사이에서 전자가 이동함으로써 일어난다. 이런 이동은 보통 안정된 전자 구성을 유지하려는 성질로 인해 일어난다.예를 들어 나트륨 원자(Na)는 가장 바깥쪽 껍질에 전자 1개가 있는데, 10개의 전자로 이루어진 꽉 찬 안쪽 껍질은 매우 안정적인 전자 구성을 갖는다. 이 때문에 나트륨은 가장 바깥쪽 껍질의 전자 1개를 잃고 '''양이온'''이 되려는 경향이 있다.
:Na → Na+ + e−
반면에 염소 원자(Cl)는 가장 바깥쪽 껍질에 7개의 전자를 가지고 있다. 이 껍질이 8개의 전자로 채워지면 안정한 상태가 되므로 염소는 전자 1개를 얻고 '''음이온'''이 되려는 경향이 있다.
:Cl + e− → Cl−
이것은 나트륨과 염소가 화학반응을 일으키게 하는 원동력이다. 이때 나트륨에서 염소로 전자 1개가 이동해서 나트륨 양이온과 염소 음이온이 형성된다. 이 양이온과 음이온은 이온 결합을 일으키고 그 결과로 염화나트륨(NaCl, 소금)을 형성한다.
:Na+ + Cl− → NaCl
이온의 화학식을 쓸 때, 그 순수 전하는 분자 또는 원자의 화학 구조 바로 뒤에 위첨자로 표기하며, 크기를 ''먼저'' 그리고 부호를 표기한다. 단일 전하를 띤 분자 또는 원자의 경우에는 전하의 크기를 생략한다. 예를 들어, 나트륨 양이온은 Na+로 표기한다.
분자 또는 원자의 다중 전하를 나타내는 또 다른 방법은 부호를 여러 번 쓰는 것이다. 이것은 전이 금속에서 자주 볼 수 있다.
단원자 이온은 특히 분광법에서 로마 숫자로 표기되기도 한다. 예를 들어, Fe2+의 경우 Fe(III) 또는 Fe III 로 표기되는데, 로마 숫자는 원소의 ''형식적인 산화 상태''를 나타내는 반면, 위첨자 아라비아 숫자는 순수 전하를 나타낸다.
4. 2. 다원자 이온의 형성
다원자 이온 및 분자 이온은 종종 H+같은 이온을 얻거나 잃음으로써 형성된다. 예를 들면 암모니아(NH3)는 H+를 받아들여서 암모늄 이온(NH4+)을 형성한다. 암모니아와 암모늄은 같은 수의 전자를 가지고 있지만 암모늄은 양전하를 띠게 하는 양성자를 더 가지고 있다.다원자 이온의 형성에는 각 원자가 가지는 전자 친화도가 중요한 역할을 한다. 예를 들자면 질산 이온(NO3-)은 질소(N) 보다 산소(O)의 전자 친화도가 크므로 해서 질소는 +5가를 산소는 -2가이나 3개가 있으므로 -6가가 돼서 결국 -1가의 음이온이 된다.
다원자 이온 및 분자 이온은 종종 중성 분자에서 양성자(H+)와 같은 원소 이온을 얻거나 잃는 과정을 통해 형성된다. 예를 들어, 암모니아(NH3)가 양성자(H+)를 받아들이는 과정—양성자화라고 함—을 통해 암모늄 이온(NH4+)이 형성된다. 암모니아와 암모늄은 본질적으로 동일한 전자 배치에 거의 같은 수의 전자를 가지고 있지만, 암모늄은 추가적인 양성자를 가지고 있어 순 양전하를 띈다.
암모니아는 전자를 잃어 양전하를 얻어 NH3+ 이온을 형성할 수도 있다. 그러나 이 이온은 질소 원자 주변에 불완전한 원자가 전자 껍질을 가지고 있기 때문에 매우 반응성이 높은 라디칼 이온이 되어 불안정하다.
라디칼 이온의 불안정성으로 인해 다원자 이온과 분자 이온은 일반적으로 전자를 얻거나 잃는 것보다 H+와 같은 원소 이온을 얻거나 잃는 방식으로 형성된다. 이를 통해 분자는 안정적인 전자 배치를 유지하면서 전하를 얻을 수 있다.
5. 이온의 종류
양이온은 원자 이름에 '이온'을 붙여 부르며, 음이온은 원자 이름에 '~화 이온'을 붙여 부른다. 예를 들어, 나트륨 이온(Na+)은 양이온이고, 염화 이온(Cl-)은 음이온이다. 단, 음이온의 경우 산소와 염소의 '소'는 생략하여 산화 이온(O2-), 염화 이온(Cl-)과 같이 부른다.[20]
산소산의 경우 산소 수에 따라 차아, 아, 과 등으로 나뉠 수 있으며, 수소 수에 따라 이수소이온, 수소이온 등으로 나뉠 수 있다.
| 표준 이름 | 이온식 | 산화수 |
|---|---|---|
| 원자 양이온 | ||
| 알루미늄 이온 | Al3+ | +3 |
| 바륨 이온 | Ba2+ | +2 |
| 베릴륨 이온 | Be2+ | +2 |
| 카드뮴 이온 | Cd2+ | +2 |
| 세슘 이온 | Cs+ | +1 |
| 칼슘 이온 | Ca2+ | +2 |
| 크로뮴 이온(II) | Cr2+ | +2 |
| 크로뮴 이온(III) | Cr3+ | +3 |
| 크로뮴 이온(VI) | Cr6+ | +6 |
| 코발트 이온(II) | Co2+ | +2 |
| 코발트 이온(III) | Co3+ | +3 |
| 구리 이온(I) | Cu+ | +1 |
| 구리 이온(II) | Cu2+ | +2 |
| 구리 이온(III) | Cu3+ | +3 |
| 갈륨 이온 | Ga3+ | +3 |
| 금 이온(I) | Au+ | +1 |
| 금 이온(III) | Au3+ | +3 |
| 헬륨 이온 | He2+ | +2 |
| 수소 이온 | H+ | +1 |
| 철 이온(II) | Fe2+ | +2 |
| 철 이온(III) | Fe3+ | +3 |
| 납 이온(II) | Pb2+ | +2 |
| 납 이온(IV) | Pb4+ | +4 |
| 리튬 이온 | Li+ | +1 |
| 마그네슘 이온 | Mg2+ | +2 |
| 망가니즈 이온(II) | Mn2+ | +2 |
| 망가니즈 이온(III) | Mn3+ | +3 |
| 망가니즈 이온(IV) | Mn4+ | +4 |
| 망가니즈 이온(VII) | Mn7+ | +7 |
| 수은 이온(II) | Hg2+ | +2 |
| 니켈 이온(II) | Ni2+ | +2 |
| 니켈 이온(III) | Ni3+ | +3 |
| 질화 이온(I) | N+ | +1 |
| 칼륨 이온 | K+ | +1 |
| 은 이온 | Ag+ | +1 |
| 나트륨 이온 | Na+ | +1 |
| 스트론튬 이온 | Sr2+ | +2 |
| 탈륨 이온 (I) | Tl+ | +1 |
| 탈륨 이온 (III) | Tl3+ | +3 |
| 주석 이온 (II) | Sn2+ | +2 |
| 주석 이온 (IV) | Sn4+ | +4 |
| 아연 이온 | Zn2+ | +2 |
| 분자 양이온 | ||
| 암모늄 이온 | NH4+ | +1 |
| 하이드로늄 이온 | H3O+ | +1 |
| 니트로일 이온 | NO2+ | +1 |
| 우라닐 이온 | UO22+ | +2 |
| 바나딜 이온 | VO2+ | +2 |
| 수은 이온(I) | Hg22+ | +2 |
| 표준 이름 | 이온식 | 산화수 |
|---|---|---|
| 원자 음이온 | ||
| 비소화 이온 | As3− | -3 |
| 브로민화 이온 | Br− | -1 |
| 염화 이온 | Cl− | -1 |
| 플루오린화 이온 | F− | -1 |
| 수화 이온 | H− | -1 |
| 아이오딘화 이온 | I− | -1 |
| 질화 이온(원자) | N3− | -3 |
| 산화 이온 | O2− | -2 |
| 인화 이온 | P3− | -3 |
| 황화 이온 | S2− | -2 |
| 텔루륨 이온 | Te2− | -1 |
| 분자 음이온 | ||
| 비소산 이온 | AsO43− | -3 |
| 아비소산 이온 | AsO33− | -3 |
| 질화 이온(분자) | N3− | -3 |
| 붕산 이온 | BO33− | -3 |
| 과브로민산 이온 | BrO4− | -1 |
| 브로민산 이온 | BrO3− | -1 |
| 아브로민산 이온 | BrO2− | -1 |
| 차아브로민산 이온 | BrO− | -1 |
| 브로민산수소 이온 | BrO− | -1 |
| 탄산 이온 | CO32− | -2 |
| 탄산수소 이온 | HCO3− | -1 |
| 수산화 이온 | OH− | -1 |
| 염소산 이온 | ClO3− | -1 |
| 과염소산 이온 | ClO4− | -1 |
| 아염소산 이온 | ClO2− | -1 |
| 차아염소산 이온 | ClO− | -1 |
| 과산화 이온 | O22− | -2 |
| 크로뮴산 이온 | CrO42− | -2 |
| 다이크로뮴산 이온 | Cr2O72− | -2 |
| 아이오딘산 이온 | IO3− | -1 |
| 질산 이온 | NO3− | -1 |
| 아질산 이온 | NO2− | -1 |
| 인산 이온 | PO43− | -3 |
| 인산수소 이온 | HPO42− | -2 |
| 인산이수소 이온 | H2PO4− | -1 |
| 아인산 이온 | PO33− | -3 |
| 과망가니즈산 이온 | MnO4− | -1 |
| 황산 이온 | SO42− | -2 |
| 황산수소 이온 | HSO4− | -1 |
| 티오황산 이온 | S2O32− | -2 |
| 티오황산수소 이온 | HS2O3− | -1 |
| 아황산 이온 | SO32− | -2 |
| 아황산수소 이온 | HSO3− | -3 |
| 아세트산 이온 | CH3COO− | -1 |
| 옥살산 이온 | C2O42− | -2 |
| 옥살산수소 이온 | HC2O4− | -1 |
| 황화수소 이온 | HS− | -1 |
| 아암모늄 이온 | NH2− | -1 |
| 시안산 이온 | OCN− | -1 |
| 티오시안산 이온 | SCN− | -1 |
| 시안화 이온 | CN− | -1 |
이온의 화학식을 표기할 때는 원자 또는 분자의 화학 구조 뒤에 위첨자로 순수 전하를 쓴다. 순수 전하는 크기를 먼저 쓰고 부호를 뒤에 쓴다. 예를 들어, 2가 양이온은 '+2'가 아닌 '2+'로 쓴다. 그러나 전하가 하나뿐인 경우에는 크기를 생략한다. 예를 들어 나트륨 이온은 Na+로 표기하고, Na1+라고 쓰지 않는다.
다중 전하를 나타내는 또 다른 방법은 부호를 여러 번 쓰는 것이다. 예를 들어 Fe++와 같이 표기할 수 있는데, 이는 전이 금속에서 자주 볼 수 있다. 때로는 부호를 원으로 둘러싸기도 하지만, 이는 장식일 뿐 화학적 의미는 변하지 않는다.
단원자 이온은 분광법에서 로마 숫자로 표기하기도 한다. 예를 들어 Fe2+는 Fe(III) 또는 Fe III로 표기할 수 있다. 여기서 로마 숫자는 원소의 형식적인 산화 상태를 나타내고, 위첨자 아라비아 숫자는 순수 전하를 나타낸다. 단원자 이온의 경우에는 두 표기법을 서로 바꿔 쓸 수 있지만, 다원자 이온에는 로마 숫자를 적용할 수 없다.
5. 1. 일반적인 양이온
Ion영어에서 일반적인 양이온은 다음과 같다.| 일반적인 명칭 | 화학식 | 옛 명칭 | |
|---|---|---|---|
| 단원자 양이온 | |||
| 알루미늄 | |||
| 바륨 | |||
| 베릴륨 | |||
| 칼슘 | |||
| 크롬(III) | |||
| 구리(I) | 아황동(cuprous) | ||
| 구리(II) | 황동(cupric) | ||
| 금(I) | 아금(aurous) | ||
| 금(III) | 금(auric) | ||
| 수소 이온 | |||
| 철(II) | 제일철(ferrous) | ||
| 철(III) | 제이철(ferric) | ||
| 납(II) | 납(plumbous) | ||
| 납(IV) | 납(plumbic) | ||
| 리튬 | |||
| 마그네슘 | |||
| 망간(II) | 망간(manganous) | ||
| 망간(III) | 망간(manganic) | ||
| 망간(IV) | |||
| 수은(II) | 수은(mercuric) | ||
| 칼륨 | 칼륨(kalic) | ||
| 은 | 은(argentous) | ||
| 나트륨 | 나트륨(natric) | ||
| 스트론튬 | |||
| 주석(II) | 주석(stannous) | ||
| 주석(IV) | 주석(stannic) | ||
| 아연 | |||
| 다원자 양이온 | |||
| 암모늄 | |||
| 옥소늄 | |||
| 수은(I) | 아황수은(mercurous) | ||
5. 2. 일반적인 음이온
6. 이온과 관련된 기술
이온은 높은 전압이나 온도를 필요로 하는 다양한 이온원을 사용하여 비화학적으로 생성될 수 있다. 이러한 이온들은 질량 분석기, 방출 분광기, 입자 가속기, 이온 주입기, 이온 엔진과 같은 다양한 장치에 사용된다.[1]
반응성이 있는 대전 입자로서, 이온들은 미생물을 파괴하여 공기 정화에 사용되며, 연기 감지기와 같은 가정용품에도 사용된다.[1]
생물체의 신호 전달 및 신진대사는 세포막을 가로지르는 정확한 이온 구배에 의해 조절되므로, 이 구배의 파괴는 세포 사멸에 기여한다. 이는 그라마이신과 암포테리신(살균제)와 같은 천연 및 인공 생물 살상제가 이용하는 일반적인 메커니즘이다.[1]
7. 이온화 방사선 검출
기체의 이온화 효과는 알파, 베타, 감마 및 X선과 같은 방사선 검출에 광범위하게 사용된다. 이러한 검출기에서 초기 이온화 사건은 방사선이 기체 분자에 충격을 가하여 "이온 쌍" 즉, 양이온과 자유 전자를 형성한다.[5] 이온화 상자는 이러한 검출기 중 가장 간단한 것으로, 전기장을 가하여 기체 내에서 ''직접 이온화''에 의해 생성된 모든 전하를 수집한다.[5]
가이거-뮬러 계수관과 비례 계수관은 모두 자유 전자가 전기장에 의해 충분한 에너지를 얻어 이온 충격에 의해 추가적인 전자를 방출하는 캐스케이드 효과를 통해 초기 이온화 사건의 효과를 증폭하는 타운젠드 애벌런치라고 알려진 현상을 사용한다.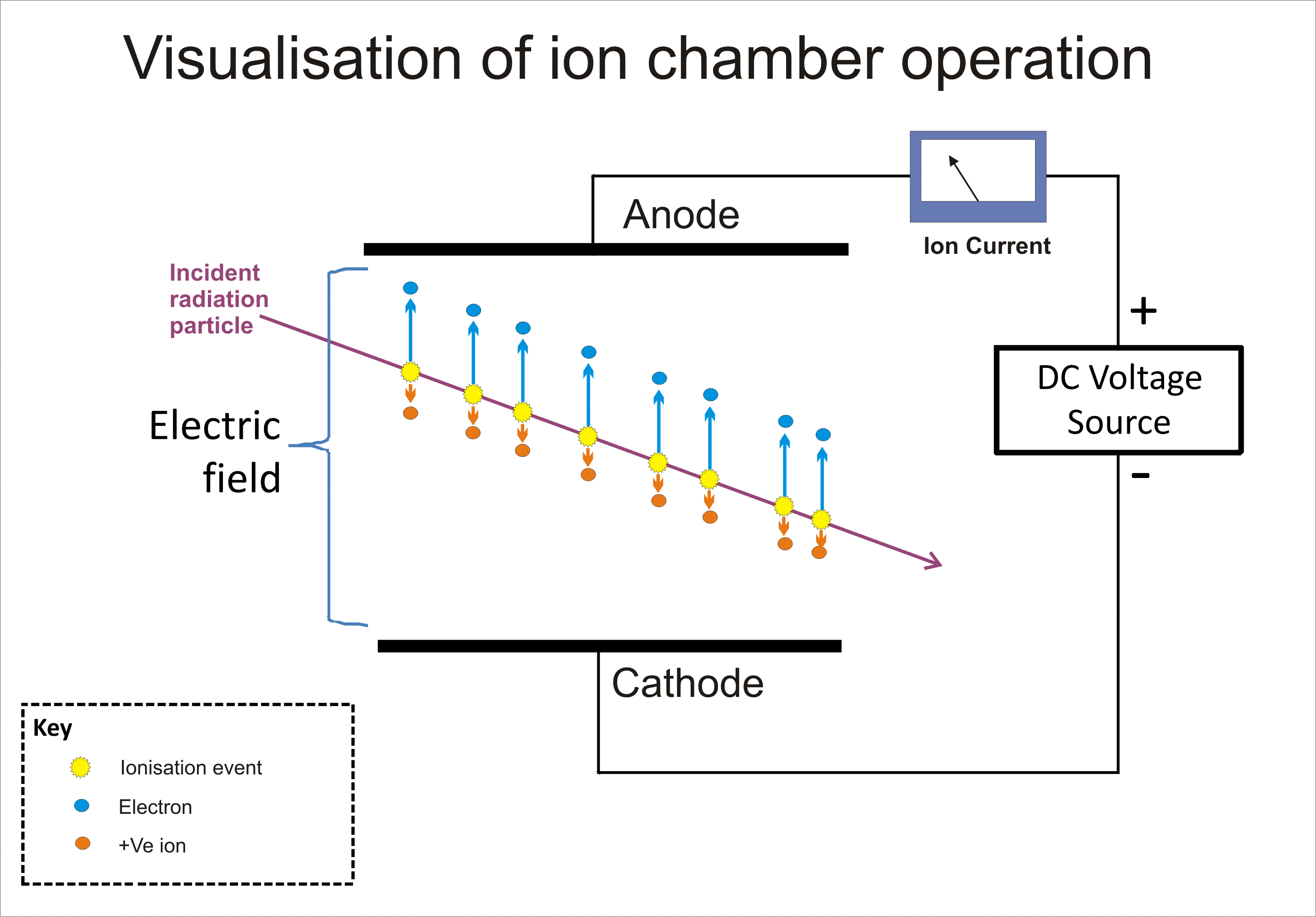

8. 이온 결합
이온 결합은 서로 다른 전하를 띤 이온이 서로 끌어당겨 발생하는 화학 결합이다. 같은 전하를 띤 이온은 서로 밀어내고, 반대 전하를 띤 이온은 서로 끌어당긴다. 따라서 이온은 일반적으로 தனியாக 존재하지 않고, 반대 전하를 띤 이온과 결합하여 결정 격자를 형성한다. 이온 결합으로 생성된 화합물을 이온 화합물이라고 하며, 이온 화합물에서는 이웃 이온 사이에 특징적인 거리가 나타나는데, 이로부터 개별 이온의 이온 반지름을 알 수 있다.
이온 결합은 주로 금속과 비금속 화합물에서 볼 수 있다. (단, 비활성 기체는 화학 결합을 거의 형성하지 않으므로 제외) 금속은 안정적인 전자 배열보다 전자가 적어, 이 전자를 잃고 전기 양성을 띠는 경향이 있다. 반면 비금속은 안정적인 전자 배열보다 전자가 부족하여, 전자를 얻고 전기 음성을 띠는 경향이 있다. 전기 양성이 매우 높은 금속과 전기 음성이 매우 높은 비금속이 결합하면, 금속 원자의 전자가 비금속 원자로 이동한다. 이 반응으로 금속 양이온과 비금속 음이온이 생성되고, 이들은 서로 끌어당겨 염을 형성한다.
예를 들어, 나트륨 원자(Na)는 가장 바깥 껍질에 전자 1개가 있다. 안쪽 껍질에는 10개의 전자가 채워져 있는데, 이는 매우 안정적인 전자 구성이다. 따라서 나트륨은 바깥쪽 전자 1개를 잃고 양이온이 되려는 경향이 있다.
:Na → Na+ + e−
반면, 염소 원자(Cl)는 가장 바깥 껍질에 7개의 전자가 있다. 이 껍질이 8개의 전자로 채워지면 안정한 상태가 되므로, 염소는 전자 1개를 얻고 음이온이 되려는 경향이 있다.
:Cl + e− → Cl−
나트륨과 염소는 이러한 경향으로 인해 화학 반응을 일으킨다. 나트륨에서 염소로 전자 1개가 이동하여 나트륨 양이온과 염소 음이온이 형성되고, 이들은 이온 결합을 통해 염화나트륨(NaCl, 소금)을 형성한다.
:Na+ + Cl− → NaCl
9. 이온과 관련된 기타 용어
- 아이온 (라틴어로 영원을 의미)
- 이온 (원자나 분자가 전자를 주고받아 전하를 띤 것)
- 아이언 (Ion) - 영국의 테크노 뮤지션
- 이온 프로덕션스 (Eon Productions) - 영국의 영화 제작사
- 현대 이온 (Hyundai i10) - A세그먼트 크기의 경차
- 이온(아이언) (Eon) - 마블 코믹스의 캐릭터
9. 1. AEON, ÆON
라틴어로 영원을 의미하는 단어이다. (아이온 참조)9. 2. Ion (일반 명사)
이온은 원자나 분자가 전자를 주고받아 전하를 띤 것을 말한다.9. 3. Eon
- 아이언 (Ion) - 영국의 테크노 뮤지션이다.
- 이온 프로덕션스 (Eon Productions) - 영국의 영화 제작사이다.
- 현대 이온 (Hyundai i10) - A세그먼트 크기의 경차이다.
- 이온(아이언) (Eon) - 마블 코믹스가 출판하는 코믹스 작품에 등장하는 캐릭터이다.
9. 4. 기타
원자 또는 분자가 전자를 주고받음으로써 전하를 띤 것을 이온이라 한다.참조
[1]
웹사이트
Collins English Dictionary | Always Free Online
http://www.collinsdi[...]
2013-12-21
[2]
웹사이트
Definition of CATION
https://www.merriam-[...]
2021-10-06
[3]
웹사이트
Definition of ANION
https://www.merriam-[...]
2021-10-06
[4]
웹사이트
What Is an Ion? Definition and Examples
https://www.thoughtc[...]
2024-08-26
[5]
서적
Radiation Detection and Measurement
Wiley
1999
[6]
서적
The Correspondence of Michael Faraday, Vol. 2: 1832–1840
https://books.google[...]
2020-10-16
[7]
웹사이트
Michael Faraday (1791–1867)
https://www.bbc.co.u[...]
BBC
2019-12-21
[8]
웹사이트
Online etymology dictionary
http://www.etymonlin[...]
2011-01-07
[9]
웹사이트
The Nobel Prize in Chemistry 1903
https://www.nobelpri[...]
2017-06-13
[10]
서적
The New Columbia Encyclopedia
https://archive.org/[...]
Columbia University
1976
[11]
서적
The New Encyclopædia Britannica
Encyclopædia Britannica, Inc.
1992
[12]
서적
Dictionary of Scientific Biography
Charles Scribner's Sons
1970
[13]
웹사이트
Oxford Reference: OVERVIEW anion
http://oxfordindex.o[...]
oxfordreference.com
2017-01-15
[14]
웹사이트
Atoms and Elements, Isotopes and Ions
http://ruby.colorado[...]
colorado.edu
2013-11-22
[15]
웹사이트
Oxford Reference: OVERVIEW cation
http://oxfordindex.o[...]
oxfordreference.com
2017-01-15
[16]
웹사이트
Elemental Chemistry
http://www.usouthal.[...]
usouthal.edu
2013-11-22
[17]
웹사이트
Amino Acids
http://chemed.chem.p[...]
purdue.edu
2013-11-22
[18]
서적
Earth
W. H. Freeman and Company
[19]
웹사이트
Chemical elements listed by ionization energy
http://www.lenntech.[...]
[20]
웹사이트
Common Ions and Their Charges
http://www.sciencege[...]
2018-05-11
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com