입방정계
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
- 1. 개요
- 2. 브라베 격자
- 3. 결정 분류
- 3.1. 주요 결정 구조
- 3.1.1. 염화세슘 구조 (CsCl Structure)
- 3.1.2. 암염 구조 (Rock-Salt Structure, NaCl Structure)
- 3.1.3. 섬아연석 구조 (Zincblende Structure, ZnS Structure)
- 3.1.4. 다이아몬드 구조
- 3.1.5. 형석 구조 (Fluorite structure)
- 3.1.6. 페로브스카이트 구조
- 3.1.7. 하이슬러 구조 (Heusler Structure)
- 3.1.8. 철 단일규화물 구조 (Iron Monosilicide Structure)
- 3.1.9. 웨어-필란 구조 (Weaire–Phelan structure)
- 3.1. 주요 결정 구조
- 4. 한국의 입방정계 연구 및 활용
- 참조
1. 개요
입방정계는 세 가지 브라베 격자, 즉 단순 입방, 체심 입방, 면심 입방 격자를 갖는 결정계이다. 각 격자는 피어슨 기호, 단위 세포 구조, 그리고 격자점 개수에서 차이를 보인다. 입방정계는 쇤플리스, 국제, 오비폴드, 콕서터 표기법으로 점군과 공간군을 표현하며, 염화세슘, 암염, 섬아연석, 다이아몬드, 형석, 페로브스카이트, 하이슬러, 철 단일규화물, 웨어-필란 구조 등 다양한 결정 구조를 포함한다. 이러한 구조들은 다양한 화합물과 재료에서 발견되며, 물질의 특성을 결정하는 중요한 요소로 작용한다.
더 읽어볼만한 페이지
- 입방정계 - 면심 입방 격자
면심 입방 격자는 단위 세포의 모서리와 면 중심에 원자가 위치하며 12개의 가장 가까운 원자와 접촉하고 단위 세포 내 4개의 원자가 존재하며, 알루미늄, 구리, 금, 은 등의 금속에서 나타나 전연성이 풍부하고 가공이 용이하며 용융점이 낮은 특징을 보이는 74%의 충진율을 가진 최밀 충전 구조이다. - 입방정계 - 체심 입방 격자
체심 입방 격자는 결정 구조의 한 형태로 단위 격자의 꼭짓점과 중심에 원자가 위치하며, 알칼리 금속에서 흔히 관찰되고, 강도가 크고 용융점이 높지만 전성과 연성이 낮은 특징을 가지며, 충전율은 68%, 단위 격자당 2개의 원자가 존재한다. - 결정계 - 삼사정계
삼사정계는 결정학에서 7가지 결정계 중 하나로, 두 개의 점군과 두 개의 공간군으로 분류되며 사장석, 알바이트, 휘석 등을 포함한다. - 결정계 - 사방정계
사방정계는 세 결정축이 직교하나 길이가 다른 결정계로, 직육면체 단위격자를 가지며, 감람석, 아라고나이트, 황철석 등의 광물을 포함하고 다양한 분야에 활용된다. - 정육면체 - 카바
카바는 사우디아라비아 메카에 있는 이슬람교의 가장 신성한 장소로, 이슬람 이전부터 아랍인들의 성역이었으며 무함마드에 의해 이슬람의 중심 성지가 되었고, 아브라함과 이스마엘이 건설했다는 기록이 있는 '검은 돌'을 포함한 여러 유물이 있는 곳이며, 하즈와 움라 순례의 중심지이다. - 정육면체 - 입체주의
입체주의는 20세기 초에 등장하여 대상을 여러 각도에서 분석하고 재구성하여 표현하는 미술 사조이며, 파블로 피카소와 조르주 브라크가 주도하여 회화, 조각 등 다양한 분야에 영향을 미쳤다.
| 입방정계 | |
|---|---|
| 결정 구조 | |
| 결정계 | 입방정계 |
| 격자 상수 | a₁ = a₂ = a₃ = a |
| 격자각 | α = β = γ = 90° |
| 브라베 격자 | |
| 종류 | 단순 입방 면심 입방 체심 입방 |
| 대칭 | |
| 점군 | m3m (Oₘ) 432 (O) 43m (Tᵈ) 23 (T) m3 (Tₕ) |
| 공간군 | 194개 (입방정계 격자 포함) |
2. 브라베 격자
입방정계에는 단순 입방(sc), 체심 입방(bcc), 면심 입방(fcc)의 세 가지 브라베 격자가 존재한다.
'''단순 입방'''(sc)은 정육면체의 각 꼭짓점에 격자점이 위치한다. 근처 8개의 단위 세포가 각 꼭짓점의 격자점을 서로 공유하고 있어서 단위 세포 내 격자점은 1개(8 × 1/8)가 된다.[1]
'''체심 입방'''(bcc)은 8개의 꼭짓점 외에 단위 세포의 정중앙에 또 하나의 격자점이 위치한다. 단위 세포 내 격자점은 2개(8 × 1/8 + 1)이다.[1]
'''면심 입방'''(fcc)은 8개의 꼭짓점에 더해서 정육면체의 각 6개 면의 두 대각선 교점인 면의 정중앙에 격자점이 위치한다. 면의 정중앙에 있는 격자점은 두 단위세포가 공유하므로 단위 세포 내 격자점은 4개(8 × 1/8 + 2 × 6/2)이다.[1] 배위수는 12이다.[1] 면심 입방은 조밀 육방과 격자점 배치가 같다고 볼 수 있다. 즉 면심 입방의 [111] 면은 육방 정계의 격자이다.
2. 1. 단순 입방 격자 (Simple Cubic, sc)
단순 입방(sc)은 정육면체의 각 꼭짓점에 격자점이 위치하는 구조이다.[1] 근처 8개의 단위 세포가 각 꼭짓점의 격자점을 서로 공유하고 있어서 단위 세포 내 격자점은 1개(8 × 1/8)가 된다.[1] 원자 충진율(APF)은 약 0.524이다.단순 입방 구조는 원자 충진율이 낮아 자연계에서 희귀하며, 폴로늄에서 발견된다.[4][5]
2. 2. 체심 입방 격자 (Body-Centered Cubic, bcc)
체심 입방 격자(cI)는 정육면체의 각 꼭짓점과 중심에 격자점이 위치한다.[1] 단위 세포당 격자점은 2개( × 8 + 1)이다.[1] 체심 입방 격자 구조를 가지는 대표적인 예로는 철, 크롬, 텅스텐, 니오븀 등이 있다. 체심입방격자의 배위수는 8이고, 원자 충진율은 약 0.680이다.2. 3. 면심 입방 격자 (Face-Centered Cubic, fcc)
면심 입방 격자(fcc)는 정육면체의 각 꼭짓점과 각 면의 중심에 격자점이 위치한다. 면의 정중앙에 있는 격자점은 두 단위세포가 공유하므로 단위 세포 내 격자점은 4개( × 8 + × 6)이다.[1] 배위수는 12이다.[1]면심 입방 격자는 조밀 육방(hcp) 구조와 밀접한 관련이 있으며, 두 구조는 육방층의 상대적 배열만 다르다. 면심 입방 격자의 [111] 면은 육방격자이다.
원자 충진율(APF)은 원자가 차지하는 부피의 비율이며, 면심 입방 격자는 약 0.740이다. 자연계에서 흔하게 발견되는 구조로, 알루미늄, 구리, 금, 은 등이 면심 입방 격자 구조를 갖는다.[4][5]
3. 결정 분류
쇤플리스, 국제, 오비폴드, 콕서터 표기법을 사용하여 입방정계에 속하는 점군과 공간군을 설명하며, 대표적인 예시는 다음과 같다.
| # | 점군 | 유형 | 예 | 공간군 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 이름[57] | 쇤플리스 | 국제 | 오비폴드 | 콕서터 | 단순 입방정계 | 면심 입방정계 | 체심 입방정계 | |||
| 195–197 | Tetartoidal | T | 23 | 332 | [3,3]+ | 좌우상 (enantiomorphic) | 울만나이트, 염소산 나트륨 | P23 | F23 | I23 |
| 198–199 | P213 | I213 | ||||||||
| 200–205 | Diploidal | Th | 2/m (m) | 3*2 | [3+,4] | 중앙 대칭 (centrosymmetric) | 황철석 | Pm, Pn | Fm, Fd | I |
| 205–206 | Pa | |||||||||
| 207–211 | Gyroidal | O | 432 | 432 | [3,4]+ | 좌우상 (enantiomorphic) | 펫자이트 | P432, P4232 | F432, F4132 | I432 |
| 212–214 | P4332, P4132 | I4132 | ||||||||
| 215–217 | Hextetrahedral | Td | 3m | *332 | [3,3] | rowspan=2| | 섬아연석 | P3m | F3m | I3m |
| 218–220 | P3n | F3c | I3d | |||||||
| 221–230 | Hexoctahedral | Oh | 4/m2/m (mm) | *432 | [3,4] | 중앙 대칭 (centrosymmetric) | 방연석 | Pmm, Pnn, Pmn, Pnm | Fmm, Fmc, Fdm, Fdc | Imm, Iad |
3. 1. 주요 결정 구조

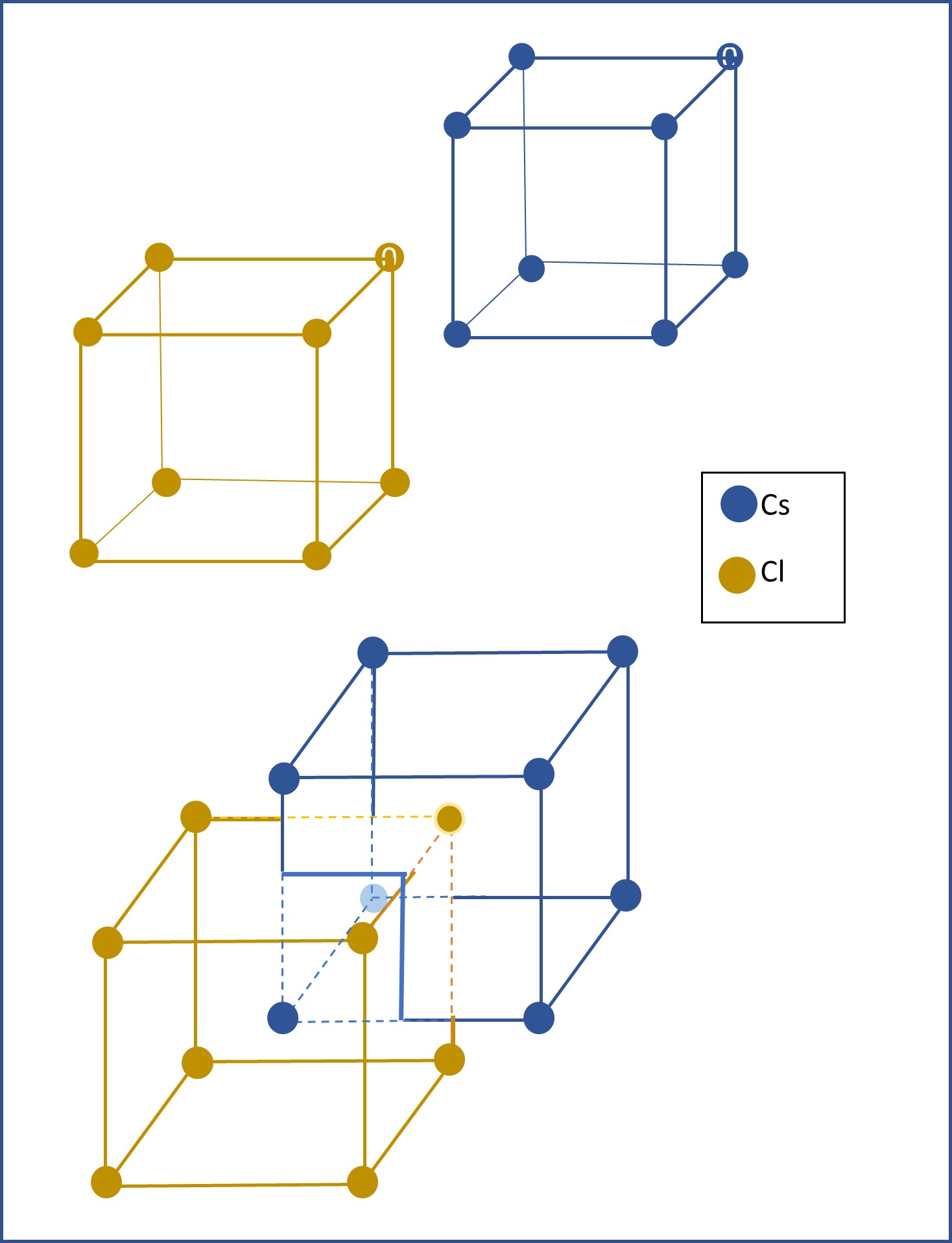
염화세슘(CsCl) 구조는 "상호 침투 단순 입방" 구조라고도 불리며, 원자 배열은 체심입방구조와 유사하지만, 두 종류의 다른 원자로 구성되어 체심입방구조와는 다르다.[6] 염화세슘 구조에서 [111] 방향으로 병진하면 원자 종류가 바뀐다. 이 구조는 각각의 원자 종류 하나씩을 가진 두 개의 별개의 단순 입방 구조가 서로 겹쳐져 있는 것으로, 염화물 큐브의 모서리는 세슘 큐브의 중심이고, 그 반대의 경우도 마찬가지이다.[6]
CsCl의 단위세포에서 각 이온은 반대 종류의 이온 큐브 중앙에 위치하므로 배위수는 8이다. 중앙 양이온은 큐브 모서리에 있는 8개의 음이온에 배위되며, 중앙 음이온은 큐브 모서리에 있는 8개의 양이온에 배위된다. 또는 이 격자를 입방형 빈 공간에 보조 원자가 있는 단순 입방 구조로 볼 수도 있다.
염화세슘 자체 외에도, 저온 또는 고압에서 제조될 때 특정 다른 알칼리 할로겐화물에도 이 구조가 나타난다.[7] 이 구조는 이온 크기가 거의 같은 두 원소로 형성될 가능성이 더 높다.(예: Cs+의 이온 반지름 = 167 pm, Cl− = 181 pm)[7]
공간군 염화세슘(CsCl) 구조는 Pmm (헤르만-모건 표기법) 또는 "221"(국제 결정학 표)이라고 하며, 슈트룩투어베리히트 지정은 "B2"이다.[8]
CsCl 구조로 결정화되는 거의 100개에 가까운 희토류 금속간 화합물이 있으며, 여기에는 희토류와 마그네슘[9], 그리고 11족, 12족[10][11], 13족 원소를 포함하는 많은 이성분 화합물이 포함된다. 염화세슘과 같은 구조를 보이는 다른 화합물로는 CsBr, CsI, 고온 RbCl, AlCo, AgZn, BeCu, MgCe, RuAl 및 SrTl이 있다.
3. 1. 1. 염화세슘 구조 (CsCl Structure)
염화세슘(CsCl) 구조는 "상호 침투 단순 입방" 구조라고도 불리며, 원자 배열은 체심입방구조와 유사하지만, 두 종류의 다른 원자로 구성되어 체심입방구조와는 다르다.[6] 염화세슘 구조에서 [111] 방향으로 병진하면 원자 종류가 바뀐다. 이 구조는 각각의 원자 종류 하나씩을 가진 두 개의 별개의 단순 입방 구조가 서로 겹쳐져 있는 것으로, 염화물 큐브의 모서리는 세슘 큐브의 중심이고, 그 반대의 경우도 마찬가지이다.[6]
CsCl의 단위세포에서 각 이온은 반대 종류의 이온 큐브 중앙에 위치하므로 배위수는 8이다. 중앙 양이온은 큐브 모서리에 있는 8개의 음이온에 배위되며, 중앙 음이온은 큐브 모서리에 있는 8개의 양이온에 배위된다. 또는 이 격자를 입방형 빈 공간에 보조 원자가 있는 단순 입방 구조로 볼 수도 있다.
염화세슘 자체 외에도, 저온 또는 고압에서 제조될 때 특정 다른 알칼리 할로겐화물에도 이 구조가 나타난다.[7] 이 구조는 이온 크기가 거의 같은 두 원소로 형성될 가능성이 더 높다.(예: Cs+의 이온 반지름 = 167 pm, Cl− = 181 pm)[7]
공간군 염화세슘(CsCl) 구조는 Pmm (헤르만-모건 표기법) 또는 "221"(국제 결정학 표)이라고 하며, 슈트룩투어베리히트 지정은 "B2"이다.[8]
CsCl 구조로 결정화되는 거의 100개에 가까운 희토류 금속간 화합물이 있으며, 여기에는 희토류와 마그네슘[9], 그리고 11족, 12족[10][11], 13족 원소를 포함하는 많은 이성분 화합물이 포함된다. 염화세슘과 같은 구조를 보이는 다른 화합물로는 CsBr, CsI, 고온 RbCl, AlCo, AgZn, BeCu, MgCe, RuAl 및 SrTl이 있다.
3. 1. 2. 암염 구조 (Rock-Salt Structure, NaCl Structure)
하늘색 = Na+ (나트륨 이온), 녹색 = Cl− (염소 이온)]]
암염 구조는 염화나트륨에서 염소 이온이 입방 밀집 구조를 이루고, 염소 이온보다 작은 나트륨 이온이 그 사이 틈을 채우는 형태이다. 각 이온은 6개의 다른 종류 이온과 이웃한다. 헤르만-모건 표기법에서 Fmm, 국제 결정학 표에서 "225"로 표시되는 공간군을 갖는다.[12] 슈트룩투어베리히트 지정은 "B1"이다.
암염 구조에서 두 종류 원자는 각각 별도의 면심 입방 격자를 형성하고, 두 격자가 서로 침투하여 3차원 체커보드 패턴을 이룬다. 각 원자는 팔면체 배위를 가지며, 최근접 이웃은 6개의 반대 종류 원자로 구성되어 정팔면체의 6개 꼭짓점처럼 배열된다. 염화나트륨에서 나트륨과 염소 원자의 비율은 1:1이다. 나트륨의 면심입방 격자와 각 팔면체 공극을 차지하는 염소로 설명할 수도 있고, 그 반대도 가능하다.[6]
이 구조를 갖는 화합물로는 염화나트륨 외에 거의 모든 알칼리 할라이드, 그리고 "많은 2가 금속 산화물, 황화물, 셀렌화물 및 텔루르화물"이 있다.[7] 반지름 비율 규칙에 따르면, 양이온이 음이온보다 다소 작을 때(양이온/음이온 반지름 비율 0.414~0.732) 이 구조가 형성될 가능성이 크다.
일부 암염 구조 결정의 원자간 거리(양이온과 음이온 사이의 거리 또는 단위 셀 길이 ''a''의 절반)는 불화나트륨(NaF)의 경우 2.3 Å(2.3 × 10−10 m),[13] 염화나트륨(NaCl)의 경우 2.8 Å,[14] 텔루르화주석(SnTe)의 경우 3.2 Å이다.[15]
| 화합물 종류 | 예시 |
|---|---|
| 알칼리 금속 수소화물 및 할라이드 | 수소화리튬, 불화리튬, 염화리튬, 브롬화리튬, 요오드화리튬, 수소화나트륨, 불화나트륨, 염화나트륨, 브롬화나트륨, 요오드화나트륨, 수소화칼륨, 불화칼륨, 염화칼륨, 브롬화칼륨, 요오드화칼륨, 수소화루비듐, 불화루비듐, 염화루비듐, 브롬화루비듐, 요오드화루비듐, 수소화세슘, 불화세슘 |
| 알칼리 토금속 칼코겐화물 | 산화마그네슘, 황화마그네슘, 셀렌화마그네슘, 텔루르화마그네슘, 산화칼슘, 황화칼슘, 셀렌화칼슘, 텔루르화칼슘, 폴로늄화칼슘, 산화스트론튬, 황화스트론튬, 셀렌화스트론튬, 텔루르화스트론튬, 폴로늄화스트론튬, 산화바륨, 황화바륨, 셀렌화바륨, 텔루르화바륨, 폴로늄화바륨 |
| 희토류 및 악티늄족 프니크티드 | 질화스칸듐, 인화스칸듐, 비소화스칸듐, 안티몬화스칸듐, 비스무트화스칸듐, 질화이트륨, 인화이트륨, 비소화이트륨, 안티몬화이트륨, 비스무트화이트륨, 질화란타넘, 인화란타넘, 비소화란타넘, 안티몬화란타넘, 비스무트화란타넘, 질화세륨, 인화세륨, 비소화세륨, 안티몬화세륨, 비스무트화세륨, 질화프라세오디뮴, 인화프라세오디뮴, 비소화프라세오디뮴, 안티몬화프라세오디뮴, 비스무트화프라세오디뮴, 질화네오디뮴, 인화네오디뮴, 비소화네오디뮴, 안티몬화네오디뮴, 비스무트화네오디뮴, 질화사마륨, 인화사마륨, 비소화사마륨, 안티몬화사마륨, 비스무트화사마륨, 질화유로피움, 인화유로피움, 질화가돌리늄, 인화가돌리늄, 비소화가돌리늄, 안티몬화가돌리늄, 비스무트화가돌리늄, 질화터븀, 인화터븀, 비소화터븀, 안티몬화터븀, 비스무트화터븀, 질화디스프로슘, 인화디스프로슘, 비소화디스프로슘, 안티몬화디스프로슘, 비스무트화디스프로슘, 질화홀뮴, 인화홀뮴, 비소화홀뮴, 안티몬화홀뮴, 비스무트화홀뮴, 질화어븀, 인화어븀, 비소화어븀, 안티몬화어븀, 비스무트화어븀, 질화툴륨, 인화툴륨, 비소화툴륨, 안티몬화툴륨, 비스무트화툴륨, 질화이터븀, 인화이터븀, 비소화이터븀, 안티몬화이터븀, 질화루테튬, 인화루테튬, 비소화루테튬, 안티몬화루테튬, 비스무트화루테튬, 질화토륨, 인화토륨, 비소화토륨, 안티몬화토륨, 질화우라늄, 일인화우라늄, 비소화우라늄, 안티몬화우라늄, 비스무트화우라늄, 질화넵투늄, 인화넵투늄, 비소화넵투늄, 안티몬화넵투늄, 비스무트화넵투늄, 질화플루토늄, 인화플루토늄, 비소화플루토늄, 안티몬화플루토늄, 비스무트화플루토늄, 질화아메리슘, 인화아메리슘, 비소화아메리슘, 안티몬화아메리슘, 비스무트화아메리슘, 질화퀴륨, 인화퀴륨, 비소화퀴륨, 안티몬화퀴륨, 비스무트화퀴륨, 질화버클륨, 인화버클륨, 비소화버클륨, 비스무트화버클륨, 비소화캘리포늄, 비스무트화캘리포늄 |
| 희토류 및 악티늄족 칼코겐화물 | 일황화스칸듐, 일황화이트륨, 일황화란타넘, 일황화세륨, 일셀렌화세륨, 일텔루르화세륨, 일황화프라세오디뮴, 일셀렌화프라세오디뮴, 일텔루르화프라세오디뮴, 일황화네오디뮴, 일셀렌화네오디뮴, 일텔루르화네오디뮴, 일황화사마륨, 일셀렌화사마륨, 일텔루르화사마륨, 일폴로늄화사마륨, 일산화유로피움, 일황화유로피움, 일셀렌화유로피움, 일텔루르화유로피움, 일폴로늄화유로피움, 일황화가돌리늄, 일황화터븀, 일폴로늄화터븀, 일황화디스프로슘, 일폴로늄화디스프로슘, 일황화홀뮴, 일폴로늄화홀뮴, 일황화어븀, 일황화툴륨, 일폴로늄화툴륨, 일산화이터븀, 일황화이터븀, 일폴로늄화이터븀, 일황화루테튬, 일폴로늄화루테튬, 일황화토륨, 일셀렌화토륨, 일황화우라늄, 일셀렌화우라늄, 일텔루르화우라늄, 일황화넵투늄, 일셀렌화넵투늄, 일텔루르화넵투늄, 일황화플루토늄, 일셀렌화플루토늄, 일텔루르화플루토늄, 일황화아메리슘, 일셀렌화아메리슘, 일텔루르화아메리슘, 일황화퀴륨, 일셀렌화퀴륨, 일텔루르화퀴륨 |
| 전이 금속 탄화물 및 질화물 | 탄화티타늄, 질화티타늄, 탄화지르코늄, 질화지르코늄, 탄화하프늄, 질화하프늄, 탄화바나듐, 질화바나듐, 탄화니오븀, 질화니오븀, 탄화탄탈럼, 질화크로뮴 |
대부분의 알칼리 금속 수소화물과 할라이드는 암염 구조를 갖지만, 일부는 염화세슘 구조를 갖는다. 많은 전이 금속 일산화물(TiO, VO, CrO, MnO, FeO, CoO, NiO, CdO)과 초기 악티늄족 일탄화물(ThC, PaC, UC, NpC, PuC)도 암염 구조를 갖는다.[36]
3. 1. 3. 섬아연석 구조 (Zincblende Structure, ZnS Structure)
섬아연석 구조(zinc blende라고도 함)는 광물 섬아연석(황화아연의 한 형태인 β-ZnS)의 이름을 따서 명명되었다. 암염 구조와 마찬가지로 두 원자 종류는 두 개의 상호 침투하는 면심입방격자를 형성한다. 그러나 두 격자의 상대적인 위치에 따라 암염 구조와 다릅니다. 섬아연석 구조는 사면체 배위수를 갖는다. 각 원자의 가장 가까운 이웃은 정사면체의 네 꼭짓점처럼 배열된 반대 유형의 네 원자로 구성된다. 황화아연에서 아연과 황의 비율은 1:1이다.[6] 전반적으로, 섬아연석 구조에서 원자의 배열은 다이아몬드 구조와 동일하지만 서로 다른 격자점에 번갈아 가며 원자 종류가 있다. 이 구조는 또한 황 원자가 사면체 간극의 절반을 차지하거나 그 반대로 아연의 FCC 격자로 설명할 수도 있다.[6]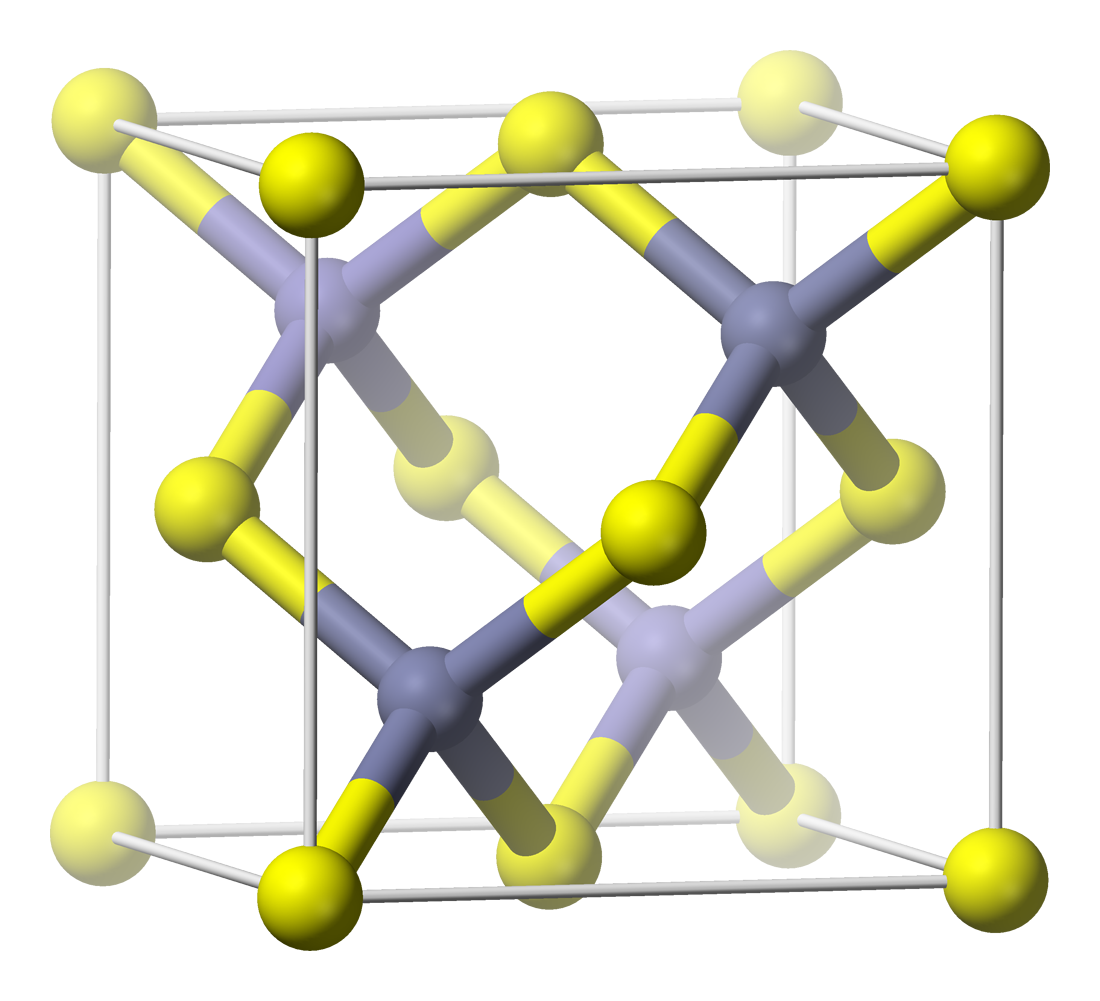
이 구조를 가진 화합물의 예로는 섬아연석 자체, 질산납(II), 많은 복합 반도체(예: 비화갈륨 및 텔루르화카드뮴) 및 다양한 이원 화합물이 있다. 붕소족 수소화물은 일반적으로 섬아연석 구조를 갖지만, 질화물은 섬유상 구조에서 더 일반적이며, 그 섬아연석 형태는 덜 알려진 다형체이다.[53][54]
| scope="col" | | 불화물 | 염화물 | 브롬화물 | 요오드화물 |
|---|---|---|---|---|
| 구리 | 불화구리(I) | 염화구리(I) | 브롬화구리(I) | 요오드화구리(I) |
| scope="col" | | 황화물 | 셀렌화물 | 텔루르화물 | 폴로늄화물 |
|---|---|---|---|---|
| 베릴륨 | 황화베릴륨 | 셀렌화베릴륨 | 텔루르화베릴륨 | 폴로늄화베릴륨[55][56] |
| 아연 | 황화아연 | 셀렌화아연 | 텔루르화아연 | 폴로늄화아연 |
| 카드뮴 | 황화카드뮴 | 셀렌화카드뮴 | 텔루르화카드뮴 | 폴로늄화카드뮴 |
| 수은 | 황화수은 | 셀렌화수은 | 텔루르화수은 | – |
이 그룹은 또한 II-VI 화합물 계열로 알려져 있으며, 대부분 섬아연석(입방) 또는 섬유상(육각형) 형태로 만들 수 있다.
| scope="col" | | 질화물 | 인화물 | 비화물 | 안티몬화물 |
|---|---|---|---|---|
| 붕소 | 질화붕소* | 인화붕소 | 비화붕소 | 안티몬화붕소 |
| 알루미늄 | 질화알루미늄* | 인화알루미늄 | 비화알루미늄 | 안티몬화알루미늄 |
| 갈륨 | 질화갈륨* | 인화갈륨 | 비화갈륨 | 안티몬화갈륨 |
| 인듐 | 질화인듐* | 인화인듐 | 비화인듐 | 안티몬화인듐 |
이 그룹은 또한 '''III-V''' 화합물 계열로 알려져 있다.
3. 1. 4. 다이아몬드 구조

다이아몬드 입방 구조는 탄소, 규소, 게르마늄, 주석에서 나타난다. fcc와 bcc와 달리, 이 구조는 원시 세포에 여러 개의 원자가 포함되어 있기 때문에 격자가 아니다.
3. 1. 5. 형석 구조 (Fluorite structure)
형석 구조 (AB₂ )는 암염 구조와 매우 유사하게, Fm3m 구조이지만 이온의 비율이 1:2이다.[48][49] 역형석 구조는 거의 동일하지만, 구조에서 음이온과 양이온의 위치가 바뀌어 있다. 이들은 Wyckoff 위치 4a와 8c로 지정되는 반면, 암염 구조의 위치는 4a와 4b이다.[48][49]3. 1. 6. 페로브스카이트 구조
페로브스카이트 구조는 ABX₃ 구조를 갖는 광물 및 세라믹 재료를 의미한다. A와 B는 서로 다른 크기의 양이온이고 X는 산소와 같은 음이온이다. 대표적인 페로브스카이트 구조 물질은 타이타늄산 칼슘(CaTiO₃)이다.페로브스카이트 구조는 태양 전지, 연료 전지, 촉매 등 다양한 분야에서 활용된다.
3. 1. 7. 하이슬러 구조 (Heusler Structure)
하이슬러 화합물Cu2MnAl의 구조를 기반으로 하는 하이슬러 구조는 삼원 화합물 중 전이 금속을 포함하는 일반적인 구조이다. 이 구조는 슈트럭투르베리히트 지정은 L21이다. 밀접하게 관련된 반하이슬러 및 역하이슬러 화합물과 함께 수백 가지의 예가 있다.
3. 1. 8. 철 단일규화물 구조 (Iron Monosilicide Structure)
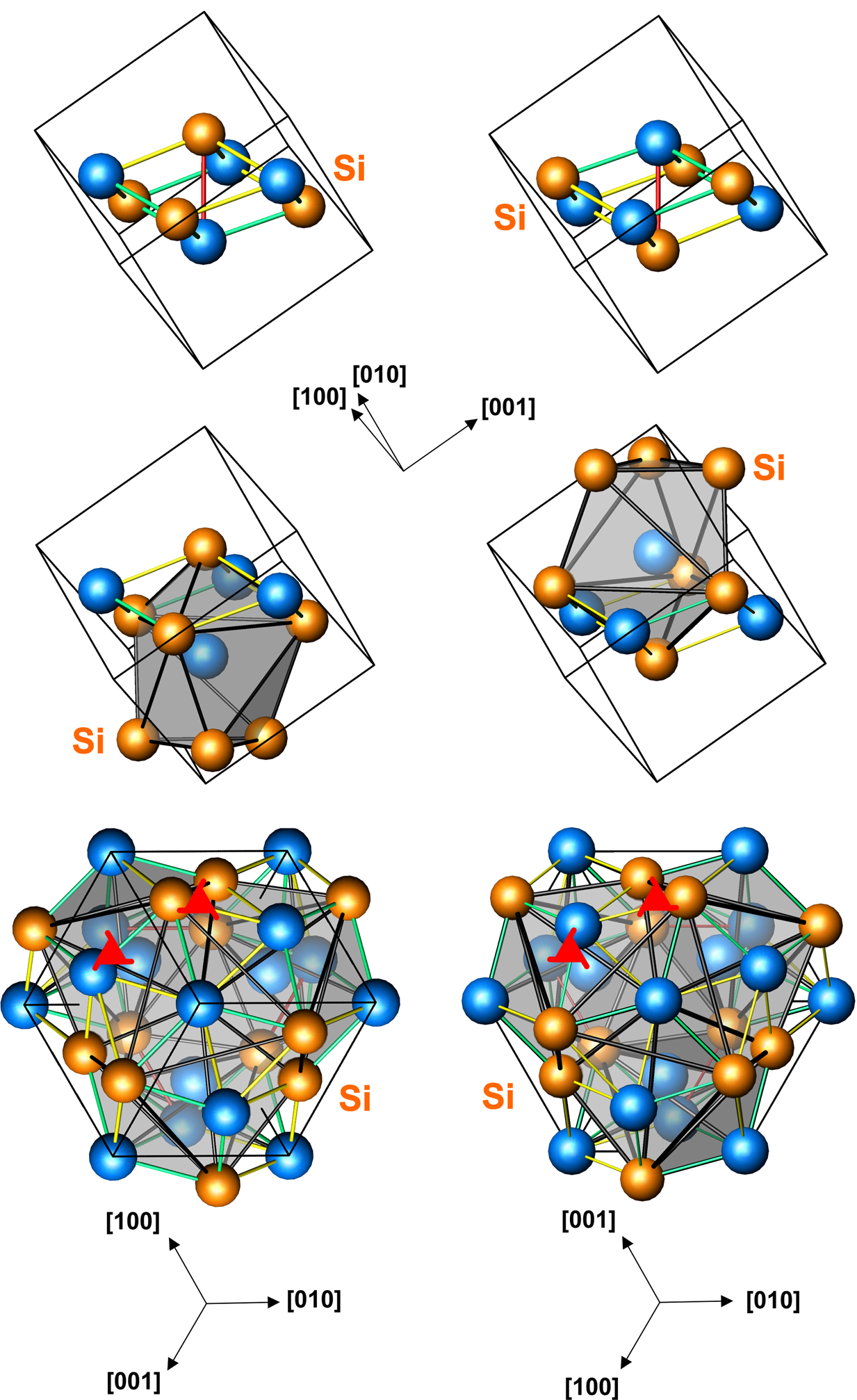
철 단일규화물 구조의 공간군은 P213(No. 198)이고, 슈트르크베리히트 표기법은 B20이다. 이것은 카이랄성 구조이며, 때때로 헬리자성 특성과 관련이 있다. 단위세포에는 각 원소당 4개의 원자가 있어 총 8개의 원자가 있다.
전이 금속 규화물과 저마늄화물뿐만 아니라 팔라듐 갈륨과 같은 다른 몇 가지 화합물에서도 예시를 찾을 수 있다.
| scope="col" | | 규화물 | 저마늄화물 |
|---|---|---|
| 망간 | 망간 단일규화물(Manganese monosilicide) | 망간 저마늄화물(Manganese germanide) |
| 철 | 철 단일규화물(Iron monosilicide) | 철 저마늄화물(Iron germanide) |
| 코발트 | 코발트 단일규화물(Cobalt monosilicide) | 코발트 저마늄화물(Cobalt germanide) |
| 크롬 | 사규화크롬(Chromium(IV) silicide) | 사저마늄화크롬(Chromium(IV) germanide) |
3. 1. 9. 웨어-필란 구조 (Weaire–Phelan structure)
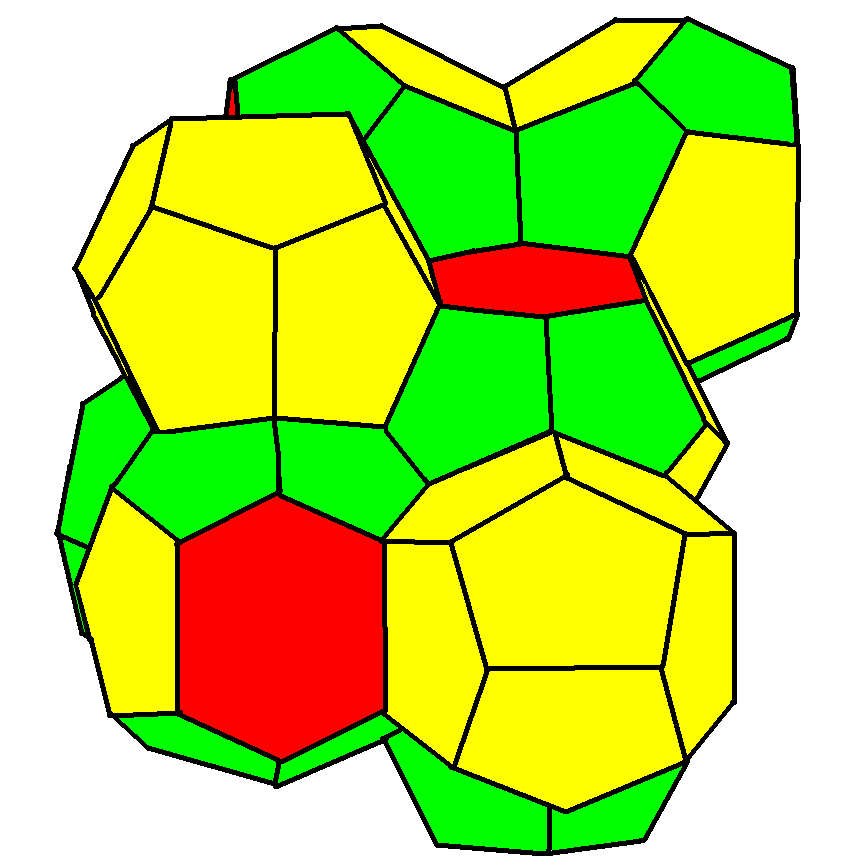
Weaire–Phelan 구조(Weaire–Phelan structure)는 Pm3n (223) 대칭성을 갖는다.
이 구조는 빈 공간에 황철석형 세포가 있는 쌓인 사면체의 세 가지 방향을 갖는다. 이것은 일반적으로 "I형 포접화합물 구조"로 알려진 화학에서 결정 구조로 발견된다. 메탄, 프로판 및 이산화탄소가 저온에서 형성하는 가스 하이드레이트는 물 분자가 Weaire–Phelan 구조의 마디에 위치하고 수소 결합되어 있으며, 더 큰 기체 분자가 다면체 케이지에 갇혀 있는 구조를 갖는다.
4. 한국의 입방정계 연구 및 활용
참조
[1]
논문
Nomenclature for crystal families, Bravais-lattice types and arithmetic classes. Report of the International Union of Crystallography Ad-Hoc Committee on the Nomenclature of Symmetry
[2]
서적
International Tables for Crystallography
[3]
웹사이트
Crystallography and Minerals Arranged by Crystal Form
http://webmineral.co[...]
[4]
리다이렉트
[5]
논문
The original discovery
[6]
웹사이트
Cubic Lattices and Close Packing
https://chem.librete[...]
2013-10-03
[7]
서적
Modern Theory of Solids
[8]
웹사이트
The CsCl (B2) Structure
http://cst-www.nrl.n[...]
[9]
논문
Magnesium-rare earth phase diagrams: Experimental investigation of the Ho-Mg system
[10]
논문
Magnetic Studies of Rare Earth Zinc Compounds with CsCl Structure
[11]
논문
Magnetic properties of CsCl‐type rare‐earth cadmium compounds
[12]
웹사이트
The NaCl (B1) Structure
http://cst-www.nrl.n[...]
[13]
논문
Electronic structure of the F centre in a sodium fluoride crystal
[14]
논문
Accuracy of an automatic diffractometer. Measurement of the sodium chloride structure factors
[15]
논문
The ternary subsystem Sn4As3-SnAs-SnTe
[16]
서적
Fluorine Compounds, Inorganic
Wiley-VCH
[17]
논문
Präzisionsbestimmungen der Gitterkonstanten der Verbindungen MgO, MgS, MgSe, MnO und MnSe
1927-06-01
[18]
논문
''Ab initio'' study of phase stability, lattice dynamics and thermodynamic properties of magnesium chalcogenides
[19]
논문
Electronic band structure of calcium selenide under pressure
[20]
서적
The Aqueous Chemistry of Polonium and the Practical Application of its Thermochemistry
https://books.google[...]
Elsevier Science
[21]
서적
Handbook on the Physics and Chemistry of Rare Earths
Elsevier
[22]
논문
The As−Sc (Arsenic-Scandium) system
[23]
논문
Structural phase transition of ScSb and YSb with a NaCl-type structure at high pressures
[24]
서적
Scandium Its Occurrence, Chemistry Physics, Metallurgy, Biology and Technology
https://books.google[...]
Elsevier Science
[25]
논문
Rare-earth arsenides
[26]
논문
The yttrium-bismuth alloy system
[27]
논문
Rare-earth mononitrides
[28]
논문
Syntheses of new rare-earth phosphides
[29]
논문
Rare-earth bismuthides
[30]
논문
Phase transitions of LnSb (Ln=lanthanide) with NaCl-type structure at high pressures
[31]
논문
The As−Eu (Arsenic-Europium) system
[32]
논문
Powder data for some new europium antimonides and bismuthides
1979
[33]
논문
Bi-Yb (bismuth-ytterbium)
[34]
논문
Tunable electronic structure and topological properties of LnPn (Ln=Ce, Pr, Sm, Gd, Yb; Pn=Sb, Bi)
2018
[35]
논문
The magnetism of localized or nearly localized 4f and 5f shells
[36]
논문
Lanthanides/Actinides: Physics I
Elsevier
[37]
논문
Synthesis of rare earth monoxides
[38]
논문
Soft-Mode Behavior in the Phonon Dispersion of YS
1978
[39]
논문
Some electric and magnetic properties of rare earth monosulfides and nitrides
[40]
논문
Antiferromagnetic Properties of Light Rare Earth Monochalcogenides
[41]
논문
Rare earth polonides
[42]
논문
The optical electrical and magnetic properties of the europium chalcogenides and the rare earth pnictides
[43]
서적
Synthesis of Lanthanide and Actinide Compounds
Springer Netherlands
[44]
논문
Lattice constants and melting points of actinide-group IVA-VIA compounds with NaCl-type structures
[45]
논문
The thorium–tellurium system
[46]
논문
Synthesis of Binary Transition Metal Nitrides, Carbides and Borides from the Elements in the Laser-Heated Diamond Anvil Cell and Their Structure-Property Relations
2011
[47]
논문
The C-Cr (Carbon-Chromium) System
[48]
웹사이트
Fluorite
http://aflow.org/Cry[...]
2020-05-22
[49]
웹사이트
Rock Salt
http://aflow.org/Cry[...]
2020-05-22
[50]
서적
Quantum Theory of the Solid State
https://books.google[...]
Springer
[51]
웹사이트
Birkbeck College, University of London
http://img.chem.ucl.[...]
[52]
웹사이트
The Zincblende (B3) Structure
http://cst-www.nrl.n[...]
[53]
논문
Cubic aluminum nitride and gallium nitride thin films prepared by pulsed laser deposition
[54]
논문
Field-effect transistors based on cubic indium nitride
2014
[55]
서적
Greenwood&Earnshaw1st
[56]
보고서
Polonium
http://www.osti.gov/[...]
United States Atomic Energy Commission
[57]
웹사이트
Crystallography and Minerals Arranged by Crystal Form
http://webmineral.co[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com


