하이드록실아민
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
하이드록실아민은 1865년 빌헬름 클레멘스 로센에 의해 하이드록실암모늄 클로라이드 형태로 처음 합성된 물질이다. 라시히 공정, 일산화질소 수소화, 전기분해적 환원 등 다양한 제조 방법을 통해 얻을 수 있으며, 나일론 6의 전구체인 사이클로헥사논옥심의 합성, 유기 및 무기 반응에서의 환원제, 지방산 산화 방지제 등으로 사용된다. 생물학적 질산화 과정, 펩타이드 절단, 헴 포함 효소 비활성화 등 생화학적 역할도 수행하며, 폭발성, 자극성, 돌연변이 유발 가능성 등의 안전 및 환경 문제와 관련하여 대한민국 소방법 및 독극물, 극물 취급법에 따라 관리된다.
더 읽어볼만한 페이지
- 하이드록실아민 - 페닐하이드록실아민
페닐하이드록실아민은 나이트로벤젠 환원이나 수소화 반응으로 얻을 수 있는 유기 화합물로, 가열 시 불안정하며 강산 조건에서 4-아미노페놀로 재배열되고 쿠페론 생성에 사용된다. - 하이드록실아민 - 몰누피라비르
몰누피라비르는 코로나19 바이러스의 RNA 복제를 억제하는 경구용 항바이러스제로, 바이러스 유전체에 돌연변이를 유발하여 증식을 억제하며, 다양한 변종에 효과를 보여 미국 FDA와 대한민국에서 긴급 사용 승인을 받아 고위험군 환자 치료에 사용된다. - 로켓 연료 - 붕소
붕소는 준금속 원소로 붕사나 붕산염 형태로 존재하며 다이아몬드 다음으로 높은 경도를 지니고, 두 가지 안정 동위원소를 가지며, 높은 중성자 흡수율로 원자력 산업과 암 치료에 사용되고, 다양한 화합물 형태로 여러 산업 분야에서 사용되며, 식물의 필수 영양소이지만 과량 섭취 시 독성을 나타낸다. - 로켓 연료 - 알루미늄
알루미늄은 은백색의 가볍고 가공성이 뛰어난 금속으로, 열 및 전기 전도성이 우수하여 다양한 산업 분야에서 합금 형태로 널리 사용되며, 보크사이트에서 추출되어 재활용 또한 활발히 이루어진다. - 환원제 - 아연
아연은 청회색 금속으로, 적당한 반응성을 지닌 환원제이며, 내식성이 뛰어나 도금에 사용되고, 합금의 주요 성분이며, 인체 필수 미량 원소이지만 과다 섭취 시 독성을 나타낸다. - 환원제 - 칼륨
칼륨은 은백색의 무른 알칼리 금속으로 반응성이 매우 높고 생물학적으로 중요한 전해질이며, 비료 생산을 비롯한 다양한 산업 분야에서 활용되지만 물과의 격렬한 반응 및 폭발성 과산화물 생성 가능성으로 취급 시 주의가 필요하며, 자연계에 세 가지 동위원소로 존재한다.
| 하이드록실아민 - [화학 물질]에 관한 문서 | |
|---|---|
| 일반 정보 | |
 | |
 | |
 | |
| IUPAC 명칭 | 하이드록실아민 |
| 다른 이름 | 아지노산 아미놀 아자놀 하이드록시아민 하이드록시아잔 하이드록실아잔 나이트린산 |
| 분자량 | 33.030 g/mol |
| 외형 | 흰색의 바늘 모양 또는 조각 모양 고체 |
| 밀도 | 1.21 g/cm³ (20 °C) |
| 용해도 | 찬물에 잘 녹음, 뜨거운 물에서는 가수 분해됨 |
| 다른 용매 용해도 | 액체 암모니아, 알코올에 쉽게 녹음 |
| 녹는점 | 33 °C |
| 끓는점 | 58 °C (분해) |
| pKa | 6.03 () |
| pKb | 7.97 |
| 쌍극자 모멘트 | 0.67553 D |
| 표준 생성 엔탈피 | -39.9 kJ/mol |
| 엔트로피 | 236.18 J/(K·mol) |
| 열용량 | 46.47 J/(K·mol) |
| 식별 정보 | |
| CAS 등록번호 | 7803-49-8 |
| PubChem CID | 787 |
| RTECS 번호 | NC2975000 |
| ChemSpider ID | 766 |
| KEGG | C00192 |
| ChEBI | 15429 |
| ChEMBL | 1191361 |
| 3DMet | B01184 |
| UNII | 2FP81O2L9Z |
| 스마일즈 표기법 | NO |
| 표준 InChI | 1S/H3NO/c1-2/h2H,1H2 |
| 표준 InChIKey | AVXURJPOCDRRFD-UHFFFAOYSA-N |
| 위험성 | |
| 외부 MSDS | ICSC 0661 |
| GHS 신호어 | 위험 |
| NFPA 704 | H: 2 F: 1 R: 3 |
| 인화점 | 129 °C |
| 자연 발화점 | 265 °C |
| LD50 | 408 mg/kg (경구, 마우스); 59–70 mg/kg (복강 내 투여, 마우스, 래트); 29 mg/kg (피하 주사, 래트) |
| EU 분류 | Carc. Cat. 3 (발암성) 폭발성 (E) 유독성 (T) 유해 (Xn) 자극성 (Xi) 환경 위험 (N) |
| 관련 화합물 | |
| 하이드록실암모늄 염 | 염화 하이드록실암모늄 질산 하이드록실암모늄 황산 하이드록실암모늄 |
| 기타 화합물 | 암모니아 하이드라진 과산화 수소 N,O-다이메틸하이드록실아민 N,N-다이에틸하이드록실아민 하이드록실아민-O-설폰산 |
| 구조 | |
| 배위 | N에서 삼각, O에서 이중 |
| 분자 모양 | N에서 삼각 피라미드, O에서 굽음 |
2. 역사
하이드록실아민은 1865년 독일 화학자 빌헬름 클레멘스 로센이 하이드록실암모늄 클로라이드 형태로 처음 합성하였다. 그는 에틸 니트레이트 존재 하에 주석과 염산을 반응시켰다.[6] 순수한 형태는 1891년 네덜란드 화학자 코르넬리스 아드리아안 로브리 드 브륀과 프랑스 화학자 레옹 모리스 크리스머에 의해 처음으로 분리되었다.[7][8]
2. 1. 초기 발견
하이드록실아민은 1865년 독일 화학자 빌헬름 클레멘스 로센(Wilhelm Clemens Lossen, 1838~1906)이 하이드록실암모늄 클로라이드 형태로 처음 합성하였다. 그는 에틸 니트레이트 존재 하에 주석과 염산을 반응시켰다.[6] 순수한 형태의 하이드록실아민은 1891년 네덜란드 화학자 코르넬리스 아드리아안 로브리 드 브륀(Cornelis Adriaan Lobry van Troostenburg de Bruyn)과 프랑스 화학자 레옹 모리스 크리스머(Léon Maurice Crismer, 1858~1944)에 의해 처음으로 분리되었다.[7][8]2. 2. 순수 분리
하이드록실아민은 1865년 독일 화학자 빌헬름 클레멘스 로센이 하이드록실암모늄 클로라이드 형태로 처음 합성했다. 그는 에틸 니트레이트가 있는 곳에서 주석과 염산을 반응시켰다.[6] 1891년에는 네덜란드 화학자 코르넬리스 아드리아안 로브리 드 브륀과 프랑스 화학자 레옹 모리스 크리스머가 순수한 형태의 하이드록실아민을 처음으로 합성했다.[7][8] 크리스머 염으로 알려진 배위착물 ZnCl₂(NH₂OH)₂ (염화아연 디(하이드록실아민))는 가열하면 하이드록실아민을 방출한다.[9]3. 제조 방법
하이드록실아민은 다양한 방법으로 생산될 수 있다. 상업적으로는 라시히 공정과 일산화질소의 수소화 반응이 주로 사용된다.[38]
- 라시히 공정: 아질산암모늄을 원료로 사용하여 하이드록실아민을 합성한다. (자세한 내용은 하위 항목 참조)
- 일산화질소 수소화: 황산 존재 하에 백금 촉매를 이용한 일산화질소의 수소화를 통해 하이드록실아민을 생산한다. (자세한 내용은 하위 항목 참조)
이 외에도 아질산 또는 아질산나트륨을 아황산 이온으로 환원시키는 방법이 있다. 생성된 하이드록실아미드-N-설페이트를 가수분해하여 하이드록실암모늄염으로 만든 후, 나트륨 부톡사이드로 중화하여 유리 하이드록실아민을 얻는다.[38]
:
:
:
율리우스 타펠(Julius Tafel)은 염산 또는 황산을 이용한 질산의 전기분해적 환원을 통해 하이드록실아민 염산염 또는 황산염을 생성할 수 있다는 것을 발견했다.[11][12]
3. 1. 라시히 공정 (Raschig process)
아질산암모늄 수용액을 0 ℃에서 중아황산이온(HSO₃⁻)과 이산화황(SO₂)으로 환원시켜 하이드록실아미도-N,N-디설페이트를 만든다. 이것을 가수분해하여 황산염(NH₃OH)₂SO₄을 얻는다.[4]:NH₄⁺NO₂⁻ + 2SO₂ + NH₃ + H₂O → 2NH₄⁺ + N(OH)(SO₃⁻)₂
:N(OH)(SO₃⁻)₂ + H₂O → NH(OH)(SO₃⁻) + HSO₄⁻
:2NH(OH)(SO₃⁻) + 2H₂O → (NH₃OH)₂SO₄ + SO₄²⁻
고체 하이드록실아민(NH₂OH)은 액체 암모니아로 처리하여 얻을 수 있다. 액체 암모니아에 불용성인 부산물인 황산암모늄((NH₄)₂SO₄)은 여과하여 제거하고, 액체 암모니아를 증발시켜 목적 생성물을 얻는다.[4]
총 반응식은 다음과 같다.
:2NO₂⁻ + 4SO₂ + 6H₂O + 6NH₃ → 4SO₄²⁻ + 6NH₄⁺ + 2NH₂OH
3. 2. 일산화질소 수소화
Hydroxylamine영어 또는 그 염(하이드록실암모늄 양이온을 포함하는 염)은 여러 경로를 통해 생산될 수 있지만 상업적으로 실행 가능한 것은 두 가지뿐이다. 하이드록실아민은 주로 황산염인 하이드록실암모늄 황산수소염([NH₃OH]⁺[HSO₄]⁻) 형태로, 황산 존재 하에 백금 촉매를 이용한 일산화질소의 수소화를 통해 생산된다.[10]3. 3. 기타 방법
율리우스 타펠(Julius Tafel)은 염산 또는 황산을 이용한 질산의 전기분해적 환원을 통해 하이드록실아민 염산염 또는 황산염을 생성할 수 있다는 것을 발견했다.[11][12]하이드록실아민은 또한 아질산 또는 아질산칼륨을 중아황산염으로 환원시켜 생성할 수 있다. 이 반응은 100 °C에서 1시간 동안 진행된다.
2024년에는 물 플라스마에서 분자 질소로부터 하이드록실아민을 직접 합성하는 실험실 합성법이 시연되었다.[13]
4. 화학적 성질 및 반응
하이드록실아민은 친전자체와 반응하여 O-알킬화 또는 N-알킬화 생성물을 형성할 수 있다.[14]
:
:
클로로술폰산과 반응하여 히드록실아민-''O''-술폰산을 생성한다. 히드록실아민-O-술폰산은 0 ℃ 이하로 보관해야 하며, 요오드 적정으로 확인할 수 있다.[15]
4. 1. 옥심 생성
하이드록실아민은 알데하이드 또는 케톤과 반응하여 옥심을 생성한다.[14]:
이 반응은 케톤과 알데하이드의 정제에 유용하다. 용액에 있는 알데하이드 또는 케톤에 하이드록실아민을 첨가하면 일반적으로 용액에서 침전되는 옥심이 생성된다. 침전물을 무기산으로 가열하면 원래의 알데하이드 또는 케톤이 회복된다.[14]
디메틸글리옥심과 같은 옥심은 리간드로도 사용된다.[14]
4. 2. 기타 반응
클로로술폰산과 반응하여 히드록실아민-''O''-술폰산을 생성한다.[15]가열하면 히드록실아민은 폭발한다. 80% 이상의 중량 농도의 수용액은 뇌관으로 쉽게 폭발할 수 있으며, 50% 용액도 대량으로 시험하면 폭발할 수 있다.[16][17] 공기 중에서는 연소가 빠르고 완전하다. 공기가 없는 경우, 순수한 히드록실아민은 더 강한 가열이 필요하며, 폭발은 완전 연소를 하지 않는다.
아민 옥사이드로의 부분적인 이성질화는 높은 반응성에 기여한다.[18]
5. 생화학적 역할 및 반응
생물학적 질산화 과정에서 암모니아(ammonia영어, NH₃)의 하이드록실아민으로의 산화는 암모니아 모노옥시게나제(ammonia monooxygenase, AMO)에 의해 매개된다.[5] 하이드록실아민 산화환원효소(hydroxylamine oxidoreductase, HAO)는 하이드록실아민을 아질산염으로 더 산화시킨다.[30]
암모니아 산화 박테리아(ammonia-oxidizing bacteria)인 ''니트로소모나스 유로파에(Nitrosomonas europaea)''에서 발견되는 시토크롬 P460 효소는 하이드록실아민을 강력한 온실가스인 아산화 질소로 전환할 수 있다.[31]
하이드록실아민은 펩타이드와 단백질에서 아스파라긴-글리신 펩타이드 결합을 매우 선택적으로 절단하는 데에도 사용될 수 있다.[32] 또한, 헴을 포함하는 효소(heme-containing enzymes)에 결합하여 영구적으로 비활성화(독성)시킨다. 물과 유사한 구조 때문에 광합성의 산소 발생 복합체(oxygen-evolving complex)의 비가역적 억제제로 사용된다.
6. 응용 분야
하이드록실아민은 주로 나일론 6의 전구체인 사이클로헥사논옥심을 합성하는데 사용된다.[10] 이 옥심을 산으로 처리하면 베크만 전위반응을 통해 카프로락탐이 만들어진다.[21] 카프로락탐은 이후 개환 중합되어 나일론 6가 된다.[22]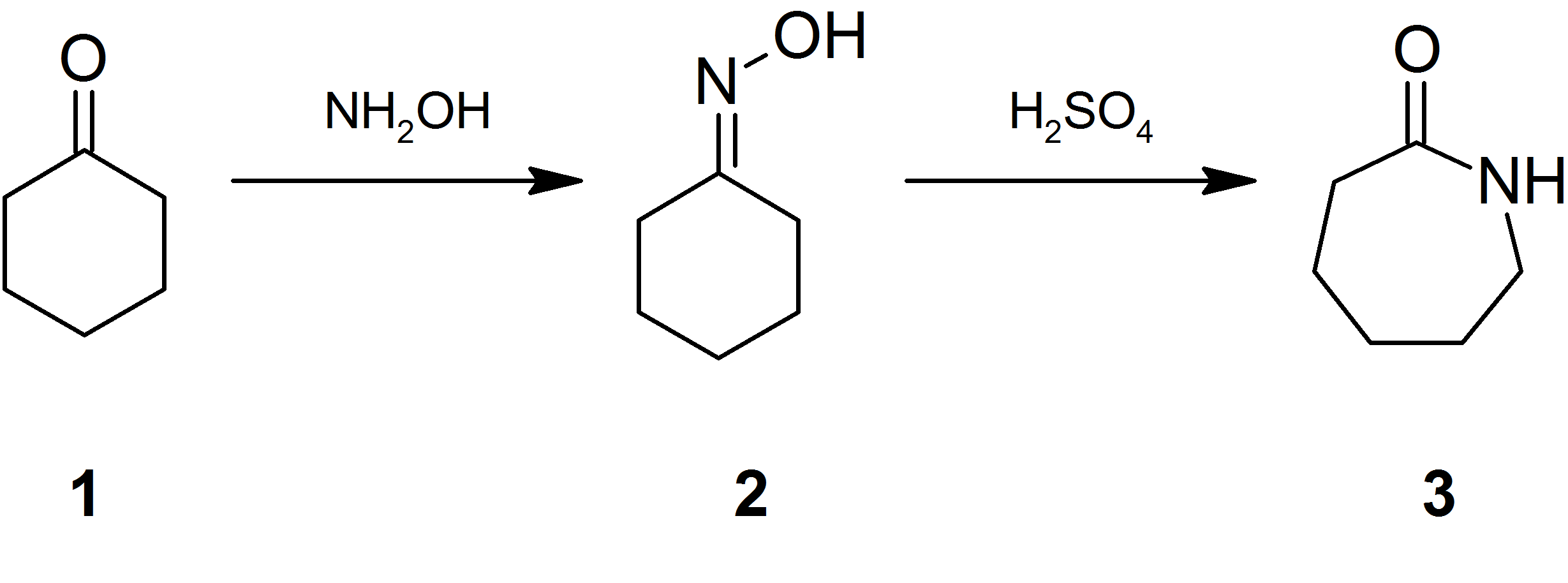
질산히드록실암모늄은 로켓 추진제로 연구되고 있으며, 일액추진제(수용액) 및 고체연료 형태로 사용된다. 또한 하이드록실아민은 농약의 원료로도 쓰인다.
6. 1. 실험실 용도
하이드록실아민과 그 염은 다양한 유기 및 무기 반응에서 환원제로 흔히 사용된다. 지방산의 산화방지제 역할도 할 수 있다.[39]고농도의 하이드록실아민은 DNA 염기 아민-하이드록실화제로 작용하여 돌연변이를 유도하는 데 사용된다.[23] 주로 시티딘을 하이드록시아미노시티딘으로 하이드록실화하여 C:G에서 T:A로 전이 돌연변이를 유발한다.[24] 시험관 내에서 고농도 또는 과도한 하이드록실아민 반응은 DNA의 다른 영역을 변형시켜 다른 유형의 돌연변이를 유발할 수 있다.[24] 어니스트 프리즈(Ernst Freese)는 히드록실아민을 가장 특이적인 돌연변이원으로 간주하기도 했다.[25] 박테리오파지 캡시드 내에 포장된 DNA의 돌연변이[26] 및 시험관 내에서 정제된 DNA의 돌연변이[27] 와 같은 특수한 용도로 사용되었다.
호이스트 AG(Hoechst AG)–셀라니즈(Celanese)가 개발한 파라세타몰의 대체적인 산업적 합성법은 케톤을 하이드록실아민을 이용하여 케톡심으로 전환하는 것을 포함한다.
일부 비화학적 용도에는 동물 가죽에서 털 제거 및 사진 현상액이 포함된다.[2] 반도체 산업에서는 히드록실아민이 종종 리소그래피 후 포토레지스트를 제거하는 "레지스트 스트리퍼"의 구성 요소이다.
히드록실아민은 단백질에 대한 번역 후 변형의 특성을 더 잘 규명하는 데 사용될 수 있다. 예를 들어, 폴리(ADP-리보스) 사슬은 글루탐산 또는 아스파르트산에 부착될 때 히드록실아민에 민감하지만, 세린에 부착될 때는 민감하지 않다.[28] 마찬가지로, 세린 또는 트레오닌 잔기에 결합된 유비퀴틴 분자는 히드록실아민에 민감하지만, 라이신(이소펩타이드 결합)에 결합된 유비퀴틴 분자는 내성을 가진다.[29]
6. 2. 기타 응용
히드록실아민은 동물 가죽의 털 제거, 사진 현상액에 사용된다.[2] 반도체 산업에서는 리소그래피 후 포토레지스트를 제거하는 "레지스트 스트리퍼"의 구성 요소로 사용된다. 또한 파라세타몰의 대체적인 산업적 합성법에 사용되는데, 호이스트 AG(Hoechst AG)–셀라니즈(Celanese)가 개발했으며, 케톤을 히드록실아민을 이용하여 케톡심으로 전환하는 것을 포함한다.
질산히드록실암모늄은 로켓 추진제로서, 일액추진제(수용액) 및 고체연료 모두 연구되고 있다. 히드록실아민 및 그 염류는 많은 유기화학 및 무기화학 반응에서 환원제로 일반적으로 사용된다. 지방산의 산화방지제로서도 작용한다.[39] 화학 이외의 용도로는 가죽의 탈모나 사진 현상액 등이 있다. 반도체 세척제로도 사용된다. 농약의 원료가 되기도 한다.
7. 안전성 및 환경 문제
하이드록실아민은 이론적으로 약 5 kJ/g의 분해 에너지를 가진 폭발물이 될 수 있으며, 80% 이상의 수용액은 밀폐된 상태에서 뇌관이나 강한 가열에 의해 쉽게 폭발할 수 있다.[16][17] 1999년 이후 하이드록실아민을 취급하는 공장이 최소 두 곳 이상 파괴되어 인명 피해가 발생했다.[33] 특히, 제1철 및 제2철 철염이 50% 용액의 분해를 가속화시키는 것으로 알려져 있다.[34]
하이드록실아민은 호흡기, 피부, 눈 및 기타 점막에 자극을 준다. 피부를 통해 흡수될 수 있으며, 섭취 시 유해하고, 잠재적인 돌연변이원이다.[35] 증기가 다량으로 체내에 들어가면 메트헤모글로빈이 생성되어 혈액의 산소 흡수력이 저하될 수 있다.[42]
2000년 6월 10일, 군마현 오지마정(당시)의 철 이온 프리 하이드록실아민 50% 수용액 제조 공장에서 폭발[40]이 있었고, 1999년 2월 19일 미국 펜실베이니아주에서도 50% 수용액 제조 공장에서 폭발 사고가 발생했다. 두 경우 모두 하이드록실아민이 고농도이거나 철 이온의 존재에 의해 격렬하게 분해되어 위험하다는 것은 알려져 있었다.
군마현의 공장 폭발을 계기로 소방 연구소에서 폭발 위험성에 대한 여러 실험을 실시했다. 그 결과는 다음과 같다.
- 시차 열 분석(DTA) 결과, 하이드록실아민의 분해는 스테인리스강 표면 촉매 작용에 의해 촉진되며, 열분해 시 TNT와 동등한 반응열을 발생시킨다. 80% 이상의 수용액은 전파성을 가지며, 뇌관 충격만으로도 쉽게 폭굉을 일으킨다.[40]
- 철 이온(Fe2+·Fe3+)은 하이드록실아민 수용액 분해에 큰 영향을 미치며, 0.9 ppm의 미량 철 이온으로도 격렬하게 분해될 수 있다. 85% 수용액에 0.2%(200 ppm)의 Fe3+ 용액을 투입하면 점화 후 수 초 만에 자연 발화한다.[40]
- 하이드록실아민의 염 중 황산염은 폭발성이 없지만, 염산염과 인산염은 폭발성이 있다. 분해의 격렬함은 황산염과 염산염이 격렬하고, 인산염은 격렬하지 않다.[40]
- 50% 수용액은 국제연합 기준으로는 자기 반응성 물질에 해당하지 않지만, 철 이온을 함유한 시료는 자기 반응성 물질로 판정되었다.
7. 1. 대한민국 법규
소방법에서 제5류 위험물(자기반응성물질)로 지정되어 있다.독극물 및 극물 취급법에 따라 극물로 지정되어 있다.[43]
참조
[1]
서적
Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)
The Royal Society of Chemistry
2014
[2]
문서
RubberBible87th
[3]
서적
Chemical Risk Analysis: A Practical Handbook
Butterworth–Heinemann
[4]
서적
Chemistry of the Elements
Reed Educational and Professional Publishing Ltd
[5]
학술지
Structural conservation of the B subunit in the ammonia monooxygenase/particulate methane monooxygenase superfamily
2014-09-01
[6]
서적
Ueber das Hydroxylamine
https://books.google[...]
1865
[7]
서적
Sur l'hydroxylamine libre
https://books.google[...]
1891
[8]
서적
Préparation de l'hydroxylamine cristallisée
https://books.google[...]
1891
[9]
서적
Inorganic Syntheses
[10]
서적
Hydroxylamine
[11]
서적
The Manufacture of Chemicals by Electrolysis
https://archive.org/[...]
D. Van Nostrand Co.
2014-06-05
[12]
서적
Process of preparing hydroxylamine hydrochloride (US2242477)
https://docs.google.[...]
U.S. Patent Office
[13]
학술지
Efficient catalyst-free N2 fixation by water radical cations under ambient conditions
[14]
서적
The Systematic Identification of Organic Compounds: A Laboratory Manual
Wiley
[15]
서적
Inorganic Chemistry
https://books.google[...]
Academic Press
[16]
학술지
Study on decomposition of hydroxylamine/water solution
https://www.scienced[...]
2003-01-01
[17]
서적
Bretherick's Handbook of Reactive Chemical Hazards
https://www.scienced[...]
2023-08-28
[18]
학술지
Ammonia oxide makes up some 20% of an aqueous solution of hydroxylamine.
2010-02-28
[19]
학술지
Nitrones
1964
[20]
서적
March's advanced organic chemistry : reactions, mechanisms, and structure
Wiley
[21]
서적
Organic chemistry
Oxford University Press
2012
[22]
학술지
Ring-Opening Polymerization—An Introductory Review
2013-04-25
[23]
학술지
Harvesting the potential of induced biological diversity
Elsevier BV
[24]
학술지
Isolation of mutant promoters in the Escherichia coli galactose operon using local mutagenesis on cloned DNA fragments
Elsevier BV
[25]
서적
Chemical Mutagens : Principles and Methods for Their Detection Volume 1
Springer US
[26]
학술지
Localized Mutagenesis of Any Specific Small Region of the Bacterial Chromosome
1971-12-01
[27]
웹사이트
Hydroxylamine Mutagenesis of plasmid DNA
http://dornsife.usc.[...]
University of Southern California
2021-12-09
[28]
학술지
HPF1 dynamically controls the PARP1/2 balance between initiating and elongating ADP-ribose modifications
2021-11-18
[29]
학술지
The E3 ligase HOIL-1 catalyses ester bond formation between ubiquitin and components of the Myddosome in mammalian cells
2019-07-02
[30]
학술지
Evidence for the structure of the active site heme P460 in hydroxylamine oxidoreductase of Nitrosomonas
1993-09-01
[31]
학술지
Nitrosomonas europaea cytochrome P460 is a direct link between nitrification and nitrous oxide emission
2016-12-20
[32]
서적
Enzyme Structure Part E
[33]
웹아카이브
Japan Science and Technology Agency Failure Knowledge Database
https://web.archive.[...]
2007-12-20
[34]
학술지
Effect of Iron Ion in the Thermal Decomposition of 50 mass% Hydroxylamine/Water Solutions
[35]
웹사이트
MSDS
https://www.sigmaald[...]
[36]
서적
Handbook of Inorganic Chemicals
McGraw-Hill
[37]
서적
Chemical Risk Analysis: A Practical Handbook
Butterworth–Heinemann
[38]
서적
Chemistry of the Elements
Butterworth-Heinemann
[39]
서적
Handbook of Inorganic Chemicals
McGraw Hill
[40]
웹사이트
ヒドロキシルアミン爆発火災
https://www.shippai.[...]
失敗学会
2024-06-30
[41]
웹사이트
平成13年7月4日法律第98号
https://www.shugiin.[...]
[42]
웹사이트
ICSC 0661 - ヒドロキシルアミン
https://chemicalsafe[...]
[43]
법률
毒物及び劇物取締法
1950-12-28
[44]
서적
Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)
The Royal Society of Chemistry
2014
[45]
문서 # 추정. RubberBible87th에 대한 정보 부족으로 type을 문서로 설정. 추가 정보 필요
RubberBible87th
[46]
서적
Chemical Risk Analysis: A Practical Handbook
Butterworth–Heinemann
[47]
서적
Chemistry of the Elements
Reed Educational and Professional Publishing Ltd
[48]
저널
Structural conservation of the B subunit in the ammonia monooxygenase/particulate methane monooxygenase superfamily
2014-09-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com