화학 전지
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
화학 전지는 자발적인 산화-환원 반응을 이용하여 전기에너지를 생성하는 장치이다. 외부 전원 공급으로 재생 가능한 2차 전지와 재생 불가능한 1차 전지로 분류된다. 갈바니 전지(볼타 전지)는 자발적 반응을 통해 전기를 생성하며, 외부 회로를 통해 전자가 이동하는 원리로 작동한다. 전해 전지는 외부 전기 에너지를 가해 비자발적인 산화-환원 반응을 유도하며, 전기 분해에 사용된다. 연료 전지는 연료와 산화제의 지속적인 공급을 통해 화학 에너지를 전기 에너지로 변환하는 방식으로 작동한다. 전지 전위는 전극 전위를 사용하여 예측할 수 있으며, 표준 환원 전위 표를 통해 각 반쪽 전지의 전압을 알 수 있다. 전지 전위는 반응물의 농도에 따라 달라지며, 표준 전지 전위와 자유 에너지 변화 사이에는 관계가 있다.
더 읽어볼만한 페이지
- 전지 - 연료전지
연료전지는 수소, 탄화수소 등의 연료와 산화제를 사용하여 화학 에너지를 직접 전기 에너지로 변환하는 고효율 발전 장치로, 다양한 종류가 있으며 여러 분야에 응용되지만 상용화를 위한 과제가 남아있다. - 전지 - 이차 전지
이차 전지는 충전과 방전을 통해 반복 사용이 가능한 전지로, 외부 전원을 이용해 에너지를 축적하고 방전 시 전기 에너지로 변환하는 원리를 활용하며, 휴대용 전자기기, 전기 자동차, 에너지 저장 시스템 등 다양한 분야에서 활용되고 안전성, 수명, 환경 문제 해결을 위한 차세대 기술 개발이 진행 중이다. - 도구 - 목재
목재는 수목의 목질부로, 오래전부터 연료, 건축 자재, 도구 등 다양한 용도로 사용되어 왔으며, 셀룰로오스, 헤미셀룰로오스, 리그닌으로 구성되고 수종에 따라 물성이 다르며, 다양한 형태로 가공되어 여러 분야에 활용되고 지속가능한 산림 관리와 기술 개발이 중요시되는 재료이다. - 도구 - 호루라기
호루라기는 입으로 불어넣는 공기나 증기를 이용하여 소리를 내는 도구로, 스포츠 경기, 경비, 교통 정리 등 다양한 분야에서 신호 전달 및 경고 목적으로 활용되며 악기로도 사용된다.
| 화학 전지 | |
|---|---|
| 화학 전지 | |
| 유형 | 전기 화학 |
| 관련 항목 | 전기 분해 전기 도금 전기 분석법 전기 화학 시리즈 전해질 이온 선택 전극 막 전위 |
2. 전지의 종류
화학 전지는 일정 시간 동안 사용하면 전지 전위가 떨어지게 되는데, 이때 외부에서 전원을 공급하면 전지가 재생될 수도 있다. 이와 같이 사용한 전지에 전류를 흘려 주어 전지가 재생되는 과정을 충전(charge)이라 하고, 전지를 사용하여 전지가 소모되는 과정을 방전(discharge)이라고 한다.
외부에서 전류를 흘려 주어도 재생되지 않는 전지를 비가역 전지 또는 1차 전지라고 하며, 볼타 전지나 건전지 등이 이에 속한다. 충전과 방전 모두 가능한 전지를 가역 전지 또는 2차 전지라고 하며, 다니엘 전지, 납 축전지, 리튬 이온 전지, 니켈 카드뮴 전지 등이 이에 속한다.[6]
2. 1. 갈바니 전지 (볼타 전지)
자발적인 산화-환원 반응을 이용하여 전기를 발생시키는 실험장치를 '''갈바니 전지(Galvanic cell)''' 또는 '''볼타 전지(voltanic cell)'''라 부른다. 이 이름은 루이지 갈바니와 알레산드로 볼타가 처음 조립하여 붙여졌다고 한다. 전지구성에서 아연 금속 막대는 ZnSO4 용액에 담겨 있고, 구리 막대는 CuSO4 용액에 담겨 있다. 각 용기에서 아연은 Zn2+으로 산화되고, Cu2+는 Cu로 환원되는 자발적인 반응이 일어남에 따라 외부 도선을 통해 전자가 이동하는 원리에 의해 전지가 작동한다. 여기에서 아연 막대와 구리 막대를 전극(electrode)이라 부른다. 아연과 구리 전극 그리고 ZnSO4, CuSO4으로 이루어진 전지를 '''다니엘(Daniell)전지'''라 한다. 이 때, 산화가 일어나는 전극을 산화전극 또는 음극(anode), 환원이 일어나는 전극을 환원전극 또는 양극(cathode)이라고 한다.
갈바니 전지(볼타 전지)는 루이지 갈바니와 알레산드로 볼타의 이름을 따서 명명되었으며, 자발적인 산화 환원 반응으로부터 전기에너지를 생성하는 전기화학 전지이다.[3]
두 개의 서로 다른 금속(예: 아연과 구리)을 전선으로 연결한다. 각 금속은 별도의 용액에 담겨 있으며, 종종 금속의 수용액 황산염 또는 질산염 형태를 사용하지만, 더 일반적으로는 금속 염과 전류를 전도하는 물을 사용한다.[4] 염다리 또는 다공성 막이 두 용액을 연결하여 전기적 중성을 유지하고 전하 축적을 방지한다. 금속의 산화/환원 전위 차이가 화학 평형에 도달할 때까지 반응을 유도한다.[1]
주요 특징:
- 자발 반응
- 전류 생성
- 전류는 전선을 통해 흐르고, 이온은 염다리를 통해 흐름
- 양극(음극), 음극(양극)
1836년 영국의 화학자 존 프레더릭 대니얼/John Frederic Daniell영어은 볼타 전지에서 수소 기체가 발생하여 전압이 떨어지는 분극 현상을 방지하기 위해 '''다니엘 전지'''를 고안하였다.'''다니엘 전지'''는 두 개의 반쪽 전지로 이루어져 있으며, 황산아연 수용액에 아연 전극을, 황산구리(II) 수용액에 구리 전극을 넣고 '''염다리'''로 연결한 전지이다. 다니엘 전지에서, 전극에서 일어나는 산화와 환원 반응인 반쪽 전지반응은 이와 같다.
- Zn 전극(산화전극, anode) : Zn(s) → Zn2+(aq) + 2e-
- Cu 전극(환원전극, cathode) : Cu2+(aq) + 2e- → Cu(s)
2. 1. 1. 다니엘 전지
1836년 영국의 화학자 존 프레더릭 대니얼(존 프레더릭 대니얼/John Frederic Daniell영어)은 볼타 전지에서 수소 기체가 발생하여 전압이 떨어지는 분극 현상을 방지하기 위해 '''다니엘 전지'''를 고안하였다.'''다니엘 전지'''는 두 개의 반쪽 전지로 이루어져 있으며, 황산아연 수용액에 아연 전극을, 황산구리(II) 수용액에 구리 전극을 넣고 '''염다리'''로 연결한 전지이다. 다니엘 전지에서, 전극에서 일어나는 산화와 환원 반응인 반쪽 전지반응은 이와 같다.- Zn 전극(산화전극, anode) : Zn(s) → Zn2+(aq) + 2e-
- Cu 전극(환원전극, cathode) : Cu2+(aq) + 2e- → Cu(s)
2. 2. 전해 전지
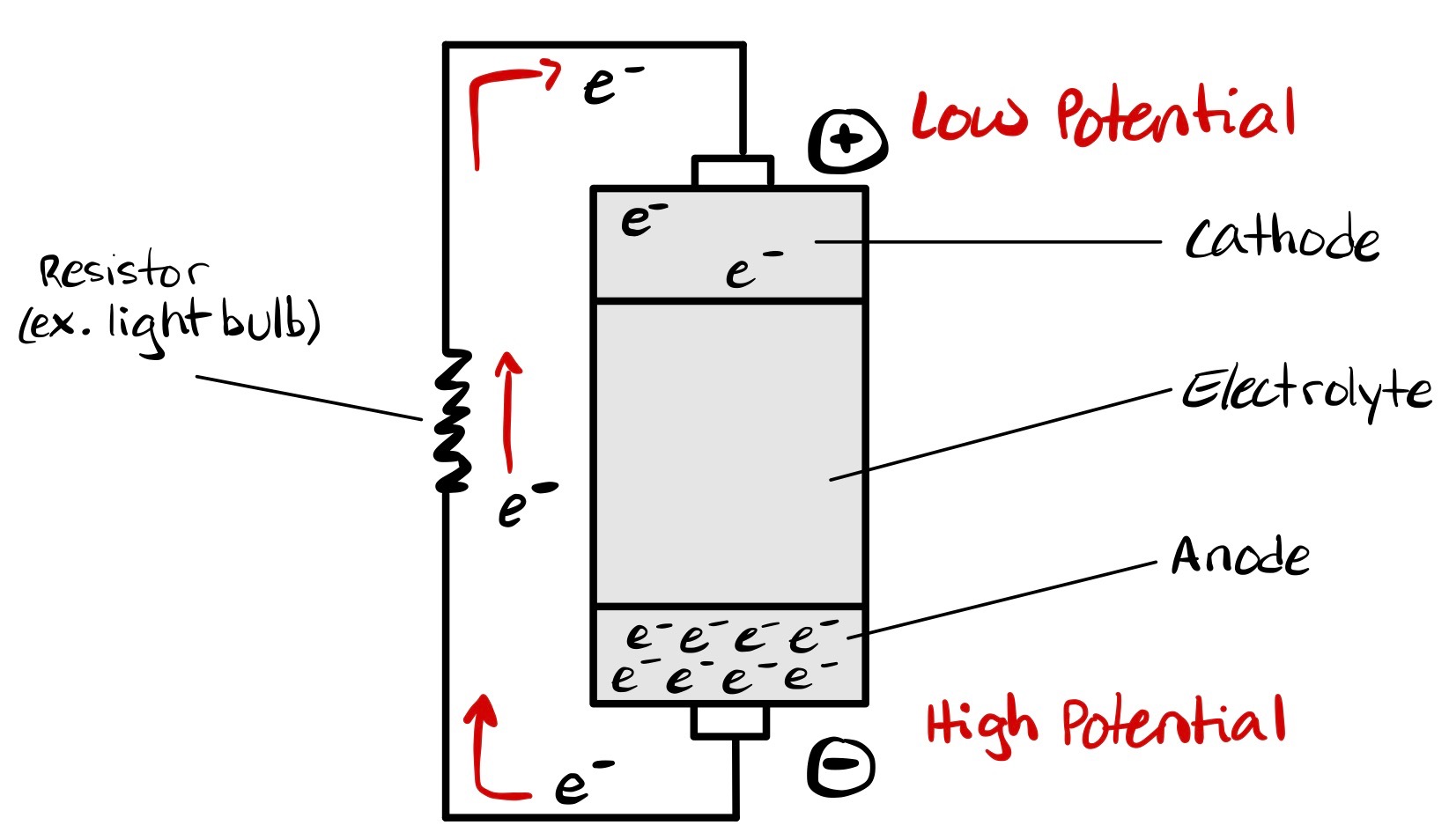
전해 전지는 외부에서 가해진 전기 에너지가 비자발적인 산화 환원 반응을 유도하는 전기 화학 전지이다.[5] 전기 분해라는 과정을 통해 화학 화합물을 분해하는 데 사용된다.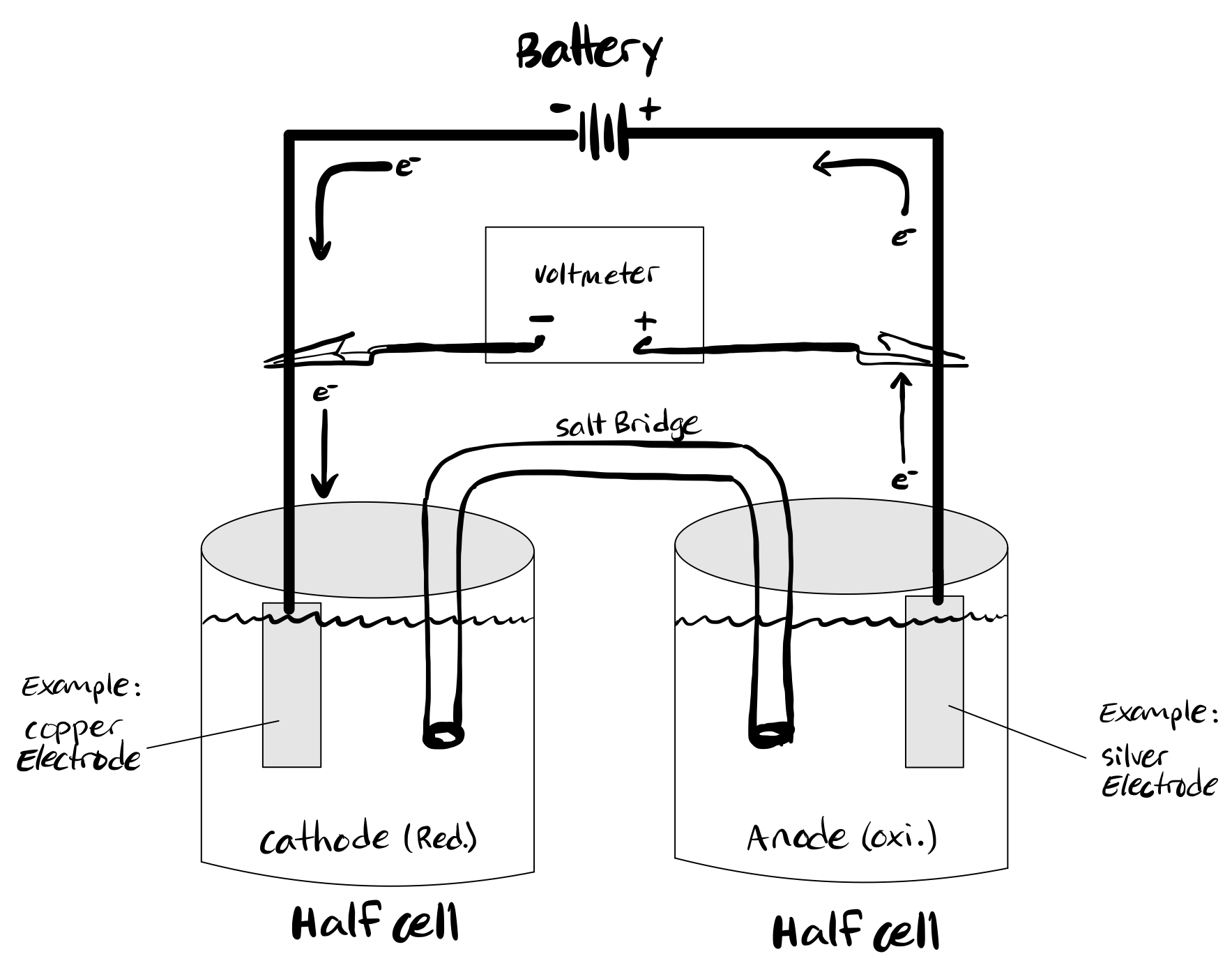
전기 분해의 중요한 예로는 물을 수소와 산소로 분해하는 것, 보크사이트를 알루미늄 및 기타 화학 물질로 분해하는 것이 있다. 전기 도금 (예: 구리, 은, 니켈 또는 크롬)은 전해 전지를 사용하여 수행된다. 전기 분해는 직류 (DC)를 사용하는 기술이다.
전해 전지의 구성 요소는 다음과 같다.
- 전해질: 일반적으로 이온이 용해된 물 또는 기타 용매의 용액이다. 염화 나트륨과 같은 용융 염도 전해질이다.
- 두 개의 전극(음극 및 양극): 산화 또는 환원이 일어날 수 있는 적절한 물질로 구성된 전기 단자이며, 서로 다른 두 개의 전위로 유지된다.
전극에 인가된 외부 전압 (전위차)에 의해 구동되면 전해질의 이온은 반대 전위를 가진 전극으로 끌려가며, 여기서 전하 전달(패러데이 또는 산화 환원) 반응이 일어날 수 있다. 충분한 외부 전압이 있어야만 전해 전지가 일반적으로 안정적이거나 비활성인 용액 내의 화학 화합물을 분해할 수 있다. 따라서 제공된 전기 에너지는 그렇지 않으면 자발적으로 발생하지 않을 화학 반응을 생성한다.
주요 특징은 다음과 같다.
- 비자발적 반응
- 전류 발생
- 전류는 전선을 통해 흐르고 이온은 염다리를 통해 흐름
- 양극(양극), 음극(음극)
2. 3. 1차 전지
외부에서 전류를 흘려 주어도 재생되지 않는 전지를 비가역 전지 또는 1차 전지라고 하며, 볼타 전지나 건전지 등이 이에 속한다. 충전과 방전이 모두 가능한 전지는 2차 전지라고 한다.[6]
1차 전지는 비가역적인 화학 반응(예: 소형 일회용 배터리)에 의해 전류를 생성하며 재충전이 불가능하다. 이들은 휴대성, 저렴한 비용, 짧은 수명 때문에 사용된다. 1차 전지는 손전등 및 휴대용 라디오와 같은 소형 가전 제품에 전원을 공급하기 위해 다양한 표준 크기로 제작된다. 1차 전지에서 화학 반응이 진행됨에 따라 배터리는 전력을 생성하는 화학 물질을 소모한다. 이 물질이 소모되면 배터리는 전기를 생성하는 것을 멈춘다.
1차 전지는 약 500억 달러 규모의 배터리 시장의 약 90%를 차지하지만, 2차 전지가 시장 점유율을 높여가고 있다. 매년 전 세계적으로 약 150억 개의 1차 전지가 버려지며,[6] 사실상 모두 매립지에 버려진다. 배터리에는 독성 중금속과 강산 또는 강알칼리가 포함되어 있으므로, 배터리는 유해 폐기물이다. 대부분의 지방 자치 단체는 이를 유해 폐기물로 분류하고 별도 폐기를 요구한다. 배터리 제조에 필요한 에너지는 배터리가 포함하는 에너지보다 약 50배 더 크다.[7][8][9][10] 적은 에너지량에 비해 높은 오염 물질 함량으로 인해 1차 전지는 낭비적이고 환경 친화적이지 않은 기술로 간주된다. 주로 무선 장치 및 무선 공구의 판매 증가로 인해 1차 전지로 경제적으로 전원을 공급할 수 없고, 일체형 충전식 배터리가 함께 제공되면서, 2차 전지 산업은 높은 성장을 보이고 있으며, 고급 제품에서 1차 전지를 서서히 대체하고 있다.
망가니즈 건전지는 흔히 건전지로 불리며, 대한민국에서 가장 널리 사용되는 1차 전지이다. (-)극은 아연 금속, (+)극은 탄소 막대, 전해질 수용액은 염화 암모늄(NH4Cl) 포화 수용액과 ZnCl2 반죽을 사용하며, 전지 전위는 1.5V 정도이다. 전해질이 액체가 아닌 반죽 형태이기 때문에 '건전지'라는 이름이 붙었다.
전극 반응은 다음과 같다.
- (-)극: Zn(s) → Zn2+(aq) + 2e- (산화)
- (+)극: 2NH4+(aq) + 2MnO2(s) + 2e- → Mn2O3(s) + H2O(l) + 2NH3(aq) (환원)
아연-탄소 건전지는 수소 기체가 발생하지 않는데, 이는 감극제인 MnO2의 산화 작용으로 수소 기체가 물로 변하기 때문이다. 휴대용 라디오, 손전등, 녹음기 등에 많이 사용된다.
2. 3. 1. 아연-탄소 전지 (망가니즈 전지)
망가니즈 건전지는 흔히 건전지로 불리며, 대한민국에서 가장 널리 사용되는 1차 전지이다. (-)극은 아연 금속, (+)극은 탄소 막대, 전해질 수용액은 염화 암모늄(NH4Cl) 포화 수용액과 ZnCl2 반죽을 사용하며, 전지 전위는 1.5V 정도이다. 전해질이 액체가 아닌 반죽 형태이기 때문에 '건전지'라는 이름이 붙었다.전극 반응은 다음과 같다.
- (-)극: Zn(s) → Zn2+(aq) + 2e- (산화)
- (+)극: 2NH4+(aq) + 2MnO2(s) + 2e- → Mn2O3(s) + H2O(l) + 2NH3(aq) (환원)
아연-탄소 건전지는 수소 기체가 발생하지 않는데, 이는 감극제인 MnO2의 산화 작용으로 수소 기체가 물로 변하기 때문이다. 휴대용 라디오, 손전등, 녹음기 등에 많이 사용된다.
2. 3. 2. 알칼라인 전지
알칼라인 전지에 대한 소스 정보와 요약 정보가 제공되지 않았습니다. 따라서 알칼라인 전지 섹션 내용을 생성할 수 없습니다.2. 3. 3. 수은 전지
(내용 없음)2. 3. 4. 산화 은 전지
(빈칸)2. 4. 2차 전지
화학 전지는 일정 시간 동안 사용하면 전지 전위가 떨어지는데, 이때 외부에서 전원을 공급하면 전지가 재생될 수도 있다. 이와 같이 사용한 전지에 전류를 흘려 주어 전지가 재생되는 과정을 충전(charge)이라 하고, 전지를 사용하여 전지가 소모되는 과정을 방전(discharge)이라고 한다.외부에서 전류를 흘려 주어도 재생되지 않는 전지를 비가역 전지 또는 1차 전지라고 하며, 볼타 전지나 건전지 등이 이에 속한다. 충전과 방전 모두 가능한 전지를 가역 전지 또는 2차 전지라고 하며, 다니엘 전지, 납 축전지, 리튬 이온 전지, 니켈 카드뮴 전지 등이 이에 속한다.


이차 전지는 가역적인 화학 반응(예: 납축전지 자동차 배터리)에 의해 전류를 생성하며, 충전이 가능하다.
납 축전지는 자동차 엔진을 시동하고 엔진이 작동하지 않을 때 자동차의 전기 부품을 작동시키는 데 사용된다. 자동차가 작동하면 발전기가 배터리를 재충전한다.
이것은 볼타 전지와 전해 전지로 작동할 수 있다. 전기를 저장하는 편리한 방법이다. 전류가 한 방향으로 흐르면 하나 이상의 화학 물질 수준이 증가하고(충전), 방전되는 동안 감소하며, 그 결과 발생하는 기전력은 일을 할 수 있다.
이 전지는 높은 전압, 낮은 비용, 신뢰성, 그리고 긴 수명 때문에 사용된다.
2. 4. 1. 납 축전지
납(Pb)과 이산화납(PbO2)을 묽은 황산에 담근 전지로, 납축전지 1개의 전지 전위는 2V 정도이다. 자동차의 배터리에 이용되는 축전지의 전지 전위는 12V 정도인데, 이것은 납축전지 6개를 직렬로 연결하여 구성되기 때문이다.1) 전극 반응 : (-)극인 Pb판과, (+)극인 PbO2판에서 일어나는 반응은 다음과 같다.
- (-)극: Pb(s) + SO42-(aq) -> PbSO4(s) + 2e- (산화)
- (+)극: PbO2(s) + SO42-(aq) + 4H+(aq) + 2e- -> PbSO4(s) + 2H2O(l) (환원)
- 전체 반응: Pb(s) + PbO2(s) + 2H2SO4(aq) -> 2PbSO4(s) + 2H2O(l)
2) 특징: 납축전지는 충전이 가능한 2차 전지이지만 크기가 너무 크고 무겁다는 단점이 있다. 납축전지를 사용하면 두 전극의 질량은 점점 증가하고, 전해액의 비중은 감소한다. 따라서 황산 용액의 비중을 조사하면 납축전지의 방전 정도를 알아낼 수 있다.
2. 4. 2. 니켈-카드뮴 전지
(소스와 요약이 제공되지 않았으므로, 내용을 생성할 수 없습니다.)2. 4. 3. 리튬 이온 전지
2. 5. 연료 전지

연료 전지는 수소 연료를 산소 또는 다른 산화제와 반응시켜 화학 에너지를 전기로 변환하는 전기화학 전지이다.
연료 전지는 화학 반응을 유지하기 위해 연료와 산소(보통 공기)를 지속적으로 공급해야 한다는 점에서 전지와 다르다. 전지의 경우 화학 에너지는 전지 내에 이미 존재하는 화학 물질에서 나온다.
연료 전지는 연료와 산소가 공급되는 한 지속적으로 전기를 생산할 수 있다.
상업용, 산업용, 주거용 건물에 주 전원 및 백업 전원으로 사용되며, 원격 또는 접근이 어려운 지역에서도 사용된다. 또한 연료 전지 자동차를 포함하여 지게차, 자동차, 버스, 보트, 오토바이 및 잠수함의 동력원으로도 사용된다.
연료 전지는 사용되는 전해질 유형과 시동 시간의 차이에 따라 분류되며, 이는 고분자 전해질 연료 전지 (PEM 연료 전지 또는 PEMFC)의 1초에서 고체 산화물 연료 전지 (SOFC)의 10분까지 다양하다.
연료 전지의 종류는 많지만 모두 다음과 같이 구성된다.
;애노드: 애노드에서 촉매는 연료가 산화 반응을 거쳐 양성자 (양전하를 띤 수소 이온)와 전자를 생성하게 한다. 양성자는 반응 후 전해질을 통해 애노드에서 캐소드로 흐른다. 동시에 전자는 외부 회로를 통해 애노드에서 캐소드로 인출되어 직류 전기를 생산한다.
;캐소드: 캐소드에서 또 다른 촉매는 수소 이온, 전자 및 산소가 반응하여 물을 형성하게 한다.
;전해질: 양전하를 띤 수소 이온(양성자)이 연료 전지의 양쪽 사이를 이동할 수 있게 한다.
관련 기술로는 연료를 재충전하여 재생할 수 있는 레독스 흐름 전지가 있다. 개별 연료 전지는 약 0.7볼트의 비교적 작은 전위를 생성하므로, 응용 분야의 요구 사항을 충족하기에 충분한 전압을 생성하기 위해 전지를 "스택"하거나 직렬로 배치한다.[11] 연료 전지는 전기 외에도 물, 열을 생성하며, 연료원에 따라 아주 소량의 이산화 질소 및 기타 배출물을 생성한다. 에너지 효율은 일반적으로 40~60%이지만, 열병합 발전 방식으로 폐열을 회수하면 최대 85%의 효율을 얻을 수 있다.
2022년, 글로벌 연료 전지 시장은 63억 달러로 추산되었으며, 2030년까지 19.9% 증가할 것으로 예상된다.[12] 많은 국가에서 재생 에너지 GW 목표를 설정하여 시장 진입을 시도하고 있다.[13]
2. 5. 1. 수소 연료 전지
연료가 연속적으로 산화되는 반응으로부터 전기 에너지를 얻는 전지를 연료 전지(fuel cell)라고 하며, 대표적인 연료 전지로 수소-산소 연료 전지가 있다.1) 수소-산소 연료 전지 : 전극으로는 금속 촉매를 주입한 다공성의 탄소 전극을 사용하고, (-)극에는 수소 기체를, (+)극에는 산소 기체를 공급해 주며, 전해질로는 KOH 수용액을 사용한다.
(-)극: 2H2(g) + 4OH-(aq) -> 4H2O(l) + 4e- (산화)
(+)극: O2(g) + 2H2O(l) + 4e- -> 4OH- (환원)
전체 반응: 2H2(g) + O2(g) -> 2H2O (l)
2) 연료 전지의 특징: ·연료 전지는 반응 생성물이 물이므로 환경오염 물질을 배출하지 않는다는 장점이 있어 1960년대에 우주 왕복선의 동력원으로 쓰인 후 최근에는 여러 분야에서 이용되고 있다. 그러나 장치가 너무 크고 값이 비싸다는 단점이 극복해야 할 과제이다.
·일반 전지와는 달리 연료 전지는 재충전할 필요가 없으며, 연료가 공급되는 한 계속해서 전기를 만들어 낼 수 있다. 즉, 수소를 (-)극에 공급하고 산소를 (+)극에 공급하여 연속적으로 전기 에너지를 생산할 수 있다.
·연료가 전기 화학적으로 반응하여 전기를 생산하는 과정에서 에너지의 손실이 매우 작으므로 70~80% 정도의 고효율 발전이 가능하다.
·소음이 매우 적으며, 공해 물질의 배출이 거의 없는 무공해 에너지 기술이다.
·도심 지역 또는 건물 내 설치가 가능하여 경제적으로 에너지를 공급할 수 있으며, 천연가스, 도시가스, 나프타, 메탄올, 폐기물 가스 등 다양한 연료를 사용할 수 있으므로 기존의 화력 발전을 대체하고, 분산 전원용 발전소, 열병합 발전소, 무공해 자동차 전원 등에 이용될 수 있다.
3. 전극 전위와 기전력
전지 전위는 전극 전위(각 반쪽 전지의 전압)를 사용하여 예측할 수 있다. 이러한 반쪽 전위는 표준 수소 전극(SHE)에 0 볼트를 할당하는 것을 기준으로 정의된다.(표준 전극 전위표 참조). 전극 전위의 전압 차이는 측정된 전위의 예측값을 제공한다. 전압 차이를 계산할 때는 먼저 반쪽 전지 반응 방정식을 다시 써서 균형 잡힌 산화-환원 방정식을 얻어야 한다.
# 가장 작은 전위를 가진 환원 반응을 반대로 한다(산화 반응/전반적인 양의 전지 전위 생성).
# 반쪽 반응은 전자 균형을 이루기 위해 정수로 곱해야 한다.
전지 전위는 대략 0에서 6볼트까지 가능하다. 수성 전해질을 사용하는 전지는 강력한 산화제 및 환원제가 물과 반응하여 더 높은 전압을 생성해야 하기 때문에 일반적으로 약 2.5볼트 미만의 전지 전위로 제한된다. 물 대신 다른 용매를 사용하는 전지에서는 더 높은 전지 전위가 가능하다. 예를 들어, 전압이 3볼트인 리튬 전지가 일반적으로 사용된다.
전지 전위는 반응물의 농도뿐만 아니라 그 종류에 따라 달라진다. 전지가 방전됨에 따라 반응물의 농도가 감소하고 전지 전위도 감소한다.
3. 1. 표준 환원 전위
반쪽 반응이 환원 반응일 때의 표준 전극 전위를 '''표준 환원 전위(standard reduction potential)'''라고 하며, E°로 나타낸다. 일반적으로 전극 전위는 표준 환원 전위 값으로 주어지며 표준 환원 전위 값이(+)이면 수소보다 환원되기 쉽고, (-)이면 수소보다 환원되기 어렵다는 것을 의미한다. 반쪽 반응이 산화 반응일 때의 표준 전극 전위를 '''표준 산화 전위(standard oxidation potential)'''라고 하며, 표준 산화 전위는 표준 환원 전위와 크기는 같지만 부호가 반대이다.'''표준 산화 전위 = -표준 환원 전위'''
전지 전위는 전극 전위(각 반쪽 전지의 전압)를 사용하여 예측할 수 있다. 이러한 반쪽 전위는 표준 수소 전극(SHE)에 0 볼트를 할당하는 것을 기준으로 정의된다.(표준 전극 전위표 참조). 전극 전위의 전압 차이는 측정된 전위의 예측값을 제공한다. 전압 차이를 계산할 때는 먼저 반쪽 전지 반응 방정식을 다시 써서 균형 잡힌 산화-환원 방정식을 얻어야 한다.
# 가장 작은 전위를 가진 환원 반응을 반대로 한다(산화 반응/전반적인 양의 전지 전위 생성).
# 반쪽 반응은 전자 균형을 이루기 위해 정수로 곱해야 한다.
전지 전위는 대략 0에서 6볼트까지 가능하다. 수성 전해질을 사용하는 전지는 강력한 산화제 및 환원제가 물과 반응하여 더 높은 전압을 생성해야 하기 때문에 일반적으로 약 2.5볼트 미만의 전지 전위로 제한된다. 물 대신 다른 용매를 사용하는 전지에서는 더 높은 전지 전위가 가능하다. 예를 들어, 전압이 3볼트인 리튬 전지가 일반적으로 사용된다.
전지 전위는 반응물의 농도뿐만 아니라 그 종류에 따라 달라진다. 전지가 방전됨에 따라 반응물의 농도가 감소하고 전지 전위도 감소한다.
3. 1. 1. 전극 전위
화학 전지 내에서 산화·환원 반응이 일어나면서 전자의 이동으로 인해 생기게 되는 두 전극 사이의 전위차를 '''전지 전위(electrode potential)'''라고 한다. 전지의 전지 전위는 두 개의 반쪽 전지를 도선으로 연결했을 때 일어나는 전자의 이동으로 인해 생기기 때문에 반쪽 전지만으로는 측정할 수 없다. 따라서 표준 수소 전극을 기준으로 표준 수소 전극과 다른 반쪽 전지로 이루어진 전지의 전지 전위를 측정하여 각 반쪽 전지 전위의 상대적인 크기를 정하게 된다. 이를 그 반쪽 전지의 '''전극 전위'''라고 한다.전지 전위는 전극 전위(각 반쪽 전지의 전압)를 사용하여 예측할 수 있다. 이러한 반쪽 전위는 표준 수소 전극(SHE)에 0 볼트를 할당하는 것을 기준으로 정의된다.(표준 전극 전위표 참조). 전극 전위의 전압 차이는 측정된 전위의 예측값을 제공한다. 전압 차이를 계산할 때는 먼저 반쪽 전지 반응 방정식을 다시 써서 균형 잡힌 산화-환원 방정식을 얻어야 한다.
# 가장 작은 전위를 가진 환원 반응을 반대로 한다(산화 반응/전반적인 양의 전지 전위 생성).
# 반쪽 반응은 전자 균형을 이루기 위해 정수로 곱해야 한다.
전지 전위는 대략 0에서 6볼트까지 가능하다. 수성 전해질을 사용하는 전지는 강력한 산화제 및 환원제가 물과 반응하여 더 높은 전압을 생성해야 하기 때문에 일반적으로 약 2.5볼트 미만의 전지 전위로 제한된다. 물 대신 다른 용매를 사용하는 전지에서는 더 높은 전지 전위가 가능하다. 예를 들어, 전압이 3볼트인 리튬 전지가 일반적으로 사용된다.
전지 전위는 반응물의 농도뿐만 아니라 그 종류에 따라 달라진다. 전지가 방전됨에 따라 반응물의 농도가 감소하고 전지 전위도 감소한다.
3. 1. 2. 표준 전극 전위
백금 전극을 사용하여 1M의 H+용액과 접촉하고 있는 1기압의 H2기체로 이루어진 반쪽 전지가 나타내는 전위를 0.00V로 정하는데, 이것을 '''표준 수소 전극'''이라고 한다.전지 전위는 전극 전위(각 반쪽 전지의 전압)를 사용하여 예측할 수 있다. 이러한 반쪽 전위는 표준 수소 전극(SHE)에 0 볼트를 할당하는 것을 기준으로 정의된다.(표준 전극 전위표 참조). 전극 전위의 전압 차이는 측정된 전위의 예측값을 제공한다. 전압 차이를 계산할 때는 먼저 반쪽 전지 반응 방정식을 다시 써서 균형 잡힌 산화-환원 방정식을 얻어야 한다.
# 가장 작은 전위를 가진 환원 반응을 반대로 한다(산화 반응/전반적인 양의 전지 전위 생성).
# 반쪽 반응은 전자 균형을 이루기 위해 정수로 곱해야 한다.
전지 전위는 대략 0에서 6볼트까지 가능하다. 수성 전해질을 사용하는 전지는 강력한 산화제 및 환원제가 물과 반응하여 더 높은 전압을 생성해야 하기 때문에 일반적으로 약 2.5볼트 미만의 전지 전위로 제한된다. 물 대신 다른 용매를 사용하는 전지에서는 더 높은 전지 전위가 가능하다. 예를 들어, 전압이 3볼트인 리튬 전지가 일반적으로 사용된다.
전지 전위는 반응물의 농도뿐만 아니라 그 종류에 따라 달라진다. 전지가 방전됨에 따라 반응물의 농도가 감소하고 전지 전위도 감소한다.
3. 1. 3. 표준 환원 전위 표
wikitable| 전극 반응(반쪽 반응) | E°(V) |
|---|
| Li+(aq) +e^{-} -> Li(s)영어 |
| K+(aq) +e^{-} -> K(s)영어 |
| Ca^{2+}(aq) +2e^{-} -> Ca(s)영어 |
| Na^{+}(aq) +e^{-} -> Na(s)영어 |
| Mg^{2+}(aq) +2e^{-} -> Mg(s)영어 |
| Al^{3+}(aq) +3e^{-} -> Al(s)영어 |
| 2H2O(l) +2e^{-} -> H2(g) + 2OH^{-}(aq)영어 |
| Zn^{2+}(aq) +2e^{-} -> Zn(s)영어 |
| Fe^{2+}(aq) +2e^{-} -> Fe(s)영어 |
| Cd^{2+}(aq) +2e^{-} -> Cd(s)영어 |
| Ni^{2+}(aq) +2e^{-} -> Ni(s)영어 |
| Sn^{2+}(aq) +2e^{-} -> Sn(s)영어 |
```
전지 전위는 전극 전위(각 반쪽 전지의 전압)를 사용하여 예측할 수 있다. 이러한 반쪽 전위는 표준 수소 전극(SHE)에 0 볼트를 할당하는 것을 기준으로 정의된다.(표준 전극 전위표 참조). 전극 전위의 전압 차이는 측정된 전위의 예측값을 제공한다. 전압 차이를 계산할 때는 먼저 반쪽 전지 반응 방정식을 다시 써서 균형 잡힌 산화-환원 방정식을 얻어야 한다.
# 가장 작은 전위를 가진 환원 반응을 반대로 한다(산화 반응/전반적인 양의 전지 전위 생성).
# 반쪽 반응은 전자 균형을 이루기 위해 정수로 곱해야 한다.
전지 전위는 대략 0에서 6볼트까지 가능하다. 수성 전해질을 사용하는 전지는 강력한 산화제 및 환원제가 물과 반응하여 더 높은 전압을 생성해야 하기 때문에 일반적으로 약 2.5볼트 미만의 전지 전위로 제한된다. 물 대신 다른 용매를 사용하는 전지에서는 더 높은 전지 전위가 가능하다. 예를 들어, 전압이 3볼트인 리튬 전지가 일반적으로 사용된다.
전지 전위는 반응물의 농도뿐만 아니라 그 종류에 따라 달라진다. 전지가 방전됨에 따라 반응물의 농도가 감소하고 전지 전위도 감소한다.
3. 2. 표준 전지 전위의 계산
두 반쪽 전지의 전극 전위 값의 차는 전지 전위에 해당한다. 따라서 전지를 구성하는 두 반쪽 전지의 표준 전극 전위 값을 알면 다음과 같이 표준 전지 전위를 계산할 수 있다.'''표준 전지 전위= (+)극의 표준 환원 전위 - (-)극의 표준 환원 전위 = (+)극의 표준 환원 전위 + (-)극의 표준 산화 전위'''
전지 전위는 전극 전위(각 반쪽 전지의 전압)를 사용하여 예측할 수 있다. 이러한 반쪽 전위는 표준 수소 전극(SHE)에 0 볼트를 할당하는 것을 기준으로 정의된다.(표준 전극 전위표 참조). 전극 전위의 전압 차이는 측정된 전위의 예측값을 제공한다. 전압 차이를 계산할 때는 먼저 반쪽 전지 반응 방정식을 다시 써서 균형 잡힌 산화-환원 방정식을 얻어야 한다.
# 가장 작은 전위를 가진 환원 반응을 반대로 한다(산화 반응/전반적인 양의 전지 전위 생성).
# 반쪽 반응은 전자 균형을 이루기 위해 정수로 곱해야 한다.
전지 전위는 대략 0에서 6볼트까지 가능하다. 수성 전해질을 사용하는 전지는 강력한 산화제 및 환원제가 물과 반응하여 더 높은 전압을 생성해야 하기 때문에 일반적으로 약 2.5볼트 미만의 전지 전위로 제한된다. 물 대신 다른 용매를 사용하는 전지에서는 더 높은 전지 전위가 가능하다. 예를 들어, 전압이 3볼트인 리튬 전지가 일반적으로 사용된다.
전지 전위는 반응물의 농도뿐만 아니라 그 종류에 따라 달라진다. 전지가 방전됨에 따라 반응물의 농도가 감소하고 전지 전위도 감소한다.
3. 2. 1. 표준 전지 전위와 자유 에너지 변화
:- 이어서 인 경우에는 반응이 자발적으로 일어난다.
- 이어서 인 경우에는 반응이 자발적으로 일어나지 않는다.(역반응이 자발적으로 일어난다.)
전지 전위는 전극 전위(각 반쪽 전지의 전압)를 사용하여 예측할 수 있다. 이러한 반쪽 전위는 표준 수소 전극(SHE)에 0 볼트를 할당하는 것을 기준으로 정의된다.(표준 전극 전위표 참조). 전극 전위의 전압 차이는 측정된 전위의 예측값을 제공한다. 전압 차이를 계산할 때는 먼저 반쪽 전지 반응 방정식을 다시 써서 균형 잡힌 산화-환원 방정식을 얻어야 한다.
# 가장 작은 전위를 가진 환원 반응을 반대로 한다(산화 반응/전반적인 양의 전지 전위 생성).
# 반쪽 반응은 전자 균형을 이루기 위해 정수로 곱해야 한다.
전지 전위는 대략 0에서 6볼트까지 가능하다. 수성 전해질을 사용하는 전지는 강력한 산화제 및 환원제가 물과 반응하여 더 높은 전압을 생성해야 하기 때문에 일반적으로 약 2.5볼트 미만의 전지 전위로 제한된다. 물 대신 다른 용매를 사용하는 전지에서는 더 높은 전지 전위가 가능하다. 예를 들어, 전압이 3볼트인 리튬 전지가 일반적으로 사용된다.
전지 전위는 반응물의 농도뿐만 아니라 그 종류에 따라 달라진다. 전지가 방전됨에 따라 반응물의 농도가 감소하고 전지 전위도 감소한다.
참조
[1]
논문
Douglas A. Skoog, Donald M. West, F. James Holler, and Stanley R. Crouch: Fundamentals of analytical chemistry, 9th ed., international ed.
http://dx.doi.org/10[...]
2013-07-30
[2]
간행물
Electrochemistry, 1. Fundamentals
https://onlinelibrar[...]
Wiley-VCH Verlag GmbH & Co. KGaA
2023-05-05
[3]
문서
Chemistry
https://web.ung.edu/[...]
Rice University
2015
[4]
서적
Principles of corrosion engineering and corrosion control.
http://worldcat.org/[...]
Butterworth-Heinemann
2013
[5]
간행물
Standard Electrode Potentials and Application to Characterization of Corrosion Phenomena
http://dx.doi.org/10[...]
Elsevier
2023-04-18
[6]
웹사이트
What if we could recycle the energy remaining in discarded batteries? Scientists now know how
https://techxplore.c[...]
2023-04-18
[7]
서적
Understanding Environmental Pollution: A Primer
https://archive.org/[...]
Cambridge University Press
2004
[8]
서적
Gcse Edexcel Science
https://books.google[...]
Letts and Lonsdale
2006
[9]
서적
The Green Office Manual: A Guide to Responsible Practice
https://books.google[...]
Routledge
2013
[10]
서적
Building the Green Economy: Success Stories from the Grassroots
https://books.google[...]
Routledge
2016
[11]
논문
Review Article: Flow battery systems with solid electroactive materials
2017-07-01
[12]
웹사이트
Fuel Cell Market Size, Share & Trends Analysis Report, 2030
https://www.grandvie[...]
2023-04-18
[13]
웹사이트
Renewable energy targets
https://energy.ec.eu[...]
2023-04-22
[14]
웹인용
Electrolytic Cells
http://hyperphysics.[...]
2018-05-17
[15]
웹인용
Electrochemical Cells
http://hyperphysics.[...]
2018-05-17
[16]
웹인용
Byjus ( a tutorial site)
http://byjus.com/che[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com