A형 간염 백신
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
A형 간염 백신은 A형 간염을 예방하기 위해 사용되는 백신으로, 상완 근육에 2회 접종하며 6~12개월 간격으로 추가 접종한다. 백신 접종 후 약 2~4주 후부터 A형 간염에 대한 보호 효과가 나타나며, 추가 접종 시 최소 25년 이상 효과가 지속될 것으로 추정된다. 미국 질병통제예방센터(CDC)는 특정 위험군과 유행 지역 거주자에게 백신 접종을 권장하며, 여행 시 감염 위험이 높은 지역 방문 시 예방 접종이 필요하다. 다양한 제약 회사에서 여러 종류의 A형 간염 백신을 생산하며, A형 간염과 B형 간염, 또는 장티푸스 백신과의 조합으로 접종되기도 한다. 백신 접종 후 심각한 부작용은 드물며, 1991년 유럽, 1995년 미국에서 처음 승인되었다. 한국은 1997년에 A형 간염 백신을 도입하여 2015년부터 국가예방접종으로 지원하고 있다.
더 읽어볼만한 페이지
- 간염 백신 - B형 간염 백신
B형 간염 백신은 B형 간염 바이러스 감염을 예방하기 위해 사용되며, 신생아에게 출생 시 예방 접종을 권장하고, 면역 기억을 통해 최소 30년 동안 보호 효과를 제공하며, 심각한 부작용은 드물다. - A형 간염 - A형 간염바이러스
A형 간염 바이러스는 피코르나바이러스과 헤파르나바이러스속의 유일한 종으로, 단일 가닥 RNA를 유전체로 가지며 외피가 없는 정이십면체 구조를 가진 바이러스이고, 경구 감염을 통해 전파된다. - 비활성화 백신 - 콜레라 백신
콜레라 백신은 콜레라 감염을 예방하기 위해 사용되는 백신으로, 세계보건기구는 질병이 풍토병인 지역에서 예방적 및 대응적 사용을 권장하며 경구 백신과 주사형 백신이 있고, 최근에는 생산 비용을 절감한 새로운 제형의 백신이 개발되어 전 세계 콜레라 백신 공급량 증가에 기여하고 있다. - 비활성화 백신 - 광견병 백신
광견병 백신은 광견병 바이러스 감염을 예방하기 위해 사용되며, 노출 전 예방 접종과 노출 후 예방 접종으로 나뉘고, 안전하며 여러 종류가 존재하고, 야생 동물에서의 광견병 확산을 통제하기 위해 경구 광견병 백신 접종 프로그램이 사용된다.
| A형 간염 백신 | |
|---|---|
| 일반 정보 | |
| 상품명 | |
| 상품명 | Havrix, 기타 |
| Drugs.com | 간염 A 바이러스 백신 (비활성화) |
| MedlinePlus | a695003 |
| 임신 AU | B2 |
| 임신 범주 | 해당 없음 |
| 투여 경로 | 근육 주사 |
| ATC 코드 | J07BC02 |
| 법적 지위 AU | S4 |
| 법적 지위 CA | 해당 없음 |
| 법적 지위 UK | 해당 없음 |
| 법적 지위 US | Rx-only (처방전 필요) |
| 법적 지위 EU | Rx-only (처방전 필요) |
| 법적 지위 EU 설명 | Havrix - 회부 |
| PubChem | 해당 없음 |
| ChemSpiderID | 해당 없음 |
| DrugBank | DB10989 |
| UNII | G54MT8V18G |
| 그림 정보 | |
 | |
2. 의학적 사용
세계보건기구(WHO)는 A형 간염이 일반적으로 발생하는 지역에서만 A형 간염 예방 접종을 권장한다.[34] 이 질병이 매우 빈번한 지역에서는 모든 사람이 어린 시절에 감염을 통해 면역이 생기기 때문에 광범위한 예방접종은 권장하지 않는다.[34] 미국 질병 관리 본부(CDC)는 고위험군의 성인과 모든 어린이를 예방 접종할 것을 권장한다.
미국 질병통제예방센터(CDC)는 1세 이상의 모든 어린이, 성적 활동으로 인해 위험에 처한 사람, 만성 간 질환이 있는 사람, 응고 인자 농축액으로 치료받는 사람, 바이러스 근처에서 일하는 사람, 유행이 발생한 지역 사회에 거주하는 사람들에게 백신 접종을 권장한다.[14] A형 간염은 여행 중 감염될 수 있는 가장 흔한 백신 예방 바이러스이므로,[15] 인도 아대륙, 아프리카, 중앙아메리카, 남아메리카, 아시아, 동유럽과 같이 바이러스가 흔한 지역으로 여행하는 사람들은 예방 접종을 받아야 한다.[14][16]
A형 간염 백신은 상완 근육에 2회 접종하며, 초기 접종 후 6~12개월 후에 추가 접종을 해야 한다.[14] A형 간염에 대한 보호는 초기 예방 접종 후 약 2~4주 후에 시작된다.[14][16] 보호 효과는 최소 15년 동안 지속되며, 추가 접종을 하면 최소 25년 동안 지속될 것으로 추정된다.[17]
2. 1. 백신 종류
여러 제약회사에서 다양한 종류의 A형 간염 백신을 생산하고 있다. 대부분의 A형 간염 백신은 비활성화된 바이러스나, 공격력이 약화된 바이러스를 포함하여 제작한다.[34] (U)단위의 정의는 제조사마다 자사 제품에서 A형 간염 항원을 측정하는 방식에 따라 다르다. 주요 백신은 다음과 같다.- 아박심(Avaxim): 사노피 파스퇴르에서 제조한다. MRC-5 세포에서 생산된 불활성화 A형 간염 바이러스를 사용한다. 각 용량은 수산화 알루미늄(0.3mg Al)에 흡착된 160 U의 항원을 함유한다.[19]
- 에팍살(Epaxal): 크루셀에서 제조하며, HAVpur 및 VIROHEP-A라는 브랜드명으로도 판매된다. 이 백신은 A형 간염 항원 외에 합성 지질 및 인플루엔자 단백질로 구성된 인공 입자인 비로솜으로 구성된다. 알루미늄을 함유하지 않는다.[20]
- 하브릭스(Havrix): 글락소스미스클라인에서 제조한다. MRC-5 세포에서 생산된 불활성화 A형 간염 바이러스를 사용한다. 성인 1회 용량은 수산화 알루미늄(0.5mg Al)에 흡착된 1440 ELISA 단위의 바이러스 항원을 함유한다. 소아 용량은 바이러스 항원과 알루미늄의 양이 절반이다.[21]
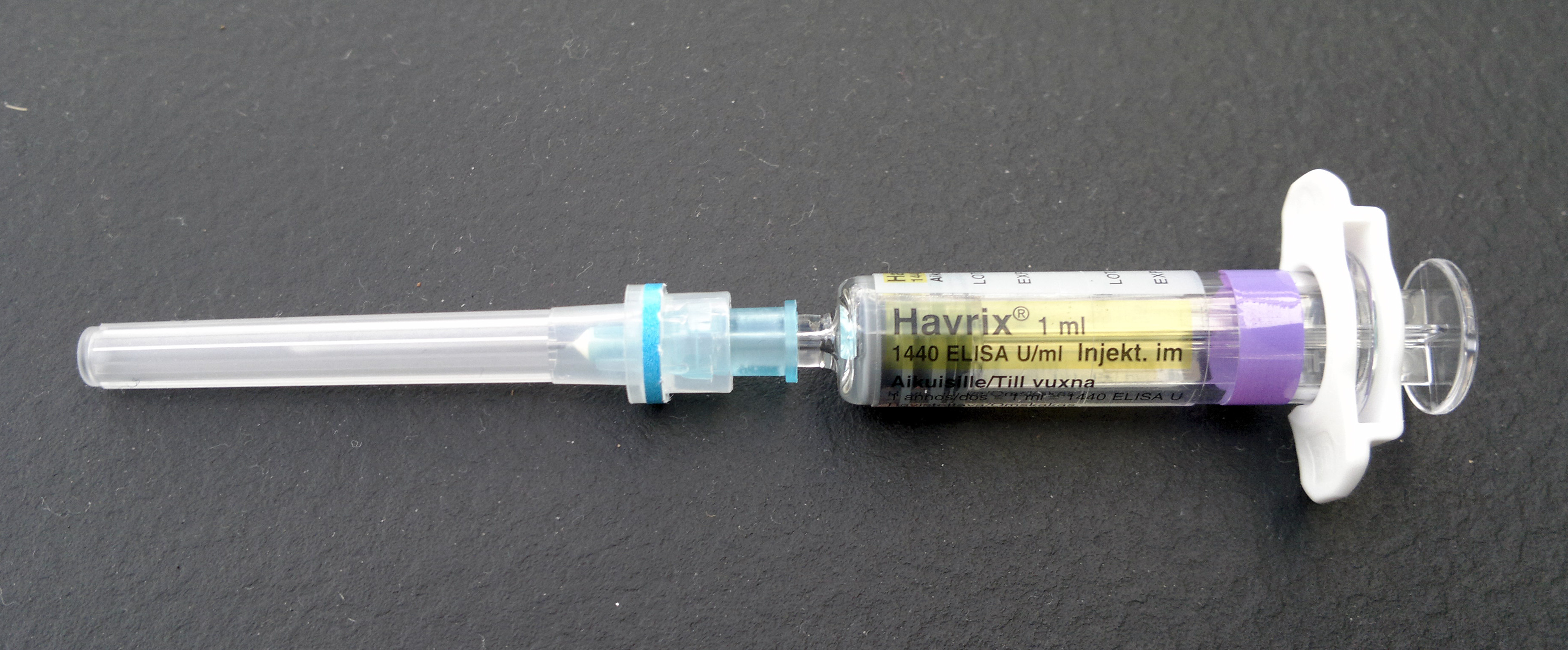
- 박타(Vaqta): 머크에서 제조한다. MRC-5 세포에서 생산된 불활성화 A형 간염 바이러스를 사용한다. 성인 용량은 0.45mg의 알루미늄(수산화 인산 알루미늄 황산염)에 흡착된 50 U의 항원을 함유하고, 소아 용량은 항원과 알루미늄의 양이 절반이다.[22]
A형 간염 및 B형 간염에 대한 A형 간염 및 B형 간염 백신[23], A형 간염과 장티푸스에 대한 A형 간염 및 장티푸스 백신[24][25][26][27]과 같은 복합 백신도 존재한다.
3. 부작용
심각한 부작용이 나타나는 경우는 매우 드물다. 주사 부위의 통증은 어린이의 약 15%와 성인의 약 절반에서 발생한다. 대부분의 A형 간염 백신은 비활성화된 바이러스나, 공격력이 약화된 바이러스를 포함하여 제작한다. 바이러스에 약한 사람이나 임신 중이거나 혹은 면역 기능이 떨어져 있는 경우에는 접종을 권장하지 않는다.[34] 처방 방법에 따라 A형 간염 백신과 B형 간염 백신 혹은 장티푸스 백신의 조합을 사용하여 접종하기도 한다.
4. 역사
최초의 A형 간염 백신은 1991년 유럽과 1995년 미국에서 승인되었으며, 세계 보건 기구 필수 의약품 목록에 들어 있다.[36] 1995년 미국의 모리스 힐먼과 그의 Merck & Co. 팀이 개발한 Vaqta 백신이 허가되었다.[9][10][11] 이 백신은 1996년경 고위험 지역에 거주하는 어린이를 대상으로 단계적으로 도입되었고, 1999년에는 감염 수준이 높은 지역으로 사용 범위가 확대되었다. GlaxoSmithKline의 Havrix는 1991년 유럽에서, 1995년 식품의약국(FDA)에서 최초 허가되었다.[12][5][13]
5. 한국에서의 A형 간염 백신
한국은 1997년 말부터 A형 간염 백신을 도입하였다.[37] 질병관리본부 정책([http://www.cdc.go.kr/CDC/cms/content/mobile/87/64787_view.html])에 따르면, 2015년 5월 1일부터 국가예방접종으로 도입되었으며, 2012년 1월 1일 이후 출생아를 대상으로 보건소 및 전국 약 7,000여 지정 의료기관을 통해 무료로 접종하고 있다.
A형 간염 백신 도입 전·후 생후 12-36개월 대상 영유아의 예방접종 기록 전산등록 현황을 살펴보면, 백신 도입 전에는 매월 6-7만 건 수준으로 접종기록이 등록되었으나 2014년 11월부터 점차 감소하여 백신 도입 전월에는 약 3,500건 수준으로 감소하였다. 하지만 백신 도입 후 첫 1개월 동안 총 225,835건이 등록됨에 따라 전년 동기간 대비 약 310% 증가하였다.[37]
참조
[1]
웹사이트
Havrix - referral
https://www.ema.euro[...]
2024-06-27
[2]
간행물
WHO position paper on hepatitis A vaccines – June 2012
[3]
간행물
WHO position paper on hepatitis A vaccines – October 2022
[4]
웹사이트
Clinical Overview of Hepatitis A
https://www.cdc.gov/[...]
2022-01-19
[5]
서적
Nanoparticulate drug delivery perspectives on the transition from laboratory to market
https://books.google[...]
Woodhead Pub.
2012
[6]
서적
The selection and use of essential medicines 2023: web annex A: World Health Organization model list of essential medicines: 23rd list (2023)
World Health Organization
[7]
간행물
Prevention of Hepatitis A Virus Infection in the United States: Recommendations of the Advisory Committee on Immunization Practices, 2020
https://www.cdc.gov/[...]
2020-07
[8]
웹사이트
Hepatitis A Vaccine Information Statement
https://www.cdc.gov/[...]
U.S. [[Centers for Disease Control and Prevention]] (CDC)
2021-10
[9]
웹사이트
Hepatitis A: Vaccine Licensed {{!}} History of Vaccines
https://www.historyo[...]
[10]
간행물
Maurice Hilleman: Creator of Vaccines That Changed the World
2018
[11]
웹사이트
Materials Documenting the Contribution of Dr. Maurice Hilleman to the Millennium Time Capsule Ceremony
https://americanhist[...]
[12]
웹사이트
Hepatitis A Vaccine Information
http://www.immunizat[...]
ImmunizationInfo
2008-06-19
[13]
웹사이트
Hepatitis A Vaccine - an overview {{!}} ScienceDirect Topics
https://www.scienced[...]
[14]
웹사이트
Hepatitis A Vaccine: What you need to know
https://www.cdc.gov/[...]
U.S. [[Centers for Disease Control and Prevention]] (CDC)
2006-03-21
[15]
웹사이트
Hepatitis, Viral, Type A
http://www2.ncid.cdc[...]
[16]
웹사이트
Hepatitis A: Introduction
http://www.nhsdirect[...]
NHS Direct
2006-10-10
[17]
간행물
Long-term protective effects of hepatitis A vaccines. A systematic review
2012-12
[18]
간행물
Hepatitis A immunisation in persons not previously exposed to hepatitis A
[19]
웹사이트
Patient Information Leaflet
http://www.medicines[...]
sanofi pasteur
2010-07
[20]
웹사이트
Epaxal
http://www.crucell.c[...]
Crucell website
[21]
웹사이트
Full Prescribing Information
https://www.fda.gov/[...]
GlaxoSmithKline
2010-07
[22]
웹사이트
VAQTA (Hepatitis A Vaccine, Inactivated)
https://www.fda.gov/[...]
U.S. [[Food and Drug Administration]] (FDA)
[23]
웹사이트
Twinrix
https://www.fda.gov/[...]
2019-10-03
[24]
웹사이트
Australian Product Information – Vivaxim (Salmonella typhi Vi polysaccharide and hepatitis A virus antigen) Vaccine
https://www.ebs.tga.[...]
[25]
웹사이트
Vivaxim Salmonella typhi vaccine; Hepatitis A vaccine
https://www.nps.org.[...]
2020-03-06
[26]
웹사이트
Vivaxim 1mL injection syringe composite pack
http://tga-search.cl[...]
Therapeutic Goods Administration (TGA)
[27]
웹사이트
Summary for ARTG Entry: 82745 Vivaxim 1mL injection syringe composite pack
http://www.ebs.tga.g[...]
Therapeutic Goods Administration (TGA)
[28]
간행물
WHO position paper on hepatitis A vaccines – June 2012.
http://www.who.int/w[...]
2012-07-13
[29]
간행물
Long-term protective effects of hepatitis A vaccines. A systematic review
2012-12
[30]
웹사이트
Hepatitis A In-Short
https://www.cdc.gov/[...]
2014-07-25
[31]
서적
Nanoparticulate drug delivery perspectives on the transition from laboratory to market
https://books.google[...]
Woodhead Pub.
2012
[32]
웹사이트
WHO Model List of Essential Medicines (19th List)
http://www.who.int/m[...]
2015-04
[33]
서적
Tarascon Pocket Pharmacopoeia 2015 Deluxe Lab-Coat Edition
Jones & Bartlett Learning
2015
[34]
저널
https://www.ncbi.nlm[...]
[35]
저널
https://www.ncbi.nlm[...]
[36]
서적
Nanoparticulate drug delivery : perspectives on the transition from laboratory to market
https://www.worldcat[...]
Woodhead Pub
2012
[37]
웹인용
A형 간염 백신의 국가예방접종 도입
http://www.cdc.go.kr[...]
2020-04-09
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com