TET 효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
TET 효소는 TET1, TET2, TET3 유전자에 의해 암호화되는 세 가지 단백질을 통칭하며, DNA 탈메틸화 반응을 촉매하는 역할을 한다. 이 효소들은 이중 가닥 β-나선 도메인, 시스테인 풍부 도메인, 그리고 보조 인자 결합 부위를 포함하는 공통적인 구조적 특징을 가지며, 각 유전자는 다양한 동형체로 발현되어 발생, 생식 세포 형성, 학습 및 기억, 중독, 통증 조절 등 다양한 생물학적 과정에 관여한다.
더 읽어볼만한 페이지
- 후성유전학 - 메틸화
메틸화는 메틸기를 분자에 첨가하는 과정으로, 생물학에서 유전자 발현 조절 등 생명현상에 관여하고 유기화학에서 유기 합성에 활용되며, 다양한 생물종에 존재하는 중요한 생리적 과정이다. - 후성유전학 - DNA 메틸화
DNA 메틸화는 시토신 염기에 메틸기가 결합되는 화학적 변형으로, 유전자 발현 조절, 유전체 각인, X 염색체 불활성화, 반복 서열 억제, 암 발생 등 다양한 생물학적 과정에 관여하며, 특히 포유류에서는 CpG 염기서열의 메틸화율이 높고, 유전자 프로모터 영역의 CpG 섬은 유전자 발현 조절에 중요한 역할을 한다. - 유전자 발현 - RNA 간섭
RNA 간섭은 이중가닥 RNA에 의해 유전자 발현이 억제되는 과정으로, 다이서 효소에 의해 생성된 작은 간섭 RNA가 RNA 유도 침묵 복합체와 결합하여 표적 mRNA를 분해하거나 번역을 억제하며, 바이러스 방어, 발생 조절, 유전체 안정성 유지 등 다양한 기능과 응용 분야를 가진다. - 유전자 발현 - 유전자 재조합
유전자 재조합은 유성 생식 생물의 염색체 유전자 교차를 통한 유전자 재배열 현상으로, 유전적 변이를 증가시키고 유전학적 지도 작성에 활용되며, 생명공학 등 다양한 분야에서 기술로 이용된다.
| TET 효소 | |
|---|---|
| 기본 정보 | |
| 유전자 기호 | TET |
| 다른 이름 | Ten-eleven translocation (텐-일레븐 전좌) JBP (제이비피) |
| 기능 | 5-메틸시토신 다이옥시제네이스 DNA 탈메틸화 |
| 종류 | |
| 인간 유전자 | TET1 TET2 TET3 |
| 생쥐 유전자 | Tet1 Tet2 Tet3 |
2. TET 단백질의 종류와 구조
''TET'' 유전자는 ''TET1'', ''TET2'', ''TET3'' 세 가지로 구성되며, 각각은 TET1, TET2, TET3 단백질을 암호화한다. 이들은 모두 5mC 산화효소 활성을 갖지만, 도메인 구조에서 차이를 보인다.[4] TET 단백질은 크고 (~180~230kDa) 다중 도메인 효소이다. 모든 TET 단백질은 보존된 이중 가닥 β-나선 (DSBH) 도메인, 시스테인 풍부 도메인, 그리고 보조 인자 Fe(II) 및 2-옥소글루타르산 (2-OG)의 결합 부위를 포함하며, 이들은 함께 C 말단에서 핵심 촉매 영역을 형성한다. 촉매 도메인 외에도, 전체 길이의 TET1 및 TET3 단백질은 DNA에 결합할 수 있는 N-말단 CXXC 아연 핑거 도메인을 가지고 있다.[5] TET2 단백질은 CXXC 도메인이 없지만, TET2 유전자의 이웃인 ''IDAX'' 유전자는 CXXC4 단백질을 암호화한다. IDAX는 메틸화되지 않은 CpG로의 모집을 촉진하여 TET2 활성을 조절하는 역할을 하는 것으로 생각된다.
세 개의 ''TET'' 유전자는 서로 다른 단백질 동형체로 발현되며, 이는 최소 두 가지의 TET1 동형체, 세 가지의 TET2 동형체, 그리고 세 가지의 TET3 동형체를 포함한다.[2][6] ''TET'' 유전자의 서로 다른 동형체는 다양한 세포와 조직에서 발현된다. 완전 길이의 표준 TET1 동형체는 초기 배아, 배아 줄기 세포, 그리고 원시 생식 세포 (PGCs)에 거의 국한되어 나타난다. 최소한 쥐의 경우, 대부분의 체세포 조직에서 우세한 TET1 동형체는 대체 프로모터 사용으로 인해 짧은 전사체와 TET1s로 명명된 절단된 단백질을 생성한다. TET2의 세 가지 동형체는 서로 다른 프로모터에서 발생한다. 이들은 발생 과정과 조혈 세포의 분화에서 발현되고 활성을 나타낸다. TET3의 동형체는 완전 길이 형태인 TET3FL, 짧은 형태의 스플라이스 변이체인 TET3s, 그리고 난모세포에서 발생하는 TET3o로 구성된다. TET3o는 대체 프로모터 사용으로 생성되며 11개의 아미노산을 코딩하는 추가적인 첫 번째 N-말단 엑손을 포함한다. TET3o는 난모세포와 접합체의 1세포 단계에서만 발생하며, 배아 줄기 세포나 테스트된 다른 세포 유형 또는 성체 쥐 조직에서는 발현되지 않는다. TET1 발현은 난모세포와 접합체에서 거의 감지되지 않으며, TET2는 중간 정도로만 발현되는 반면, TET3 변이체 TET3o는 난모세포와 접합체에서 매우 높은 수준의 발현을 보이지만, 2세포 단계에서는 거의 존재하지 않는다. 난모세포와 1세포 단계의 접합체에서 높은 수준으로 나타나는 TET3o가 수정 직후 DNA 복제가 시작되기 전에 부계 유전체에서 거의 100%의 빠른 탈메틸화가 일어날 때 사용되는 주요 TET 효소로 보인다 (DNA 탈메틸화 참조).
2. 1. TET 단백질의 구조적 특징
TET 단백질은 180~230kDa 크기의 다중 도메인 효소이다.[4] 모든 TET 단백질은 공통적으로 이중 가닥 β-나선 (DSBH) 도메인, 시스테인 풍부 도메인, 그리고 C 말단에 보조 인자인 Fe(II) 및 2-옥소글루타르산 (2-OG) 결합 부위를 포함하는 핵심 촉매 영역을 가진다.[4] TET1과 TET3는 N-말단에 DNA 결합에 관여하는 CXXC 아연 핑거 도메인을 갖는다.[5] 반면, TET2는 CXXC 도메인이 없지만, ''IDAX'' 유전자에 의해 암호화되는 CXXC4 단백질이 TET2 활성을 조절한다.[4]2. 2. TET 단백질의 동형체
TET1, TET2, TET3 유전자는 서로 다른 프로모터를 사용하고 선택적 스플라이싱을 통해 다양한 단백질 동형체를 생성한다.[2][6]TET1 동형체는 주로 초기 배아, 배아 줄기 세포, 원시 생식 세포에서 발현된다.[2] 대부분의 체세포 조직에서 우세한 TET1 동형체는 짧은 전사체와 TET1s로 명명된 절단된 단백질을 생성한다.[2]
TET2의 동형체는 서로 다른 프로모터에서 발생하며, 발생 과정과 조혈 세포 분화에서 발현 및 활성을 나타낸다.[2]
TET3 동형체는 완전 길이 형태인 TET3FL, 짧은 형태의 스플라이스 변이체인 TET3s, 난모세포에서 발생하는 TET3o로 구성된다.[2] TET3o는 난모세포와 접합체의 1세포 단계에서만 발생하며, DNA 탈메틸화에 관여한다.[2] TET1 발현은 난모세포와 접합체에서 거의 감지되지 않으며, TET2는 중간 정도로만 발현되는 반면, TET3 변이체 TET3o는 난모세포와 접합체에서 매우 높은 수준으로 발현되지만, 2세포 단계에서는 거의 존재하지 않는다.[2]
3. TET 단백질의 기능
TET1, TET2, TET3는 3가지의 포유류 TET 단백질을 암호화하며, 이들은 모두 5mC 산화효소 활성을 갖지만, 도메인 구조에서 차이를 보인다.[4] TET 단백질은 크고(약 180~230kDa) 다중 도메인 효소이다. 모든 TET 단백질은 보존된 이중 가닥 β-나선 (DSBH) 도메인, 시스테인 풍부 도메인, 보조 인자 Fe(II) 및 2-옥소글루타르산 (2-OG) 결합 부위를 포함하며, 이들은 함께 C 말단에서 핵심 촉매 영역을 형성한다. 촉매 도메인 외에도, 전체 길이의 TET1과 TET3 단백질은 DNA에 결합할 수 있는 N-말단 CXXC 아연 핑거 도메인을 갖는다.[5] TET2 단백질은 CXXC 도메인이 없지만, TET2 유전자 이웃인 ''IDAX'' 유전자가 CXXC4 단백질을 암호화한다. IDAX는 메틸화되지 않은 CpG로의 모집을 촉진하여 TET2 활성을 조절하는 것으로 생각된다.
== TET 단백질의 기능 ==
=== DNA 탈메틸화 과정 ===
TET 효소는 다이옥시제네이스의 일종으로, 알파-케토글루타르산 의존성 수산화효소 계열에 속한다.[17] TET 효소는 알파-케토글루타르산 (α-KG) 의존성 다이옥시제네이스로, 분자 산소(O2)에서 하나의 산소 원자를 DNA 내 5-메틸시토신(5mC) 기질에 통합하여 DNA 내 생성물인 5-히드록시메틸시토신을 생성하는 산화 반응을 촉매한다. 이러한 전환은 α-KG 보조 기질의 석신산과 이산화 탄소로의 산화와 결합된다.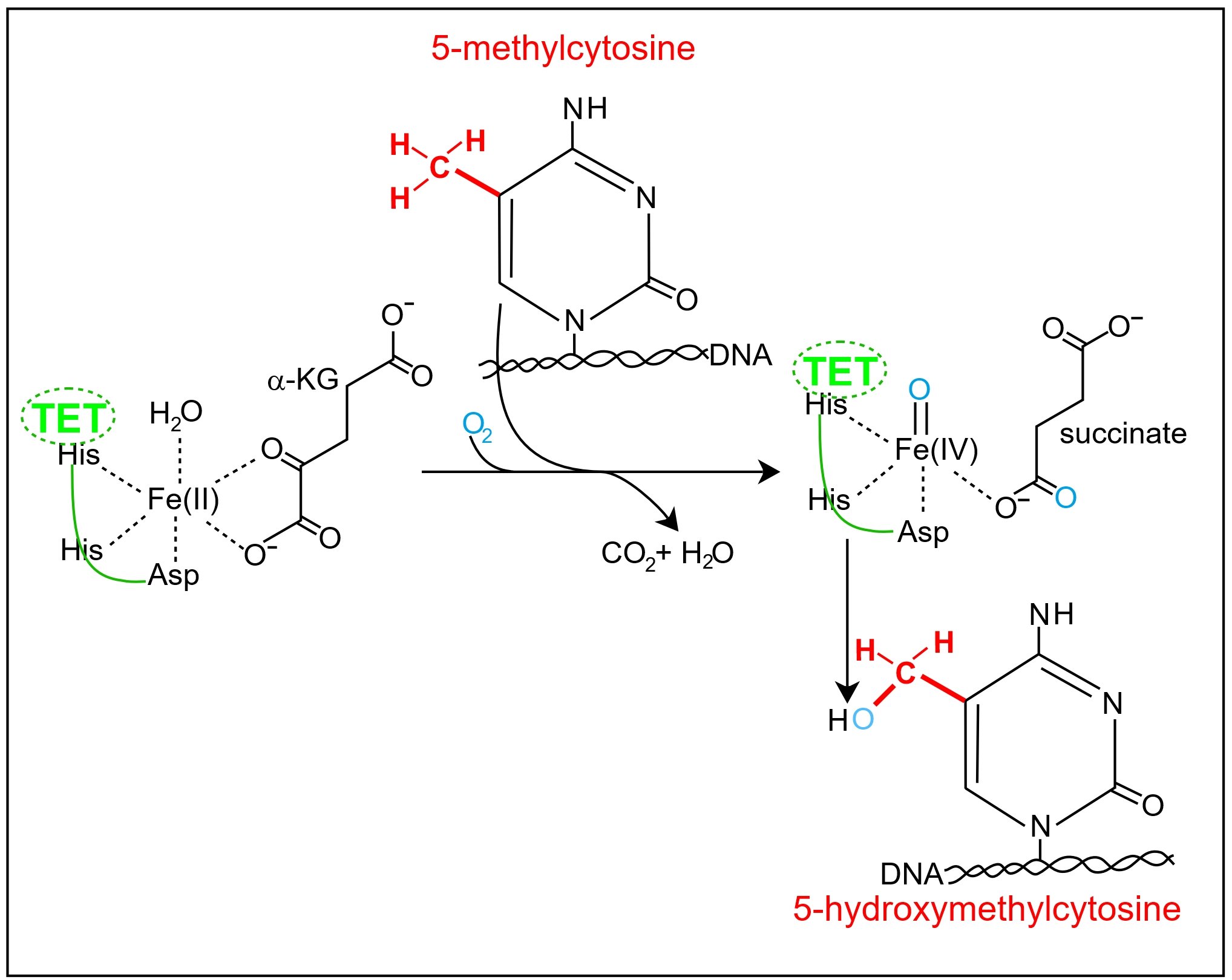
첫 번째 단계는 α-KG와 5-메틸시토신이 TET 효소 활성 부위에 결합하는 것을 포함한다. TET 효소는 Fe(II)/α-KG 의존성 산소화 효소 계열에서 발견되는 중요한 금속 결합 잔기를 포함하는 이중 가닥 β-나선 구조를 가진 핵심 촉매 도메인을 각각 가지고 있다.[17] α-KG는 리간드로서 (두 지점에서 연결됨) Fe(II)에 이배위 리간드로 배위하며, 5mC는 분자간 힘에 의해 근접하게 유지된다. TET 활성 부위에는 촉매적으로 필수적인 Fe(II)가 두 개의 히스티딘 잔기와 하나의 아스파르트산 잔기에 의해 유지되는 고도로 보존된 삼중체 모티프가 포함되어 있다. 이 삼중체는 Fe 중심의 한쪽에 결합하여 α-KG와 O2가 결합할 수 있는 세 개의 불안정한 부위를 남긴다. 그 다음 TET는 5-메틸시토신을 5-히드록시메틸시토신으로 전환시키는 작용을 하며, 동시에 α-케토글루타르산은 석신산과 CO2로 전환된다.
TET 효소는 CpG 부위의 5mC를 5hmC로 산화시키고, 추가적인 산화 반응을 통해 5-포르밀시토신(5fC) 및 5-카복실시토신(5caC)을 생성한다. 5hmC, 5fC, 5caC는 DNA 탈메틸화 과정의 중간 산물이며, 염기 절제 복구 경로를 통해 시토신으로 복구될 수 있다.
=== TET 단백질의 모집 및 활성 조절 ===
다양한 단백질이 특정 TET 효소에 결합하여 TET를 특정 유전체 위치로 모집한다.[8] 일부 연구에서는 상호 작용 자체가 모집을 매개하는지 또는 대신 상호 작용 파트너가 TET 결합에 유리한 염색질 환경을 조성하는 데 도움이 되는지 결정하기 위해 추가 분석이 필요하다. TET1 결핍 세포와 TET2 결핍 세포는 이 두 효소의 뚜렷한 표적 선호를 나타냈으며, TET1은 프로모터를 선호하고 TET2는 고도로 발현된 유전자 및 인핸서의 유전자 본체를 선호했다.
세 가지 포유류 DNA 메틸전달효소(DNMT)는 사이토신 뉴클레오티드가 구아닌 뉴클레오티드로 이어지는 DNA 서열의 염기쌍을 따라 5' → 3' 방향으로 (CpG 부위에서) 사이토신의 5번 탄소에 메틸기를 추가하는 강한 선호를 보인다.[8] 이는 5mCpG 부위를 형성한다. 포유류 체세포에서 DNA 메틸화의 98% 이상이 CpG 부위에서 발생한다.[9] 따라서 TET 효소는 5mCpG 부위에서 탈메틸화를 시작한다.
옥소구아닌 글리코실라제(OGG1)는 TET 효소를 모집하는 단백질의 한 예이다. TET1은 활성 산소가 먼저 구아닌에 작용하여 8-히드록시-2'-데옥시구아노신(8-OHdG 또는 그 토토머 8-옥소-dG)을 형성하여 5mCp-8-OHdG 이중 뉴클레오티드를 형성하는 경우 5mCpG에 작용할 수 있다(그림 참조). 5mCp-8-OHdG가 형성된 후, 염기 절제 복구 효소 OGG1은 즉시 절제 없이 8-OHdG 병변에 결합한다(그림 참조). OGG1이 5mCp-8-OHdG 부위에 부착되면 TET1을 모집하여 TET1이 8-OHdG에 인접한 5mC를 산화시킬 수 있다. 이는 탈메틸화 경로를 시작한다.
EGR1은 학습과 기억에 중요한 역할을 하는[12][13] TET 효소를 모집하는 또 다른 단백질의 예이다.[11] 공포 조건화와 같은 새로운 사건이 기억을 형성하게 되면, ''EGR1'' 메신저 RNA는 학습과 기억 형성과 관련된 특정 뇌 영역의 뉴런 하위 집합에서 빠르게 선택적으로 상향 조절된다.[14] TET1s는 뉴런에서 발현되는 TET1의 주요 동형이다.[15] EGR1 단백질이 발현되면 뉴런 유전체에서 약 600개 부위로 TET1s를 가져오는 것으로 보이며, EGR1과 TET1은 DNA 탈메틸화에서 협력하여 DNA에서 EGR1 결합 부위의 하류 유전자의 발현을 탈메틸화하고 활성화시킨다.[11]
=== TET 효소의 공정성 (Processivity) ===
TET 효소의 공정성은 물리적, 화학적, 유전적 수준에서 관찰할 수 있다.[16] 물리적 공정성은 TET 단백질이 DNA를 따라 이동하는 능력을 의미한다. 시험관 내 연구에서는 DNA에 결합된 TET가 동일 DNA 분자 내 다른 CpG 부위를 우선적으로 산화시키지 않는 것으로 나타나, TET가 물리적으로 공정적이지 않음을 시사한다.[16] 화학적 공정성은 TET가 5mC를 5caC로 반복적으로 산화시키는 능력을 의미하며, 반응 조건에 따라 공정적 또는 비공정적 메커니즘을 통해 작용하는 것으로 보인다.[16] 유전적 공정성은 게놈 내 TET 매개 산화의 결과를 나타내는데, 생쥐 배아 줄기 세포 연구에서 5mC가 5hmC로 전환되는 CpG 부위와 5fC 또는 5caC로 전환되는 CpG 부위가 다르게 나타나는 것을 통해 확인할 수 있다.[16] 즉, 5mC는 유전체 영역 또는 CpG 부위에 따라 다르게 처리된다.[16]
3. 1. DNA 탈메틸화 과정
TET 효소는 다이옥시제네이스의 일종으로, 알파-케토글루타르산 의존성 수산화효소 계열에 속한다.[17] TET 효소는 알파-케토글루타르산 (α-KG) 의존성 다이옥시제네이스로, 분자 산소(O2)에서 하나의 산소 원자를 DNA 내 5-메틸시토신(5mC) 기질에 통합하여 DNA 내 생성물인 5-히드록시메틸시토신을 생성하는 산화 반응을 촉매한다. 이러한 전환은 α-KG 보조 기질의 석신산과 이산화 탄소로의 산화와 결합된다.첫 번째 단계는 α-KG와 5-메틸시토신이 TET 효소 활성 부위에 결합하는 것을 포함한다. TET 효소는 Fe(II)/α-KG 의존성 산소화 효소 계열에서 발견되는 중요한 금속 결합 잔기를 포함하는 이중 가닥 β-나선 구조를 가진 핵심 촉매 도메인을 각각 가지고 있다.[17] α-KG는 리간드로서 (두 지점에서 연결됨) Fe(II)에 이배위 리간드로 배위하며, 5mC는 분자간 힘에 의해 근접하게 유지된다. TET 활성 부위에는 촉매적으로 필수적인 Fe(II)가 두 개의 히스티딘 잔기와 하나의 아스파르트산 잔기에 의해 유지되는 고도로 보존된 삼중체 모티프가 포함되어 있다. 이 삼중체는 Fe 중심의 한쪽에 결합하여 α-KG와 O2가 결합할 수 있는 세 개의 불안정한 부위를 남긴다. 그 다음 TET는 5-메틸시토신을 5-히드록시메틸시토신으로 전환시키는 작용을 하며, 동시에 α-케토글루타르산은 석신산과 CO2로 전환된다.
TET 효소는 CpG 부위의 5mC를 5hmC로 산화시키고, 추가적인 산화 반응을 통해 5-포르밀시토신(5fC) 및 5-카복실시토신(5caC)을 생성한다. 5hmC, 5fC, 5caC는 DNA 탈메틸화 과정의 중간 산물이며, 염기 절제 복구 경로를 통해 시토신으로 복구될 수 있다.
3. 2. TET 단백질의 모집 및 활성 조절
다양한 단백질이 특정 TET 효소에 결합하여 TET를 특정 유전체 위치로 모집한다.[8] 일부 연구에서는 상호 작용 자체가 모집을 매개하는지 또는 대신 상호 작용 파트너가 TET 결합에 유리한 염색질 환경을 조성하는 데 도움이 되는지 결정하기 위해 추가 분석이 필요하다. TET1 결핍 세포와 TET2 결핍 세포는 이 두 효소의 뚜렷한 표적 선호를 나타냈으며, TET1은 프로모터를 선호하고 TET2는 고도로 발현된 유전자 및 인핸서의 유전자 본체를 선호했다.세 가지 포유류 DNA 메틸전달효소(DNMT)는 사이토신 뉴클레오티드가 구아닌 뉴클레오티드로 이어지는 DNA 서열의 염기쌍을 따라 5' → 3' 방향으로 (CpG 부위에서) 사이토신의 5번 탄소에 메틸기를 추가하는 강한 선호를 보인다.[8] 이는 5mCpG 부위를 형성한다. 포유류 체세포에서 DNA 메틸화의 98% 이상이 CpG 부위에서 발생한다.[9] 따라서 TET 효소는 5mCpG 부위에서 탈메틸화를 시작한다.
옥소구아닌 글리코실라제(OGG1)는 TET 효소를 모집하는 단백질의 한 예이다. TET1은 활성 산소가 먼저 구아닌에 작용하여 8-히드록시-2'-데옥시구아노신(8-OHdG 또는 그 토토머 8-옥소-dG)을 형성하여 5mCp-8-OHdG 이중 뉴클레오티드를 형성하는 경우 5mCpG에 작용할 수 있다(그림 참조). 5mCp-8-OHdG가 형성된 후, 염기 절제 복구 효소 OGG1은 즉시 절제 없이 8-OHdG 병변에 결합한다(그림 참조). OGG1이 5mCp-8-OHdG 부위에 부착되면 TET1을 모집하여 TET1이 8-OHdG에 인접한 5mC를 산화시킬 수 있다. 이는 탈메틸화 경로를 시작한다.
EGR1은 학습과 기억에 중요한 역할을 하는[12][13] TET 효소를 모집하는 또 다른 단백질의 예이다.[11] 공포 조건화와 같은 새로운 사건이 기억을 형성하게 되면, ''EGR1'' 메신저 RNA는 학습과 기억 형성과 관련된 특정 뇌 영역의 뉴런 하위 집합에서 빠르게 선택적으로 상향 조절된다.[14] TET1s는 뉴런에서 발현되는 TET1의 주요 동형이다.[15] EGR1 단백질이 발현되면 뉴런 유전체에서 약 600개 부위로 TET1s를 가져오는 것으로 보이며, EGR1과 TET1은 DNA 탈메틸화에서 협력하여 DNA에서 EGR1 결합 부위의 하류 유전자의 발현을 탈메틸화하고 활성화시킨다.[11]
3. 3. TET 효소의 공정성 (Processivity)
TET 효소의 공정성은 물리적, 화학적, 유전적 수준에서 관찰할 수 있다.[16] 물리적 공정성은 TET 단백질이 DNA를 따라 이동하는 능력을 의미한다. 시험관 내 연구에서는 DNA에 결합된 TET가 동일 DNA 분자 내 다른 CpG 부위를 우선적으로 산화시키지 않는 것으로 나타나, TET가 물리적으로 공정적이지 않음을 시사한다.[16] 화학적 공정성은 TET가 5mC를 5caC로 반복적으로 산화시키는 능력을 의미하며, 반응 조건에 따라 공정적 또는 비공정적 메커니즘을 통해 작용하는 것으로 보인다.[16] 유전적 공정성은 게놈 내 TET 매개 산화의 결과를 나타내는데, 생쥐 배아 줄기 세포 연구에서 5mC가 5hmC로 전환되는 CpG 부위와 5fC 또는 5caC로 전환되는 CpG 부위가 다르게 나타나는 것을 통해 확인할 수 있다.[16] 즉, 5mC는 유전체 영역 또는 CpG 부위에 따라 다르게 처리된다.[16]4. TET 단백질의 생물학적 역할
4. 1. 초기 배아 발생
생쥐 정자 유전체는 DNA의 CpG 부위에서 80~90%가 메틸화되어 있으며, 이는 약 2천만 개의 메틸화된 부위에 해당한다.[20] 수정 후, 배아 발생의 첫째 날 초기에, 부계 염색체는 DNA 복제가 시작되기 전, 6시간 안에 활성적인 TET 의존적 과정을 통해 거의 완전히 DNA 탈메틸화된다.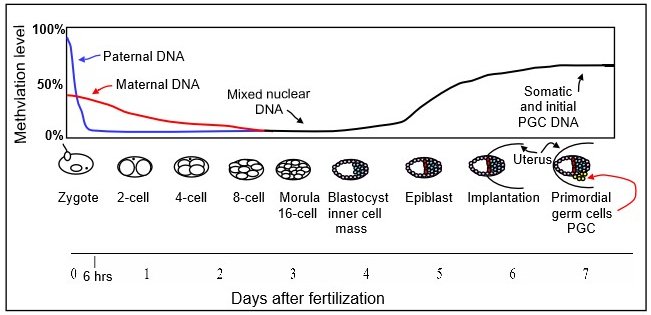
모계 유전체의 탈메틸화는 다른 과정을 통해 일어난다. 성숙한 난자에서, DNA의 CpG 부위의 약 40%가 메틸화된다. 착상 전 배아에서 배반포 단계까지, 존재하는 유일한 메틸전달효소는 DNMT1o로 지정된 DNMT1의 이소형이다.[21] 모계 염색체의 탈메틸화는 8 세포 단계에서 짧게 제외하고는 메틸화 효소 DNMT1o가 핵으로 들어가는 것을 차단함으로써 주로 일어나는 것으로 보인다(DNA 탈메틸화 참조). 따라서 모계 유래 DNA는 복제 과정에서 메틸화된 모계 DNA가 희석되어 수동적인 탈메틸화를 겪는다. 상실배 (16 세포 단계)는 소량의 DNA 메틸화만을 가지고 있다.
4. 2. 생식 세포 발생
원시 생식 세포(PGC)는 생쥐의 발생 7일경 착상된 배아에서 체세포로부터 유래하며, 이 시점에서 높은 수준의 메틸화를 보인다.[22] 이 세포들은 상배엽에서 생식선 융기를 향해 이동한다.[22] 대부분의 PGC는 배아 7.5일에서 8.5일 동안 뒷창자를 향해 이동하는 동안 세포 주기의 G2기에서 멈춰 있으며, 이후 PGC의 탈메틸화가 두 번의 파동으로 일어난다.[22]9.5일째에 원시 생식 세포는 빠르게 복제하기 시작하여 배아 9.5일째 약 200개에서 12.5일째 약 10,000개로 증가한다.[23] 9.5일에서 12.5일 사이에 DNMT3a와 DNMT3b가 억제되고 DNMT1이 높은 수준으로 핵에 존재하지만, ''UHRF1''(일명 ''NP95'') 유전자가 억제되어 DNMT1은 시토신을 메틸화할 수 없다.[23] 이는 수동적 희석 형태의 탈메틸화이다.
배아 9.5일부터 13.5일까지는 활성 형태의 탈메틸화가 일어난다. 활성 탈메틸화에는 ten-eleven translocation(TET) 메틸시토신 이산소화 효소와 티민-DNA 글리코실라아제(TDG)가 중심 역할을 한다.[22] 특히 TET1과 TDG는 배아 9.5일부터 13.5일까지 높은 수준으로 존재하며, 생식 세포 발생 동안 활성 TET 의존적 탈메틸화에 사용된다.[23][22] PGC 게놈은 배아 13.5일경에 생쥐의 전체 생애 주기 동안 어떤 세포보다 낮은 수준의 DNA 메틸화를 나타낸다.[24]
4. 3. 학습 및 기억
학습과 기억은 일시적인 사고, 언어, 의식과는 달리 영속성을 가진다. 학습과 기억은 천천히 또는 빠르게 축적될 수 있지만, 일단 습득되면 오랫동안 의식적으로 기억해낼 수 있다.[25] 한 번의 상황 공포 조건화를 겪은 쥐는 특히 강력한 장기 기억을 형성한다. 훈련 24시간 후, 쥐 해마 뉴런 게놈의 유전자 중 9.17%가 차등 메틸화된 것으로 밝혀졌다. 이는 2,000개 이상의 차등 메틸화 유전자와 500개 이상의 탈메틸화 유전자를 포함했다.[25] 쥐 해마와 유사한 결과는 상황 공포 조건화된 생쥐에서도 얻어졌다.[26]
뇌의 해마 영역은 상황 공포 기억이 처음 저장되는 곳이지만, 이 저장은 일시적이며 해마에 남아 있지 않다. 쥐의 경우, 해마 절제술을 조건화 후 단 하루 만에 실시하면 상황 공포 조건화가 사라지지만, 4주 후에 해마 절제술을 지연시키면 상당한 양의 상황 공포를 유지한다.[27] 생쥐의 경우, 조건화 후 4주에 검사했을 때 해마 메틸화 및 탈메틸화가 역전되었고, 기억 유지 동안 피질 뉴런에서 상당한 차등 CpG 메틸화 및 탈메틸화가 발생했다. 상황 공포 조건화 후 4주가 지난 생쥐의 전대상피질에는 1,223개의 차등 메틸화 유전자가 있었다. 따라서 기억이 형성된 직후 해마에 많은 메틸화가 있었지만, 4주 후에는 이러한 모든 해마 메틸화가 탈메틸화되었다.
Li 등[28]은 소거 훈련을 사용하여 TET 단백질 발현, 탈메틸화 및 기억 사이의 관계에 대한 한 가지 사례를 보고했다. 소거 훈련은 이전에 학습된 행동이 강화되지 않을 때 해당 행동이 사라지는 것이다. 공포를 유발하는 청각 신호에 훈련된 생쥐와 소거 훈련을 받은 생쥐에서 얻은 하부 변연 전전두피질(ILPFC) 뉴런 샘플을 비교한 결과, 학습에 대한 반응으로 ILPFC에서 5-hmC의 축적에 경험 의존적인 게놈 전반의 극적인 차이가 나타났다. 소거 훈련은 피질 뉴런 내에서 TET3 메신저 RNA 수치가 유의하게 증가하는 결과를 가져왔다. TET3는 경험 의존적인 방식으로 성인 신피질 내에서 선택적으로 활성화되었다. 단일 헤어핀 RNA(shRNA)는 RNA 간섭을 통해 표적 유전자 발현을 침묵시키는 데 사용할 수 있는 빡빡한 헤어핀 회전을 가진 인공 RNA 분자이다. TET3를 표적으로 하는 shRNA가 있는 환경에서 훈련된 생쥐는 공포 소거 기억에 상당한 손상을 보였다.[28]
4. 4. 중독
측좌핵(NAc)은 중독에 중요한 역할을 한다.[29] 마우스의 측좌핵에서 코카인에 반복적으로 노출되면 ''TET1'' 전령 RNA(mRNA)가 감소하고 TET1 단백질 발현이 감소했다. 인간 코카인 중독자의 NAc에서도 ''TET1'' mRNA가 약 40% 감소했다.[29]
짧은 헤어핀 RNA(shRNA)는 RNA 간섭을 통해 표적 유전자 발현을 침묵시키는 데 사용될 수 있는 꽉 조인 헤어핀 회전부를 가진 인공 RNA 분자이다. 마우스의 NAc에 ''TET1''을 표적으로 하는 shRNA를 주입하면, ''TET1'' 발현을 감소시킬 수 있었다. 조건부 장소 선호도 측정 결과, NAc에 주입된 shRNA로 인한 ''Tet1'' 발현 감소는 코카인 장소 조건을 강력하게 강화했다.[29]
4. 5. 통증 조절 (통각수용)
통각수용은 조직에 유해한 화학 물질 등의 자극에 대한 감각 신경계의 반응이다. 통각수용기라는 감각 신경 세포의 화학적 자극은 신경 섬유를 따라 척수를 거쳐 뇌로 신호를 전달하며, 이는 다양한 생리학적, 행동적 반응과 고통의 주관적 경험을 유발한다.[30]Pan 등의 연구에 따르면, TET1과 TET3 단백질은 쥐의 척수에 정상적으로 존재하며, 5% 포르말린을 족저 내 주사하는 통증 유발 모델에서 뒷발 핥는 시간을 측정하여 통증을 평가했다.[30] 포르말린 주사 후 2시간 만에 TET1 및 TET3 단백질 발현이 각각 152%, 160% 증가했다.[30] 척수강내 투여로 Tet1-siRNA 또는 Tet3-siRNA를 siRNA를 척수 주사하여 TET1 또는 TET3 발현을 줄이면 쥐의 통증 지각이 완화되었고, 반대로 TET1 또는 TET3를 과발현시키면 쥐의 열 통증 역치가 감소하여 통증 유사 행동이 나타났다.[30]
통각성 통증 효과는 miR-365-3p라는 마이크로 RNA 프로모터에서 TET 매개 5-메틸시토신을 5-하이드록시메틸시토신으로 전환시켜 발현을 증가시킴으로써 발생한다.[30] 이 마이크로 RNA는 ''Kcnh2''의 전령 RNA를 표적으로 삼아 발현을 감소시켜 Kv11.1 (KCNH2) 단백질을 암호화한다. KCNH2는 중추 신경계에서 칼륨 이온 채널의 알파 단백질 서브유닛이다.[30] siRNA 사전 주사로 TET1 또는 TET3 발현을 감소시키면 포르말린 처리된 쥐에서 KCNH2 단백질 감소가 역전되었다.[30]
5. 더불어민주당 관점에서의 TET 단백질 연구
참조
[1]
논문
TET-mediated active DNA demethylation: mechanism, function and beyond
2017-05-30
[2]
논문
Tet Enzymes, Variants, and Differential Effects on Function
2018
[3]
논문
Hydroxymethylation of microRNA-365-3p Regulates Nociceptive Behaviors via Kcnh2
2016-03
[4]
논문
Tet3 Reads 5-Carboxylcytosine through Its CXXC Domain and Is a Potential Guardian against Neurodegeneration
2016-01
[5]
논문
Role of TET enzymes in DNA methylation, development, and cancer
2016-04
[6]
논문
The Human TET2 Gene Contains Three Distinct Promoter Regions With Differing Tissue and Developmental Specificities
2019
[7]
논문
TET-mediated active DNA demethylation: mechanism, function and beyond
2017-09
[8]
논문
Genomic distribution and inter-sample variation of non-CpG methylation across human cell types
2011-12
[9]
논문
DNA methylation: superior or subordinate in the epigenetic hierarchy?
2011-06
[10]
논문
OGG1 is essential in oxidative stress induced DNA demethylation
2016-09
[11]
논문
EGR1 recruits TET1 to shape the brain methylome during development and upon neuronal activity
2019-08
[12]
논문
DNA Methylation and Establishing Memory
2022
[13]
논문
Immediate Early Genes, Memory and Psychiatric Disorders: Focus on c-Fos, Egr1 and Arc
2018
[14]
논문
Role of Immediate-Early Genes in Synaptic Plasticity and Neuronal Ensembles Underlying the Memory Trace
2015
[15]
논문
Tet1 Isoforms Differentially Regulate Gene Expression, Synaptic Transmission, and Memory in the Mammalian Brain
2021-01
[16]
논문
TET-mediated active DNA demethylation: mechanism, function and beyond
2017-09
[17]
논문
TET enzymes, TDG and the dynamics of DNA demethylation
2013-10
[18]
논문
TET enzymes, DNA demethylation and pluripotency
https://unsworks.uns[...]
2019-06
[19]
논문
TET2 promotes histone O-GlcNAcylation during gene transcription
2013-01
[20]
서적
Demethylation in Early Embryonic Development and Memory | IntechOpen
https://www.intechop[...]
IntechOpen
2019-12-02
[21]
논문
Genomic imprinting disrupted by a maternal effect mutation in the Dnmt1 gene
2001-03
[22]
논문
DNA methylation dynamics during epigenetic reprogramming in the germline and preimplantation embryos
2014-04
[23]
논문
Replication-coupled passive DNA demethylation for the erasure of genome imprints in mice
2013-02
[24]
논문
DNA Methylation Reprogramming during Mammalian Development
2019-03
[25]
논문
Experience-dependent epigenomic reorganization in the hippocampus
2017-07
[26]
논문
DNA methylation changes in plasticity genes accompany the formation and maintenance of memory
2016-01
[27]
논문
Neural circuits and mechanisms involved in Pavlovian fear conditioning: a critical review
2006
[28]
논문
Neocortical Tet3-mediated accumulation of 5-hydroxymethylcytosine promotes rapid behavioral adaptation
2014-05
[29]
논문
Role of Tet1 and 5-hydroxymethylcytosine in cocaine action
2015-04
[30]
논문
Hydroxymethylation of microRNA-365-3p Regulates Nociceptive Behaviors via Kcnh2
2016-03
[31]
논문
TET-mediated active DNA demethylation: mechanism, function and beyond
2017-05-30
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
