고리형 다이-아데노신 일인산
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
고리형 다이-아데노신 일인산(c-di-AMP)은 박테리아에서 발견되는 신호 전달 뉴클레오타이드로, 다이아데닐산 시클라제(DAC) 효소에 의해 합성된다. c-di-AMP는 포스포다이에스터레이스(PDE) 효소에 의해 분해되며, 합성 및 분해 효소의 농도 조절을 통해 그 수준이 조절된다. c-di-AMP는 세포벽 손상 항생제에 대한 내성을 증가시키고 세포 팽압을 감소시키는 등 다양한 생리적 기능을 조절하며, 지방산 합성, 세포 용해 및 RNA 합성에 관여한다. 진핵 세포에서는 STING 경로를 활성화하여 I형 인터페론 반응을 유도하고 바이러스 감염에 대한 방어 기전을 활성화한다.
더 읽어볼만한 페이지
- 고리형 뉴클레오타이드 - 고리형 아데노신 일인산
고리형 아데노신 일인산(cAMP)은 2차 신호전달자로서 세포 외부 신호를 세포 내부로 전달하며, 아데닐산 고리화효소에 의해 ATP로부터 합성되고 포스포다이에스터레이스에 의해 AMP로 분해되며, 단백질 인산화 효소 A(PKA)를 활성화하여 다양한 생화학적 과정, 특히 글리코겐, 당, 지질 대사를 조절한다. - 고리형 뉴클레오타이드 - 고리형 구아노신 일인산
고리형 구아노신 일인산(cGMP)은 세포 내 신호 전달에 관여하는 고리형 뉴클레오타이드로, 구아닐산 시클라제에 의해 합성되어 이온 채널, 글리코젠 분해, 세포 자멸사, 혈소판 억제, 혈관 확장 및 시각 광수용 과정에 관여하며, 다양한 질병과 관련되어 있고 포스포다이에스터레이스에 의해 분해된다. - 뉴클레오타이드 - 아데노신 삼인산
아데노신 삼인산(ATP)은 아데닌, 리보스, 세 개의 인산기로 구성된 뉴클레오티드로서, 고에너지 인산 결합의 가수분해를 통해 에너지를 방출하여 세포 과정에 사용되는 생명체의 주요 에너지 저장 및 전달 분자이며, 다양한 대사 경로를 통해 생성 및 재생될 뿐만 아니라 세포 신호 전달과 DNA 및 RNA 합성에도 필수적인 역할을 한다. - 뉴클레오타이드 - 폴리뉴클레오타이드
폴리뉴클레오타이드는 DNA와 RNA를 구성하는 뉴클레오타이드가 연결된 고분자이며, 생물체의 게놈을 구성하고 생화학 실험, 의학 및 미용 분야에서 활용된다.
| 고리형 다이-아데노신 일인산 - [화학 물질]에 관한 문서 | |
|---|---|
| 일반 정보 | |
 | |
| IUPAC 이름 | (1S,6R,8R,9R,10S,15R,17R,18R)-8,17-비스(6-아미노퓨린-9-일)-3,12-다이하이드록시-3,12-다이옥소-2,4,7,11,13,16-헥사옥사-3λ5,12λ5-다이포스파트라이사이클로[13.3.0.06,10]옥타데케인-9,18-다이올 |
| 다른 이름 | 3',5'-고리형 다이-AMP c-di-AMP c-di-아데노신 일인산 |
| 식별 정보 | |
| CAS 등록번호 | 54447-84-6 |
| UNII | WH9B66EIX2 |
| PubChem | 11158091 |
| ChEBI | 71578 |
| ChemSpider ID | 9333199 |
| SMILES | C1[C@@H]2[C@H]([C@H]([C@@H](O2)N3C=NC4=C(N=CN=C43)N)O)OP(=O)(OC[C@@H]5[C@H]([C@H]([C@@H](O5)N6C=NC7=C(N=CN=C76)N)O)OP(=O)(O1)O)O |
| InChI | 1S/C20H24N10O12P2/c21-15-9-17(25-3-23-15)29(5-27-9)19-11(31)13-7(39-19)1-37-43(33,34)42-14-8(2-38-44(35,36)41-13)40-20(12(14)32)30-6-28-10-16(22)24-4-26-18(10)30/h3-8,11-14,19-20,31-32H,1-2H2,(H,33,34)(H,35,36)(H2,21,23,25)(H2,22,24,26)/t7-,8-,11-,12-,13-,14-,19-,20-/m1/s1 |
| InChIKey | PDXMFTWFFKBFIN-XPWFQUROSA-N |
| 속성 | |
| 분자식 | C20H24N10O12P2 |
| 외관 | 해당 없음 |
| 밀도 | 해당 없음 |
| 녹는점 | 해당 없음 |
| 끓는점 | 해당 없음 |
| 용해도 | 해당 없음 |
| 위험성 | |
| 주요 위험 | 해당 없음 |
| 인화점 | 해당 없음 |
| 자동 발화점 | 해당 없음 |
2. 합성
c-di-AMP는 막 결합형 다이아데닐산 시클라제(DacA) 효소에 의해 합성된다. DacA는 두 개의 ATP 분자를 축합하여 c-di-AMP를 생성하며, 이 과정에서 두 개의 피로인산염이 방출된다.[5][6] DacA는 망간 또는 코발트 금속 이온 보조 인자를 필요로 한다.[7] 대부분의 박테리아는 하나의 DAC 효소만 가지고 있지만, 바실루스 서브틸리스와 같은 일부 박테리아는 DisA 및 CdaS의 두 가지 추가 DAC 효소를 가지고 있다.[2]
포스포다이에스터레이스(PDE) 효소는 고리형 다이-AMP를 선형 분자인 5'-pApA (phospho-adenylyl adenosine|포스포-아데닐릴 아데노신영어)로 분해한다. 5'-pApA는 GdpP 유전자 의존적 c-di-AMP 가수분해를 제한하는 피드백 억제 루프에 관여한다.[8]
고리형 다이-AMP는 신호 전달 뉴클레오타이드이므로, 그 농도는 환경 변화를 감지하는 합성 또는 분해 효소에 의해 조절된다.[9] c-di-AMP의 조절은 중요한데, 높은 c-di-AMP 수치는 비정상적인 생리 현상, 성장 결함, 감염 시 독성 감소로 이어지기 때문이다.[9] 일부 박테리아에서는 c-di-AMP를 분해하는 포스포다이에스터라아제의 손실이 세포 사멸을 초래한다.[9][10][11]
락토코커스 락티스에서 GImM I154F 돌연변이는 c-di-AMP 합성을 억제한다. GImM은 c-di-AMP 수준을 조절하는 인산 글루코사민 뮤테이즈 효소이다.[4]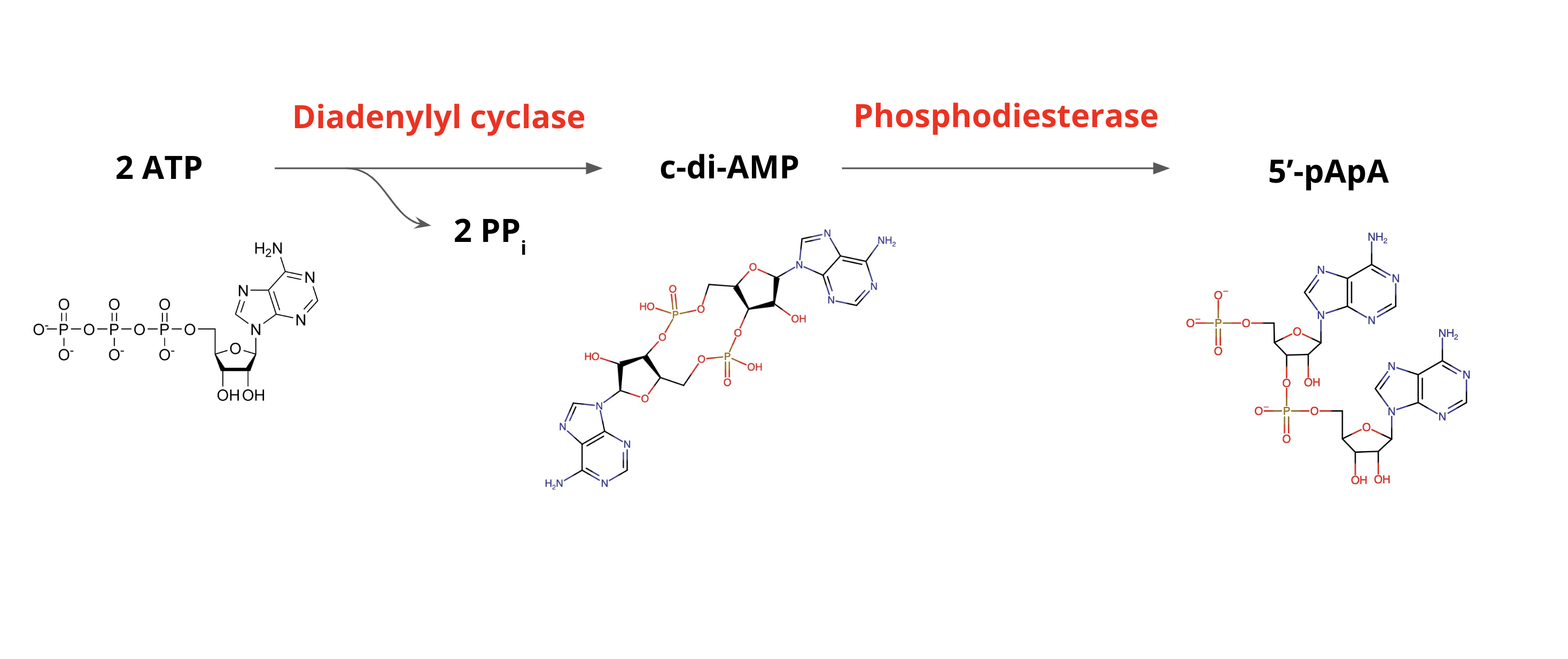
3. 분해
4. 조절
세포 내 c-di-AMP 수치는 효소 조절 외에도, 세포질에서 c-di-AMP를 분비하는 다약제 내성 수송체를 통해 능동적으로 수송되어 조절될 수 있다. 리스테리아 모노사이토제네스에서 이러한 효과가 관찰되었다.[9]
고농도 c-di-AMP는 수용체 및 표적 단백질에 결합하여 특정 경로를 제어한다. c-di-AMP 수치 증가는 β-락탐 등 세포벽 손상 항생제에 대한 내성 증가 및 세포 팽압 감소와 관련이 있다.[12][13]
4. 1. 지방산 합성 조절
c-di-AMP는 Mycobacterium smegmatis의 지방산 생합성 조절에 관여한다.[14] 저칼륨 조건에서 황색포도상구균 성장에 영향을 미치며,[15] 고초균의 DNA 완전성 감지에도 관여한다.[16]
4. 2. 세포 용해 및 RNA 합성 조절
c-di-AMP는 세포 용해 조절에 관여하는 것으로 알려져 있다. 연구에 따르면 c-di-AMP 수치가 낮은 박테리아 돌연변이 균주는 모균주보다 훨씬 빠르게 용해되었다.[4][18]
c-di-AMP는 또한 박테리아 RNA 합성 억제와 관련이 있다. c-di-AMP는 박테리아 엄격 반응에 관여하는 알람호르몬 (p)ppGpp의 생성을 자극한다.[19]
4. 3. STING 경로 활성화 (진핵 세포)
진핵 세포에서 고리형 다이-아데노신 일인산(c-di-AMP)은 I형 인터페론(IFN) 반응을 유발하여 바이러스 감염에 대한 방어 기전을 활성화한다. 이러한 감지 및 활성화 경로는 STING, TBK1 및 IRF3을 포함한다.[20][21] c-di-AMP는 또한 수지상 세포를 자극하여 T 세포 활성화를 유도할 수 있다.[22]
c-di-AMP는 손상된 DNA를 감지하기 위해 선천 면역 경로 STING (인터페론 유전자 자극 물질)을 활성화한다. 이 뉴클레오타이드는 헬리케이즈 DDX41에 결합하여 STING 경로를 활성화하거나, STING 단백질에 직접 결합한다.[23] 고리형 다이-AMP는 (2’3’-cGAMP와 함께) STING 이합체의 닫힘을 유도하여 STING 중합 및 경로 활성화를 유도하는 리간드로 확인되었다.[24] I형 IFN 반응이 c-di-AMP에 대한 반응으로 유도되지 않으면 STING은 경로 활성화를 위해 소포체에서 세포질로 재배치될 수 없으며, 이는 c-di-AMP가 세포 내 전위를 통해 STING 중합 및 활성화에서 지배적인 리간드임을 시사한다.[24][25]
참조
[1]
논문
A bacterial cyclic dinucleotide activates the cytosolic surveillance pathway and mediates innate resistance to tuberculosis
2015-04
[2]
논문
Cyclic di-AMP: another second messenger enters the fray
2013-08
[3]
논문
Cyclic nucleotides in archaea: Cyclic di-AMP in the archaeon Haloferax volcanii and its putative role
2019-09
[4]
논문
Cyclic-di-AMP synthesis by the diadenylate cyclase CdaA is modulated by the peptidoglycan biosynthesis enzyme GlmM in Lactococcus lactis
2016-03
[5]
논문
Replenishing the cyclic-di-AMP pool: regulation of diadenylate cyclase activity in bacteria
2016-11
[6]
논문
Making and Breaking of an Essential Poison: the Cyclases and Phosphodiesterases That Produce and Degrade the Essential Second Messenger Cyclic di-AMP in Bacteria
2019-01
[7]
논문
Structural and biochemical analysis of the essential diadenylate cyclase CdaA from Listeria monocytogenes
2015-03
[8]
논문
New Insights into the Cyclic Di-adenosine Monophosphate (c-di-AMP) Degradation Pathway and the Requirement of the Cyclic Dinucleotide for Acid Stress Resistance in Staphylococcus aureus
2016-12
[9]
논문
Too much of a good thing: regulated depletion of c-di-AMP in the bacterial cytoplasm
2016-04
[10]
논문
An Essential Poison: Synthesis and Degradation of Cyclic Di-AMP in Bacillus subtilis
2015-10
[11]
논문
Mycoplasma pneumoniae
2017-07-13
[12]
논문
A Novel Phosphodiesterase of the GdpP Family Modulates Cyclic di-AMP Levels in Response to Cell Membrane Stress in Daptomycin-Resistant Enterococci
2017-03
[13]
논문
A Delicate Connection: c-di-AMP Affects Cell Integrity by Controlling Osmolyte Transport
2018-03
[14]
논문
DarR, a TetR-like transcriptional factor, is a cyclic di-AMP-responsive repressor in Mycobacterium smegmatis
2013-02
[15]
논문
Systematic identification of conserved bacterial c-di-AMP receptor proteins
2013-05
[16]
논문
Cyclic di-AMP homeostasis in bacillus subtilis: both lack and high level accumulation of the nucleotide are detrimental for cell growth
2013-01
[17]
논문
Analysis of the role of Bacillus subtilis σ(M) in β-lactam resistance reveals an essential role for c-di-AMP in peptidoglycan homeostasis
2012-02
[18]
논문
Cyclic di-AMP is critical for Listeria monocytogenes growth, cell wall homeostasis, and establishment of infection
2013-05
[19]
논문
Cross-talk between two nucleotide-signaling pathways in Staphylococcus aureus
2015-02
[20]
논문
MPYS is required for IFN response factor 3 activation and type I IFN production in the response of cultured phagocytes to bacterial second messengers cyclic-di-AMP and cyclic-di-GMP
2011-09
[21]
논문
STING is a direct innate immune sensor of cyclic di-GMP
2011-09
[22]
논문
The mucosal adjuvant cyclic di-AMP exerts immune stimulatory effects on dendritic cells and macrophages
2014-04-22
[23]
논문
The helicase DDX41 recognizes the bacterial secondary messengers cyclic di-GMP and cyclic di-AMP to activate a type I interferon immune response
2012-12
[24]
논문
STING Polymer Structure Reveals Mechanisms for Activation, Hyperactivation, and Inhibition
2019-07
[25]
논문
STING-dependent recognition of cyclic di-AMP mediates type I interferon responses during Chlamydia trachomatis infection
2013-04
[26]
논문
A bacterial cyclic dinucleotide activates the cytosolic surveillance pathway and mediates innate resistance to tuberculosis
2015-03-02
[27]
논문
Cyclic di-AMP: another second messenger enters the fray
2013-07-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com