네기시 반응
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
네기시 반응은 유기아연 화합물을 이용한 유기 화학 반응으로, 주로 아릴, 알케닐, 알키닐 유기아연 화합물과 유기할로겐화합물을 팔라듐 또는 니켈 촉매 하에서 반응시켜 탄소-탄소 결합을 형성하는 크로스 커플링 반응이다. 이 반응은 비대칭 2,2'-바이피리딘, 바이페닐, 헥사페로세닐벤젠 등 다양한 화합물 합성에 적용되며, 팔라듐과 니켈 촉매를 사용하는 두 가지 주요 메커니즘을 통해 진행된다. 네기시 반응은 산업적으로는 스즈키 반응이나 Heck 반응만큼 널리 사용되지는 않지만, 천연물 전합성에 유용하게 활용된다.
네기시 반응은 아연상의 유기기로는 아릴, 알케닐, 알키닐기 등이, 유기할로겐화합물로는 할로겐화아릴, 알케닐, 알릴 등이 주로 쓰인다.[58] 촉매로는 테트라키스(트리페닐포스핀)팔라듐(0) 등의 팔라듐 촉매가 주로 사용되지만,[58] 니켈 촉매도 사용 가능하다.
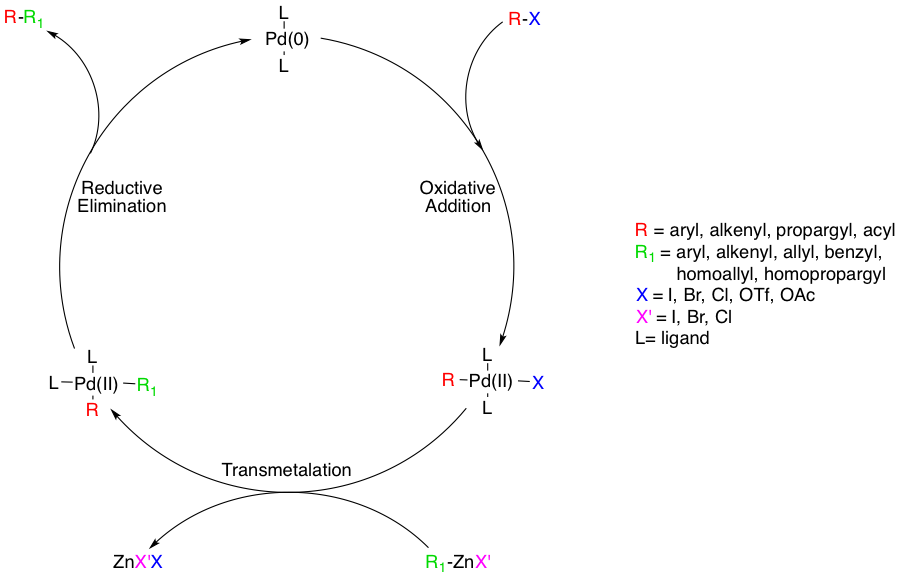
반응 기구는 팔라듐을 촉매로 하는 다른 크로스 커플링 반응과 동일하다. 먼저 유기할로겐화합물 R'-Y의 C-X 결합에 Pd(0)가 산화적 부가하여 R'-Pd(II)-Y가 되고, 이어서 유기아연화합물 R-ZnX와의 사이에 전이 금속화 반응에 따라 R'-Pd(II)-R이 생성된 후에 환원적 제거가 일어나 R-R'이 생성, 동시에 Pd(0)가 재생된다.[8]
2. 특징
유기아연화합물은 산화적 부가나 금속 교환을 통해 관능기를 갖는 것도 제조할 수 있어, 크로스 커플링 반응 중에서도 기질 적용 범위가 넓다. 또한, 유기아연화합물이 일정한 반응성을 가지므로 염기나 친핵체와 같은 첨가물이나 가열이 필요하지 않다는 특징이 있다.
네기시 반응은 다음과 같은 합성에 적용된 사례가 있다.
새로운 변형에서는 팔라듐이 할로케톤 ''2-클로로-2-페닐아세토페논''에 의해 산화된 후, 생성된 팔라듐 OPdCl 복합체가 유기아연 화합물과 유기주석 화합물을 모두 이중 전이금속화 반응을 통해 수용한다.[25]
400px
니켈 촉매 네기시 반응의 예로는 sp2-sp2, sp2-sp3, sp3-sp3 시스템이 있다. 네기시가 처음 연구한 시스템에서, 아릴-아릴 교차 결합은 Ni(acac)2를 PPh3와 (i-Bu)2AlH로 환원시켜 ''in situ''에서 생성된 Ni(PPh3)4에 의해 촉매되었다.[26]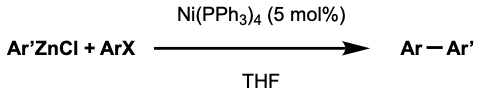
아릴과 알케닐 파트너의 교차 결합을 허용하도록 다양한 변형이 개발되었다. Knochel 등이 개발한 변형에서는 아릴 아연 브로마이드를 비닐 트리플레이트 및 비닐 할라이드와 반응시켰다.[27]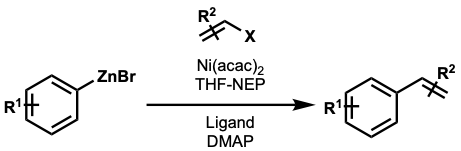
sp3-sp3 중심 간의 반응은 종종 더 어렵지만, 전자 인출 그룹이 있는 불포화 리간드를 보조 촉매로 첨가하면 일부 시스템에서 수율이 향상되었다. 불포화 리간드의 추가적인 배위는 β-수소 제거보다 환원성 제거를 선호하는 것으로 여겨진다.[28][29] 이것은 일부 알킬-아릴 시스템에서도 효과가 있다.[30]
여러 비대칭 변형이 존재하며, 많은 경우 Pybox 리간드를 사용한다.[31][32][33]
3. 반응 메커니즘
산화 첨가의 실제 메커니즘은 해결되지 않았지만, 두 가지 가능한 경로가 있다. 한 경로는 SN2 유사 메커니즘을 통해 진행되어 입체 화학이 반전되는 것으로 생각된다. 다른 경로는 협동 반응을 통해 진행되며 입체 화학을 유지한다. 첨가는 시스 형태이지만, Pd(II) 복합체는 빠르게 트랜스 형태로 이성질화된다.[10]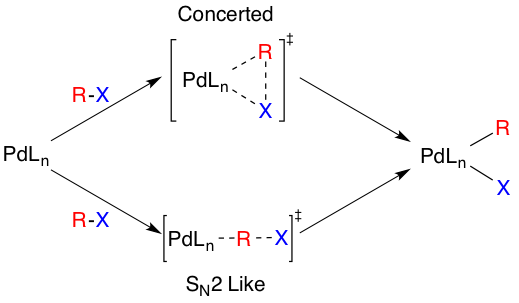

다음으로, 전이 금속화 단계가 발생하여 유기 아연 시약이 Pd(II) 복합체의 할라이드와 유기 치환체를 교환하여 트랜스 Pd(II) 복합체와 아연 할라이드 염을 생성한다. 유기 아연 기질은 아릴, 비닐, 알릴, 벤질, 호모알릴 또는 호모프로파길일 수 있다.[8] 전이 금속화는 일반적으로 속도 제한 단계이며, 이 단계에 대한 완전한 메커니즘적 이해는 아직 이루어지지 않았지만, 여러 연구를 통해 이 과정에 대한 단서가 제시되었다. 연구에 따르면 시스 및 트랜스 비스 알킬 유기 팔라듐 복합체 간에 경쟁적 평형이 존재하지만, 유일한 생산적인 중간체는 시스 복합체이다.[13][14]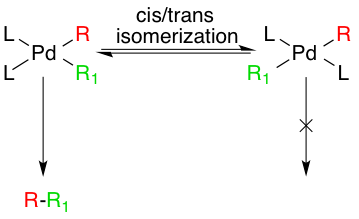
네기시 결합의 촉매 경로의 마지막 단계는 환원성 제거이며, 세 개의 배위 전이 상태를 통해 진행되어 결합된 유기 생성물을 생성하고 Pd(0) 촉매를 재생성하는 것으로 생각된다. 이 단계가 발생하려면 앞서 언급한 시스 알킬 유기 팔라듐 복합체가 형성되어야 한다.[15]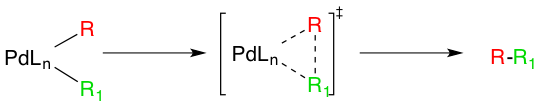
유기 아연 할라이드와 디유기 아연 화합물 모두 출발 물질로 사용할 수 있다. 한 모델 시스템에서 전이 금속화 단계에서 전자는 시스 부가물 R-Pd-R'를 생성하여 빠른 환원성 제거를 통해 생성물을 얻는 반면, 후자는 트랜스 부가물을 생성하여 먼저 느린 트랜스-시스 이성질화를 거쳐야 한다는 것을 발견했다.[13]
일반적인 부반응은 호모 결합이다. 한 네기시 모델 시스템에서 호모 결합 형성은 디아릴 금속 중간체와 아릴 금속 할라이드 간의 두 번째 전이 금속화 반응의 결과로 밝혀졌다.[16]
: Ar–Pd–Ar' + Ar'–Zn–X → Ar'–Pd–Ar' + Ar–Zn–X
: Ar'–Pd–Ar' → Ar'–Ar' + Pd(0) ''(호모 결합)''
: Ar–Zn–X + H2O → Ar–H + HO–Zn–X ''(탈할로겐화 반응 동반)''
니켈 촉매 시스템은 결합 파트너에 따라 다른 메커니즘으로 작동할 수 있다. 팔라듐(0) (Pd0) 또는 팔라듐(II) (PdII)만 포함하는 팔라듐 시스템과 달리, 니켈 촉매 시스템은 다양한 산화 상태의 니켈을 포함할 수 있다.[17] 두 시스템은 산화 첨가, 전이 금속화 및 환원성 제거와 유사한 기본 단계를 포함한다는 점에서 유사하다. 두 시스템 모두 β-수소화물 제거 및 알킬 친전자체의 어려운 산화 첨가 문제를 해결해야 한다.[18]
활성화되지 않은 알킬 친전자체의 경우, 가능한 메커니즘 중 하나는 먼저 전이 금속화 메커니즘이다. 이 메커니즘에서 알킬 아연 종은 먼저 니켈 촉매와 전이 금속화된다. 그런 다음 니켈은 알킬 할라이드에서 할라이드를 추출하여 알킬 라디칼을 생성하고 라디칼 첨가 후 니켈을 산화시킨다.[19]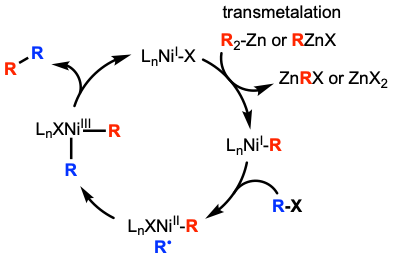
니켈 촉매 교차 결합의 메커니즘을 고려할 때 중요한 한 가지 요소는 NiIII 종으로부터는 환원성 제거가 용이하지만 NiII 종으로부터는 매우 어렵다는 것이다. Kochi와 Morrell은 NiII 복합체 Ni(PEt3)2(Me)(''o''-톨릴)을 분리하여 이에 대한 증거를 제시했는데, 이 복합체는 이 기본 단계에 관여할 만큼 충분히 빠르게 환원성 제거를 겪지 않았다.[20]
3. 1. 팔라듐 촉매 반응
반응 메커니즘은 팔라듐을 촉매로 하는 다른 크로스 커플링 반응과 동일하다. 먼저 유기할로겐화합물 R'-Y의 C-X 결합에 Pd(0)가 산화적 부가하여 R'-Pd(II)-Y가 되고, 이어서 유기아연화합물 R-ZnX와의 사이에 전이 금속화 반응에 따라 R'-Pd(II)-R이 생성된 후에 환원적 제거가 일어나 R-R'이 생성, 동시에 Pd(0)가 재생된다.[8]
산화 첨가의 실제 메커니즘은 해결되지 않았지만, 두 가지 가능한 경로가 있다. 한 경로는 SN2 유사 메커니즘을 통해 진행되어 입체 화학이 반전되는 것으로 생각된다. 다른 경로는 협동 반응을 통해 진행되며 입체 화학을 유지한다. 첨가는 시스 형태이지만, Pd(II) 복합체는 빠르게 트랜스 형태로 이성질화된다.[10]
다음으로, 전이 금속화 단계가 발생하여 유기 아연 시약이 Pd(II) 복합체의 할라이드와 유기 치환체를 교환하여 트랜스 Pd(II) 복합체와 아연 할라이드 염을 생성한다. 유기 아연 기질은 아릴, 비닐, 알릴, 벤질, 호모알릴 또는 호모프로파길일 수 있다.[8] 전이 금속화는 일반적으로 속도 제한 단계이며, 이 단계에 대한 완전한 메커니즘적 이해는 아직 이루어지지 않았지만, 여러 연구를 통해 이 과정에 대한 단서가 제시되었다. 연구에 따르면 시스 및 트랜스 비스 알킬 유기 팔라듐 복합체 간에 경쟁적 평형이 존재하지만, 유일한 생산적인 중간체는 시스 복합체이다.[13][14]
|300px|시스/트랜스 이성질화를 통한 활성 종 생성|centre]]
네기시 결합의 촉매 경로의 마지막 단계는 환원성 제거이며, 세 개의 배위 전이 상태를 통해 진행되어 결합된 유기 생성물을 생성하고 Pd(0) 촉매를 재생성하는 것으로 생각된다. 이 단계가 발생하려면 앞서 언급한 시스 알킬 유기 팔라듐 복합체가 형성되어야 한다.[15]
|450px|center|환원성 제거 메커니즘]]
유기 아연 할라이드와 디유기 아연 화합물 모두 출발 물질로 사용할 수 있다. 한 모델 시스템에서 전이 금속화 단계에서 전자는 시스 부가물 R-Pd-R'를 생성하여 빠른 환원성 제거를 통해 생성물을 얻는 반면, 후자는 트랜스 부가물을 생성하여 먼저 느린 트랜스-시스 이성질화를 거쳐야 한다는 것을 발견했다.[13]
일반적인 부반응은 호모 결합이다. 한 네기시 모델 시스템에서 호모 결합 형성은 디아릴 금속 중간체와 아릴 금속 할라이드 간의 두 번째 전이 금속화 반응의 결과로 밝혀졌다.[16]
: Ar–Pd–Ar' + Ar'–Zn–X → Ar'–Pd–Ar' + Ar–Zn–X
: Ar'–Pd–Ar' → Ar'–Ar' + Pd(0) ''(호모 결합)''
: Ar–Zn–X + H2O → Ar–H + HO–Zn–X ''(탈할로겐화 반응 동반)''
3. 2. 니켈 촉매 반응
반응 메커니즘은 표준 팔라듐(Pd) 촉매 교차 결합 경로를 통해 진행되며, 팔라듐(0) (Pd(0)) 종으로 시작하여 유기 할로겐화물 종을 포함하는 산화 첨가 단계에서 팔라듐(II) (Pd(II))로 산화된다.[8] 이 단계는 아릴, 비닐, 알키닐 및 아실 할라이드, 아세테이트 또는 트리플레이트와 함께 표준 산화 첨가 상대 속도(I>OTf>Br>>Cl)를 따르는 기질로 진행된다.[9]
산화 첨가의 실제 메커니즘은 해결되지 않았지만, 두 가지 가능한 경로가 있다. 한 경로는 SN2 유사 메커니즘을 통해 진행되어 입체 화학이 반전되는 것으로 생각된다. 다른 경로는 협동 반응을 통해 진행되며 입체 화학을 유지한다.
첨가는 시스 형태이지만, Pd(II) 복합체는 빠르게 트랜스 형태로 이성질화된다.[10]
다음으로, 전이 금속화 단계가 발생하여 유기 아연 시약이 Pd(II) 복합체의 할라이드와 유기 치환체를 교환하여 트랜스 Pd(II) 복합체와 아연 할라이드 염을 생성한다. 유기 아연 기질은 아릴, 비닐, 알릴, 벤질, 호모알릴 또는 호모프로파길일 수 있다.[8] 전이 금속화는 일반적으로 속도 제한 단계이며, 이 단계에 대한 완전한 메커니즘적 이해는 아직 이루어지지 않았지만, 여러 연구를 통해 이 과정에 대한 단서가 제시되었다. 알킬아연 종은 전이 금속화 전에 고차 아연산염 종을 형성하는 반면, 아릴아연 종은 그렇지 않다.[11] ZnXR과 ZnR2는 모두 반응성 시약으로 사용할 수 있으며, Zn은 네 개의 배위 복합체를 선호하는 것으로 알려져 있다.[12] 연구에 따르면 시스 및 트랜스 비스 알킬 유기 팔라듐 복합체 간에 경쟁적 평형이 존재하지만, 유일한 생산적인 중간체는 시스 복합체이다.[13][14]
네기시 결합의 촉매 경로의 마지막 단계는 환원성 제거이며, 세 개의 배위 전이 상태를 통해 진행되어 결합된 유기 생성물을 생성하고 Pd(0) 촉매를 재생성하는 것으로 생각된다. 이 단계가 발생하려면 앞서 언급한 시스 알킬 유기 팔라듐 복합체가 형성되어야 한다.[15]
유기 아연 할라이드와 디유기 아연 화합물 모두 출발 물질로 사용할 수 있다. 한 모델 시스템에서 전이 금속화 단계에서 전자는 시스 부가물 R-Pd-R'를 생성하여 빠른 환원성 제거를 통해 생성물을 얻는 반면, 후자는 트랜스 부가물을 생성하여 먼저 느린 트랜스-시스 이성질화를 거쳐야 한다는 것을 발견했다.[13]
일반적인 부반응은 호모 결합이다. 한 네기시 모델 시스템에서 호모 결합 형성은 디아릴 금속 중간체와 아릴 금속 할라이드 간의 두 번째 전이 금속화 반응의 결과로 밝혀졌다.[16]
: Ar–Pd–Ar' + Ar'–Zn–X → Ar'–Pd–Ar' + Ar–Zn–X
: Ar'–Pd–Ar' → Ar'–Ar' + Pd(0) ''(호모 결합)''
: Ar–Zn–X + H2O → Ar–H + HO–Zn–X ''(탈할로겐화 반응 동반)''
니켈 촉매 시스템은 결합 파트너에 따라 다른 메커니즘으로 작동할 수 있다. 팔라듐(0) (Pd0) 또는 팔라듐(II) (PdII)만 포함하는 팔라듐 시스템과 달리, 니켈 촉매 시스템은 다양한 산화 상태의 니켈을 포함할 수 있다.[17] 두 시스템은 산화 첨가, 전이 금속화 및 환원성 제거와 유사한 기본 단계를 포함한다는 점에서 유사하다. 두 시스템 모두 β-수소화물 제거 및 알킬 친전자체의 어려운 산화 첨가 문제를 해결해야 한다.[18]
활성화되지 않은 알킬 친전자체의 경우, 가능한 메커니즘 중 하나는 먼저 전이 금속화 메커니즘이다. 이 메커니즘에서 알킬 아연 종은 먼저 니켈 촉매와 전이 금속화된다. 그런 다음 니켈은 알킬 할라이드에서 할라이드를 추출하여 알킬 라디칼을 생성하고 라디칼 첨가 후 니켈을 산화시킨다.[19]
니켈 촉매 교차 결합의 메커니즘을 고려할 때 중요한 한 가지 요소는 NiIII 종으로부터는 환원성 제거가 용이하지만 NiII 종으로부터는 매우 어렵다는 것이다. Kochi와 Morrell은 NiII 복합체 Ni(PEt3)2(Me)(''o''-톨릴)을 분리하여 이에 대한 증거를 제시했는데, 이 복합체는 이 기본 단계에 관여할 만큼 충분히 빠르게 환원성 제거를 겪지 않았다.[20]
4. 반응 범위 (Scope)
2-브로모피리딘과 테트라키스(트리페닐포스핀)팔라듐(0)을 이용한 비대칭 2,2'-바이피리딘 합성,[21] ''o''-톨릴아연 클로라이드와 ''o''-아이오도톨루엔 및 테트라키스(트리페닐포스핀)팔라듐(0)을 이용한 바이페닐 합성,[22] 1-데킨과 (''Z'')-1-헥세닐 아이오다이드로부터 5,7-헥사데카디엔 합성에 적용되었다.[23]
네기시 반응은 헥사페로세닐벤젠의 합성에 적용되었다.[24] 헥사아이오도벤젠, 디페로세닐아연 및 트리스(디벤질리덴아세톤)디팔라듐(0)을 테트라하이드로푸란 내에서 반응시켰다. 수율은 4%에 불과하여 아릴 코어 주변의 상당한 혼잡성을 나타낸다.
새로운 변형에서 팔라듐은 먼저 할로케톤 ''2-클로로-2-페닐아세토페논'' '''1'''에 의해 산화되고, 생성된 팔라듐 OPdCl 복합체는 유기아연 화합물 '''2'''와 유기주석 화합물 '''3'''을 모두 이중 전이금속화 반응을 통해 수용한다.[25]
니켈 촉매 네기시 반응의 예로는 sp2-sp2, sp2-sp3, sp3-sp3 시스템이 있다. 네기시가 처음 연구한 시스템에서, 아릴-아릴 교차 결합은 Ni(acac)2를 PPh3와 (i-Bu)2AlH로 환원시켜 ''in situ''에서 생성된 Ni(PPh3)4에 의해 촉매되었다.[26] 아릴과 알케닐 파트너의 교차 결합을 허용하도록 다양한 변형이 개발되었다. Knochel 등이 개발한 변형에서는 아릴 아연 브로마이드를 비닐 트리플레이트 및 비닐 할라이드와 반응시켰다.[27]
sp3-sp3 중심 간의 반응은 종종 더 어렵지만, 전자 인출 그룹이 있는 불포화 리간드를 보조 촉매로 첨가하면 일부 시스템에서 수율이 향상되었다. 불포화 리간드의 추가적인 배위는 β-수소 제거보다 환원성 제거를 선호하는 것으로 여겨진다.[28][29] 이것은 일부 알킬-아릴 시스템에서도 효과가 있다.[30]
여러 비대칭 변형이 존재하며, 많은 경우 Pybox 리간드를 사용한다.[31][32][33]
4. 1. 예시
4. 2. 산업적 응용
네기시 반응은 스즈키 반응 및 Heck 반응만큼 산업 분야에서 자주 사용되지는 않는데, 이는 필요한 아릴 또는 알킬 아연 시약의 물과 공기에 대한 민감성 때문이다.[34][35] 2003년, 노바티스(Novartis)는 천식 치료를 위한 신약 후보 물질로 연구되던 포스포다이에스터레이스 4D형 억제제인 PDE472의 제조에 네기시 반응을 사용했다.[36] 네기시 반응은 스즈키 반응의 대안으로 사용되어, 원하는 벤조디옥사졸 합성 중간체의 수율을 4.5 kg 규모에서 73%로 개선했다.[37]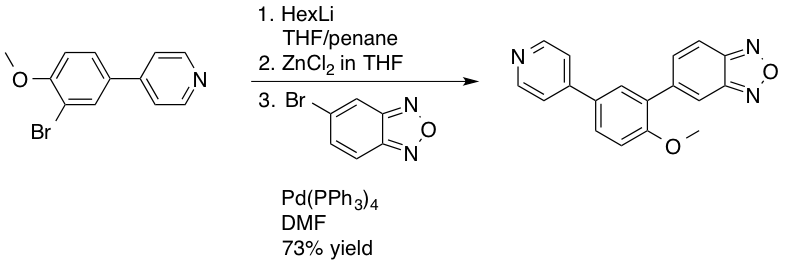
4. 3. 천연물 전합성 응용
네기시 반응은 물과 산소에 대한 민감성 때문에 산업 화학에서는 거의 사용되지 않지만, 천연물 전합성에 널리 사용된다.[8] 다른 교차 결합 반응에 비해 반응성이 증가하여 네기시 반응은 천연물 합성에서 복잡한 중간체를 결합하는 데 이상적이다.[8] 또한, 아연(Zn)은 스틸 반응에 사용되는 Sn과 같은 다른 금속보다 환경 친화적이다.[8] 네기시 반응의 주요 단점은 물과 산소에 대한 민감성 외에도 다른 교차 결합 반응에 비해 작용기에 대한 내성이 상대적으로 낮다는 것이다.[39](−)-스테모아미드는 ''Stemona tuberosa''의 뿌리 추출물에서 발견되는 천연물로, 일본과 중국 민간 의학에서 호흡기 질환 치료에 사용되었으며, (−)-스테모아미드는 구충제이기도 하다. 솜파이와 연구진은 중간 단계에서 β,γ-불포화 에스테르와 중간체 디엔을 결합하여 sp3-sp2 C-C 결합을 형성하는 네기시 반응을 통해 (−)-스테모아미드를 합성했다.[40]
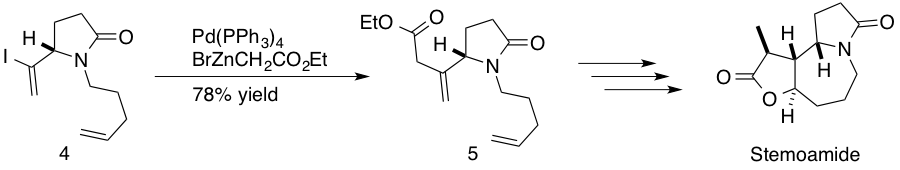
키바야시와 연구진은 푸밀리오톡신 B의 전체 합성에 네기시 반응을 활용했다. 푸밀리오톡신 B는 파나마 독 개구리인 Dendrobates pumilio에서 분리된 주요 독성 알칼로이드 중 하나로, 전압 의존성 나트륨 채널에 조절 효과를 나타내어 강심성 및 근긴장성 활성을 나타낸다.[41] 키바야시는 합성 후반 단계에서 네기시 반응을 사용하여 아연 알킬리덴 인돌리지딘과 (E)-비닐 요오드화물을 결합했다.[42]
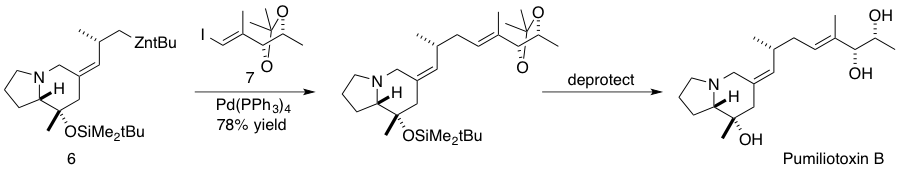
식물 Chrysochlamys ulei에서 분리된 δ-트랜스-토코트리에놀산은 DNA 중합 효소 β(pol β)를 억제하는 것으로 나타난 천연물이다. 헤흐트와 맬로니는 sp3 호모프로파길 아연 시약과 sp2 비닐 요오드화물을 결합하는 네기시 반응을 통해 δ-트랜스-토코트리에놀산을 합성했다.[43]
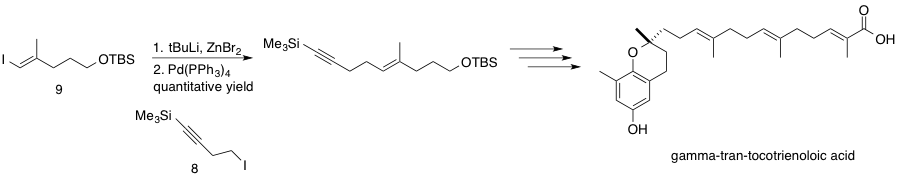
스미스와 푸는 이차 친핵체와 이차 알킬 친전자체의 결합 방법을 사용하여 항종양 활성을 갖는 α-셈브라-2,7,11-트리엔-4,6-디올의 형식적 합성에 성공했다.[44]
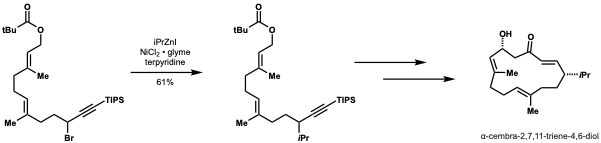
키르슈닝과 슈미트는 니켈 촉매 네기시 교차 결합을 카롤락톤의 첫 번째 전체 합성에 적용했다.[45]
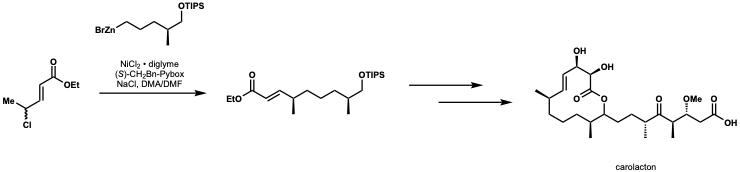
5. 유기 아연 전구체 제조
알킬아연 시약은 디메틸아세트아미드(DMAC)에서 요오드를 사용하여 해당 알킬 브로마이드로부터 얻을 수 있다.[46] 촉매적인 I2는 친핵성 첨가에 대해 아연을 활성화하는 역할을 한다.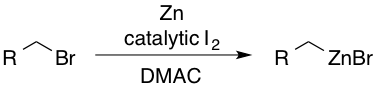
아릴 아연은 그리냐르 시약과 유사한 중간체를 통해 온화한 반응 조건에서 합성할 수 있다.[47]
:
유기아연은 Knochel 등이 시연한 바와 같이 한 단계 절차로 생성되어 사용될 수 있다.[48]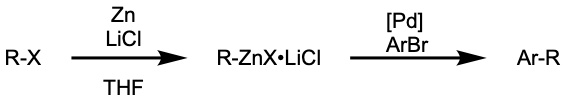
참조
[1]
논문
Highly general stereo-, regio-, and chemo-selective synthesis of terminal and internal conjugated enynes by the Pd-catalysed reaction of alkynylzinc reagents with alkenyl halides
[2]
서적
Strategic applications of named reactions in organic synthesis : background and detailed mechanisms ; 250 named reactions
Elsevier Academic Press
2007
[3]
논문
Cross-Couplings of Unactivated Secondary Alkyl Halides: Room-Temperature Nickel-Catalyzed Negishi Reactions of Alkyl Bromides and Iodides
https://pubs.acs.org[...]
2003-12
[4]
논문
Selective carbon-carbon bond formation via transition metal catalysis. 3. A highly selective synthesis of unsymmetrical biaryls and diarylmethanes by the nickel- or palladium-catalyzed reaction of aryl- and benzylzinc derivatives with aryl halides
https://doi.org/10.1[...]
1977-05-01
[5]
논문
Efficient Cross-Coupling of Functionalized Arylzinc Halides Catalyzed by a Nickel Chloride−Diethyl Phosphite System
https://doi.org/10.1[...]
2005-10-01
[6]
논문
A novel stereospecific alkenyl-alkenyl cross-coupling by a palladium- or nickel-catalyzed reaction of alkenylalanes with alkenyl halides
[7]
논문
Selective carbon-carbon bond formation via transition metal catalysis. 3. A highly selective synthesis of unsymmetrical biaryls and diarylmethanes by the nickel- or palladium-catalyzed reaction of aryl- and benzylzinc derivatives with aryl halides
[8]
서적
Strategic Applications of Named Reactions in Organic Synthesis
Elsevier Academic Press
[9]
웹사이트
Chemistry 115 Handouts
https://faculty.chem[...]
Harvard University Department of Chemistry
[10]
논문
On the Configuration Resulting from Oxidative Addition of RX to Pd(PPh3)4 and the Mechanism of the cis-to-trans Isomerization of [PdRX(PPh3)2] Complexes (R = Aryl, X = Halide)
[11]
논문
Higher-order zincates as transmetalators in alkyl-alkyl negishi cross-coupling
2012-07
[12]
논문
Computational perspective on Pd-catalyzed C-C cross-coupling reaction mechanisms
2013-11
[13]
논문
Insights into the mechanism of the Negishi reaction: ZnRX versus ZnR2 reagents
2007-03
[14]
논문
Palladium round trip in the Negishi coupling of trans-[PdMeCl(PMePh2)2] with ZnMeCl: an experimental and DFT study of the transmetalation step
2010-08
[15]
서적
The Organometallic Chemistry of the Transition Metals
John Wiley and Sons Inc.
[16]
논문
Revealing a second transmetalation step in the Negishi coupling and its competition with reductive elimination: improvement in the interpretation of the mechanism of biaryl syntheses
2009-07
[17]
논문
Nickel-catalysed Negishi cross-coupling reactions: scope and mechanisms
https://pubs.rsc.org[...]
2009-05-27
[18]
논문
Cross-Couplings of Unactivated Secondary Alkyl Halides: Room-Temperature Nickel-Catalyzed Negishi Reactions of Alkyl Bromides and Iodides
https://pubs.acs.org[...]
2003-12
[19]
논문
Nickel-Catalyzed Negishi Arylations of Propargylic Bromides: A Mechanistic Investigation
https://doi.org/10.1[...]
2014-11-26
[20]
논문
Mechanistic studies of nickel catalysis in the cross coupling of aryl halides with alkylmetals. Role of arylalkylnickel(II) species as intermediates
https://doi.org/10.1[...]
1975-12-01
[21]
간행물
Synthesis of 4-, 5-, and 6-methyl-2,2'-bipyridine by a Negishi cross-coupling strategy: 5-methyl-2,2'-bipyridine
[22]
간행물
Synthesis of biaryls via palladium-catalyzed cross-coupling: 2-methyl-4'-nitrobiphenyl
[23]
간행물
Palladium-catalyzed synthesis of conjugated dienes
[24]
논문
Hexaferrocenylbenzene
https://zenodo.org/r[...]
2006-06
[25]
논문
Oxidative cross-coupling through double transmetallation: surprisingly high selectivity for palladium-catalyzed cross-coupling of alkylzinc and alkynylstannanes
2006-11
[26]
논문
Selective carbon-carbon bond formation via transition metal catalysis. 3. A highly selective synthesis of unsymmetrical biaryls and diarylmethanes by the nickel- or palladium-catalyzed reaction of aryl- and benzylzinc derivatives with aryl halides
https://doi.org/10.1[...]
1977-05-01
[27]
논문
Efficient Cross-Coupling of Functionalized Arylzinc Halides Catalyzed by a Nickel Chloride−Diethyl Phosphite System
https://doi.org/10.1[...]
2005-10-01
[28]
논문
An Efficient Nickel-Catalyzed Cross-Coupling Between sp3 Carbon Centers
https://onlinelibrar[...]
1998
[29]
논문
Nickel-Catalyzed Cross-Coupling between Functionalized Primary or Secondary Alkylzinc Halides and Primary Alkyl Halides
https://doi.org/10.1[...]
2002-01-01
[30]
논문
Ni(II)-Catalyzed Cross-Coupling between Polyfunctional Arylzinc Derivatives and Primary Alkyl Iodides
https://doi.org/10.1[...]
1998-11-01
[31]
논문
Asymmetric Nickel-Catalyzed Negishi Cross-Couplings of Secondary α-Bromo Amides with Organozinc Reagents
https://pubs.acs.org[...]
2005-04
[32]
논문
Nickel-Catalyzed Asymmetric Negishi Cross-Couplings of Secondary Allylic Chlorides with Alkylzincs
https://pubs.acs.org[...]
2008-03-01
[33]
논문
Ni-Catalyzed Cascade Formation of C(sp3)C(sp3) Bonds by Cyclization and Cross-Coupling Reactions of Iodoalkanes with Alkyl Zinc Halides
https://onlinelibrar[...]
2007
[34]
논문
Palladium-catalyzed cross-coupling: a historical contextual perspective to the 2010 Nobel Prize
2012-05
[35]
논문
One-pot Negishi cross-coupling reactions of in situ generated zinc reagents with aryl chlorides, bromides, and triflates
2008-09
[36]
논문
Large-Scale Negishi Coupling as Applied to the Synthesis of PDE472, an Inhibitor of Phosphodiesterase Type 4D
[37]
논문
Recent Applications of Palladium-Catalyzed Coupling Reactions in the Pharmaceutical, Agrochemical, and Fine Chemical Industries
[38]
논문
Palladium-catalyzed cross-coupling reactions in total synthesis
2005-07
[39]
논문
Advances in the Negishi coupling
[40]
논문
Total synthesis of (-)-stemoamide
2007-05
[41]
논문
Interaction of pumiliotoxin B with an "alkaloid-binding domain" on the voltage-dependent sodium channel
1992-12
[42]
논문
Convergent Approach to Pumiliotoxin Alkaloids. Asymmetric Total Synthesis of (+)-Pumiliotoxins A, B, and 225F
[43]
논문
A stereocontrolled synthesis of delta-trans-tocotrienoloic acid
2005-09
[44]
논문
Nickel-Catalyzed Negishi Cross-Couplings of Secondary Nucleophiles with Secondary Propargylic Electrophiles at Room Temperature
2008
[45]
논문
Total Synthesis of Carolacton, a Highly Potent Biofilm Inhibitor
https://onlinelibrar[...]
2012
[46]
논문
Highly efficient, general procedure for the preparation of alkylzinc reagents from unactivated alkyl bromides and chlorides
2003-02
[47]
논문
Ni(II)-Catalyzed Cross-Coupling between Polyfunctional Arylzinc Derivatives and Primary Alkyl Iodides
[48]
논문
One-Pot Negishi Cross-Coupling Reactions of In Situ Generated Zinc Reagents with Aryl Chlorides, Bromides, and Triflates
https://pubs.acs.org[...]
2008-09-19
[49]
간행물
'Negishi, E. Acc. Chem. Res. 1982, 15, 340-348.'
[50]
간행물
'Erdik, E. Tetrahedron 1992, 48, 9577-9648.'
[51]
간행물
'King, A. O.; Okukado, N.; Negishi, E. J. Chem. Soc., Chem. Commun. 1977, 683-684.'
[52]
간행물
'Negishi, E.; King, A. O.; Okukado, N. J. Org. Chem. 1977, 42, 1821-1823.'
[53]
간행물
'Negishi, E.; Takahashi, T.; King, A. O. Org. Synth. Coll. Vol. 8, p.430 (1993); Vol. 66, p.67 (1988).'
http://www.orgsynth.[...]
[54]
간행물
'Negishi, E. Acc. Chem. Res. 1982, 15, 340-348.'
[55]
간행물
'Erdik, E. Tetrahedron 1992, 48, 9577-9648.'
[56]
간행물
'King, A. O.; Okukado, N.; Negishi, E. J. Chem. Soc., Chem. Commun. 1977, 683-684.'
[57]
간행물
'Negishi, E.; King, A. O.; Okukado, N. J. Org. Chem. 1977, 42, 1821-1823.'
[58]
간행물
'Negishi, E.; Takahashi, T.; King, A. O. Org. Synth. Coll. Vol. 8, p.430 (1993); Vol. 66, p.67 (1988).'
http://www.orgsynth.[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com