삼산화 황
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
삼산화 황(SO₃)은 황 원자를 중심으로 평면 정삼각형 구조를 갖는 화합물이다. 기체 상태에서는 단량체 형태로 존재하며, 액체 및 고체 상태에서는 삼량체, 중합체 형태로 존재한다. 삼산화 황은 황산의 무수물로, 물과 격렬하게 반응하여 황산을 생성하며, 강력한 산화제, 루이스 산, 술폰화제 역할을 한다. 산업적으로는 접촉법을 통해 생산되며, 황산, 술폰화 반응, 황산디메틸 제조 등에 사용된다. 삼산화 황은 부식성이 강하고 강력한 산화제이며, 물과 반응하여 황산을 생성하므로 취급에 주의해야 한다.
더 읽어볼만한 페이지
- 황 산화물 - 이산화 황
이산화 황은 자연적 및 인위적 과정으로 생성되는 기체 화합물로, 황산 제조 중간체, 식품 보존제, 환원제 등으로 사용되지만 대기 오염과 산성비의 원인이 되며 기후 변화에도 영향을 미친다. - 무기 황 화합물 - 이황화 탄소
이황화 탄소는 1796년 람파디우스가 합성한 무색 휘발성 액체로, 높은 굴절률과 우수한 용매 특성을 지니지만, 가연성과 독성으로 인해 건강 문제를 유발하여 사용량이 감소하고 법적 규제를 받고 있다. - 무기 황 화합물 - 이산화 황
이산화 황은 자연적 및 인위적 과정으로 생성되는 기체 화합물로, 황산 제조 중간체, 식품 보존제, 환원제 등으로 사용되지만 대기 오염과 산성비의 원인이 되며 기후 변화에도 영향을 미친다. - 산 무수물 - 피로인산
피로인산은 화학식 H₄P₂O₇을 갖는 무기산으로, 피로인산나트륨 이온 교환 등으로 제조되고 DNA 합성 부산물로 생성되며 가수분해 시 방출되는 에너지는 세포 내 과정에 사용된다. - 산 무수물 - 이산화 탄소
이산화탄소(CO₂)는 탄소 원자 하나와 산소 원자 두 개로 이루어진 무색·무취의 기체로, 드라이아이스로 승화하며, 탄산 형성, 연소, 호흡, 광합성 등 다양한 과정에서 발생하고, 산업적으로 널리 사용되지만 지구 온난화의 주요 원인이자 고농도에서 인체에 유독한 물질이다.
| 삼산화 황 - [화학 물질]에 관한 문서 | |
|---|---|
| 일반 정보 | |
 | |
 | |
| IUPAC 명칭 | 설포닐리덴옥시단 |
| 다른 이름 | 삼산화 황 무수 황산 산화황(VI) |
| 식별 정보 | |
| CAS 등록번호 | 7446-11-9 |
| Gmelin 등록번호 | 1448 |
| PubChem CID | 24682 |
| ChemSpider ID | 23080 |
| EINECS 번호 | 231-197-3 |
| UN 번호 | UN 1829 |
| ChEBI ID | 29384 |
| RTECS 번호 | WT4830000 |
| 표준 InChI | 1S/O3S/c1-4(2)3 |
| 표준 InChIKey | AKEJUJNQAAGONA-UHFFFAOYSA-N |
| SMILES (단량체) | O=S(=O)=O |
| SMILES (γ-삼량체) | O=S0(=O)OS(=O)(=O)OS(=O)(=O)O0 |
| SMILES (α/β 중합체) | OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)OS(=O)(=O)O |
| 물성 | |
| 분자식 | SO3 |
| 몰 질량 | 80.066 g/mol |
| 밀도 | 1.92 g/cm3 (액체) |
| 녹는점 | 16.9 °C |
| 끓는점 | 45 °C |
| 용해도 | 황산과 반응 |
| 외관 | 공기 중에서 발연하는 무색 내지 흰색 결정성 고체. 무색 액체 및 기체. |
| 냄새 | 다양함. 증기는 자극적이며 이산화황과 유사함. 미스트는 무취. |
| 열화학 | |
| 표준 생성 엔탈피 | −395.7 kJ/mol |
| 엔트로피 | 256.77 J K−1 mol−1 |
| 위험성 | |
| 주요 위험 | 부식성이 강함, 매우 강력한 탈수제 |
| GHS 그림 문자 | ' ' |
| GHS 신호어 | 위험 |
| H 문구 | '' |
| P 문구 | '' |
| NFPA 704 | 건강: 3 화재: 0 반응성: 3 기타: W+OX |
| 인화점 | 불연성 |
| LC50 | 쥐, 4시간 375 mg/m3 |
| 관련 화합물 | |
| 관련 양이온 | 삼산화 셀레늄 삼산화 텔루륨 삼산화 폴로늄 |
| 관련 산화물 | 일산화 황 이산화 황 |
| 기타 화합물 | 황산 |
2. 분자 구조 및 결합
VSEPR 이론에 따르면, 기체 상태의 SO₃는 황 원자를 중심으로 한 평면 정삼각형 구조(D₃h 대칭)를 가질 것으로 예측된다. 황 원자의 산화수는 +6이고, 전하는 0이며, 6개의 전자쌍을 가지고 있다. 분자궤도함수 이론의 관점에서 보면, 이들 전자쌍의 대부분은 비결합적인 성질을 가지고 있으며, 전형적인 초원자가 분자이다.
고체 SO₃는 미량의 물에 의존하는 복잡한 거동을 보인다.[22] 응축되는 형태에 따라 γ-SO₃, α-SO₃, β-SO₃등 여러가지 상(phase)이 존재한다. γ-SO₃는 삼량체, α-SO₃와 β-SO₃는 고분자형태를 가진다. γ상과 β상은 준안정상이며, 시간이 지남에 따라 안정한 α상으로 서서히 상전이한다. 이 상전이에는 미량의 물이 관여하고 있다.[24]
고체의 증기압은 동일 온도에서는 α < β < γ 순으로 커진다. 또한 액체의 증기압은 γ상의 값과 거의 같다. 따라서 α-SO₃의 결정을 가열하면 유리 용기를 파쇄할 정도로 증기압이 급증하는데, 이 현상은 α폭발이라 불린다.[24]
SO₃는 높은 흡습성을 가진다. 뜨겁고 진한 황산에 나무나 면을 담그면 발화하는데, 이는 SO₃가 나무나 면의 탄수화물에 포함된 수분을 탈수시켜 탄수화물이 더 잘 타기 때문이다.[24]
2. 1. 단량체 (Monomer)
VSEPR 이론에 따르면, 기체 상태의 SO₃는 황 원자를 중심으로 한 평면삼각형 구조(D₃h 점군)를 가질 것으로 예측된다.[7] 황 원자는 +6의 산화수를 가지며, 형식 전하는 0이다. 세 개의 황-산소 결합 길이는 모두 같으며 1.42 Å이다.[1] 기체 삼산화 황의 전기 쌍극자 모멘트는 0이다. 분자궤도함수 이론의 관점에서 보면, 이들 전자쌍의 대부분은 비결합적인 성질을 가지고 있으며, 전형적인 초원자가 분자이다.2. 2. 삼량체 (Trimer)
액체 및 기체 SO₃영어는 단량체와 고리형 삼량체 사이의 평형 상태에 존재한다.[8] 고체 SO₃의 성질은 복잡하며, 적어도 3가지의 다형체가 알려져 있으며, 이들 사이의 전환은 미량의 물에 의존한다.[9]순수한 SO₃는 16.8 °C에서 고체가 되어 γ-SO₃ 형태를 이루는데, 이는 고리형 삼량체 구조 [S(=O)₂(μ-O)]₃를 채택한다.[10][1]
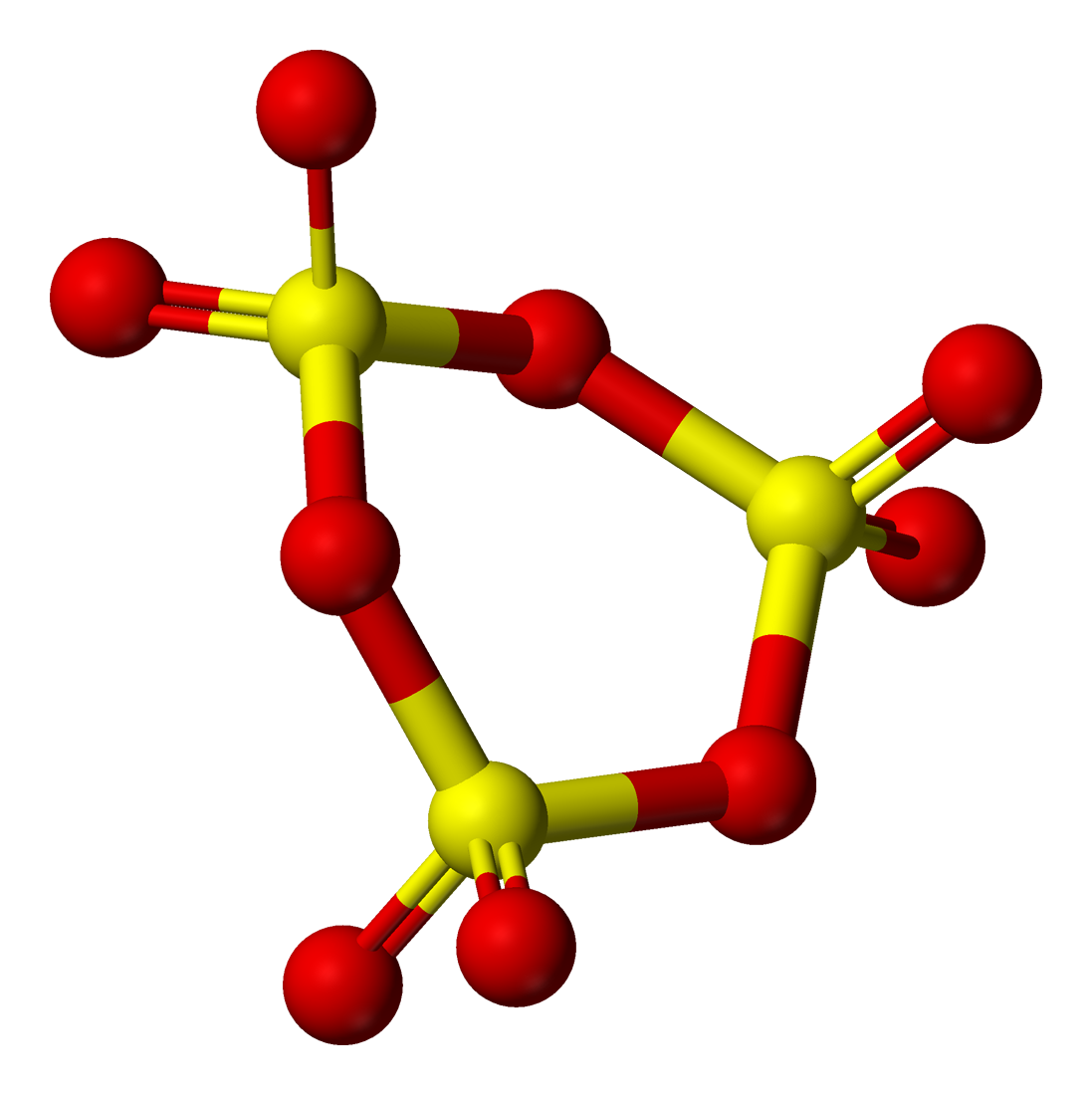
고체 SO₃는 미량의 물에 의존하는 복잡한 거동을 보인다.[22] 기체가 응축되면 순수한 삼산화 황이 γ-SO₃라 불리는 삼량체를 형성한다. 이 고체는 무색이며 녹는점은 16.8℃이다. 이 고리형 구조는 [S(=O)₂(μ-O)]₃으로 표기된다.[23]
2. 3. 중합체 (Polymer)
27 °C 이상에서 응축된 삼산화 황(SO₃)은 α-SO₃를 생성하며, 석면과 같은 섬유상 외관을 가진다.[1] α-SO₃는 구조적으로 [S(=O)₂(μ-O)]ₙ 형태의 고분자(중합체)이며, 각 사슬의 끝은 히드록실기(OH)로 종결된다.[1] β-SO₃도 섬유상 구조를 가지지만, α-SO₃와는 다른 분자량과 녹는점(32.5 °C)을 갖는다.[24] γ-SO₃와 β-SO₃는 준안정상이며, 시간이 지나면 안정한 α-SO₃로 전환된다. 이 전환은 미량의 물에 의해 촉진된다.[11]고체 SO₃의 상대 증기압은 α < β < γ 순으로 증가하며, 이는 상대적인 분자량을 나타낸다.[11]
3. 화학적 성질
삼산화 황은 황산의 무수물이며, 물과 격렬하게 반응하여 황산을 생성한다. 이 반응은 급격한 발열 반응이다.[1] 340℃ 이상에서는 황산, 삼산화 황, 물 사이에서 평형이 성립한다.
삼산화 황은 이황화염소와 반응하여 염화티오닐을 생성한다.[1]
:
삼산화 황을 진한 황산에 녹인 것을 발연황산이라고 한다.
3. 1. 수화 반응
SO₃는 H₂SO₄의 무수물이다. 따라서 물과 격렬하게 반응하여 황산을 생성한다. (ΔfH° = −200 kJ/mol)[12]기체 상태의 삼산화황은 상대적으로 건조한 대기에서도 황산 미스트(안개)를 형성하기 때문에 격렬하게 연기가 난다. SO₃는 매우 흡습성이 강하다. 수화열이 충분히 크기 때문에 SO₃와 목재 또는 면화의 혼합물은 발화될 수 있다. 이러한 경우 SO₃는 이러한 탄수화물을 탈수시킨다.[11]
3. 2. 탈산소 반응
SO3는 이산화 질소(N2O5)와 반응하여 피로황산의 니트로늄 염([NO2]2S2O7)을 생성한다.3. 3. 산화제
삼산화 황은 산화제이다. 삼산화 황은 이염화황을 염화티오닐로 산화시킨다.[1]:SO3 + SCl2 → SOCl2 + SO2
3. 4. 루이스 산
SO₃는 강한 루이스 산으로 피리딘, 디옥산, 트리메틸아민과 같은 루이스 염기와 쉽게 착물을 형성한다.[13] 예를 들어 피리딘과 반응하면 삼산화황-피리딘 착물을 생성한다.3. 5. 술폰화제
삼산화 황은 강력한 술폰화제이며, 기질에 SO3기를 첨가한다. 기질은 종종 방향족 술폰화와 같이 유기물질이다.[14] 활성화된 기질의 경우, 삼산화 황의 루이스 염기 부가물이 효과적인 술폰화제이다.[15]4. 생성
공기 중에서 이산화 황이 삼산화 황으로 직접 산화되는 반응은 매우 느리게 진행된다.[21]
: 2 SO2 + O2 → 2 SO3 (Δ''H'' = −198.4 kJ/mol)
실험실에서는 황산수소나트륨의 열분해를 통해 2단계로 삼산화 황을 합성할 수 있다. 다른 금속의 황산수소염을 사용해도 반응이 진행되며, 반응 조건은 중간체의 안정성에 따라 달라진다.
# 탈수:
#: 2NaHSO4 → Na2S2O7 + H2O (315°C)
# 열분해:
#: Na2S2O7 → Na2SO4 + SO3 (460°C)
접촉법으로 삼산화 황을 공업적으로 제조할 수 있다. 먼저 황이나 황철석을 태워 이산화 황을 만들고, 전기집진으로 정제한다. 그 후 이산화 황을 산소 및 오산화바나듐을 촉매로 사용하여 400~600℃에서 가열하여 산화시킨다.
: S + O2 → SO2
: 2SO2 + O2 → 2SO3
연실법 과정에서 이산화 황이 이산화질소와 반응하여 삼산화 황이 생성되기도 한다.
: SO2 + NO2 → SO3 + NO
4. 1. 산업적 생산 (접촉법)
산업적으로 삼산화 황(SO₃)은 접촉법에 의해 생산된다. 이산화 황(SO₂)은 황 또는 황철석(황화철 광석)을 연소시켜 생산된다. 정전기 집진기를 이용하여 정제된 후, SO₂는 촉매를 이용하여 400~600 °C에서 대기 중의 산소로 산화된다. 일반적인 촉매는 규조토 또는 실리카 지지체에 산화칼륨(K₂O)으로 활성화된 오산화바나듐(V₂O₅)으로 구성된다. 백금도 매우 잘 작용하지만 너무 비싸고 불순물에 의해 훨씬 쉽게 중독(비활성화)된다.[16]이렇게 만들어진 삼산화황의 대부분은 황산으로 전환된다.
접촉법으로 제조되는 삼산화황은 먼저 황 또는 황철석의 연소에 의해 이산화 황(아황산가스)을 합성하고, 전기집진으로 정제한다. 그 후 이산화 황을 산소 및 오산화바나듐의 존재하에 400~600℃로 가열하여 산화시켜서 얻을 수 있다.
또한, 질산법(연실법)의 과정에서 이산화황이 이산화질소와 반응해도 생성된다.[21]
접촉법 및 연실법에 대해서는 황산#공업적 제법 문서에 자세히 설명되어 있다.
4. 2. 실험실 제법
과황산나트륨의 2단계 열분해를 통해 삼산화 황을 제조할 수 있다. 피로황산나트륨은 중간 생성물이다.[17]- 315 °C에서의 탈수:
: 2 NaHSO4 → Na2S2O7 + H2O
- 460 °C에서의 분해:
: Na2S2O7 → Na2SO4 + SO3
황산(H2SO4) 촉매 존재 하에서는 훨씬 낮은 온도(45~60 °C)에서 위와 같은 분해 반응이 일어난다.[18] KHSO4는 더 높은 온도에서 같은 반응을 한다.[17]
진한 황산과 무수 사염화주석을 이용한 염의 열분해를 포함하는 2단계 방법도 있다.
- 1:2 몰 비율의 사염화주석과 황산의 거의 환류 온도(114 °C)에서의 반응:
: SnCl4 + 2 H2SO4 → Sn(SO4)2 + 4 HCl
- 150 °C ~ 200 °C에서 무수 사황산주석(IV)의 열분해:
: Sn(SO4)2 → SnO2 + 2 SO3
이 방법은 과황산나트륨 방법에 비해 훨씬 낮은 온도를 필요로 하며 파손 위험 없이 일반적인 붕규산 유리 실험 기구를 사용하여 수행할 수 있다는 장점이 있다. 단점은 상당량의 염화수소 가스가 발생하며 이를 포집해야 한다는 점이다.
오산화인으로 황산을 탈수시켜 삼산화 황을 제조할 수도 있다.[19]
5. 응용
삼산화 황은 술폰화 반응의 주요 시약이다.[20] 황산디메틸은 디메틸 에테르와 삼산화 황의 반응으로 상업적으로 생산된다.[20]
:CH3OCH3 + SO3 → (CH3)2SO4영어
황산 에스터는 세제, 염료, 의약품으로 사용된다.
B2O3로 안정화된 삼산화 황은 20세기에 Baker & Adamson 사가 "''Sulfan''"이라는 상품명으로 거래했다.
6. 안전성
삼산화 황은 강력한 산화제이자 부식성이 강한 물질이다.[1] 물과 격렬하게 반응하여 고농도의 부식성 황산을 생성한다.[1]
참조
[1]
서적
Greenwood&Earnshaw2nd
[2]
웹사이트
SULFUR TRIOXIDE CAMEO Chemicals NOAA
https://cameochemica[...]
[3]
서적
Small-Scale Synthesis of Laboratory Reagents with Reaction Modeling
https://books.google[...]
CRC Press
[4]
웹사이트
Substance:Sulfur trioxide - Learn Chemistry Wiki
http://www.rsc.org/l[...]
[5]
웹사이트
Sulfur trioxide 227692
https://www.sigmaald[...]
2020-09-01
[6]
논문
Toward elimination of descrepancies between theory and experiment: The rate constant of the atmospheric conversion of SO3 to H2SO4
[7]
서적
Inorganic Chemistry
Pearson
2012
[8]
논문
Infrared Spectrum and Thermodynamic Properties of Gaseous Sulfur Trioxide
1962-02-00
[9]
서적
Inorganic Chemistry
Academic Press/De Gruyter
[10]
논문
The crystal structure of the ice-like form of sulphur trioxide (γ-modification)
1941-00-00
[11]
서적
Merck Index of Chemicals and Drugs
[12]
웹사이트
The Manufacture of Sulfuric Acid and Superphosphate
http://nzic.org.nz/C[...]
Chemical Processes in New Zealand
2016-04-22
[13]
서적
Advanced Inorganic Chemistry
Wiley-Interscience
[14]
논문
α-Sulfopalmitic Acid
[15]
논문
Sodium β-Styrenesulfonate and β-Styrenesulfonyl Chloride
[16]
서적
Sulfuric Acid and Sulfur Trioxide
Wiley-VCH
[17]
논문
The thermal decomposition of potassium and sodium-pyrosulfate
https://research.utw[...]
1969-05-00
[18]
웹사이트
Preparation of Sulfur Trioxide and Oleum
https://www.sciencem[...]
[19]
웹사이트
How to make sulfur trioxide - YouTube
https://www.youtube.[...]
2017-09-21
[20]
서적
Ullmann's Encyclopedia of Industrial Chemistry
2000
[21]
서적
日本大百科全書(ニッポニカ)
小学館
[22]
서적
Inorganic Chemistry
Academic Press
[23]
서적
Advanced Inorganic Chemistry
[24]
서적
Merck Index of Chemicals and Drugs
[25]
웹인용
SULFUR TRIOXIDE CAMEO Chemicals NOAA
https://cameochemica[...]
[26]
서적
Small-Scale Synthesis of Laboratory Reagents with Reaction Modeling
https://books.google[...]
CRC Press
[27]
웹인용
Substance:Sulfur trioxide - Learn Chemistry Wiki
http://www.rsc.org/l[...]
[28]
웹인용
Sulfur trioxide 227692
https://www.sigmaald[...]
2020-09-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com