이산화 황
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
이산화 황(SO₂)은 굽은형 분자로, 황을 포함한 물질의 연소나 황화물 광석의 배소 과정에서 자연적, 인위적으로 발생한다. 이산화 황은 좋은 환원제이며, 표백제, 식품 보존제, 와인 제조 등 다양한 용도로 사용된다. 하지만 대기 오염의 주요 원인 물질로, 산성비, 호흡기 질환, 기후 변화 등 환경과 건강에 심각한 영향을 미친다. 이에 따라 각국은 이산화 황 배출 규제를 강화하고 저감 기술을 개발하고 있다.
더 읽어볼만한 페이지
- 황 산화물 - 삼산화 황
삼산화 황은 다양한 화학 반응에 관여하며, 기체 상태에서는 평면 정삼각형 구조를, 액체 및 고체 상태에서는 다양한 형태를 가지는 황의 산화물로, 황산 제조의 중간체, 술폰화 반응의 시약 등으로 산업적으로 활용되지만 물과 격렬하게 반응하고 부식성이 강해 취급 시 주의가 필요하다. - 대기 오염원 - 일산화 탄소
일산화 탄소는 무색, 무취, 무미의 기체로 탄소와 산소 원자가 삼중 결합된 이원자 분자이며, 불완전 연소로 생성되는 대기오염물질이자 독성을 지니고 금속 제련, C1 화학, 의약품 및 식품 포장 등 산업 분야에서 활용되지만, 헤모글로빈과 결합하여 산소 운반 능력을 저하시켜 인체에 유해한 화합물이다. - 대기 오염원 - 황화 수소
황화 수소는 무색 기체로 달걀 썩는 냄새가 나며, 금속 이온과 반응하여 금속 황화물 침전을 생성하고, 연소 시 물과 이산화 황을 생성하며, 산업적으로 황산 또는 황화물 합성에 사용되고, 생체 내 신호 분자로 작용하며, 유독하여 흡입 시 호흡 마비 및 사망을 초래한다. - 무기 황 화합물 - 이황화 탄소
이황화 탄소는 1796년 람파디우스가 합성한 무색 휘발성 액체로, 높은 굴절률과 우수한 용매 특성을 지니지만, 가연성과 독성으로 인해 건강 문제를 유발하여 사용량이 감소하고 법적 규제를 받고 있다. - 무기 황 화합물 - 삼산화 황
삼산화 황은 다양한 화학 반응에 관여하며, 기체 상태에서는 평면 정삼각형 구조를, 액체 및 고체 상태에서는 다양한 형태를 가지는 황의 산화물로, 황산 제조의 중간체, 술폰화 반응의 시약 등으로 산업적으로 활용되지만 물과 격렬하게 반응하고 부식성이 강해 취급 시 주의가 필요하다.
| 이산화 황 - [화학 물질]에 관한 문서 | |
|---|---|
| 이산화 황 | |
 | |
 | |
 | |
| 일반 정보 | |
| IUPAC 명칭 | 이산화 황 |
| 다른 이름 | 아황산 무수물 산화 황(IV) |
| 화학식 | SO₂ |
| 분자량 | 64.066 g/mol |
| 외형 | 무색 기체 |
| 냄새 | 자극적; 갓 그은 성냥과 유사 |
| 식별 | |
| CAS 등록번호 | 7446-09-5 |
| PubChem | 1119 |
| ChemSpider ID | 1087 |
| UNII | 0UZA3422Q4 |
| EINECS | 231-195-2 |
| UN 번호 | 1079, 2037 |
| KEGG | D05961 |
| MeSH 이름 | 이산화 황 |
| ChEBI | 18422 |
| ChEMBL | 1235997 |
| RTECS | WS4550000 |
| Beilstein | 3535237 |
| Gmelin | 1443 |
| SMILES | O=S=O |
| 표준 InChI | 1S/O2S/c1-3-2 |
| 표준 InChIKey | RAHZWNYVWXNFOC-UHFFFAOYSA-N |
| 속성 | |
| 밀도 | 2.619 kg/m³ |
| 용해도 | 94 g/L, 아황산 형성 |
| 녹는점 | 201 K (-72.15 °C) |
| 끓는점 | -10 °C (263 K) |
| 증기압 | 10 °C: 230 kPa 20 °C: 330 kPa 30 °C: 462 kPa 40 °C: 630 kPa |
| pKa | ~1.81 |
| pKb | ~12.19 |
| 점성 | 12.82 μPa·s |
| 자기 감수율 | −18.2·10⁻⁶ cm³/mol |
| 구조 | |
| 점군 | C₂v |
| 배위수 | Digonal (선형) |
| 분자 모양 | 굽은 형 (Dihedral) |
| 쌍극자 모멘트 | 1.62 D |
| 열화학 | |
| 표준 생성 엔탈피 | −296.81 kJ/mol |
| 엔트로피 | 248.223 J K⁻¹ mol⁻¹ |
| 위험성 | |
| GHS 그림 문자 | |
| GHS 신호어 | 위험 |
| H 문구 | H314, H331 |
| NFPA 704 | 건강: 3 화재: 0 반응성: 0 |
| IDLH | 100 ppm |
| REL (권장 노출 기준) | TWA 2 ppm (5 mg/m³) ST 5 ppm (13 mg/m³) |
| PEL (허용 노출 기준) | TWA 5 ppm (13 mg/m³) |
| LC50 | 쥐 (1시간): 2520 ppm 생쥐 (30분): 3000 ppm |
| LCLo | 쥐 (20분): 993 ppm 쥐 (5시간): 611 ppm 생쥐 (20분): 764 ppm 사람 (10분): 1000 ppm 사람 (5분): 3000 ppm |
| 관련 화합물 | |
| 다른 황 산화물 | 일산화 황 삼산화 황 이황화 일산화물 |
| 관련 물질 | 오존 이산화 셀레늄 이산화 텔루륨 이산화 폴로늄 |
| 관련 물질 | |
| 관련 화합물 | 삼산화 황 아황산 황산 |
2. 구조 및 결합
이산화 황(Sulfur dioxide영어)은 ''C''₂ᵥ 대칭 점군을 갖는 굽은형 분자이다. 원자가 결합 이론적 접근 방식으로는 두 가지 공명 구조 사이의 공명으로 결합을 설명한다.
이산화 황은 물에 잘 녹는 물질로, 환원 작용을 한다. 물이 있으면 이산화 황은 물질의 색을 탈색시키는데, 종이나 옷과 같이 섬세한 재료에 표백제로 유용하게 사용된다. 하지만 이 표백 효과는 대기 중의 산소가 환원된 염료를 다시 산화시켜 색을 복원하기 때문에 일반적으로 오래 지속되지는 않는다. 하수 처리 과정에서 이산화 황은 배출 전 염소 처리된 하수를 처리하는 데 사용되는데, 이는 이산화 황이 유리 염소 및 결합 염소를 염화물로 환원시키기 때문이다.[32]
이산화 황은 자연적, 인위적 요인으로 발생한다.
황-산소 결합의 결합 차수는 1.5이다.[10] 전자 계산 형식에 따르면, 황 원자는 +4의 산화 상태와 +1의 형식 전하를 갖는다.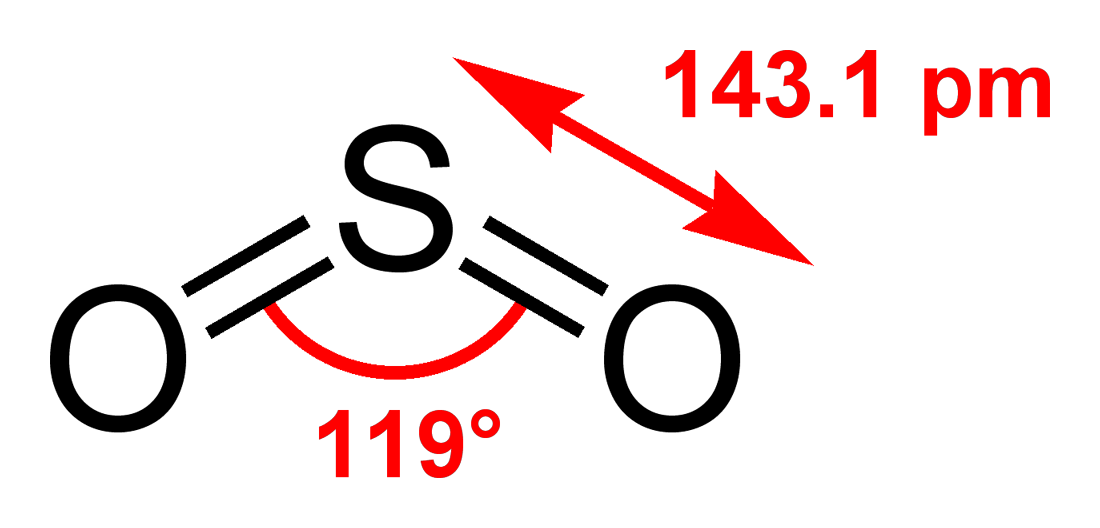
이산화 황은 C2v 대칭의 굽은형 구조이다. 황 원자의 형식 산화수는 +4이고, 전하는 0이며, 5개의 전자쌍을 가지고 있다. 분자 궤도 함수 이론의 관점에서 보면 많은 전자쌍이 결합에 관여하고 있어 전형적인 초원자가 화합물이라고 여겨졌지만, 실제로는 오존과 유사한 비교적 단순한 결합 구조임이 밝혀졌다.
최근의 실험에 의해 이산화 황의 S-O 결합은 오존과 마찬가지로 1.5중 결합이지만, 전기 음성도의 차이에 의해 황 원자가 +2가, 산소 원자가 -1에 가까워짐으로써 양자 간의 이온 결합적인 힘이 작용하고, 이것이 더해짐으로써 이중 결합 수준의 결합 에너지가 된다는 것이 밝혀졌다.[82][83][84]
3. 성질
이산화 황은 물에 잘 녹지만, 적외선 분광법과 라만 분광법으로 관찰했을 때 아황산(H₂SO₃)은 거의 존재하지 않는다. 이산화 황 수용액은 물과 반응하여 중황산이온(HSO₃⁻)의 스펙트럼을 나타내며, 실제로 존재하는 환원제는 다음과 같다.
:SO₂ + H₂O ⇌ HSO₃⁻ + H⁺
이산화 황의 온도에 따른 용해도는 다음과 같다.[69][70]온도 용해도 (g/100ml) 0 ℃ 22 10 ℃ 15 20 ℃ 11 25 ℃ 9.4 30 ℃ 8 40 ℃ 6.5 50 ℃ 5 60 ℃ 4 70 ℃ 3.5 80 ℃ 3.4 90 ℃ 3.5 100 ℃ 3.7
4. 발생
자연적으로는 주로 화산 활동을 통해 발생하며, 인위적으로는 황을 함유한 연료(석탄, 석유 등)의 연소, 황화물 광석 제련, 황산 제조 공정 등에서 발생한다. 한국에서는 산업 시설, 자동차 배기가스 등이 주요 배출원이다.[95]
4. 1. 자연 발생
이산화 황은 지구 대기 중에 약 15 ppb의 매우 낮은 농도로 존재한다.[11]
화산 분화 시에는 다량의 이산화 황이 방출될 수 있다. 1991년 필리핀의 피나투보 산 분화에서는 1,500만에서 2,000만 톤의 이산화 황이 방출되었다. 성층권에 도달한 이산화 황은 황산 에어로졸을 형성하여 장기간에 걸쳐 지표의 일사량을 감소시켜 곡물 수확량에 영향을 미치기도 한다(예: 여름 없는 해, 1993년 미국 쌀 폭동). 이러한 영향은 500만 톤 이상의 이산화 황이 방출될 때 나타나기 시작하는 것으로 추정된다.[87] 2011년 12월, 일본 사쿠라지마는 125회나 폭발적인 분화를 기록했는데, 이때 관측된 평균 방출량은 일일 1,800톤에서 2,900톤으로 추정된다.[86]
다른 행성에서도 이산화 황은 다양한 농도로 발견된다. 금성의 대기에서 이산화 황은 세 번째로 풍부한 기체이며, 150 ppm을 차지한다. 금성 대기에서는 물과 반응하여 아황산(SO2 + H2O ⇌ HSO−3+ H+) 구름을 형성하며, 행성의 전 지구적 대기 황 순환의 주요 구성 요소이며 지구 온난화에 기여한다.[12] 초기 화성의 온난화에서 주요 요인으로 여겨지며, 하층 대기의 농도는 100 ppm에 달했을 것으로 추정되지만,[13] 현재는 미량만 존재한다. 금성과 화성 모두에서, 지구와 마찬가지로 이산화 황의 주요 원천은 화산 활동으로 여겨진다. 목성의 위성인 이오의 대기는 90%가 이산화 황이며,[14] 목성의 대기에도 미량이 존재하는 것으로 생각된다. 제임스 웹 우주 망원경은 외계 행성 WASP-39b에서 이산화 황의 존재를 관측했는데, 이는 행성 대기에서 광화학 반응을 통해 생성된 것이다.[15]
얼음 형태로는 갈릴레이 위성에 풍부하게 존재하는 것으로 여겨진다. 예를 들어 이오의 후행 반구에서는 승화된 얼음이나 서리 형태로,[16] 그리고 유로파, 가니메데, 칼리스토의 지각과 맨틀에서 발견되며, 액체 상태로 존재하고 물과 쉽게 반응할 가능성도 있다.[17]
4. 2. 인위적 발생
공장에서 배출된 오염물질(아황산가스)의 농도가 환경보전법에 의하여 허용된 기준치 이내라 하더라도 그 유해의 정도가 통상의 수인한도를 넘어 인근 농장의 관상수를 고사하게 하는 한 원인이 되었다면 그 배출행위로 인한 손해배상책임을 면치 못한다.[95]
미국 환경보호청(EPA)이 2002년에 보고한 자료[85]에 따르면, 미국의 이산화 황 배출량 변화는 다음과 같다(단위: 쇼트톤).
| 년 | 배출량 |
|---|---|
| 1970년 | 약 28268791.79kg |
| 1980년 | 약 23500627.42kg |
| 1990년 | 약 21480326.43kg |
| 1996년 | 약 17108601.91kg |
| 1997년 | 약 17565823.15kg |
| 1998년 | 약 17681942.83kg |
| 1999년 | 약 17115859.39kg |
주로 EPA의 산성비 대책 프로그램 주도로 미국의 이산화 황 배출량은 1983년부터 2002년 사이에 약 33% 감소했다. 이는 배기가스의 황산화물 제거 기술(탈황 기술)이 발전하여 황을 포함하는 연료를 연소시켜도 황산화물을 회수할 수 있게 된 덕분이다. 특히 산화 칼슘은 이산화 황과 반응하여 아황산 칼슘이 되어 이산화 황을 흡착한다.
:
2006년 현재, 중국이 세계에서 이산화 황을 가장 많이 배출하는 국가이다. 2005년 배출량은 25490000ton이었다. 이 배출량을 2000년 것과 비교하면 약 27% 증가했으며, 미국의 1980년 배출량에 해당한다.
5. 합성
이산화 황은 황을 태우거나 황을 포함한 물질을 연소할 때 생성되는 생성물이다.[1]
:S8 + 8 O2 → 8 SO2, ΔH = −297 kJ/mol
황화수소와 유기황 화합물의 연소도 이와 유사하게 진행된다.[1]
:2 H2S + 3 O2 → 2 SO2 + 2 H2O
황화물 광석 배소(예: 황철석, 섬아연석, 진사(황화수은)) 과정에서도 SO2가 방출된다.[19]
:4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
:2 ZnS + 3 O2 → 2 ZnO + 2 SO2
:HgS + O2 → Hg + SO2
:4 FeS + 7 O2 → 2 Fe2O3 + 4 SO2
이산화황은 규산칼슘 시멘트 제조 과정에서도 부산물로 생성될 수 있다. 이때 CaSO₄를 코크스와 모래와 함께 가열한다.[20]
:2 CaSO4 + 2 SiO2 + C → 2 CaSiO3 + 2 SO2 + CO2
실험실에서는 뜨거운 진한 황산을 구리 조각에 작용시켜 이산화황을 생성할 수 있다.
:Cu + 2 H2SO4 → CuSO4 + SO2 + 2 H2O
주석도 진한 황산과 반응하지만, 주석(II)황산염을 생성하며, 이것은 나중에 360 °C에서 열분해되어 이산화주석과 무수 이산화황을 생성한다.
:Sn + H2SO4 → SnSO4 + H2
:SnSO4 → SnO2 + SO2
아황산염과 산이 반응하면 이산화황이 생성된다.
:H+ + HSO3- → SO2 + H2O
6. 반응
이산화 황은 물과 반응하여 아황산을 생성하지만, 실제로는 중아황산이온(HSO3-) 형태로 존재한다.[21]
이산화 황은 산화제 또는 환원제로 작용할 수 있다.
이산화 황은 유기 합성에서 설포닐기의 공급원으로 사용되기도 한다. 아릴 다이아조늄염을 이산화 황과 염화제일구리로 처리하면 해당 아릴 설포닐 클로라이드가 생성된다.[40]

7. 용도
이산화황은 황산 제조 과정의 중간 물질로, 접촉법을 통해 황산을 생산하는 데 가장 많이 사용된다.[1] 1979년 미국에서는 2,360만 톤의 이산화황이 황산 제조에 사용되었는데, 이는 다른 용도로 사용된 15만 톤에 비해 압도적으로 많은 양이다.[18] 대부분의 이산화황은 황을 연소시키거나 황철석 같은 황화물 광석을 가열하여 생산된다.[18]
이산화황은 항균 및 산화 방지 효과가 있어 건조 살구, 건조 무화과와 같은 건조 과일의 식품 보존제로 사용되며, 유럽에서는 E220으로 불린다.[23][24] 과일의 색깔을 유지하고 부패를 방지하는 역할을 한다.[25]
와인 제조 과정에서도 이산화황은 중요한 역할을 한다. 로마 시대부터 빈 와인 용기에 황을 태워 신선함을 유지하는 데 사용되었다.[26] 현대 와인 제조에서는 항생제 및 항산화제로서 박테리아에 의한 변질과 산화를 방지하고, 휘발성 산도를 최소화하는 데 사용된다.[28][29] 이산화황을 함유한 와인에는 "아황산염 함유"라는 표시가 붙는다.
와이너리 위생 관리에도 이산화황이 사용된다. 코르크 오염 때문에 표백제를 사용할 수 없는 와이너리에서는 이산화황, 물, 구연산 혼합물을 사용하여 장비를 청소하고 살균한다.[30]
이산화황은 환원제 역할도 한다. 물이 있는 환경에서 물질의 색을 탈색시키는 표백 효과가 있어 종이, 옷 등의 표백제로 사용된다. 그러나 이 효과는 공기 중의 산소에 의해 재산화되므로 오래 지속되지 않는다.[32] 하수 처리 과정에서는 염소 처리된 하수를 방류하기 전 이산화황으로 처리하여 염소를 제거한다.[32]
20세기 초, 부에노스아이레스에서는 흑사병을 옮기는 쥐벼룩을 박멸하기 위해 이산화황을 훈증제로 사용했다. 이 방법은 남아메리카의 다른 지역으로도 확대되어 효과를 보았다.[33]
이산화황은 쉽게 액화되고 증발열이 높아 냉매로도 사용되었다. 프레온이 개발되기 전에는 가정용 냉장고의 냉매로 사용되기도 했다.
클로드 리브의 저서 『나폴레옹의 범죄』에 따르면, 19세기 초 프랑스에서는 아이티 노예 반란 진압에 이산화황이 사용되기도 했다.
이산화황은 폐의 신축 관련 수용체 신호를 억제하여 헤링어-브로이어 반사를 억제하는 효과가 있다.
곤충 표본을 만들 때 초산에틸 사용으로 체모가 젖거나 체색이 변하는 등의 문제가 발생하는 곤충의 살충제로 이산화황이 사용되기도 한다.
8. 환경에 미치는 영향
이산화황은 호흡기를 자극하여 기침, 천식, 기관지염 등의 질환을 유발한다.[88] 0.5 ppm 이상에서 냄새를 감지하고, 30~40 ppm 이상에서는 호흡 곤란을 일으키며, 100 ppm 농도에 50~70분 이상 노출되면 위험하다. 400 ppm 이상인 경우 수 분 내에 생명이 위험할 수 있으며, 500 ppm을 초과하면 후각이 마비되어 오히려 악취를 느끼지 못하게 된다. 고농도 지역에 단시간 노출되는 것보다 저농도 지역에 장시간 노출되는 경우 피해가 더 크다.
대표적인 사례로 1961년경부터 발생한 일본의 4대 공해병 중 하나인 요코하마 천식(四日市ぜんそく)이 있다. 1960~70년대 일본 전역에 고농도 오염을 일으켰으나, 탈황 장치를 통해 공장 등의 고정 발생원과 석유 사용에 의한 오염이 개선되었다. 아시오마이산(足尾) 동산 광독 사건과 1952년 수 주일 만에 1만 명 이상이 사망한 런던 스모그 사건도 이산화황으로 인한 대기 오염의 심각성을 보여준다.
19세기 중반 크림 전쟁의 세바스토폴 전투에서는 영국군이 이산화황을 화학무기로 사용했을 가능성도 제기되고 있다.
2007년 현재, 일본의 이산화황 환경 기준은 1시간 값의 1일 평균이 0.04 ppm 이하이며, 1시간 값이 0.1 ppm 이하인 것으로 규정되어 있다.
8. 1. 대기 오염
이산화황은 주요 대기오염 물질 중 하나로, 인간의 건강에 상당한 영향을 미친다.[47] 성냥, 석탄, 벙커C유와 같이 황이 포함된 연료가 연소될 때 발생하는 연기 등을 통해 일상생활에서도 이산화황에 노출될 수 있다.[46]2008년 미국 정부 산업 위생 전문가 협의회(ACGIH)는 단기 노출 기준을 0.25ppm으로 낮추었다. 미국 직업안전보건청(OSHA)은 시간가중평균 허용노출농도(PEL)를 5ppm (13 mg/m3)으로, 국립 직업안전위생연구소(NIOSH)는 즉시 위험 생명 위협 수준(IDLH)을 100ppm으로 설정했다.[48] 2010년 미국 환경보호청(EPA)은 75ppb 수준의 새로운 1시간 기준을 설정하여 주요 SO2 대기질 기준(NAAQS)을 개정했다.[47]

대규모 화산 폭발은 화산 폭발 지수 4 이상일 때 황산염 에어로졸 농도에 큰 영향을 미치는데, 이산화황과 수증기를 성층권으로 직접 분출시켜 황산염 에어로졸 플룸을 생성하기 때문이다.[49] 산업혁명 이전에는 디메틸 황화물이 주요 화산 활동이 없는 일반적인 해의 황산염 에어로졸 농도에 가장 큰 영향을 미쳤다. 1990년 IPCC 제1차 평가 보고서에 따르면, 1980년대 화산 분출에 의한 이산화황 배출량은 약 1,000만 톤, 디메틸 황화물은 4,000만 톤이었다. 그러나 당시 전 세계 인류의 황 배출량은 모든 자연적인 황 함유 화합물 배출량을 합친 것과 맞먹는 수준이었다. 인위적 배출량은 1860년 연간 300만 톤 미만에서 1980년 약 8,000만 톤으로 크게 증가했으며, 유럽과 북미 산업 지역에서는 인위적 배출량이 자연적 배출량보다 10배 이상 많았다.[51] 1990년대 초, 인위적 황 배출량은 북반구에서 지배적이었고(연간 황 배출량의 16%만이 자연적), 남반구 배출량의 절반 미만이었다.[53] 미국 동부에서는 황산염 입자가 대기 오염의 25% 이상을 차지했고,[61] 석탄 화력 발전소의 이산화황 배출(석탄 PM2.5) 노출은 모든 원인의 PM2.5 노출보다 사망 위험이 2.1배 높았다.[52]
2007년 현재, 일본의 이산화황 환경 기준은 1시간 값의 1일 평균이 0.04 ppm 이하, 1시간 값이 0.1 ppm 이하이다.
8. 1. 1. 산성비
이산화 황은 대기 중에서 황산으로 변환되어 산성비를 유발한다.[54] 산성비는 미국 애디론댁 산맥과 같이 지리적으로 민감한 지역의 호수와 개울에서 계류송어를 비롯한 어류 및 곤충을 멸종시켰다.[55] 또한 토양 속 미생물을 감소시키고, 알루미늄 등 중금속의 이동성을 증가시키는 반면, 마그네슘과 같은 필수 영양소와 미네랄을 유실시켜 토양 기능을 악화시킨다.[56][57][58][59][60] 낮은 pH를 견디지 못하는 식물은 죽게 되며, 고산 지대 숲은 높은 고도에서 황산염을 함유한 안개에 자주 노출되기 때문에 가장 큰 피해를 입는 생태계 중 하나이다.산성비는 인체에 직접적인 영향을 줄 정도로 희석되지는 않았지만, 황산염 농도가 높은 스모그나 공기를 흡입하면 심장 및 폐 질환(예: 천식, 기관지염)을 유발할 수 있다.[61] 이와 더불어 조산 및 저체중아 출산과도 관련이 있다. 베이징에서 임신한 여성 74,671명을 대상으로 한 연구에 따르면, 공기 중 SO2|이산화 황영어 농도가 100μg/m3 증가할 때마다 유아의 체중이 7.3g 감소했으며, 이는 다른 형태의 대기 오염과 함께 저체중아 출산의 가장 큰 원인으로 작용한다.[62]

8. 1. 2. 호흡기 질환
이산화황은 호흡기를 자극하여 기침, 천식, 기관지염 등의 질환을 유발한다.[88] 고농도에 노출될 경우 폐 손상, 사망에 이를 수 있다.0.5 ppm 이상에서 냄새를 감지하고, 30~40 ppm 이상에서는 호흡 곤란을 일으키며, 100 ppm 농도에 50~70분 이상 노출되면 위험하다. 400 ppm 이상인 경우 수 분 내에 생명이 위험할 수 있다. 500 ppm을 초과하면 후각이 마비되어 오히려 악취를 느끼지 못하게 된다. 고농도 지역에 단시간 노출되는 것보다 저농도 지역에 장시간 노출되는 경우 피해가 더 크다.
대표적인 예로 일본의 제2차 세계 대전 이후 4대 공해병 중 하나인 1961년경부터 발생한 요코하마 천식(四日市ぜんそく)이 있다. 1960~70년대에 고농도 오염을 일본 전역에 일으켰으나, 공장 등의 고정 발생원과 석유 사용에 의한 발생은 탈황 장치를 통해 오염이 개선되었다. 아시오마이산(足尾) 동산 광독 사건도 유명하다. 해외에서는 1952년 수 주일 만에 1만 명 이상이 사망한 런던 스모그 사건이 있다.
19세기 중반 크림 전쟁의 세바스토폴 전투에서 영국군이 화학무기로 사용했을 가능성도 제기되고 있다.
8. 1. 3. 기후 변화
이산화 황은 대기 중에서 에어로졸을 형성하여 햇빛을 반사하고, 지구를 냉각시키는 효과를 유발할 수 있다. 이를 전 지구적 어둠화라고 부르기도 한다.[49][50][51] 대규모 화산 폭발로 인해 성층권에 이산화 황이 주입되면, 황산염 에어로졸 플룸이 생성되어 이러한 현상이 두드러지게 나타날 수 있다.[49]하지만 이러한 냉각 효과는 일시적이며, 장기적으로는 온실가스 배출로 인한 지구 온난화가 더 큰 문제이다. IPCC 제1차 평가 보고서에 따르면, 1980년대 화산 분출로 인한 이산화황 배출량은 약 1,000만 톤이었던 반면, 인위적 배출량은 1860년 연간 300만 톤 미만에서 1980년 약 8,000만 톤으로 크게 증가했다.[51]
8. 2. 규제 및 저감 노력
한국은 대기환경보전법을 통해 이산화황 배출 허용 기준을 설정하고, 배출 사업장에 대한 규제를 시행하고 있다.[95] 공장에서 배출된 오염물질(아황산가스)의 농도가 허용 기준치 이내라 하더라도, 그 유해성이 인근 농장에 피해를 줄 정도라면 손해배상 책임을 져야 한다.이산화황 배출 저감 기술로는 배연 탈황 설비, 저유황 연료 사용 등이 있다. 배연탈황은 발전소 등에서 유황 함유 연료를 연소할 때 발생하는 이산화황을 화학적으로 결합시키는 기술이다. 예를 들어, 산화칼슘(생석회)은 이산화황과 반응하여 아황산칼슘을 형성한다.
: CaO + SO₂ → CaSO₃
이후 CaSO₃는 산화되어 CaSO₄(무수석고)를 생성한다. 유럽에서 판매되는 대부분의 석고는 이러한 배연탈황 과정에서 나온다.
유동층 연소에서는 석회석을 열매체로 사용하여 연소 중 석탄에서 황을 제거할 수 있다.[65] 연료 연소 전에 황을 제거하여 SO₂ 생성을 방지할 수도 있다. 정유소의 클라우스 공정은 황을 부산물로 생산하며, 스트레트포드 공정 역시 연료에서 황을 제거하는 데 사용된다. 산화철을 사용하는 산화환원 공정(Lo-Cat[66], Sulferox[67] 등)도 활용 가능하다. 선박 엔진의 경우, 칼슘 첨가제 및 마그네슘 카르복실레이트와 같은 연료 첨가제를 사용하여 이산화황 배출을 줄일 수 있다.[68]
9. 건강에 미치는 영향
이산화 황은 주요 대기오염 물질 중 하나로, 인간의 건강에 상당한 영향을 미친다.[47] 일상생활에서 황을 포함한 연료(성냥, 석탄, 벙커C유) 연소 등을 통해 이산화 황에 노출될 수 있다.[46]
이산화 황은 호흡기를 자극하여 기침, 천식, 기관지염 등의 질환을 유발한다.[88] 0.5 ppm 이상에서 냄새를 감지할 수 있으며, 30~40 ppm 이상에서는 호흡 곤란을 일으킨다. 100 ppm 농도에 50~70분 이상 노출되면 위험하며, 400 ppm 이상인 경우 수 분 내에 생명이 위험해질 수 있다. 500 ppm을 초과하면 후각이 마비되어 오히려 악취를 느끼지 못한다. 고농도에 단시간 노출되는 것보다 저농도에 장시간 노출되는 경우 피해가 더 크다.
대표적인 이산화 황 중독 사례는 다음과 같다.
- 요코하마 천식: 일본의 4대 공해병 중 하나로, 1961년경부터 발생하여 1960~70년대에 일본 전역에 고농도 오염을 일으켰다.
- 아시오마이산(足尾) 동산 광독 사건
- 런던 스모그: 1952년 수 주일 만에 1만 명 이상이 사망한 사건이다.
- 크림 전쟁 (세바스토폴 전투): 영국군이 화학무기로 사용했을 가능성이 제기되고 있다.
2008년, 미국 정부 산업 위생 전문가 협의회(ACGIH)는 단기 노출 기준을 0.25ppm으로 낮추었다. 미국의 직업안전보건청(OSHA)은 시간가중평균 허용노출농도(PEL)를 5ppm (13 mg/m3)으로 설정했고, 국립 직업안전위생연구소(NIOSH)는 즉시 위험 생명 위협 수준(IDLH)을 100ppm으로 설정했다.[48] 2010년, 미국 환경보호청(EPA)은 75ppb 수준의 새로운 1시간 기준을 설정하여 주요 SO2 대기질 기준(NAAQS)을 개정했다.[47] 2007년 현재, 일본의 이산화 황 환경 기준은 1시간 값의 1일 평균이 0.04 ppm 이하이며, 1시간 값이 0.1 ppm 이하인 것으로 규정되어 있다.
10. 안전성
이산화 황은 식품 첨가물로 사용될 때 일부 천식 환자에게 알레르기 반응을 일으킬 수 있다.[43] 아황산염에 대한 민감성 증상은 섭취 후 수 분 이내에 생명을 위협할 수 있는 호흡 곤란으로 나타나며, 비천식 환자에게도 피부염, 두드러기, 홍조, 저혈압, 복통, 설사, 아나필락시스 등의 다양한 증상을 유발할 수 있다.[44][45]
고농도의 이산화 황을 흡입하면 호흡기 자극, 질식 등의 위험이 있다.[46] 이산화 황은 주요 대기 오염 물질이며 인간의 건강에 상당한 영향을 미친다.[47]
미국에서는 이산화 황 노출 기준을 다음과 같이 설정하고 있다.
| 기관 | 기준 |
|---|---|
| 미국 정부 산업 위생 전문가 협의회(ACGIH) | 단기 노출 기준 0.25ppm |
| 직업안전보건청(OSHA) | 시간가중평균 허용노출농도(PEL) 5ppm (13 mg/m3) |
| 국립 직업안전위생연구소(NIOSH) | 즉시 위험 생명 위협 수준(IDLH) 100ppm[48] |
| 미국 환경보호청(EPA) | 1시간 기준 75ppb[47] |
11. 역사
이산화 황은 지구에서도 발견되며, 대기 중에 약 15 ppb의 매우 낮은 농도로 존재한다.[11]
참조
[1]
웹사이트
Sulfur Dioxide
https://pubchem.ncbi[...]
U.S. National Library of Medicine
2024-03-22
[2]
문서
RubberBible87th
[3]
웹사이트
Hazardous Substances Data Bank
https://pubchem.ncbi[...]
[4]
논문
Correlation constants for chemical compounds
1976
[5]
웹사이트
Sulfur dioxide
http://toxtown.nlm.n[...]
U.S. National Library of Medicine
2019-12-30
[6]
웹사이트
C&L Inventory
https://echa.europa.[...]
[7]
문서
PGCH
[8]
문서
Sulfur dioxide
[9]
서적
Antimony, Gold, and Jupiter's Wolf: How the Elements Were Named
https://books.google[...]
Oxford University Press
2019
[10]
논문
Chemical bonding in oxofluorides of hypercoordinatesulfur
[11]
웹사이트
Sulfur Dioxide Trends
https://www.epa.gov/[...]
US EPA, OAR
2016-05-04
[12]
논문
Variations of sulphur dioxide at the cloud top of Venus's dynamic atmosphere
[13]
논문
A Sulfur Dioxide Climate Feedback on Early Mars
[14]
서적
Io after Galileo
Springer-Praxis
2007
[15]
웹사이트
James Webb Space Telescope reveals an exoplanet atmosphere as never seen before
https://phys.org/new[...]
[16]
서적
ICES in the Solar System
[17]
웹사이트
Europa's Hidden Ice Chemistry – NASA Jet Propulsion Laboratory
http://www.jpl.nasa.[...]
Jpl.nasa.gov
2013-09-24
[18]
서적
Sulfur Dioxide
Ullmann
[19]
서적
Inorganic Chemistry, Fifth Edition
W. H. Freeman and Company
[20]
웹사이트
WHITEHAVEN COAST ARCHAEOLOGICAL SURVEY
http://www.lakestay.[...]
lakestay.co.uk
2007
[21]
웹사이트
Information archivée dans le Web
http://publications.[...]
[22]
서적
Chemistry of the Elements
Butterworth-Heinemann
[23]
논문
Analysis of Sulfur in Dried Fruits Using NAA
https://www.ipen.br/[...]
2011-10
[24]
웹사이트
Current EU approved additives and their E Numbers
http://www.food.gov.[...]
The Food Standards Agency website
[25]
웹사이트
Preserving foods: Drying fruits and Vegetable
https://nchfp.uga.ed[...]
University of Georgia cooperative extension service
[26]
웹사이트
Practical Winery & vineyard Journal Jan/Feb 2009
http://www.practical[...]
www.practicalwinery.com
2009-02-01
[27]
웹사이트
Sulphites in wine
http://www.morethano[...]
MoreThanOrganic.com
[28]
서적
Wine science: principles and applications
Elsevier/Academic Press
[29]
논문
Demonstrating the efficiency of sulphur dioxide replacements in wine: A parameter review
[30]
웹사이트
Chlorine Use in the Winery
http://www.extension[...]
Purdue University
[31]
웹사이트
Use of ozone for winery and environmental sanitation
https://www.practica[...]
Practical Winery & Vineyard Journal
[32]
서적
Wastewater Engineering
McGraw Hill
[33]
논문
Fumigating the Hygienic Model City: Bubonic Plague and the Sulfurozador in Early-Twentieth-Century Buenos Aires
2018-07
[34]
논문
Sulfur Dioxide: a Novel Gaseous Signal in the Regulation of Cardiovascular Functions
[35]
논문
Advances in the study on endogenous sulfur dioxide in the cardiovascular system
https://journals.lww[...]
2014-11-05
[36]
논문
Correlation between endogenous sulfur dioxide and homocysteine in children with pulmonary arterial hypertension associated with congenital heart disease
2014-08-01
[37]
논문
Sulfur dioxide inhibits vascular smooth muscle cell proliferation via suppressing the Erk/MAP kinase pathway mediated by cAMP/PKA signaling
2014-05-01
[38]
논문
The biological effect of endogenous sulfur dioxide in the cardiovascular system.
2011-11-16
[39]
논문
Endogenous sulfur dioxide protects against isoproterenol-induced myocardial injury and increases myocardial antioxidant capacity in rats.
2011-01-01
[40]
간행물
m-Trifluoromethylbenzenesulfonyl Chloride
[41]
논문
Stable carbonium ions. XLVII. Alkylcarbonium ion formation from alkanes via hydride (alkide) ion abstraction in fluorosulfonic acid-antimony pentafluoride-sulfuryl chlorofluoride solution
1967-08-01
[42]
웹사이트
Volcanic gases
https://en.vedur.is/[...]
null
[43]
웹사이트
Center for Science in the Public Interest – Chemical Cuisine
http://www.cspinet.o[...]
2010-03-17
[44]
웹사이트
California Department of Public Health: Food and Drug Branch: Sulfites
http://www.cdph.ca.g[...]
2013-09-27
[45]
논문
Adverse reactions to the sulphite additives
null
2012
[46]
웹사이트
Sulfur Dioxide Basics
https://www.epa.gov/[...]
[47]
웹사이트
Sulfur Dioxide (SO2) Pollution
https://www.epa.gov/[...]
[48]
웹사이트
NIOSH Pocket Guide to Chemical Hazards
https://www.cdc.gov/[...]
[49]
웹사이트
Volcanic Sulfur Aerosols Affect Climate and the Earth's Ozone Layer
http://volcanoes.usg[...]
United States Geological Survey
2009-02-17
[50]
논문
Aerosol chemistry of emissions from three contrasting volcanoes in Italy
[51]
간행물
Chapter 1: Greenhouse Gases and Aerosols
https://www.ipcc.ch/[...]
IPCC
[52]
논문
Mortality risk from United States coal electricity generation
2023-11-24
[53]
논문
Sulfur emissions to the atmosphere from natural sources
http://link.springer[...]
1992-04-01
[54]
논문
Acid rain and its environmental effects: Recent scientific advances
[55]
웹사이트
Effects of Acid Rain – Surface Waters and Aquatic Animals
http://www.epa.gov/a[...]
[56]
논문
The Global Distribution of Acidifying Wet Deposition
https://doi.org/10.1[...]
2002-10-01
[57]
웹사이트
Effects of Acid Rain – Forests
http://www.epa.gov/a[...]
[58]
논문
Long-Term Effects of Acid Rain: Response and Recovery of a Forest Ecosystem
http://www.esf.edu/e[...]
2013-02-09
[59]
논문
Acid rain and acidification in China: the importance of base cation deposition
http://www.sciencedi[...]
2020-04-22
[60]
논문
The effects of acid rain on forest nutrient status
1982
[61]
웹사이트
Effects of Acid Rain – Human Health
http://www.epa.gov/a[...]
2013-02-09
[62]
논문
Association between air pollution and low birth weight: a community-based study
1997-05-01
[63]
논문
Global warming will happen faster than we think
https://www.research[...]
2018-12-05
[64]
논문
A Global Perspective on Sulfur Oxide Controls in Coal-Fired Power Plants and Cardiovascular Disease
2018-02-08
[65]
서적
Mechanical Engineering Reference Manual for the PE Exam
Professional Publications, Inc
[66]
웹사이트
FAQ's About Sulfur Removal and Recovery using the LO-CAT® Hydrogen Sulfide Removal System
https://web.archive.[...]
[67]
간행물
Process screening analysis of alternative gas treating and sulfur removal for gasification
http://www.netl.doe.[...]
SFA Pacific, Inc.
2011-10-31
[68]
간행물
Marine Emissions Abatement
http://www.fuelspec.[...]
SFA International, Inc.
[69]
서적
Heat Transfer
McGraw-Hill Companies, Inc.
[70]
서적
Fundamentals of Heat and Mass Transfer
John Wiley and Sons, Inc.
[71]
웹사이트
3.2 Properties of inorganic compounds ; Part 4: Silicon - Zirconium
http://www.kayelaby.[...]
イギリス国立物理学研究所
2022-01-18
[72]
웹사이트
Table of Geometries based on VSEPR
http://chemed.chem.p[...]
[73]
백과사전
二酸化イオウ
岩波書店
1982-11-05
[74]
웹사이트
SO2
http://www.chm.bris.[...]
[75]
문서
p. 700
[76]
저널
Chemical Bonding in Higher Main Group Elements
[77]
저널
On the role of d orbitals in sulfur hexafluoride
[78]
저널
The propagation of basis set error and geometry optimization in ab initio calculations. A statistical analysis of the sulfur d‐orbital problem
[79]
저널
Ylides, phosphoniumNo d Orbitals but Walsh Diagrams and Maybe Banana Bonds: Chemical Bonding in Phosphines, Phosphine Oxides, and Phosphonium Ylides
[80]
저널
Chemical Bonding in Hypervalent Molecules Revised. 3. Application of the Atoms in Molecules Theory to Y3X-CH2 (X = N, P, or As; Y = H or F) and H2X-CH2 (X = O, S, or Se) Ylides
[81]
저널
How relevant are S=O and P=O Double Bonds for the Description of the Acid Molecules H2SO3, H2SO4, and H3PO4, respectively?
[82]
저널
Determination of S-O bond order in sulfur dioxide and dimethyl sulfite using a low‐energy particle‐accelerator technique
[83]
저널
A comparison of the oxygen 1s photoabsorption spectra of SO2 and NO2
[84]
저널
The Significance of Ionic Bonding in Sulfur Dioxide: Bond Orders from X-ray Diffraction Data
[85]
웹사이트
アーカイブされたコピー
http://www.epa.gov/a[...]
2008-12-18
[86]
웹사이트
桜島の火山活動解説資料(平成22年1月)
https://www.data.jma[...]
福岡管区気象台火山監視・情報センター,鹿児島地方気象台
[87]
웹사이트
トンガ噴火は日本に「令和の米騒動」引き起こすか? 米教授が指摘する“圧倒的に少ない”物質とは
https://dot.asahi.co[...]
AERA.com
2022-01-20
[88]
웹사이트
大気中の二酸化硫黄(SO2),浜松市
http://www.city.hama[...]
[89]
문서
RubberBible87th
[90]
저널
Correlation constants for chemical compounds
1976
[91]
웹사이트
Sulfur dioxide
http://toxtown.nlm.n[...]
U.S. National Library of Medicine
[92]
웹사이트
https://echa.europa.[...]
[93]
문서
PGCH|0575
[94]
문서
Sulfur dioxide
[95]
판결
대법원 1991.7.23 선고 89다카1275 판결
1991-07-23
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

