아크로신
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
아크로신은 정자에 존재하는 주요 단백질 분해 효소로, 난세포의 투명대 관통을 돕는 역할을 한다. 트립신과 유사한 세린 프로테아제이며, 프로아크로신 형태로 저장되었다가 첨체 반응을 통해 활성화된다. 아크로신은 단백질 C 억제제(PCI)에 의해 조절되며, 불임, 피임, HIV 감염 억제와 관련된 연구가 진행되고 있다. 아크로신은 N-말단과 C-말단 도메인에서 처리 과정을 거쳐 활성화되며, S1 포켓과 음이온 결합 엑소사이트와 같은 구조적 특징을 가진다.
더 읽어볼만한 페이지
- EC 3.4.21 - 트롬빈
트롬빈은 혈액 응고 과정에서 중요한 세린 프로테아제 효소로서, 프로트롬빈 활성화를 통해 피브리노겐을 피브린으로 전환시켜 혈전 형성을 촉진하고, 혈소판 활성화, 혈관 수축, 단백질 C 활성화, 질병 발병 등 다양한 생리활성과 의학 및 식품 분야 응용 가능성을 가진다. - EC 3.4.21 - 단백분해효소 K
단백분해효소 K는 칼슘 이온에 의해 활성화되어 소수성 아미노산을 선호하는 단백질 분해 효소로, 넓은 pH 범위에서 안정적이며 핵산 정제 시 뉴클레아제 비활성화에 효과적이고 분자생물학 연구에 다양하게 활용된다. - 발생생물학 - 내배엽
내배엽은 동물 배아 발생 시 가장 안쪽에 위치한 층으로 소화관, 간, 췌장, 폐 등 주요 기관을 형성하며, 낭배 형성 과정에서 다양한 신호 전달 경로를 통해 분화되고 줄기세포 연구에 활용되며, 식물에서는 뿌리의 피질 가장 안쪽 세포층을 의미한다. - 발생생물학 - 배엽
배엽은 동물의 초기 발생 과정에서 나타나는 외배엽, 중배엽, 내배엽의 세 가지 세포층으로, 각 층은 특정 기관과 조직으로 분화하며 동물의 발생과 진화를 이해하는 데 중요하다.
| 아크로신 | |
|---|---|
| 일반 정보 | |
| EC 번호 | 3.4.21.10 |
| CAS 번호 | 9068-57-9 |
| IUBMB EC 번호 | 3/4/21/10 |
| GO 코드 | 0004284 |
 | |
| 상세 정보 | |
| 설명 | 포유류의 단백질, 인간에서 발견됨. |
| 역할 | 수정 과정에서 정자가 난자의 투명대를 뚫고 들어갈 수 있도록 돕는 단백질 분해 효소임. |
| 기능 | 정자의 첨체 반응에 관여하며, 난자 투명대를 분해하여 정자가 난자에 접근할 수 있도록 함. |
2. 효소 메커니즘
아크로신은 트립신과 유사한 특성을 갖는 세린 프로테아제이다.[3]
2. 1. 촉매 메커니즘
반응은 일반적인 세린 프로테아제 메커니즘에 따라 진행된다. 먼저 His-57이 Ser-195를 탈양성자화하여 친핵성을 증가시킨다. 탈양성자화된 Ser-195가 펩타이드의 카르보닐 탄소를 공격하여 사면체 중간체를 형성한다. 이 사면체 중간체가 붕괴하면서 His-57이 H2N-R1 이탈기를 양성자화시킨다. His-57이 물 분자를 탈양성자화시키고, 활성화된 물 분자가 카르보닐 탄소를 공격하여 두 번째 사면체 중간체를 형성한다. 사면체 중간체가 붕괴하면서 Ser-195가 이탈하고, His-57이 Ser-195를 양성자화시켜 촉매 전 상태로 복귀하며, 펩타이드 결합이 끊어진 자리에 카르복실산이 생성된다.[3]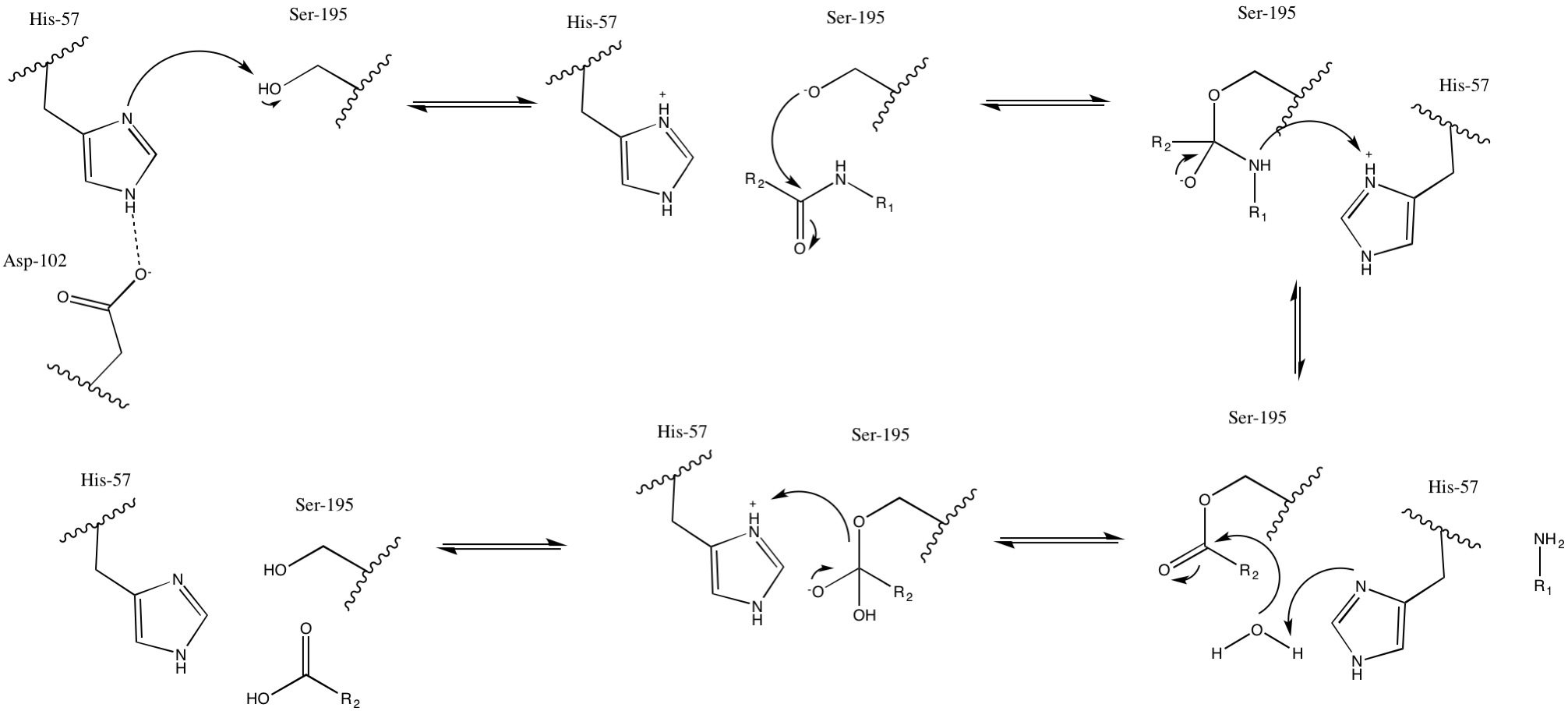
3. 생물학적 기능
아크로신은 성숙한 정자의 첨체에 있는 주요 단백질 분해 효소이다. 프로아크로신 형태로 첨체 내에 저장되며, 자극이 가해지면 첨체 반응을 통해 β-아크로신으로 활성화된다. 활성화된 β-아크로신은 투명대를 용해시켜 정자가 난세포로 침투하는 것을 돕는다.[3]
3. 1. 첨체 반응에서의 역할 논란
유전자 녹아웃 실험에서 β-아크로신(활성 단백질 분해 효소)이 없는 쥐의 정자도 투명대를 통과할 수 있다는 사실이 밝혀졌다.[4] 따라서 일부 연구자들은 아크로신이 첨체 반응 후 첨체 내용물의 확산을 돕는 역할을 한다고 주장한다. 반면 다른 연구자들은 정자와 투명대 사이의 이차 결합 단백질로서의 역할을 뒷받침하는 증거를 제시한다.[5][6][7] 이차 결합 단백질 가설에 따르면, 아크로신은 투명대의 분자에 결합하여 정자를 난세포에 묶어두는 역할을 할 수 있다. 이러한 "묶어두기"는 정자의 운동성에 의해 침투를 보장할 수 있다.[8]3. 2. 아크로신 조절
단백질 C 억제제(PCI)는 남성 생식기에 혈장보다 40배 높은 농도로 존재하며 아크로신의 단백질 분해 활성을 억제한다.[9] 따라서 PCI는 보호 역할을 하는 것으로 추정된다. 첨체 효소가 조기에 방출되거나 정자가 남성 생식관 내에서 변성되는 경우, 높은 농도의 PCI가 아크로신이 인접 조직에 단백질 분해 손상을 입히는 것을 막는다.[10]4. 구조
β-아크로신은 수퇘지, 황소, 쥐, 기니피그, 생쥐, 그리고 인간 동형체 사이에서 높은 수준의 서열 동일성(70-80%)을 보인다.[3] 트립신, 키모트립신과 같은 다른 세린 프로테아제와도 27-35% 정도의 유사한 서열 동일성을 갖는다.[3]
4. 1. 활성화 과정
프로아크로신은 N-말단과 C-말단 도메인 모두에서 처리 과정을 거쳐 활성화된다. 먼저 Arg-22와 인접한 발린 사이가 절단되어 22개 잔기로 이루어진 경쇄와 α-아크로신이라고 불리는 활성 프로테아제를 생성한다.[3] 이 경쇄는 중쇄와 2개의 이황화 결합으로 연결되어 단백질 이량체를 형성한다. N-말단 절단 후, C-말단 도메인에서 세 번의 절단을 통해 70개 잔기가 제거되어 β-아크로신이 생성된다.[3]4. 2. N-결합형 당화
아크로신에는 N-결합형 당화 가능 부위로 확인된 두 개의 부위가 있다: Asn-2와 Asn-169.[3]4. 3. 촉매 삼합체 및 결합 포켓
아크로신의 촉매 삼합체는 His-57, Asp-102, Ser-195 잔기로 구성된다.[3] 이 잔기들은 다른 프로테아제에 대해 채택된 명명 방식과 일치하는 "S1" 포켓이라고 불리는 결합 포켓에서 발견된다.[11] S1 포켓은 아크로신의 Arg 및 Lys 기질에 대한 특이성을 조절하며, 보존된 Trp-215는 결합 부위 입구의 "게이트키퍼" 잔기 역할을 한다.[3]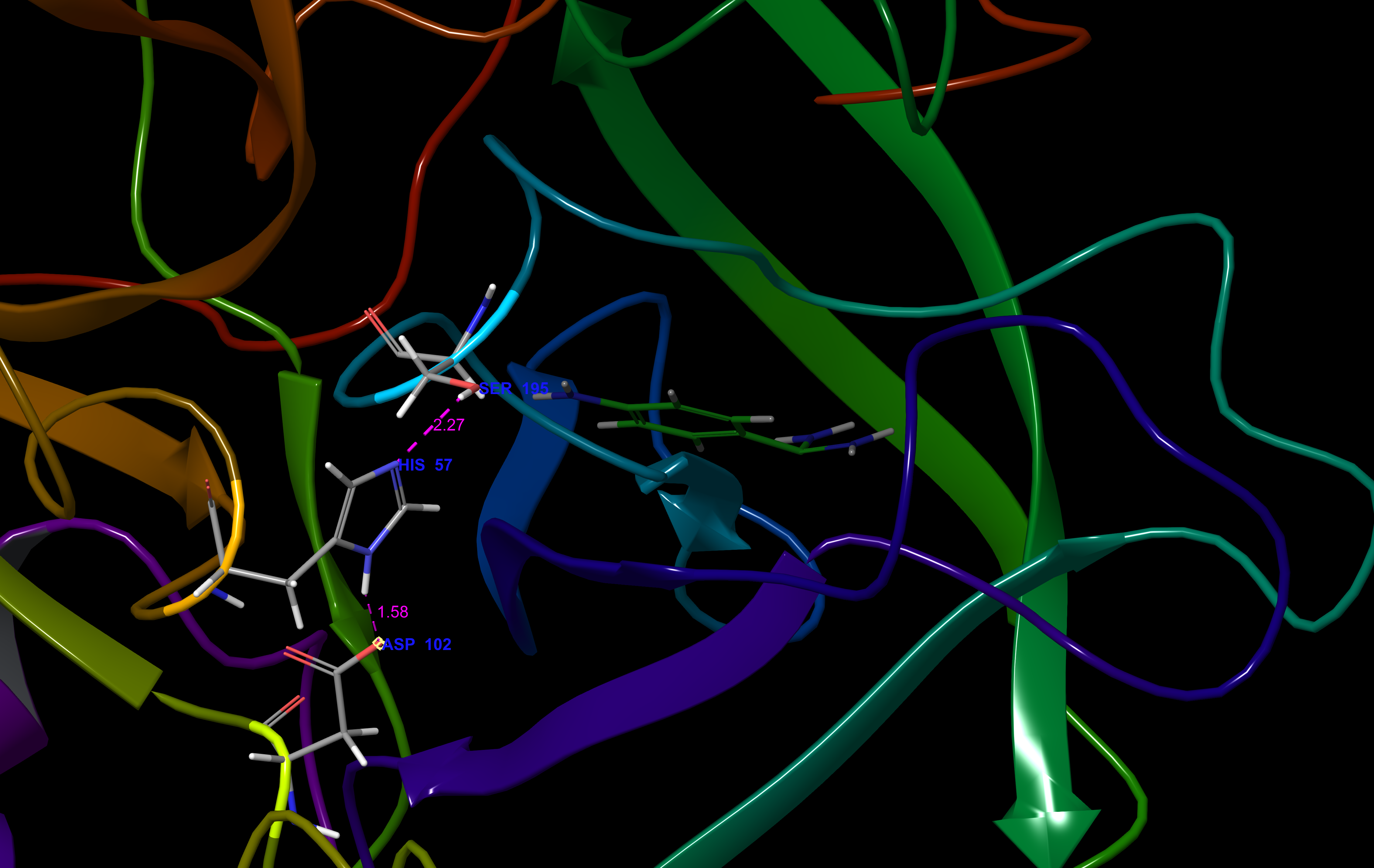
4. 4. 음이온 결합 엑소사이트
β-아크로신의 중요한 구조적 요소는 표면 영역에 있는 고도로 하전된 패치(아미노산과 번역 후 변형 모두를 통해 형성됨)인 "음이온 결합 엑소사이트"이다.[3] 이 부위는 과도한 양전하 영역으로 구성되며, 과도한 음전하를 가진 고도로 당화되고 황산화된 영역인 투명대에 결합하는 데 중요하다고 가정되었다.[12] 이러한 구조적 특징은 전하-전하 상호작용이 단백질-투명대 "연결" 복합체를 안정화할 것이라는 보조 결합 단백질 가설과 일치한다.[13] 수라민 - 상당한 음전하를 가진 다황산화 약물이 정자-투명대 결합을 억제하는 것으로 밝혀졌다는 사실은 이러한 구조적 가설과 더욱 일치한다.[14]5. 질병 및 의약학적 관련성
아크로신은 불임, 피임, HIV 감염 억제 등과 관련하여 연구가 진행되고 있다. 아크로신 활성과 정자 운동성의 상관관계,[17] 아크로신 억제제의 피임 효과,[18][19] HIV 감염 억제 효과[20] 등이 밝혀졌다.
5. 1. 불임과의 관련성
아크로신이 투명대 관통에 필수적인 요소는 아니라는 연구 결과가 있다.[15] 그러나 생쥐 모델을 사용한 다른 연구에서는 아크로솜 단백질분해효소 활성 저하와 불임 사이의 연관성이 나타났다.[16] 또 다른 연구에서는 아크로신 활성과 정자 운동성 간의 유의미한 상관관계가 입증되었다.[17]5. 2. 피임제 개발
한 연구에 따르면, 아크로신은 투명대 관통에 필수적인 요소는 아니지만, 생쥐 모델을 사용한 다른 연구에서는 아크로솜 단백질분해효소 활성 저하와 불임 사이의 연관성이 나타났다.[15][16] 다른 연구 그룹에서는 아크로신 활성과 정자 운동성 간의 유의미한 상관관계를 입증했다.[17] 토끼 모델에서 아크로신과 히알루론산 분해 효소의 알려진 억제제인 테트라데실황산나트륨을 분비하는 질내 피임 기구는 완전한 피임 효과를 보였다.[18] 아크로신의 정확한 작용 기전은 완전히 밝혀지지 않았지만, 따라서 아크로신은 피임제의 새로운 표적으로 작용할 수 있다. 아크로신은 위치와 높은 세포 특이성으로 인해 독특한 약물 표적으로 나타날 수 있다.[19] 따라서 아크로신 억제제 개발은 안전하고 가역적인 남성 피임법 또는 질내 피임 기구 사용을 통한 여성 피임법의 기반을 제공할 수 있다.[19]5. 3. HIV 감염 억제
세린 프로테아제는 HIV 활성화에 중요한 역할을 한다. 연구에 따르면 아크로신 억제제인 4'-아세트아미도페닐 4-구아니디노벤조에이트는 바이러스를 접종한 림프구에서 HIV 감염을 억제하는 능력이 있다.[20] 이는 아크로신 억제제가 HIV 전파 예방에 잠재적으로 유용한 제제가 될 수 있음을 시사한다.[20]참조
[1]
논문
Molecular cloning of human preproacrosin cDNA
1990-01
[2]
논문
Role of acrosomal matrix proteases in sperm-zona pellucida interactions
[3]
논문
Effector Sites in the Three-Dimensional Structure of Mammalian Sperm β-Acrosin
2000-11-15
[4]
간행물
Sperm from mice carrying a targeted mutation of the acrosin gene can penetrate the oocyte zona pellucida and effect fertilization
J. Biol. Chem.
1994
[5]
간행물
Acrosin accelerates the dispersal of sperm acrosomal proteins during acrosome reaction
J. Biol. Chem.
1998
[6]
간행물
Identification of a zona-binding protein from boar spermatozoa as proacrosin. Expl
Cell Res
1987
[7]
간행물
Interaction of zona pellucida glycoproteins, sulphated carbohydrates and synthetic polymers with proacrosin, the putative egg-binding protein from mammalian spermatozoa
Development
1991
[8]
간행물
The head shapes of some mammalian spermatozoa and their possible relationship to the shape of the penetration slit through the zona pellucida. J. Reprod. Fertil.
1988
[9]
논문
Protein C inhibitor in human body fluids. Seminal plasma is rich in inhibitor antigen deriving from cells throughout the male reproductive system
1992
[10]
논문
Inhibition of acrosin by protein C inhibitor and localization of protein C inhibitor to spermatozoa
1994
[11]
간행물
On the size of the active site in proteases. I. Papain. Biochim. Biophys. Res. Commun
1967
[12]
논문
Further fractionation of the glycoprotein families of porcine zona pellucida by anion exchange HPLC and some characterization of the separated fractions
[13]
간행물
In vitro biosynthesis of three sulphated glycoproteins of murine zonae pellucidae by oocytes grown in follicle culture
J. Biol. Chem.
1983
[14]
논문
Inhibition of sperm-zona binding by suramin, a potential "lead" compound for design of new anti-fertility agents
[15]
논문
Acrosomal proteinase activity of human spermatozoa and relation of results to semen quality
1988-10
[16]
간행물
Total acrosin activity correlates with fertility potential after fertilization in vitro
Fertil Steril
1991-11
[17]
논문
Determination of sperm acrosin activity for evaluation of male fertility
2000-09
[18]
간행물
An intravaginal contraceptive device for the delivery of an acrosin and hyaluronidase inhibitor
Fertil Steril
1984-02
[19]
논문
Fragment-Based Design of Novel Quinazolinon Derivatives as Human Acrosin Inhibitors
2013-04-01
[20]
논문
Acrosin inhibitor, 4'-acetamidophenyl 4-guanidinobenzoate, an experimental vaginal contraceptive with anti-HIV activity
1995-05
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com