파이 역결합
1. 개요
파이 역결합은 전이 금속과 불포화 리간드 사이에서 나타나는 금속-리간드 상호작용의 한 유형이다. IUPAC에 따르면, 파이 역결합은 금속의 d 오비탈에서 리간드의 비어있는 π* 반결합 오비탈로 전자가 이동하는 것을 포함하며, 금속-리간드 결합을 강화하고 리간드 내 결합을 약화시킨다. 일산화 탄소, 일산화 질소, 이소시아나이드, 알켄, 알카인, 포스핀 등이 파이 역결합을 형성하는 리간드로 작용할 수 있으며, 이들의 특성과 결합 방식은 분광학적 분석을 통해 연구된다.
| 유형 | 화학 결합의 한 형태; 배위 결합의 일종 |
|---|---|
| 설명 | 금속 중심이 리간드로부터 전자를 받아들이는 것 외에, 다시 금속이 리간드에게 전자를 되돌려주는 상호작용 |
| 관련 현상 | 시너지 효과 π-상호작용 |
|---|---|
| 관련 결합 | 배위 결합 |
| 중요성 | 금속-리간드 결합 강화, 특정 분자의 안정화, 촉매 반응에서의 역할 |
|---|---|
| 영향 | 결합 길이 변화, 진동 주파수 변화, 분자 궤도 에너지 변화 |
-
배위화학 -
리간드
리간드는 비공유 전자쌍을 가진 작용기로 금속 이온과 배위 결합하여 착물을 형성하는 분자 또는 이온이며, 배위 원자, 배위 부위 수, 결정장 이론에 따라 분류되고 다양한 분야에 응용된다. -
배위화학 -
배위수
배위수는 중심 원자에 직접 결합한 이웃 원자의 총 개수를 의미하는 개념으로, 배위 화합물의 성질과 원자 배열을 이해하는 데 중요하며, 결정 구조나 리간드 종류에 따라 다양한 값을 가지고 실험적 방법이나 계산 화학을 통해 결정될 수 있다. -
화학 결합 -
원자가 전자
원자가 전자는 원자의 최외각 전자껍질에 존재하며 화학적 성질을 결정하는 데 중요한 역할을 하고, 주족 원소는 최외각 전자껍질의 전자로 정의되지만 전이 원소는 (n-1)d 궤도의 전자도 포함하며, 주기율표 족에 따라 예측 가능하지만 예외도 존재하고, 화학 결합, 산화 상태, 전기 전도도에 영향을 미친다. -
화학 결합 -
파울리 배타 원리
파울리 배타 원리는 1925년 볼프강 파울리가 제시한 양자역학 원리로, 동일한 페르미온은 동일한 양자 상태에 존재할 수 없으며, 원자의 전자 배치, 화학 결합, 천체 특성 등을 설명하는 데 중요한 역할을 한다.
2. 금속-리간드 상호작용
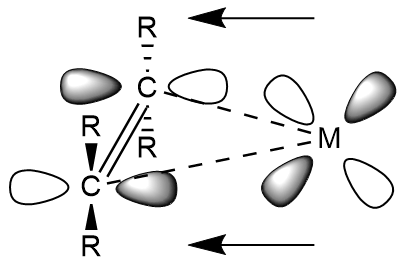
파이 역결합은 주로 전이 금속과 다양한 불포화 리간드 사이에서 나타나는 현상이다.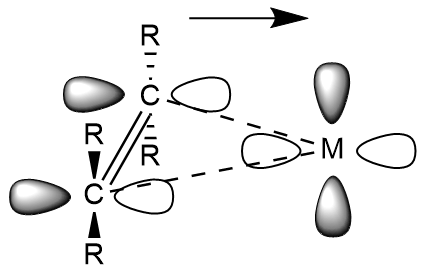

2.1. 금속 카보닐, 나이트로실, 아이소사이안화물
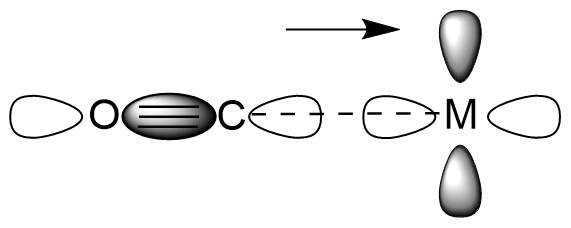
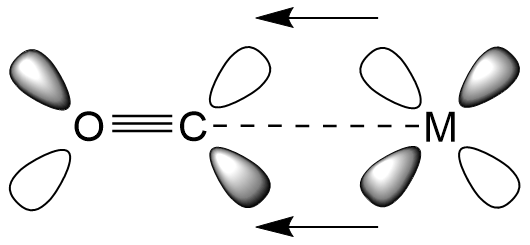
전자는 금속의 d-궤도에서 CO(및 그 유사체)의 반결합 분자 궤도로 부분적으로 이동한다. 이 전자 이동은 금속–C 결합을 강화하고 C–O 결합을 약화시킨다. M–CO 결합의 강화는 M–C 결합의 진동수 증가로 나타난다(일반적으로 일반적인 적외선 분광계의 범위를 벗어남). 또한 M–CO 결합 길이가 짧아진다. C–O 결합의 약화는 자유 CO (2143 cm-1)에서 IR 스펙트럼에서 νCO 밴드 감소로 나타나며, 예를 들어 Ni(CO)4에서 2060 cm-1, Cr(CO)6에서 1981 cm-1, 음이온 [Fe(CO)4]2−에서 1790 cm-1로 나타난다. 이러한 이유로 IR 분광법은 금속-카르보닐 화학에서 중요한 진단 기술이다. 자세한 내용은 금속 카르보닐의 적외선 분광법 문서에서 다룬다.
CO 이외에도 많은 리간드가 강한 "역결합자"이다. 일산화 질소는 CO보다 훨씬 더 강한 π 수용체이며, νNO는 금속-니트로실 화학에서 진단 도구이다. 아이소사이안화물 (RNC)은 π 역결합이 가능한 또 다른 종류의 리간드이다. CO와 대조적으로, 아이소사이안화물의 C 원자에 있는 σ-공여 고립 전자쌍은 반결합성을 가지며, 착물 형성 시 CN 결합이 강화되고 νCN이 증가한다. 동시에 π 역결합은 νCN을 낮춘다. σ-결합과 π 역결합의 균형에 따라 νCN은 증가하거나(예: Pt(II)와 같은 약한 π-공여 금속과의 착물 형성 시) 감소할 수 있다(예: Ni(0)과 같은 강한 π-공여 금속과의 착물 형성 시). 아이소사이안화물의 경우, 또 다른 매개변수는 MC=N–C 각도인데, 이는 전자가 풍부한 시스템에서 180°에서 벗어난다. 다른 리간드는 약한 π 역결합 능력을 가지고 있으며, 이는 CO의 활성화 효과를 생성하며, 이는 시스 효과로 설명된다.
2.2. 금속-알켄, 금속-알카인 착물

금속-카르보닐 화합물과 마찬가지로, 전자는 금속의 d-오비탈에서 알켄과 알카인의 반결합 분자 오비탈로 부분적으로 이동한다. 이러한 전자 이동은 금속-리간드 결합을 강화하고 리간드 내의 C-C 결합을 약화시킨다. 금속-알켄 및 알카인의 경우, M–C2R4 및 M–C2R2 결합의 강화는 각각 더 큰 sp3 및 sp2 특성을 갖는 C–C–R 각도의 굽힘으로 나타난다. 따라서 강한 π 역결합은 금속-알켄 착물이 금속사이클로프로판의 특성을 갖게 한다. 전기 음성 치환기를 갖는 알켄과 알킨은 더 큰 π 역결합을 나타낸다. 강한 π 역결합 리간드에는 테트라플루오로에틸렌, 테트라시아노에틸렌, 헥사플루오로-2-뷰타인 등이 있다.
2.3. 금속-포스핀 착물


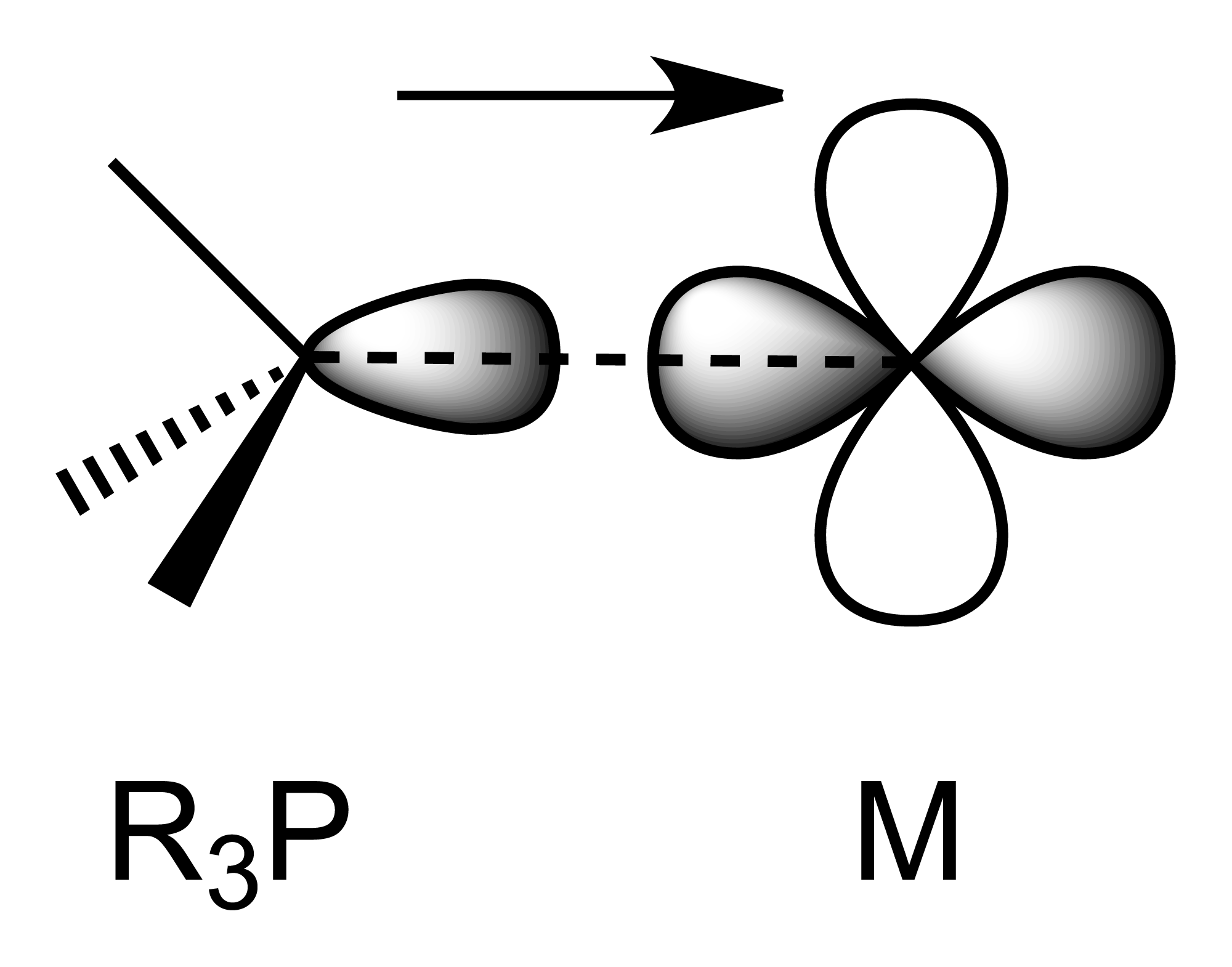
포스핀은 금속 p 또는 d 오비탈로부터 전자 밀도를 π 대칭성을 갖는 P–C σ* 반결합 오비탈의 조합으로 받아들인다. 포스핀이 전자 밀도가 높은 금속 원자와 결합할 때, P–C σ* 오비탈이 전자로 채워지면서 역결합으로 P–C 결합이 길어질 것으로 예상된다. 예상되는 P–C 거리의 증가는 종종 상반된 효과에 의해 가려진다. 인의 비공유 전자쌍이 금속에 기증되면서 P(비공유 전자쌍)–R(결합 전자쌍) 반발력이 감소하여 P–C 결합을 짧게 만든다. 두 효과는 전자 하나만 다른 금속-포스핀 착물의 구조를 비교하여 분리되었다. R3P–M 착물의 산화는 더 긴 M–P 결합과 더 짧은 P–C 결합을 초래하며, 이는 π-역결합과 일치한다. 초기 연구에서는 포스핀 리간드가 M–P 파이 결합을 형성하기 위해 3d 오비탈을 사용한다고 생각했지만, 현재는 인의 d 오비탈은 에너지가 너무 높아 결합에 관여하지 않는 것으로 받아들여지고 있다.
3. IUPAC 정의
국제 순수·응용 화학 연합(IUPAC)에서는 파이 역결합을 다음과 같이 정의한다.
π-결합된 리간드가 전이 금속과 결합하는 방식을 설명하는 것으로, 리간드의 채워진 π-오비탈 또는 비공유 전자쌍 오비탈에서 금속의 비어있는 오비탈로 전자가 이동하는 과정(공여체-수용체 결합)과 함께, 금속의 nd 오비탈(금속-리간드 축에 대해 π-대칭을 이룸)에서 리간드의 비어있는 π*-반결합 오비탈로 전자가 방출되는(역결합) 상승 작용이 포함된다.
