리간드
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
리간드는 금속 이온과 결합하여 착물을 형성하는 분자 또는 이온으로, 1800년대 초부터 배위 화합물의 조성이 알려졌다. 리간드는 금속에 제공하는 전자쌍의 수, 배위 방식, 작용기, 덴티시티, 햅티시티 등에 따라 분류되며, 생화학 분야에서는 수용체와 결합하여 세포 내 신호를 전달하는 역할을 한다. 리간드는 루이스 염기로, 금속은 루이스 산으로 간주되며, 분광화학 계열에 따라 리간드의 세기를 정렬할 수 있다. 또한, 리간드 교환 반응과 금속-리간드 다중 결합과 같은 다양한 화학적 특성을 보인다.
더 읽어볼만한 페이지
- 리간드 - 바이피리딘
바이피리딘은 피리딘 고리들의 결합 위치에 따라 다양한 이성질체로 존재하며, 2,2'-바이피리딘은 킬레이트 리간드로, 4,4'-바이피리딘은 제초제 전구체로, 일부 3,4'-바이피리딘 유도체는 심부전 치료제로 사용된다. - 리간드 - 다이메톡시에테인
다이메톡시에테인은 화학식 CH3OCH2OCH3를 갖는 유기 화합물로, 다이메틸 에터와 산화 에틸렌의 반응을 통해 산업적으로 생산된다. - 배위화학 - 배위수
배위수는 중심 원자에 직접 결합한 이웃 원자의 총 개수를 의미하는 개념으로, 배위 화합물의 성질과 원자 배열을 이해하는 데 중요하며, 결정 구조나 리간드 종류에 따라 다양한 값을 가지고 실험적 방법이나 계산 화학을 통해 결정될 수 있다. - 배위화학 - 배위 결합
배위 결합은 한 원자가 다른 원자에 비공유 전자쌍을 제공하여 형성되는 공유 결합의 한 종류로, 전자쌍을 주는 원자는 루이스 염기, 받는 원자는 루이스 산이라고 하며, 금속-리간드 결합을 설명하는 데 사용되지만 일반 공유 결합과의 구분이 명확하지 않은 경우도 있다. - 무기화학 - 알칼리
알칼리는 아랍어에서 유래하여 식물 재를 의미하며, 물에 녹아 수산화 이온을 생성하고 pH가 높으며 부식성이 있고 피부에 미끈거리는 특징을 보이는 물질을 지칭하며, 염기의 하위 집합으로 알칼리 금속 또는 알칼리 토금속의 염기성 염, 또는 물에 녹아 수산화 이온을 형성하는 염기를 포함한다. - 무기화학 - 동소체
동소체는 동일한 원소로 이루어졌으나 원자 배열의 차이로 물리화학적 성질이 다른 물질을 지칭하며, 탄소의 다이아몬드와 흑연, 산소의 산소와 오존 등이 대표적인 예시이다.
2. 역사
1800년대 초, 프러시안 블루와 황산구리(II)와 같은 화합물을 통해 배위화합물의 조성이 알려져 있었다. 알프레드 베르너는 화학식과 이성질체를 연구하여, 코발트(III) 및 크롬(III) 화합물의 화학식이 금속을 중심으로 6개의 리간드가 팔면체 구조를 이루고 있음을 밝혔다. 알프레드 베르너와 칼 소미에스키는 규소 화학과 관련하여 "리간드"라는 용어를 처음 사용했다. 베르너는 코발트 아민 염화물에서 배위된 염화물과 이온성 염화물의 차이를 설명하고, 이전에는 설명할 수 없었던 많은 이성질체를 설명했다. 그는 최초의 배위화합물인 헥솔을 광학 이성질체로 분리하여 키랄성이 반드시 탄소 화합물과 관련이 있다는 이론을 뒤엎었다.[4][5]
리간드 결합 부위는 리간드가 결합하는 부위로, 이때 리간드는 수용체와 결합하여 세포 내의 신호를 전달한다. 이러한 맥락에서 '리간드 구동성 채널'은 리간드로서 작용이 있는 약물이 결합함으로써 열림과 닫힘이 제어되는 이온 채널을 가리킨다.[1]
리간드는 금속에 제공하는 전자쌍의 수에 따라 분류할 수 있다. 맬컴 그린(Malcolm Green)은 공유 결합 분류를 위한 "CBC 방법"을 제안했는데, 이는 리간드를 세 가지 기본 유형, 즉 2전자, 1전자, 0전자 중성 리간드에 해당하는 L, X, Z 기호로 나타낸다.[10][11]
3. 생화학
4. 리간드의 분류
리간드는 비공유 전자쌍을 가진 작용기(아미노기, 포스피노기, 카르복실기, 티올기 등)를 통해 금속과 배위 결합하여 착물을 형성한다. 배위 원자는 주로 질소, 인, 산소, 황이다. 일산화탄소나 카르벤과 같이 탄소 원자를 배위 원소로 하는 리간드도 존재한다. 금속의 d 전자는 일산화탄소나 에틸렌과 같은 π 궤도의 반결합 궤도를 가진 리간드에 대한 역기여가 일어난다.
또한, 리간드에는 한 곳에서만 배위하는 단좌 리간드 외에, 두 곳 이상에서 배위하는 다좌 리간드가 있다. 다좌 리간드에 의해 생성되는 착물은 킬레이션에 의한 엔트로피 효과로 인해 단좌 착물보다 안정적이다. 현재 균일계 촉매 반응에서는 카이랄 리간드를 사용한 불균일 합성이 활발하며, 다양한 키랄 다좌 리간드가 합성되고 있다.
4. 1. 배위 방식에 따른 분류
리간드는 금속에 "기증"하는 전자의 수에 따라 분류될 수 있다.4. 2. 덴티시티와 햅티시티
많은 리간드는 여러 결합 부위를 통해 금속 이온에 결합할 수 있는데, 이는 리간드가 두 개 이상의 원자에 비공유 전자쌍을 가지고 있기 때문이다.[12] 여러 원자를 통해 결합하는 리간드는 ''킬레이트화''된다고 한다. 두 개의 부위를 통해 결합하는 리간드는 ''이좌배위 리간드'', 세 개의 부위를 통해 결합하는 리간드는 ''삼좌배위 리간드''로 분류된다. "바이트 각"은 이좌배위 킬레이트의 두 결합 사이의 각도를 나타낸다.
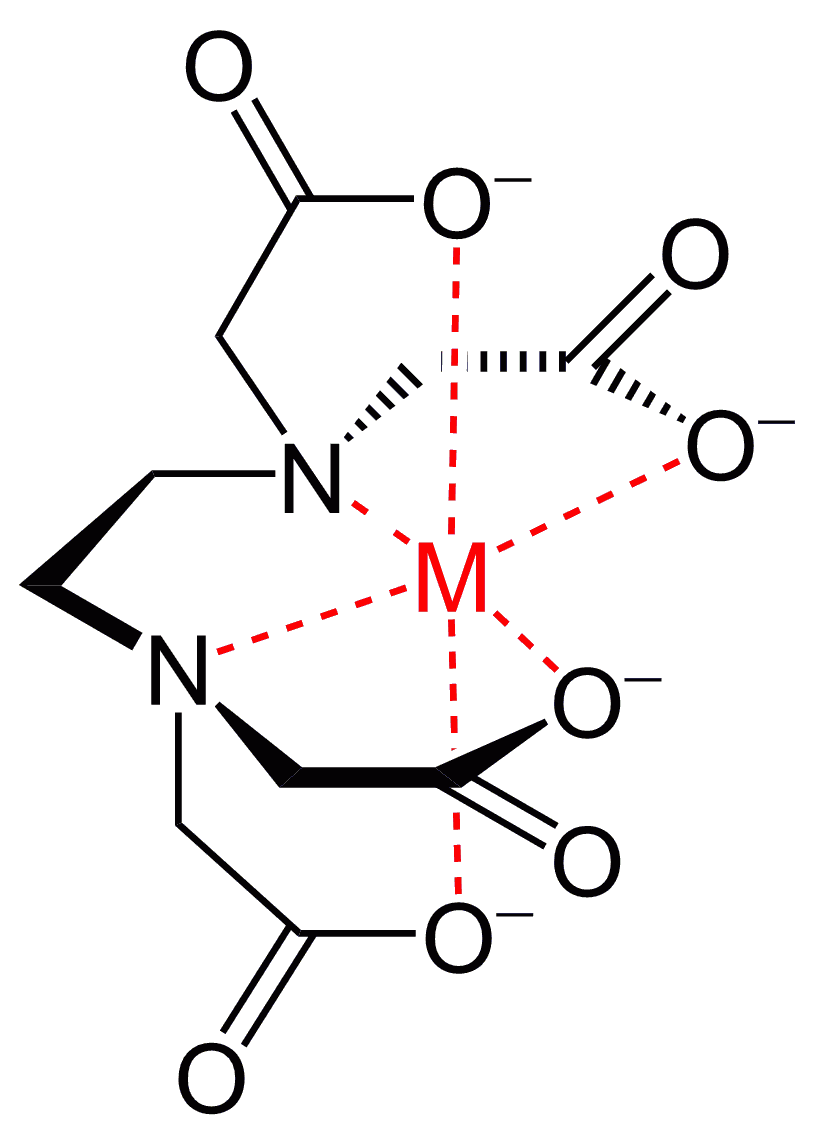
덴티시티 (''κ''로 표현)는 리간드가 금속에 결합된 비인접 원자의 수를 나타낸다. 트리스(에틸렌디아민)코발트(III) 착물은 [Co(κ2-en)3]3+로 나타낼 수 있다. 다좌배위 리간드가 금속 중심에 결합하는 횟수는 "''κn''"으로 표시되며, 여기서 ''n''은 리간드가 금속에 부착되는 부위의 수를 나타낸다. EDTA4−는 육좌배위일 때 ''κ''6-리간드로 결합하지만, 아민과 카르복실산염 산소 원자는 인접하지 않다. 리간드의 덴티시티는 종종 명확하기 때문에 이 기술자는 종종 생략된다.
다좌배위 리간드의 착물을 ''킬레이트'' 착물이라고 하며, 일좌배위 리간드에서 유래된 착물보다 안정성이 높다. 이러한 향상된 안정성을 ''킬레이트 효과''라고 하며, 일반적으로 엔트로피의 영향으로 인한 것이다.
킬레이트 효과와 관련된 것은 거대 고리 효과이다. 거대 고리 리간드는 중심 원자를 적어도 부분적으로 둘러싸고 결합하여 중심 원자를 큰 고리의 중앙에 남겨두는 리간드이다. 거대 고리 리간드가 더 단단하고 덴티시티가 높을수록 거대 고리 착물은 더 불활성화된다. 헴이 그 예인데, 여기서 철 원자는 포르피린 거대 고리의 중앙에 있다.
'''햅티시티'''(그리스 문자 ''η''로 표시)는 금속 중심에 부착되는 공여 부위를 구성하는 ''연속적인'' 원자의 수를 나타낸다. ''η 표기법''은 여러 개의 원자가 배위될 때 적용된다. 예를 들어, ''η''2는 두 개의 연속적인 원자를 통해 배위되는 리간드이다. 뷰타디엔은 금속에 결합된 탄소 원자의 수에 따라 ''η''2 및 ''η''4 착물을 모두 형성한다.[13][14][15]
4. 3. 기타 분류
리간드는 금속에 제공하는 전자의 수에 따라 분류될 수 있다. L 리간드는 루이스 염기이며, 아민, 포스핀, CO, N2, 알켄 등이 이에 해당한다. 이수소와 탄화수소는 애고스틱 상호작용을 통해 L 리간드로 작용할 수 있다. X 리간드는 할라이드와 슈도할라이드이며, 염화물과 같은 음이온 전구체에서 유래한다. 수소화물 및 알킬과 같이 음이온의 염이 실제로 존재하지 않는 리간드도 X 리간드에 포함된다.[8][9]
유기금속 화학에서는 맬컴 그린이 대중화한 공유 결합 분류 (CBC) 방법에 따라 리간드를 분류한다. 이 방법은 리간드를 2전자, 1전자, 0전자 중성 리간드에 해당하는 L, X, Z 기호로 나타낸다.[10][11]
리간드는 여러 결합 부위를 통해 금속 이온에 결합할 수 있다. 이러한 리간드를 다좌 리간드라고 하며, 킬레이트화된다고 표현한다. 두 개의 부위로 결합하는 리간드는 이좌배위 리간드, 세 개의 부위로 결합하는 리간드는 삼좌배위 리간드로 분류된다. 바이트 각은 이좌배위 킬레이트의 두 결합 사이의 각도를 의미한다. 킬레이트 리간드는 일반적으로 유기 연결기를 통해 도너기를 연결하여 형성된다. 에틸렌디아민은 에틸렌(−CH2CH2−) 연결기로 두 개의 암모니아기를 연결하여 얻은 대표적인 이좌배위 리간드이다. 육좌배위 킬레이트제인 EDTA는 여섯 개의 부위를 통해 결합하여 일부 금속을 완전히 둘러쌀 수 있는 다좌배위 리간드의 대표적인 예시이다. 다좌배위 리간드가 금속 중심에 결합하는 횟수는 ''κn''으로 표시하며, ''n''은 리간드가 금속에 부착되는 부위의 수를 나타낸다. EDTA4−는 육좌배위일 때 ''κ''6-리간드로 결합한다. 킬레이트 시스템의 결합 친화도는 킬레이트 각도 또는 바이트 각에 따라 달라진다.
다좌배위 리간드의 착물은 ''킬레이트'' 착물이라고 하며, 일좌배위 리간드로 만들어진 착물보다 안정성이 높다. 이를 ''킬레이트 효과''라고 하며, 엔트로피의 영향으로 인해 하나의 다좌배위 리간드가 여러 개의 일좌배위 리간드를 치환하는 반응이 더 유리하기 때문이다.
킬레이트 효과와 관련된 거대 고리 효과는 중심 원자를 둘러싸 결합하여 중심 원자를 큰 고리의 중앙에 남겨두는 거대 고리 리간드에 의해 나타난다. 거대 고리 리간드가 더 단단하고 덴티시티가 높을수록 거대 고리 착물은 더 안정적이다. 헴은 철 원자가 테트라피롤 거대 고리의 네 개의 질소 원자에 결합된 포르피린 거대 고리의 중앙에 있는 예시이다. 니켈의 디메틸글리옥심산염 착물은 디메틸글리옥심에서 유도된 합성 거대 고리이다.
리간드는 비공유 전자쌍을 가진 작용기(아미노기, 포스피노기, 카르복실기, 티올기 등)를 통해 금속과 배위 결합하여 착물을 형성한다. 배위 원자는 주로 질소, 인, 산소, 황이다. 일산화탄소나 카르벤과 같이 탄소 원자를 배위 원소로 하는 리간드도 존재한다. 금속의 d 전자는 일산화탄소나 에틸렌과 같은 π 궤도의 반결합 궤도를 가진 리간드에 대한 역기여가 일어난다.
다좌 리간드는 두 곳 이상에서 배위하여 킬레이션에 의한 엔트로피 효과로 인해 단좌 착물보다 안정적인 착물을 생성한다. 키랄 다좌 리간드는 불균일 합성에 사용되며, 다양한 키랄 다좌 리간드가 합성되고 있다.
5. 리간드의 세기
일반적으로 리간드는 루이스 염기, 금속은 루이스 산으로 간주된다. 리간드와 금속 이온의 결합은 분자 궤도 함수 이론으로 설명할 수 있다.[6][7] 리간드의 HOMO(최고 점유 분자 궤도)와 금속의 LUMO(최저 비점유 분자 궤도)의 에너지 차이에 따라 결합 세기가 결정된다.
금속과 리간드의 결합은 일련의 분자 궤도를 생성하며, 팔면체 환경에서 5개의 축퇴된 d-궤도는 3개(dxy, dxz, dyz)와 2개(dz², dx²-y²)의 궤도 집합으로 분리된다. 이 두 집합 사이의 에너지 차이를 분리 파라미터 Δo라고 하며, Δo의 크기는 리간드의 장 세기에 의해 결정된다. 강한 장 리간드는 약한 장 리간드보다 Δo를 더 크게 증가시킨다.
리간드는 Δo의 크기에 따라 분광화학 계열 순서로 배열할 수 있다. 리간드의 세기는 금속 착물의 광흡수 스펙트럼 등 다양한 특성에 영향을 미치는데, 이는 타나베-스가노 도표에 설명되어 있다.
리간드가 낮은 에너지 LUMO를 가지는 경우, 역결합을 통해 금속-리간드 결합이 더 안정화될 수 있다. 일산화탄소는 역결합을 통해 금속과 결합하는 대표적인 리간드이다.
6. 일반적인 리간드
사실상 모든 분자와 이온은 금속에 대한 리간드 역할을 할 수 있다. 일반적인 리간드로는 할로젠화물, 슈도할로겐화물 같은 음이온 리간드와 암모니아, 일산화탄소, 물 같은 중성 리간드가 있다. 단순 유기 종 또한 음이온(RO−, RCO2−)이나 중성(R2O, R2S, R3−''x''NH''x'', R3P)으로 매우 일반적이다.
리간드와 금속 이온의 결합은 분광화학 계열에 따라 세기가 달라지는데, 금속 이온은 특정 리간드에 우선적으로 결합한다. 일반적으로 '경성' 금속 이온은 약한 장 리간드를 선호하는 반면, '연성' 금속 이온은 강한 장 리간드를 선호한다.
리간드는 비공유 전자쌍을 가진 작용기를 통해 금속과 배위 결합하며, 아미노기, 포스피노기, 카르복실기, 티올기 등이 대표적이다. 배위 원자는 주로 질소, 인, 산소, 황이며, 일산화탄소나 카벤처럼 탄소 원자를 배위 원소로 하는 리간드도 존재한다.[6][7] 금속의 d 전자는 일산화탄소나 에틸렌과 같은 π 궤도의 반결합 궤도를 가진 리간드에 대한 역기여가 일어난다.
또한, 리간드에는 배위 부위를 한 곳에만 가지는 단좌 리간드 외에, 두 곳 이상에서 배위하는 다좌 리간드가 있다. 다좌 리간드에 의해 생성되는 착물은 킬레이션에 의한 엔트로피 효과에 의해 단좌 착물보다 안정적이다.
일반적인 몇 가지 리간드의 예시는 다음과 같다.