구조생물학
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
구조생물학은 생체 분자의 3차원 구조를 연구하는 학문으로, X선 결정학, 핵자기 공명(NMR), 극저온 전자 현미경(cryo-EM) 등의 기술을 활용한다. 1912년 X선 회절 실험을 시작으로 DNA 이중 나선 구조 규명, 단백질 구조 분석 기술 발전, 컴퓨터 및 측정 장비의 발전과 더불어 획기적인 발전을 이루었다. 구조생물학은 질병 기전 이해, 신약 개발, 생체 기능 조절 등 다양한 분야에 기여하며, 특히 알츠하이머병, 파킨슨병, HIV/AIDS, 암 등의 치료법 개발에 중요한 역할을 한다.
더 읽어볼만한 페이지
- 구조생물학 - 기본단위체
기본단위체(프로토머)는 생물학적 시스템에서 기능하는 특정 분자나 복합체를 이루는 기본 단위체로서, 헤모글로빈, 아스파르트산 카바모일기전이효소, 바이러스 캡시드, HIV-1 프로테아제 등이 그 예시이며, 단백질 구조 안정성, 효소 활성 조절, 바이러스 캡시드 형성 등 다양한 생명 현상에 관여한다. - 구조생물학 - 결합 부위
단백질의 결합 부위는 리간드와 특이적으로 상호작용하여 생화학적 과정에서 기능적 변화를 유발하는 특정 영역으로, 활성 부위나 알로스테릭 부위 등으로 나뉘며 신약 개발 및 질병 기전 연구에 응용되고 있다. - 단백질 구조 - 메틸화
메틸화는 메틸기를 분자에 첨가하는 과정으로, 생물학에서 유전자 발현 조절 등 생명현상에 관여하고 유기화학에서 유기 합성에 활용되며, 다양한 생물종에 존재하는 중요한 생리적 과정이다. - 단백질 구조 - 녹색 형광 단백질
녹색 형광 단백질(GFP)은 해파리에서 발견된 단백질로, 특정 파장의 빛을 흡수하여 녹색 형광을 방출하며, 자체 발색단 형성 능력과 유전자 조작을 통한 개량형 개발로 생물학 연구에서 리포터 유전자로 널리 사용되지만, 실험 결과 해석 시 주의가 필요하고 대체 기술 또한 개발 중이다. - 분자생물학 - 단백질
단백질은 아미노산 중합체로 생체 구조 유지와 기능에 필수적이며, 아미노산 서열에 따라 고유한 3차원 구조를 형성하여 효소, 구조, 수송, 저장, 수축, 방어, 조절 단백질 등 다양한 기능을 수행하고, 인체 내에서 건강 유지와 질병 예방에 중요한 역할을 하는 필수 영양소이다. - 분자생물학 - 의학
의학은 질병의 진단, 예후, 치료, 예방을 연구하는 과학 및 실천 분야이며, 고대부터 발전하여 현대에는 다양한 전문 분야로 세분화되고 첨단 기술 발전에 따라 혁신적인 변화를 겪고 있다.
| 구조생물학 | |
|---|---|
| 개요 | |
| 학문 분야 | 분자생물학, 생화학, 물리학의 융합 학문 |
| 연구 대상 | 생체 분자의 3차원 구조 및 동역학 |
| 주요 연구 방법 | X선 결정학 NMR 분광법 극저온 전자 현미경 단백질 구조 예측 (계산 생물학적 방법) |
| 상세 내용 | |
| 정의 | 생체 분자의 분자 구조를 연구하는 분자생물학의 한 분야 |
| 주요 연구 대상 | 단백질 핵산 (DNA, RNA) 탄수화물 지질 |
| 연구 목표 | 생체 분자의 구조와 기능 간의 관계 규명 |
| 활용 분야 | 신약 개발 질병 치료 생명 현상 이해 |
| 역사 | X선 회절을 이용한 DNA 구조 규명 (1953년, 제임스 왓슨과 프랜시스 크릭) |
| 발전 | 저온 전자 현미경 기술 발전으로 막단백질 등 거대 분자 복합체의 구조 분석 가능 |
| 관련 분야 | 계산 생물학 생물정보학 분자 모델링 |
| 연구 방법 | |
| 실험적 방법 | X선 결정학: 분자 구조를 원자 수준에서 밝힘 NMR: 용액 상태의 분자 구조와 동역학 연구 극저온 전자 현미경: 생체 분자를 극저온 상태로 유지하여 구조 분석 |
| 이론적 방법 | 단백질 구조 예측: 아미노산 서열로부터 단백질 3차원 구조 예측 분자 동역학: 분자의 움직임과 상호 작용 시뮬레이션 |
| 관련 학문 분야 | |
| 주요 관련 학문 | 분자생물학 생화학 물리학 화학 정보학 |
| 세부 관련 학문 | 결정학 분광학 전자 현미경 계산화학 생물정보학 |
| 참고 문헌 | |
2. 역사와 발전
최근에는 생물학적 구조를 모델링하고 연구하기 위해 계산 방법이 개발되었다. 예를 들어, 분자 역학(MD)은 생물학적 분자의 동적 움직임을 분석하는 데 일반적으로 사용된다. 1975년, MD를 사용한 생물학적 접힘 과정의 첫 번째 시뮬레이션이 네이처에 게재되었다.[18] X선 자유 전자 레이저의 개발로 생물학적 분자의 역학 및 움직임 분석이 가능해졌으며,[13] 합성 생물학 지원에 구조 생물학이 활용되고 있다.[14] 최근, 단백질 구조 예측은 알파폴드라는 새로운 기계 학습 방법에 의해 크게 개선되었다.[19] 일부에서는 계산적 접근 방식이 구조 생물학 연구 분야를 선도하기 시작했다고 주장한다.[20]
일본에서 최초로 얻어진 단백질 입체 구조는 가다랭이심근의 시토크롬 c이다. 현재는 유전자 공학적으로 대장균 발현계에서 재조합 단백질을 대량으로 생산할 수 있으며, 단백질 결정화 과정도 체계화되었다. 방사광이라는 강력하고 파장 선택 가능한 X선 광원이 이용되었고, 헨드릭슨에 의해 새로운 MAD법이라는 위상법이 개발된 것과 셀렌화 단백질의 이용이 개발됨으로써 1990년대에 해석 능력이 기하급수적으로 증가했다. 또한, 회절 강도 데이터 처리, 위상 결정, 구조 정밀화 등의 과정이 비약적으로 발전한 소프트웨어와 그래픽 기술을 포함한 컴퓨터의 성능 향상으로 단백질 구조 데이터 뱅크([http://www.rcsb.org/pdb/ PDB])에 등록되는 단백질 입체 구조는 해마다 증가하고 있다.
2. 1. 초기 발전
1912년 막스 폰 라우에는 결정화된 황산구리에 X선을 쪼여 회절 패턴을 생성했다.[6] 이 실험은 X선 결정학의 발전과 생물학적 구조 탐구에 활용되는 결과를 낳았다.[7] 1951년, 로절린드 프랭클린과 모리스 윌킨스는 X선 회절 패턴을 사용하여 데옥시리보핵산(DNA)의 첫 번째 이미지를 얻었다. 제임스 왓슨과 프랜시스 크릭은 1953년 이 기술을 사용하여 DNA의 이중 나선 구조를 모델링했으며, 1962년 윌킨스와 함께 노벨 생리의학상을 수상했다.[8]펩신 결정은 테오도르 스베드베리에 의해 X선 회절에 사용하기 위해 결정화된 최초의 단백질이었으며, 그는 1962년 노벨 화학상을 수상했다.[9] 최초의 단백질 3차 구조인 미오글로빈의 구조는 1958년 존 켄드루에 의해 발표되었다.[10] 이 당시 단백질 구조 모델링은 오크로마나 와이어 모델을 사용하여 수행되었다.[11] 1970년대 후반 CCP4와 같은 모델링 소프트웨어의 발명으로,[12] 현재는 컴퓨터의 도움을 받아 모델링이 이루어진다.
1930년대 후반과 1940년대 초, 이시도어 라비, 펠릭스 블로흐, 에드워드 밀스 퍼셀의 연구를 통해 핵자기 공명(NMR)이 개발되었다. 현재 고체 핵자기 공명은 단백질의 구조와 동적 특성(단백질 NMR)을 결정하기 위해 구조 생물학 분야에서 널리 사용되고 있다.[15]
1990년, 리처드 헨더슨은 극저온 전자 현미경 (cryo-EM)을 사용하여 박테리오로돕신의 최초 3차원, 고해상도 이미지를 제작했다.[16] 그 이후로, cryo-EM은 생물학적 이미지의 3차원, 고해상도 구조를 결정하는 데 점점 더 널리 사용되는 기술로 부상했다.[17]
광학 현미경으로 관찰 가능한 세포와 '''구조 생물학'''('''X선 결정 구조 분석''', '''NMR''', 극저온 전자 현미경, 전자 회절 등)이 비교적 용이한 저분자 생체 물질 (지방산, 보조 효소 등)에 관한 분자 구조 연구는 비교적 오래전부터 발전해 왔다. 특히 전자 현미경이 개발된 후에는 비교적 대형 생체 분자 (리보솜 등) 정도의 크기를 관찰할 수 있게 되었다.
그러나 분자 생물학이 발전하기 전 반세기 전까지는 생체의 주요 성분으로 알려진 단백질 및 DNA 등 핵산의 생체 고분자의 입체 구조에 관한 지식은 거의 알려지지 않았다.
1953년 왓슨과 크릭이 유전자의 본체인 DNA의 구조를 X선 회절 사진 등의 정보로부터 2중 나선임을 밝혀냈고(X선 회절상을 실제로 촬영한 것은 로절린드 프랭클린), DNA 2중 나선 구조를 바탕으로 유전 정보가 자손에게 전달되는 방식을 명확히 제시했다. 제안된 중심 원리에 의해 분자 생물학은 여명기에서 비약적인 발전을 시작한다.
단백질의 경우, X선 회절 실험으로 얻어지는 회절 강도 데이터로부터 '''위상 결정'''을 하기까지의 과정보다 단순히 단백질의 '''결정화'''에 대량의 단백질이 필요한 것이 걸림돌이 되어, 처음에는 미오글로빈, 리소짐 등이 시험되었다.
2. 2. 핵자기 공명 (NMR) 기술의 발전
1930년대 후반과 1940년대 초, 이시도어 라비, 펠릭스 블로흐, 에드워드 밀스 퍼셀의 연구를 통해 핵자기 공명(NMR)이 개발되었다.[15] 고체 핵자기 공명은 단백질의 구조와 동적 특성(단백질 NMR)을 결정하기 위해 구조 생물학 분야에서 널리 사용되고 있다.[15]컴퓨터의 발전과 대장균 발현계를 이용하여 안정 동위 원소를 단백질에 용이하게 넣을 수 있게 됨으로써, NMR은 분자량 5만 정도의 단백질까지 다룰 수 있게 되었다.
2. 3. 극저온 전자 현미경 (cryo-EM) 기술의 발전
1990년 리처드 헨더슨은 극저온 전자 현미경(cryo-EM)을 사용하여 박테리오로돕신의 최초 3차원, 고해상도 이미지를 제작했다.[16] 그 이후로, cryo-EM은 생물학적 이미지의 3차원, 고해상도 구조를 결정하는 데 점점 더 널리 사용되는 기술로 부상했다.[17]2. 4. 한국의 구조생물학 연구
일본에서는 2002년부터 5년간 3000종류의 단백질 입체 구조 분석을 목표로 하는 '''단백질 3000 프로젝트'''가 진행되었다.[27][28] 이 프로젝트의 거점으로 세계 최대의 싱크로트론 방사광 시설인 SPring-8(효고현 사요군)과 포톤 팩토리(고 에너지 가속기 연구 기구, 이바라키현 쓰쿠바시)가 방사광 X선 결정 구조 분석 데이터 측정에 사용되었고, 이화학연구소 요코하마 연구소 GSC (가나가와현 요코하마시)의 NMR 시설에서 NMR을 사용하였다. 일본 전국의 대학, 연구 기관 등 구조 생물 관련 다수의 연구 그룹에 의해 밤낮으로 단백질의 입체 구조 분석이 이루어졌다.일본의 구조 생물학 관련 프로젝트로는 [http://www.tanpaku.org/ 타겟 단백질 연구 프로그램](2007년~2011년), 창약 등 지원 기술 기반 플랫폼 사업 (PDIS, 2012년~2016년), [https://www.binds.jp/ 창약 등 첨단 기술 지원 기반 플랫폼](BINDS, 2017년~2021년, 2022년~2026년)이 실시되어 왔다.
3. 구조 해석 방법
생체 분자는 매우 작아, 가장 성능이 좋은 광학 현미경으로도 자세히 관찰하기 어렵다. 따라서 구조 생물학자들은 일반적으로 수백만 개의 동일한 분자에 대한 측정을 동시에 수행하여 구조를 결정한다. 구조 해석에 사용되는 주요 방법은 다음과 같다.
- 질량 분석법
- 거대 분자 결정학
- 중성자 회절
- 단백질 분해
- 단백질 핵자기 공명 분광법 (NMR)
- 전자 상자성 공명 (EPR)
- 극저온 전자 현미경 (cryoEM)
- 전자 결정학 및 미세 결정 전자 회절
- 다중 각도 광 산란
- 소각 산란
- 초고속 레이저 분광법
- 이방성 테라헤르츠 마이크로 분광법
- 2차원 적외선 분광법
- 이중 편광 간섭계 및 원형 이색성
이러한 방법들은 대부분 거대 분자의 "네이티브 상태"를 연구하는 데 사용된다. 그러나 변형된 방법을 통해 새로운 분자나 변성된 분자가 원래 상태를 회복하는 과정을 관찰하기도 한다.
1990년대부터 2010년까지는 X선 결정 구조 해석과 NMR 방법이 주로 사용되었다. 2014년경부터는 극저온 전자 현미경 및 전자 회절을 이용한 구조 결정이 증가하고 있다.
각 방법의 특징은 다음과 같다.
| 해석 기술 | 특징 |
|---|---|
| X선 결정 구조 해석 | 다른 방법에 비해 처리량이 높고 고분해능의 입체 구조 결정을 할 수 있다. |
| NMR | 단백질의 동적 정보를 얻을 수 있다. |
| 극저온 전자 현미경 | 거대한 단백질 복합체의 구조 결정이 가능하다. 결정장에 영향을 받지 않는 용액 상태에서의 구조를 얻을 수 있다. 클러스터링을 이용하여 한 번의 실험으로 여러 컨포메이션의 구조 결정을 할 수 있는 경우도 있다. |
| 전자 회절 | 하전 아미노산의 하전 상태 정보를 얻을 수 있다. 방사광 X선 결정 구조 해석에서 사용하는 결정보다 더 작은 결정(수십~수백 nm)에서 구조 결정을 할 수 있다. |
구조 생물학자들은 생물 정보학을 이용하여 특정 모양을 만드는 DNA 서열 패턴을 찾기도 한다. 소수성 분석을 통해 예측된 막 토폴로지를 기반으로 적분 막 단백질의 구조를 추론할 수도 있다. 단백질 구조 예측을 참조한다.
3. 1. X선 결정학
생체 분자는 가장 진보된 광학 현미경으로도 자세히 볼 수 없을 정도로 작다. 거대 분자 결정학은 구조 생물학자들이 사용하는 구조 결정 방법 중 하나로, 동일한 분자 수백만 개에 대한 측정을 동시에 수행한다.X선 결정 구조 해석(X선 회절)은 단백질 등 생체 분자의 구조 해석을 수행하는 방법이다. X선 결정 구조 해석을 통해 단백질의 구조를 알아내려면 다음과 같은 절차를 거친다.
1. 목표 단백질의 대량 조제
2. 목표 단백질의 '''결정화'''
3. X선 회절(X선 조사) · 회절 강도 측정
4. '''위상 결정''' (회절 강도에서 결정 구조 인자를 구하기 위해서는 위상 정보가 필요하다. 위상은 중원자 동형 치환법, 이상 분산을 이용한 방법, 또는 분자 치환법에 의해 결정한다. 중원자 동형 치환법이나 이상 분산을 이용한 방법을 수행하려면 백금, 금, 수은, 셀렌 등의 화합물로 수식된 단백질 결정이 필요하며, 분자 치환법을 수행하려면 유사 단백질의 입체 구조가 이미 얻어져 있어야 한다.)
5. 전자 밀도 계산 (결정 구조 인자에서 푸리에 합성으로 전자 밀도를 계산한다.)
6. 분자 모델링
7. 구조 정밀화 (수동으로 구축한 모델에는 왜곡이나 오류가 있다. 따라서, 사람이 수정한 작업과 원자간 거리에 구속 조건을 부여하여 컴퓨터 계산으로 가장 왜곡이 적은 구조로 수정하는 작업을, 구조 인자와 잘 일치하는 구조로 수렴할 때까지 계속한다.)
이상의 절차에서 가장 시간이 오래 걸리는 단계는 '''결정화''' 및 '''위상 결정''' 과정이다. 결정화는 예전보다 쉬워졌지만 100% 성공하는 것은 아니며, 얻어진 결정이 구조 해석에 사용할 수 있는지는 위상 결정을 할 때까지 알 수 없다. 위상 결정은 컴퓨터의 능력 향상에 따라 속도가 빨라지고 있지만 현재도 어려운 과정 중 하나이다.
현재(2021년) 위상 결정법으로 주로 사용되는 기법은 분자 치환법 및 단파장 이상 분산법(SAD법)이 주류이다. 많은 경우, 단백질 구조 데이터 뱅크에 공개되어 있는 유사 구조를 이용할 수 있으므로, 이 경우에는 먼저 분자 치환법을 이용한다. 이용 가능한 유사 구조가 없는 경우에는 SAD법을 사용하여 실험적으로 위상 결정하는 경우가 많다. 또한, 새로운 위상 결정 수단으로 [https://deepmind.com/ DeepMind]가 개발한 AlphaFold2[30]가 [https://www.itmedia.co.jp/news/articles/2107/20/news136.html 출력하는 구조를 분자 치환법의 주형 구조로 이용하는 방법]도 있다.
회절 강도 결정에는 과거에는 감광 필름을 사용했고, 2010년경까지는 감광 필름보다 고감도이고 다이내믹 레인지가 큰 '''이미징 플레이트'''나 판독 속도가 빠른 '''CCD''' 등이 주로 사용되었다. 최근(2021년 현재)에는 HPC(Hybrid Photon Counting) 혹은 PAD(Pixel Array Detector)라고 불리는 X선의 광자를 직접 검출하는 [https://www.dectris.com/technology/hybrid-photon-counting/direct-detection/ 검출기]가 주류이다.
X선 결정 구조 해석의 특징은, 결정화된 단백질의 입체 구조가 결정되고, 아미노산 배좌가 엄밀하게 결정된다는 것이다. 컨포메이션의 변화 모습을 파악할 수는 없지만, 결정화 조건을 변경함으로써 단백질의 다양한 상태를 정적으로 파악할 수 있다. 또한, 라우에법에 의해 밀리초 등의 짧은 시간 상태를 파악하려는 시도도 이루어지고 있지만, 모든 단백질 결정에 적용할 수 있는 것은 아니며, 과제도 많다. 최근(2021년 현재)에는 X선 자유 전자 레이저에 의한 시분할 구조 해석을 위한 기술 개발이 적극적으로 이루어지고 있으며, 몇몇 단백질[31][32]에서 상세한 시분할 구조에 대한 논의가 이루어지고 있다.
3. 2. 핵자기 공명 (NMR)
생체 분자는 매우 작아, 가장 성능이 좋은 광학 현미경으로도 자세히 관찰하기 어렵다. 따라서 구조 생물학자들은 일반적으로 수백만 개의 동일한 분자에 대한 측정을 동시에 수행하여 구조를 결정한다. 핵자기 공명 (NMR)은 이러한 방법 중 하나이다.[29]1990년대부터 2010년까지는 인접한 원자 간의 거리와 각도를 조사하는 방법인 NMR이 일반적이었다. NMR은 단백질의 동적 정보를 얻을 수 있다는 특징이 있다.
NMR 방법으로 단백질의 구조 분석을 수행하는 절차는 다음과 같다.
1. 안정 동위 원소를 포함하는 목표 단백질을 준비한다.
2. NMR 스펙트럼을 측정한다.
3. 스펙트럼 피크를 개별 아미노산에 대응시킨다.
4. 원자 간 거리 및 각도를 측정한다.
5. 위의 조건을 만족하는 입체 구조를 계산한다.
6. 구조의 세부 사항을 구축한다.
위 절차에서 속도 제한 요인이 되는 것은 3번 과정, 즉 스펙트럼 피크의 귀속이다. 이는 X선 결정 구조 분석에서 위상 결정에 해당한다. 또한, NMR 실험 데이터의 거칠기에 따라 컴퓨터에 의한 입체 구조 계산이 복잡해지는 경우도 있다.
NMR의 특징은 고농도의 용액 속 단백질을 시료로 하기 때문에 용액 중의 요동을 어느 정도 파악할 수 있다는 점이다. 역동적인 컨포메이션 변화를 포착하는 것은 어렵지만, 보다 가동성이 높은 부위 등의 측정이 가능하다. X선 결정 구조 분석과 비교하면 안정 동위 원소 표지 단백질의 준비 비용이 높다는 점, 고분자량 단백질의 구조 분석에 취약하다는 점 등이 단점이다.
3. 3. 극저온 전자 현미경 (cryo-EM)
생체 분자는 가장 진보된 광학 현미경으로도 자세히 볼 수 없을 정도로 작다. 구조 생물학자들이 구조를 결정하기 위해 사용하는 방법 중 하나로 극저온 전자 현미경 (cryoEM)이 있다. 2010년대 중반부터 극저온 전자 현미경에 의한 단입자 분석 및 전자 회절을 통해 구조 결정이 이루어지는 경우가 증가하고 있다.극저온 전자 현미경은 거대한 단백질 복합체의 구조 결정이 가능하다는 점과, 결정장에 영향을 받지 않는 용액 상태에서의 구조를 얻을 수 있다는 점이 특징이다. 또한, 클러스터링을 이용하여 한 번의 실험으로 여러 컨포메이션의 구조 결정을 할 수 있는 경우도 있다.
3. 4. 기타 방법
생체 분자는 가장 진보된 광학 현미경으로도 자세히 볼 수 없을 정도로 작다. 구조 생물학자들이 구조를 결정하기 위해 사용하는 방법은 일반적으로 동일한 분자 수백만 개에 대한 측정을 동시에 수행하는 것이다. 이러한 방법에는 다음이 포함된다.- 질량 분석법
- 거대 분자 결정학
- 중성자 회절
- 단백질 분해
- 단백질 핵자기 공명 분광법 (NMR)
- 전자 상자성 공명 (EPR)
- 극저온 전자 현미경 (cryoEM)
- 전자 결정학 및 미세 결정 전자 회절
- 다중 각도 광 산란
- 소각 산란
- 초고속 레이저 분광법
- 이방성 테라헤르츠 마이크로 분광법
- 2차원 적외선 분광법
- 이중 편광 간섭계 및 원형 이색성
연구자들은 대부분 이를 사용하여 거대 분자의 "네이티브 상태"를 연구한다. 그러나 이러한 방법의 변형은 또한 새로운 분자 또는 변성 분자가 네이티브 상태를 취하거나 재취하는 것을 관찰하는 데 사용된다. 단백질 접힘 참조.
구조 생물학자들이 구조를 이해하기 위해 취하는 세 번째 접근 방식은 특정 모양을 만들어내는 다양한 DNA 서열 간의 패턴을 찾는 생물 정보학이다. 연구자들은 종종 소수성 분석에 의해 예측된 막 토폴로지를 기반으로 적분 막 단백질의 구조적 측면을 추론할 수 있다. 단백질 구조 예측 참조.
생체 분자의 구조 해석을 수행하는 방법에는 X선 결정 구조 해석(싱크로트론 방사광 사용), NMR, 극저온 전자 현미경, 전자 회절 등이 있다.
1990년대부터 2010년까지는 규칙적으로 배열된 결정에 단파장의 전자기파를 쪼이는 방법(X선 결정 구조 해석)과 인접한 원자 간의 거리와 각도를 조사하는 방법(NMR)이 일반적이었다. 2014년경부터는 이에 더해 극저온 전자 현미경에 의한 단입자 분석 및 전자 회절을 통해 구조 결정이 이루어지는 경우가 증가하고 있다.
각 해석 기술의 특징은 다음과 같다.
| 해석 기술 | 특징 |
|---|---|
| X선 결정 구조 해석 | 다른 방법에 비해 압도적으로 처리량이 높고 고분해능의 입체 구조 결정을 할 수 있다. |
| NMR | 단백질의 동적 정보를 얻을 수 있다. |
| 극저온 전자 현미경 | 거대한 단백질 복합체의 구조 결정이 가능하다. 결정장에 영향을 받지 않는 용액 상태에서의 구조를 얻을 수 있다. 클러스터링을 이용하여 한 번의 실험으로 여러 컨포메이션의 구조 결정을 할 수 있는 경우도 있다. |
| 전자 회절 | 하전 아미노산의 하전 상태 정보를 얻을 수 있다. 방사광 X선 결정 구조 해석에서 사용하는 결정보다 더 작은 결정(수십~수백 nm)에서 구조 결정을 할 수 있다. |
4. 응용 분야
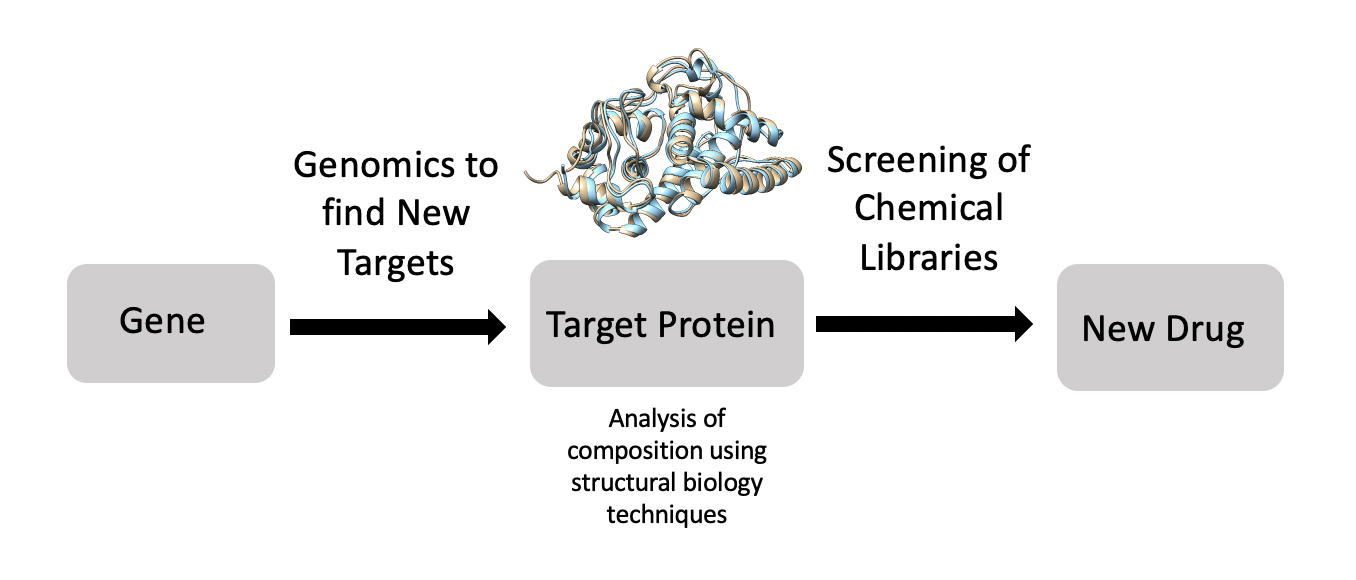
구조생물학은 생물학에 많은 지식을 가져다주었으며, 특히 중요한 기여는 다음과 같다.
- DNA의 이중 나선 구조 해명[33][34]
- ATP 합성 효소 F1 부위의 입체 구조 결정[35]
- 리보솜 대 서브유닛의 상세한 구조 및 번역 과정 해명[36][37][38]
- 박테리오로도신 입체 구조 결정 및 광 구동 과정 해명[39]
- 시토크롬 c 산화 효소(호흡 사슬의 말단 효소) 입체 구조 결정 및 프로톤 펌프 기구 해명[40]
- β2 아드레날린 수용체[41]
- 아쿠아포린[42]
- 칼륨 채널[43]
4. 1. 질병 기전 이해
구조 생물학은 인간 질병의 분자적 구성 요소와 기전을 이해하는 데 크게 기여해 왔다. 예를 들어, 극저온 전자 현미경(cryo-EM)과 고체 핵자기 공명 분광법(ssNMR)은 알츠하이머병, 파킨슨병, 제2형 당뇨병과 관련된 아밀로이드 섬유 응집 연구에 사용되었다.[21] 또한, 과학자들은 극저온 전자 현미경을 이용해 알츠하이머병 환자의 뇌에서 타우 필라멘트의 고해상도 모델을 생성하여, 더 나은 치료법 개발에 기여할 수 있게 되었다.[22] 구조 생물학 도구는 병원체와 숙주 간 상호작용을 설명하는 데에도 사용된다. 예를 들어, 바이러스학자들이 HIV 외피가 인간 면역 반응 회피에 어떻게 기여하는지 이해하는 데 도움을 주었다.[23]구조 생물학은 약물 발견의 중요한 구성 요소이기도 하다.[24] 과학자들은 유전체를 통해 표적을 찾고, 구조 생물학을 활용하여 해당 표적을 연구하며, 적합한 약물을 개발한다. 특히, 리간드-핵자기 공명, 질량 분석법, X선 결정학은 약물 발견에 널리 사용되는 기술이다. 예를 들어, 연구자들은 구조 생물학을 통해 Met (암의 주요 약물 표적인 원암 유전자에 의해 암호화된 단백질)을 더 잘 이해하게 되었다.[25] AIDS 환자 치료를 위한 HIV 표적 연구도 유사하게 진행되었다.[24] 또한, 구조 중심 약물 발견을 통해 미생물 감염에 대한 새로운 항균제 개발도 이루어지고 있다.[24]
4. 2. 신약 개발
구조 생물학은 약물 발견의 중요한 구성 요소이다.[24] 과학자들은 유전체를 사용하여 표적을 식별하고, 구조 생물학을 사용하여 해당 표적을 연구하며, 해당 표적에 적합한 약물을 개발할 수 있다. 특히, 리간드-핵자기 공명, 질량 분석법, X선 결정학은 약물 발견 과정에서 일반적으로 사용되는 기술이다. 예를 들어, 연구자들은 구조 생물학을 사용하여 암에서 중요한 약물 표적인 원암 유전자에 의해 암호화된 단백질인 Met을 더 잘 이해했다.[25] AIDS 환자를 치료하기 위해 HIV 표적에 대한 유사한 연구가 수행되었다.[24] 연구자들은 또한 구조 중심 약물 발견을 사용하여 미생물 감염에 대한 새로운 항균제를 개발하고 있다.[24]
4. 3. 생체 기능 조절
구조 생물학은 인간 질병의 근본적인 분자 구성 요소와 메커니즘을 이해하는 데 큰 기여를 해왔다. 예를 들어, 극저온 전자 현미경(cryo-EM)과 고체 핵자기 공명 분광법(ssNMR)은 알츠하이머병, 파킨슨병, 제2형 당뇨병과 관련된 아밀로이드 섬유의 응집을 연구하는 데 사용되었다.[21] 극저온 전자 현미경은 알츠하이머병 환자의 뇌에서 타우 필라멘트의 고해상도 모델을 생성하는데 사용되어, 향후 더 나은 치료법 개발에 도움이 될 수 있다.[22] 구조 생물학 도구는 병원체와 숙주 간의 상호 작용을 설명하는 데에도 사용될 수 있다. 예를 들어, 바이러스학자들이 HIV 외피가 바이러스가 인간의 면역 반응을 회피하도록 하는 방식을 이해하는 데 기여했다.[23]구조 생물학은 약물 발견의 중요한 구성 요소이기도 하다.[24] 과학자들은 유전체를 사용하여 표적을 식별하고, 구조 생물학을 사용하여 해당 표적을 연구하며, 해당 표적에 적합한 약물을 개발할 수 있다. 특히, 리간드-핵자기 공명, 질량 분석법, X선 결정학은 약물 발견 과정에서 일반적으로 사용되는 기술이다. 예를 들어, 구조 생물학을 사용하여 암에서 중요한 약물 표적인 원암 유전자에 의해 암호화된 단백질인 Met을 더 잘 이해할 수 있었다.[25] AIDS 환자를 치료하기 위해 HIV 표적에 대한 유사한 연구가 수행되었다.[24] 또한, 구조 중심 약물 발견을 사용하여 미생물 감염에 대한 새로운 항균제를 개발하고 있다.[24]
구조생물학은 생물학에 많은 지식을 가져다주었으며, 특히 중요한 것들은 다음과 같다.
5. 과제 및 전망
컴퓨터와 측정 장비의 발전으로 많은 단백질의 구조 분석이 가능해지고 있다. 하지만 결정화는 여전히 실험상 어려운 문제 중 하나이다. 결정화하기 쉬운 단백질은 호열균이나 고도호염균에 많다고 알려져 있으며, 막 단백질 등 불안정한 단백질의 경우 이러한 숙주를 이용하여 발현계를 구축하기도 한다. 2013년경부터 시작된 극저온 전자 현미경의 기술 혁신으로, 이전까지 구조 결정이 불가능했던 단백질의 구조가 다수 밝혀지고 있다. X선 결정 구조 분석에서도 LCP법[44] (지질 메조페이스법)을 이용하여, 이전까지 어려웠던 막 단백질의 구조 분석이 많이 이루어지고 있다. 또한, 방사광 X선, 특히 삽입 광원을 이용한 미소 빔이 사용 가능하게 된 것, 하드웨어, 소프트웨어의 개발[45][46]이 진행되어 측정·분석의 대부분이 자동화된 것으로 실험의 처리량이 획기적으로 향상된 것도 X선 결정 구조 분석의 발전에 크게 기여했다.
단백질의 '''접힘''' ('''폴딩''') 과정 해명이나 단백질의 다이내믹한 컨포메이션 변화에 관해서는 기존의 방법으로는 관측이 어렵다. 접힘 기구에 관해서는 짧은 펩타이드를 컴퓨터 시뮬레이션으로 접히게 하는 방법 등이 있지만, 현실의 접힘 기구를 밝히는 어떠한 방법의 개발이 시급하다. 컨포메이션 변화에 관해서는 단분자 관측 등의 기술을 이용하여 연구하고 있으며, 컴퓨터 시뮬레이션으로 연구하는 예도 있다.
단백질이나 핵산의 입체 구조가 판명되어도, 생물체 내에서 일어나고 있는 반응의 소과정까지 이해하고 있는 상황이라고는 할 수 없다. 정적인 입체 구조에서, 보다 동적인 단백질의 거동을 측정하는 것이 요구되고 있다.
6. 관련 용어
- 생물물리학
- 단분자 세포 생물학
- 분자생물학
- 박테리오로돕신
참조
[1]
웹사이트
Journal of Structural Biology {{!}} ScienceDirect.com by Elsevier
https://www.scienced[...]
2024-04-18
[2]
논문
Structural Biology: A Century-long Journey into an Unseen World
2015-07-03
[3]
논문
The evolution of protein NMR
2013-01-01
[4]
서적
Foundations of Structural Biology.
Elsevier
2000
[5]
논문
Molecular dynamics simulations of biomolecules
2002-09
[6]
논문
Structural Biology: A Century-long Journey into an Unseen World
2015-07
[7]
논문
Highly accurate protein structure prediction with AlphaFold
2021-07-15
[8]
웹사이트
The Nobel Prize in Physiology or Medicine 1962
https://www.nobelpri[...]
2022-10-01
[9]
논문
A brief history of macromolecular crystallography, illustrated by a family tree and its Nobel fruits
2014-09
[10]
논문
A three-dimensional model of the myoglobin molecule obtained by x-ray analysis
1958-03
[11]
논문
Developments in x-ray crystallographic structure determination of biological macromolecules
2014-03
[12]
웹사이트
About CCP4
http://legacy.ccp4.a[...]
2021-04-02
[13]
논문
X-ray science: The big guns
2014-01
[14]
논문
Structural data in synthetic biology approaches for studying general design principles of cellular signaling networks
2012-11
[15]
논문
The way to NMR structures of proteins
2001-11
[16]
논문
Model for the structure of bacteriorhodopsin based on high-resolution electron cryo-microscopy
1990-06
[17]
논문
Revolutionary cryo-EM is taking over structural biology
2020-02-10
[18]
논문
Computer simulation of protein folding
1975-02
[19]
논문
Highly accurate protein structure prediction with AlphaFold
2021-08
[20]
논문
Computational Structural Biology: Successes, Future Directions, and Challenges
2019-02-12
[21]
논문
A new era for understanding amyloid structures and disease
http://eprints.white[...]
2018-12
[22]
논문
Cryo-EM structures of tau filaments from Alzheimer's disease
2017-07-13
[23]
논문
The structural biology of HIV-1: mechanistic and therapeutic insights
2012-03-16
[24]
논문
Structural Biology and the Design of New Therapeutics: From HIV and Cancer to Mycobacterial Infections: A Paper Dedicated to John Kendrew
2017-08
[25]
논문
Structures and diseases
2008-02
[26]
서적
Foundations of Structural Biology
Elsevier
2000
[27]
웹사이트
タンパク3000 [生命科学系主要プロジェクト一覧]
http://togodb.biosci[...]
国立研究開発法人[[科学技術振興機構]]バイオサイエンスデータベースセンター
2020-07-30
[28]
논문
RIKEN aids international structural genomics efforts
https://pubmed.ncbi.[...]
2007-01-04
[29]
논문
Electron crystallography of ultrathin 3D protein crystals: Atomic model with charges
https://www.pnas.org[...]
2015-03-17
[30]
논문
Highly accurate protein structure prediction with AlphaFold
https://www.nature.c[...]
2021-08
[31]
논문
A three-dimensional movie of structural changes in bacteriorhodopsin
https://www.sciencem[...]
2016-12-23
[32]
논문
Time-resolved serial femtosecond crystallography reveals early structural changes in channelrhodopsin
https://elifescience[...]
2021-03-23
[33]
논문
Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid
https://pubmed.ncbi.[...]
1953-04-25
[34]
논문
Molecular structure of deoxypentose nucleic acids
https://pubmed.ncbi.[...]
1953-04-25
[35]
논문
Structure at 2.8 Â resolution of F1-ATPase from bovine heart mitochondria
https://www.nature.c[...]
1994-08
[36]
논문
The Complete Atomic Structure of the Large Ribosomal Subunit at 2.4 A Resolution
https://www.sciencem[...]
2000-08-11
[37]
논문
Structure of Functionally Activated Small Ribosomal Subunit at 3.3 Å Resolution
https://linkinghub.e[...]
2000-09
[38]
논문
Structure of the 30S ribosomal subunit
http://www.nature.co[...]
2000-09
[39]
논문
Structure of the protein subunits in the photosynthetic reaction centre of Rhodopseudomonas viridis at 3Å resolution
https://www.nature.c[...]
1985-12
[40]
논문
The Whole Structure of the 13-Subunit Oxidized Cytochrome c Oxidase at 2.8 A
https://www.sciencem[...]
1996-05-24
[41]
논문
Crystal structure of the β2 adrenergic receptor–Gs protein complex
https://www.nature.c[...]
2011-09
[42]
논문
Structural determinants of water permeation through aquaporin-1
https://www.nature.c[...]
2000-10
[43]
논문
The Structure of the Potassium Channel: Molecular Basis of K+ Conduction and Selectivity
https://www.sciencem[...]
1998-04-03
[44]
논문
Lipidic cubic phases: A novel concept for the crystallization of membrane proteins
https://www.pnas.org[...]
1996-12-10
[45]
논문
ZOO : an automatic data-collection system for high-throughput structure analysis in protein microcrystallography
http://scripts.iucr.[...]
2019-02-01
[46]
논문
KAMO: towards automated data processing for microcrystals
http://scripts.iucr.[...]
2018-05-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com