다이엔
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
다이엔은 두 개의 이중 결합을 포함하는 유기 화합물의 일종으로, 이중 결합의 상대적 위치에 따라 누적, 공액, 비공액 다이엔으로 분류된다. 다이엔은 불포화 탄소 원자를 대체하는 헤테로원자를 포함할 수 있으며, 폴리엔과 유사한 성질을 가진다. 다이엔은 중합, 고리화 첨가, 첨가 반응 등 다양한 반응에 참여하며, 산업적으로 부타디엔과 같은 합성 고무의 전구체로 사용된다. 또한, 유기금속 화학에서 리간드로도 활용된다.
더 읽어볼만한 페이지
| 다이엔 | |
|---|---|
| 화학 정보 | |
| 화학식 | CnH2n-2 |
| 분자량 | 가변적 |
| IUPAC 명명법 | 알카다이엔 |
| 다른 이름 | 다이올레핀 |
| 구조 및 이성질체 | |
| 종류 | 축적된 분리된 공액된 |
| 관련 화합물 | |
| 관련 화합물 | 알켄 알카인 폴리엔 |
2. 종류
다이엔은 이중 결합의 상대적 위치에 따라 세 가지 종류로 나눌 수 있다.[1]
- 누적 다이엔: 이중 결합이 공통 원자를 공유하며, 알렌이라고도 한다.
- 공액 다이엔: 하나의 단일 결합으로 분리된 공액 이중 결합을 가진다. 공명으로 인해 다른 다이엔보다 더 안정적이다.
- 비공액 다이엔: 두 개 이상의 단일 결합으로 분리된 이중 결합을 가진다. 이성질체 공액 다이엔보다 덜 안정하며, '분리된 다이엔'이라고도 한다.
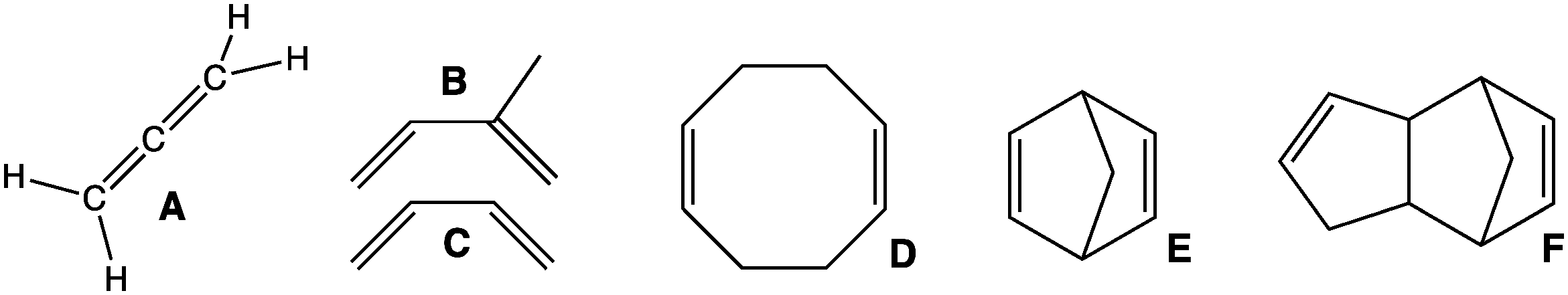
''골드 북'' 정의에 따르면, "다이엔"은 불포화 탄소 원자를 대체하는 하나 이상의 헤테로원자를 포함할 수 있으며, 더 구체적으로 '헤테로다이엔'이라고 불릴 수 있는 구조를 제공한다.[1]
두 개 이상의 이중 결합을 포함하는 화합물은 폴리엔이라고 하며, 폴리엔과 다이엔은 많은 성질을 공유한다. 다이엔의 일반식은 CnH2n−2이며, 와이팅 반응으로 합성된다.
2. 1. 누적 다이엔
다이엔은 이중 결합의 상대적 위치에 따라 세 가지 종류로 나눌 수 있다.[1]- '''누적 다이엔'''은 이중 결합이 공통 원자를 공유한다. 그 결과는 더 구체적으로 알렌이라고 한다.
- '''공액 다이엔'''은 하나의 단일 결합으로 분리된 공액 이중 결합을 가지고 있다. 공액 다이엔은 공명으로 인해 다른 다이엔보다 더 안정적이다.
- '''비공액 다이엔'''은 두 개 이상의 단일 결합으로 분리된 이중 결합을 가지고 있다. 일반적으로 이성질체 공액 다이엔보다 덜 안정하다. 이것은 또한 '''분리된''' 다이엔이라고도 한다.

2. 2. 공액 다이엔
다이엔은 이중 결합의 상대적 위치에 따라 세 가지 종류로 나눌 수 있다.[1]# '''누적 다이엔'''은 이중 결합이 공통 원자를 공유한다. 그 결과는 더 구체적으로 알렌이라고 한다.
# '''공액 다이엔'''은 하나의 단일 결합으로 분리된 공액 이중 결합을 가지고 있다. 공액 다이엔은 공명으로 인해 다른 다이엔보다 더 안정적이다.
# '''비공액 다이엔'''은 두 개 이상의 단일 결합으로 분리된 이중 결합을 가지고 있다. 일반적으로 이성질체 공액 다이엔보다 덜 안정하다. 이것은 또한 '''분리된''' 다이엔이라고도 한다.
''골드 북'' 정의에 따르면, "다이엔"은 불포화 탄소 원자를 대체하는 하나 이상의 헤테로원자를 포함할 수 있으며, 더 구체적으로 ''헤테로다이엔''이라고 불릴 수 있는 구조를 제공한다.[1]
유기 화학에서 공액 다이엔은 기능적인 관능기이다. 다이엔의 일반식은 CnH2n−2이다. 또한, 다이엔은 와이팅 반응으로 합성된다.
2. 3. 비공액 다이엔 (고립 다이엔)
비공액 다이엔은 '''고립 다이엔'''이라고도 하며, 2개 이상의 단일 결합에 의해 이중 결합끼리 떨어져 있다. 이성질체 공액 다이엔보다 덜 안정하며, '''분리된 다이엔'''이라고도 한다.[1]2. 4. 헤테로다이엔
''골드 북'' 정의에 따르면, "다이엔"은 불포화 탄소 원자를 대체하는 하나 이상의 헤테로원자를 포함할 수 있으며, 더 구체적으로 ''헤테로다이엔''이라고 불릴 수 있는 구조를 제공한다.[1] 헤테로다이엔은 1개 이상의 불포화탄소 원자가 헤테로 원자로 치환된 다이엔이다.은 이중 결합이 2개의 탄소 원자에 의해 떨어진 비공액 디엔이다.
- -은 단순한 공액 디엔이다.
- -은 가장 단순한 알렌이다.
3. 구조
다이엔의 시스체와 트랜스체는 다른 화합물과는 다른 이름이 있으며, 각각 '''s-시스''', '''s-트랜스'''라고 한다. "s"는 단일 결합(single bond)의 머리글자이며, 단일 결합이 시스인지 트랜스인지에 따라 결정되며 이중 결합의 위치와는 관계가 없다.
또한, 시스체는 고무 탄성을 가지며, 트랜스체는 고무 탄성을 가지지 않는다. 이것은 시스체가 트랜스체에 비해 둥글게 수축된 상태를 취하기 쉽기 때문이다. 시스체에서 둥글게 수축된 상태는 엔트로피 (무질서도)가 크며, 늘어난 상태는 엔트로피가 작기 때문에, 시스체를 늘리면 원래 상태로 돌아가려고 수축한다.
4. 합성
산업 규모에서 부타디엔은 부탄(butane)의 열분해를 통해 제조된다. 이와 유사하게 선택성이 없는 공정으로 디시클로펜타디엔(dicyclopentadiene)은 콜타르(coal tar)에서 얻어진다.[2]
실험실에서는 탈할로겐화수소반응 및 축합 반응(Condensation (chemistry))과 같이 더 정교하고 미세한 공정이 사용된다. 화이팅 반응(Whiting reaction)과 같은 수많은 유기 반응 방법이 개발되었다. 비공액 디엔 계열은 공액 디엔의 올리고머화 및 이량체화(Dimer (chemistry))로부터 유도된다. 예를 들어, 1,5-사이클로옥타디엔과 4-비닐사이클로헥센은 1,3-부타디엔(1,3-Butadiene)의 이량체화에 의해 생성된다.[2]
디엔을 포함하는 지방산은 생합성에 의해 아세틸 CoA로부터 합성된다.[2]
α,ω-디엔의 화학식은 (CH2)n(CH=CH2)2이다. 이들은 산업적으로 고리형 디엔의 에텐 분해 반응에 의해 제조된다. 예를 들어, 1,5-헥사디엔(1,5-Hexadiene)과 1,9-데카디엔은 유용한 가교제 및 합성 중간체로, 각각 1,5-사이클로옥타디엔(1,5-Cyclooctadiene)과 사이클로옥텐으로부터 생성된다. 촉매는 알루미나 상의 Re2O7에서 유도된다.[2]
5. 반응 및 이용
다이엔은 중합, 고리화 첨가, 첨가, 복분해, 산-염기 반응, 리간드 등 다양한 반응에 사용된다.
- 중합 반응: 알켄의 중합에 사용되며, 특히 1,3-부타디엔은 합성 고무의 전구체, 아이소프렌은 천연 고무의 전구체로 사용된다. 클로로프렌도 관련 화합물이다.
- 고리화 첨가 반응: 디엘스-알더 반응과 같은 고리화 첨가 반응에 사용된다. 다니셰프스키 다이엔과 같은 특수 다이엔은 천연물 합성에 활용된다.
- 첨가 반응: 브로민, 수소와 같은 시약을 첨가하여 1,2-첨가 및 1,4-첨가 생성물을 만든다. 극성 시약을 첨가하면 복잡한 구조가 생성될 수 있다.[3]
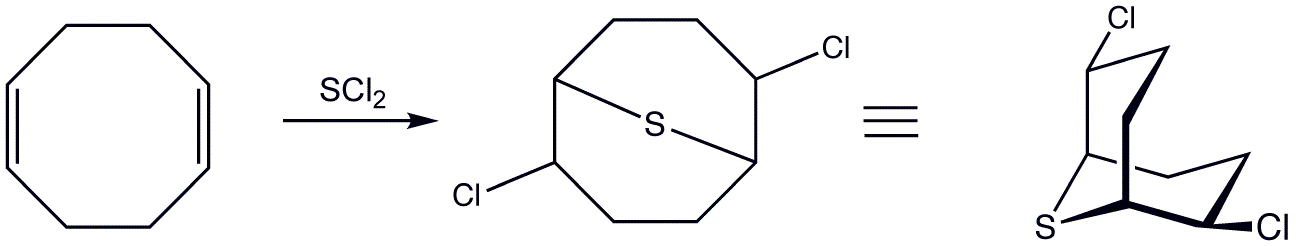
- 복분해 반응: 비공액 다이엔은 고리 닫힘 반응에 사용되며, 이 반응에는 금속 촉매가 필요하다.
- 산성도: 이중 결합에 인접한 위치는 생성된 알릴 음이온이 공명에 의해 안정화되기 때문에 산성을 띤다. 1,4-다이엔의 3번 위치 또는 1,3-다이엔의 5번 위치에서 양성자를 제거하면 펜타다이엔일 음이온이 생성된다. 사이클로펜타다이엔에서 양성자를 제거하면 사이클로펜타다이엔일 음이온이 생성된다.

- 리간드: 다이엔은 유기금속 화학에서 널리 사용되는 배위자이다. 비스(시클로옥타디엔)니켈(0)의 시클로옥타디엔("cod") 배위자는 불안정하다. 어떤 경우에는 다이엔이 관찰자 배위자 역할을 하여 촉매 주기 전체에 걸쳐 배위된 상태로 남아 제품 분포에 영향을 미친다. 키랄 다이엔도 사용된다.[5] 다른 다이엔 착물에는 (부타디엔)철 트리카르보닐, 시클로부타다이엔철 트리카르보닐 및 시클로옥타디엔 로듐 클로라이드 이량체가 있다.
5. 1. 중합 반응
알켄의 가장 널리 사용되는 반응은 다이엔(dienes)을 포함하여 중합이다. 1,3-부타디엔은 타이어에 사용되는 합성 고무의 전구체이며, 아이소프렌은 천연 고무의 전구체이다. 클로로프렌은 관련 화합물이지만, 합성 단량체이다.5. 2. 고리화 첨가 반응
공액 다이엔의 중요한 반응은 디엘스-알더 반응이다. 다니셰프스키 다이엔과 같은 특수 다이엔은 천연물 합성에 이러한 반응성을 활용하기 위해 개발되었다.5. 3. 첨가 반응
공액 다이엔은 브로민과 수소와 같은 시약을 1,2-첨가 및 1,4-첨가 경로를 통해 첨가한다. 극성 시약을 첨가하면 복잡한 구조가 생성될 수 있다.[3]5. 4. 복분해 반응
비공액 다이엔은 고리 닫힘 반응의 기질이다. 이러한 반응에는 금속 촉매가 필요하다.5. 5. 산성도
이중 결합에 인접한 위치는 생성된 알릴 음이온이 공명에 의해 안정화되기 때문에 산성을 띤다. 이러한 효과는 더 많은 알켄이 관여하여 더 큰 안정성을 생성함에 따라 더욱 두드러진다. 예를 들어, 1,4-다이엔의 3번 위치 또는 1,3-다이엔의 5번 위치에서 양성자를 제거하면 펜타다이엔일 음이온이 생성된다. 음이온이 방향족인 경우, 예를 들어 사이클로펜타다이엔에서 양성자를 제거하여 사이클로펜타다이엔일 음이온을 생성하는 경우 훨씬 더 큰 효과가 나타난다.5. 6. 리간드
다이엔은 유기금속 화학에서 널리 사용되는 배위자이다. 경우에 따라 촉매 주기 동안 제거되는 자리 표시자 배위자로 사용된다. 예를 들어, 비스(시클로옥타디엔)니켈(0)의 시클로옥타디엔("cod") 배위자는 불안정하다. 어떤 경우에는 다이엔이 관찰자 배위자 역할을 하여 촉매 주기 전체에 걸쳐 배위된 상태로 남아 제품 분포에 영향을 미친다. 키랄 다이엔도 설명되어 있다.[5] 다른 다이엔 착물에는 (부타디엔)철 트리카르보닐, 시클로부타디엔철 트리카르보닐 및 시클로옥타디엔 로듐 클로라이드 이량체가 있다.참조
[1]
서적
dienes
[2]
간행물
Metathesis
Wiley-VCH
[3]
학술지
9-Thiabicyclo[3.3.1]nonane-2,6-dione
[4]
학술지
A Chiral Chelating Diene as a New Type of Chiral Ligand for Transition Metal Catalysts: Its Preparation and Use for the Rhodium-Catalyzed Asymmetric 1,4-Addition
[5]
학술지
Chiral Diene Ligands in Asymmetric Catalysis
https://pubs.acs.org[...]
2022-09-28
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com