스즈키-미야우라 반응
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
스즈키-미야우라 반응은 유기 붕소 화합물과 유기 할로겐 화합물을 사용하여 팔라듐 촉매 하에 탄소-탄소 결합을 형성하는 크로스 커플링 반응이다. 이 반응은 관능기 허용성이 높고 입체 장애에 강하며, 유기 붕소 화합물의 안정성, 부생성물의 용이한 제거, 낮은 독성으로 인해 실험실에서 산업 규모까지 폭넓게 응용된다. 반응 메커니즘은 팔라듐 촉매 사이클을 따르며, 산화적 부가, 전이 금속화, 환원적 제거 단계를 거친다. 스즈키-미야우라 반응은 다양한 용매 시스템과 촉매를 사용할 수 있으며, 의약품 및 정밀 화학 물질의 합성에 널리 활용된다.
더 읽어볼만한 페이지
- 짝지음 반응 - 만니히 반응
만니히 반응은 아민, 포름알데히드, 카르보닐 화합물을 사용하여 β-아미노 카르보닐 화합물을 생성하는 유기 반응이다. - 짝지음 반응 - 네기시 반응
네기시 반응은 팔라듐 또는 니켈 촉매를 사용하여 유기아연 화합물과 유기 할로겐 화합물 간의 탄소-탄소 결합을 형성하는 교차 커플링 반응으로, 천연물 합성 및 의약품 개발에 응용되어 네기시 에이이치에게 노벨 화학상을 수상하게 한 유기 금속 화학 반응이다. - 탄소-탄소 결합 형성 반응 - 그리냐르 시약
그리냐르 시약은 할로겐화 알킬과 마그네슘을 에테르 용매에서 반응시켜 얻는 유기금속 화합물로, 강한 친핵성과 염기성을 이용하여 다양한 유기 화합물 합성에 널리 쓰이며 수분과 산소에 민감하여 무수 조건에서 취급해야 한다. - 탄소-탄소 결합 형성 반응 - 만니히 반응
만니히 반응은 아민, 포름알데히드, 카르보닐 화합물을 사용하여 β-아미노 카르보닐 화합물을 생성하는 유기 반응이다.
| 스즈키-미야우라 반응 | |
|---|---|
| 명칭 | |
| 이름 | 스즈키 반응 |
| 다른 이름 | 스즈키-미야우라 반응 스즈키 커플링 미야우라-스즈키 반응 鈴木・宮浦反応 (すずき・みやうらかんのう) 鈴木反応 (すずきはんのう) 鈴木カップリング (すずきカップリング) |
| 일반 정보 | |
| 반응 유형 | 짝지음 반응 |
| 이름의 유래 | 아키라 스즈키 |
| 관련 인물 | |
| 관련 인물 | 아키라 스즈키 |
| 반응 | |
| 반응식 | R1, R2 = 아릴 등, X = I, Br, Cl, OTf 등, Y = OH |
2. 특징
1970년대부터 다양한 크로스 커플링 반응이 개발되었는데, 1979년 스즈키 아키라와 미야우라 노리오는 유기 붕소와 유기 할로겐 화합물을 사용한 새로운 크로스 커플링 반응에 대해 보고했다.[51][52] 그 후, 팔라듐 촉매 및 반응 시스템의 발전, 붕소 화합물의 합성법 진보의 시너지 효과로, 스즈키-미야우라 반응의 적용 범위와 유용성이 더욱 증가하여 현재에 이르고 있다.[53]
스즈키-미야우라 반응은 다른 유사 반응에 비해 흔한 붕산을 사용할 수 있고, 반응 조건이 온화하며, 독성이 덜하다는 특징이 있다. 붕산은 유기 주석 화합물과 유기 아연 화합물보다 독성이 적고 환경에 더 안전하며, 반응 혼합물에서 무기 부산물을 쉽게 제거할 수 있다. 또한 비교적 저렴하고 쉽게 준비할 수 있는 시약을 사용하기 때문에 선호된다. 용매로 물을 사용할 수 있다는 점[41]은 이 반응을 더 경제적이고, 친환경적이며, 다양한 수용성 시약과 함께 사용하기에 실용적으로 만들어준다.
아릴 또는 비닐 붕산 및 아릴 또는 비닐 할로젠화물 등 다양한 시약을 스즈키 커플링에 사용할 수 있다. 또한 알킬 브로마이드를 통합하기 위해 반응 범위를 확장하는 연구도 진행되었다.[18] 스즈키 커플링 반응에는 다양한 유형의 할로겐화물을 사용할 수 있을 뿐만 아니라, 슈도할로젠화물인 트리플레이트 (OTf)를 할로젠화물의 대체물로 사용할 수도 있다. 할로겐화물 또는 슈도할로젠화물을 갖는 커플링 파트너의 상대적 반응성은 R2–I > R2–OTf > R2–Br >> R2–Cl 이다. 붕산 에스터와 유기트리플루오로붕산염을 붕산 대신 사용할 수 있다. 촉매는 팔라듐 나노물질 기반 촉매일 수도 있다.[19] 새로운 유기인 리간드 (SPhos)를 사용하면, 0.001 mol%까지의 촉매 로딩이 보고되었다.[20] 이러한 발전과 공정의 전반적인 유연성으로 인해 스즈키 커플링은 화학 합성에 널리 사용되고 있다.
2. 1. 장점
스즈키 아키라, 미야우라 노리오 등이 1979년에 유기붕소와 유기할로겐화물을 이용한 새로운 크로스 커플링 반응에 대해 보고했다.[54][55] 그 후 팔라듐 촉매나 반응계의 진보, 붕소 화합물의 합성법 진보의 상승 효과로 스즈키-미야우라 커플링 반응의 적용 범위나 유용성은 더욱 늘어나서 현재에 이르고 있다.[56]이 반응의 장점은 다음과 같다.
- 관능기 허용성이 높고 입체 장애에 강하다.
- 원료가 되는 유기붕소화합물이 물이나 공기에 안정되어 취급하기 쉽다.
- 함수용매 중에서도 반응이 진행된다.
- 부생성물이 수용성이어서 제거하기 쉽고, 독성도 낮다.
이러한 실용상의 이점 덕분에 실험실부터 공업 규모까지 폭넓게 응용되고 있다.
스즈키-미야우라 반응은 다른 유사 반응에 비해 흔한 붕산을 사용할 수 있고, 반응 조건이 온화하며, 독성이 덜하다는 장점이 있다. 붕산은 유기 주석 화합물과 유기 아연 화합물보다 독성이 적고 환경에 더 안전하며, 반응 혼합물에서 무기 부산물을 쉽게 제거할 수 있다. 또한 비교적 저렴하고 쉽게 준비할 수 있는 시약을 사용하기 때문에 선호된다. 용매로 물을 사용할 수 있다는 점[41]은 이 반응을 더 경제적이고, 친환경적이며, 다양한 수용성 시약과 함께 사용하기에 실용적으로 만들어준다.
아릴 또는 비닐 붕산 및 아릴 또는 비닐 할로젠화물 등 다양한 시약을 스즈키 커플링에 사용할 수 있다. 또한 알킬 브로마이드를 통합하기 위해 반응 범위를 확장하는 연구도 진행되었다.[18] 스즈키 커플링 반응에는 다양한 유형의 할로겐화물을 사용할 수 있을 뿐만 아니라, 슈도할로젠화물인 트리플레이트 (OTf)를 할로젠화물의 대체물로 사용할 수도 있다. 할로겐화물 또는 슈도할로겐화물을 갖는 커플링 파트너의 상대적 반응성은 R2–I > R2–OTf > R2–Br >> R2–Cl 이다. 붕산 에스터와 유기트리플루오로붕산염을 붕산 대신 사용할 수 있다. 촉매는 팔라듐 나노물질 기반 촉매일 수도 있다.[19] 새로운 유기인 리간드 (SPhos)를 사용하면, 0.001 mol%까지의 촉매 로딩이 보고되었다.[20] 이러한 발전과 공정의 전반적인 유연성으로 인해 스즈키 커플링은 화학 합성에 널리 사용되고 있다.
3. 반응 메커니즘
스즈키-미야우라 반응의 메커니즘은 팔라듐 촉매를 중심으로, 산화적 첨가, 전이 금속화, 환원성 제거의 세 단계로 나눌 수 있다. 이 반응들은 염기와 리간드의 영향을 받으며, 이를 통해 반응의 효율성과 선택성을 조절할 수 있다.
3. 1. 촉매 사이클
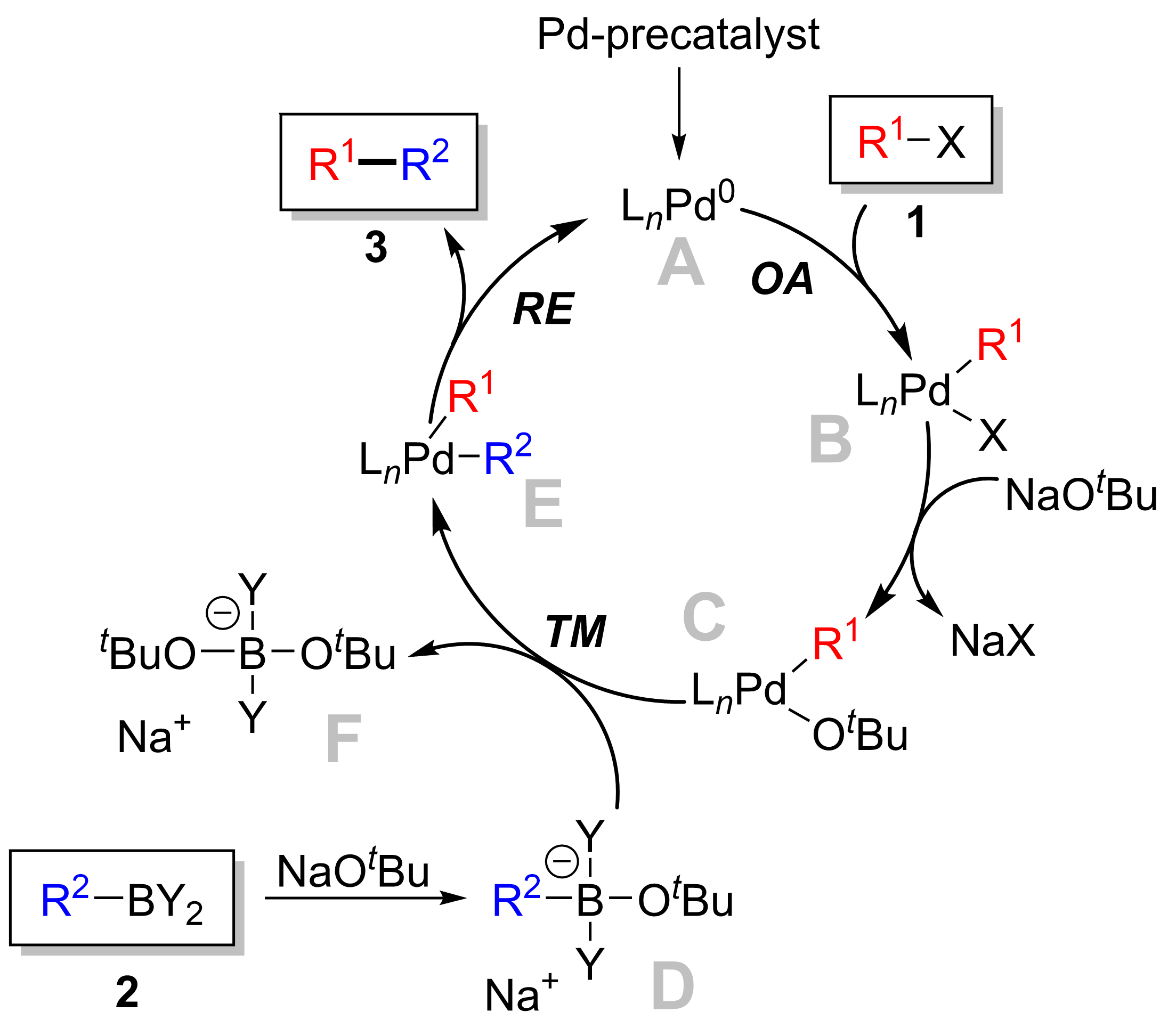
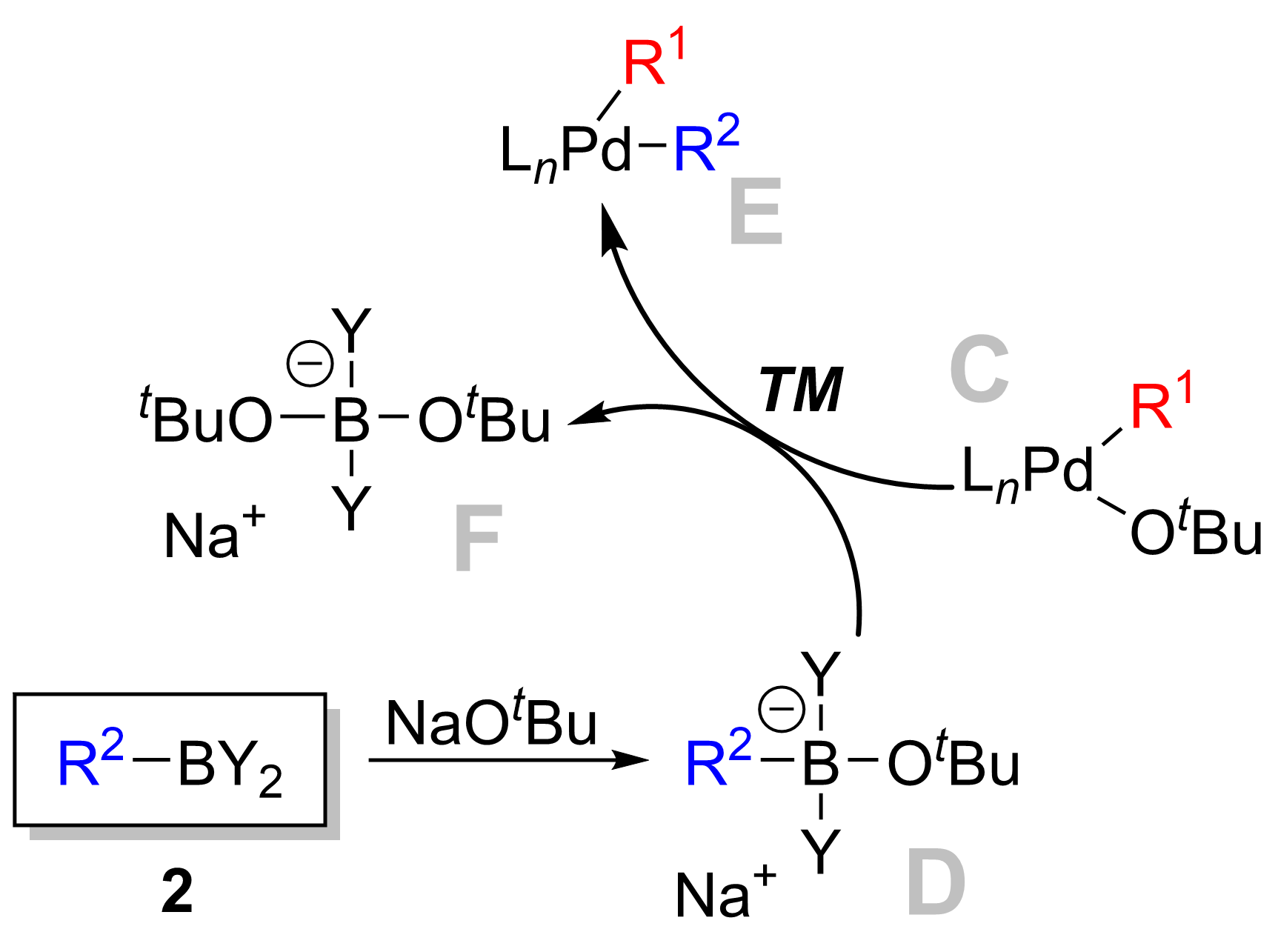
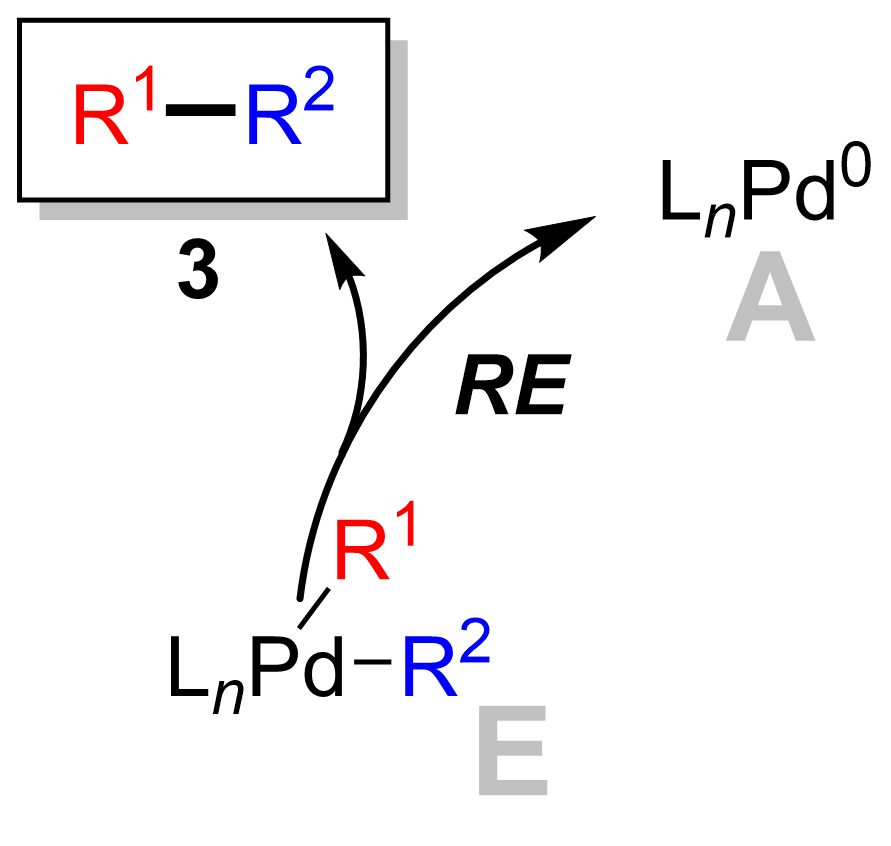
반응 메커니즘은 일반적으로 할로겐화아릴에 0값 팔라듐의 산화적 부가, 할로겐과 방향족 붕소화합물과의 배위자 교환(금속 교환), 생성물인 비아릴의 환원적 이탈을 거치는 것으로 여겨지고 있다. 마지막 환원적 이탈에 의해 0값의 팔라듐이 재생되면서 촉매 사이클이 형성된다. 친핵체는 기질의 붕소상에 부가해서 산염 착물을 만들고, 탄소-붕소 결합을 활성화시켜서 배위자 교환의 단계를 용이하게 한다. 또, 친핵체는 배위자로서 산화적 부가 직후에 생성하는 유기 팔라듐 중간체 상의 할로겐과 치환되면서 반응성을 높이는 경우도 있다.[8]스즈키 반응의 메커니즘은 팔라듐 촉매의 관점에서 가장 잘 볼 수 있다. 촉매 사이클은 활성 Pd0 촉매 종 '''A'''의 형성으로 시작된다. 이는 팔라듐의 산화적 첨가에 참여하여 할로겐화물 시약 '''1'''과 반응하여 유기팔라듐 중간체 '''B'''를 형성한다. 염기와의 반응 (메타테시스)은 중간체 '''C'''를 생성하며, 이는 붕소-에이트 착물 '''D''' (붕산 시약 '''2'''와 염기의 반응으로 생성)과의 전이 금속화를 통해 일시적인 유기팔라듐 종 '''E'''를 형성한다. 환원성 제거 단계는 원하는 생성물 '''3'''의 형성을 유도하고, 원래의 팔라듐 촉매 '''A'''를 복원하여 촉매 사이클을 완료한다.
스즈키 커플링은 염기 존재 하에서 일어나며, 오랫동안 염기의 역할은 완전히 이해되지 않았다. 염기는 처음에는 트라이알킬보레인(BR3)과 알콕사이드 (−OR)의 반응의 경우, 트라이알킬 보레이트(R3B-OR)를 형성하는 것으로 여겨졌다. 이 종은 더 친핵성이며 전이 금속화 단계에서 존재하는 팔라듐 착물에 대해 더 반응성이 있는 것으로 간주될 수 있다.[11][9][10] Duc 등은 스즈키 커플링의 반응 메커니즘에서 염기의 역할을 조사했으며, 염기가 세 가지 역할을 한다는 것을 발견했다: 팔라듐 착물 [ArPd(OR)L2]의 형성, 트라이알킬 보레이트의 형성, 그리고 알콕사이드와 팔라듐 착물의 반응에 의한 환원성 제거 단계의 가속화.[11]
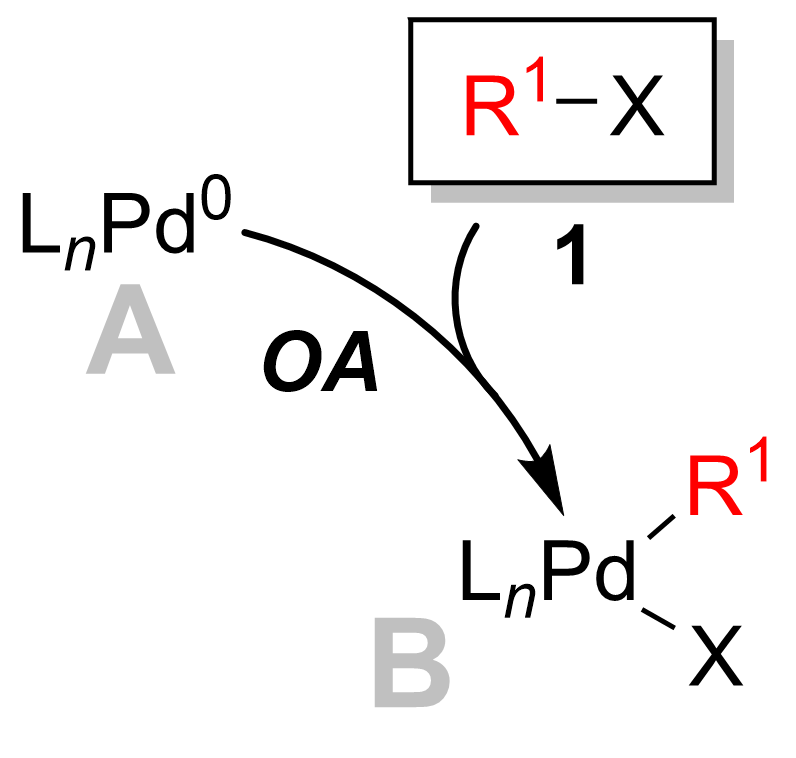
대부분의 경우 산화적 첨가는 촉매 주기의 속도 결정 단계이다.[12] 이 단계에서 팔라듐 촉매는 팔라듐(0)에서 팔라듐(II)로 산화된다. 촉매적으로 활성인 팔라듐 종 '''A'''는 아릴 할라이드 기질 '''1'''과 결합하여 유기팔라듐 착물 '''B'''를 생성한다. 아래 그림에서 볼 수 있듯이, 산화적 첨가 단계는 탄소-할로겐 결합을 끊고 팔라듐은 이제 할로겐(X)뿐만 아니라 R1 기에도 결합한다.
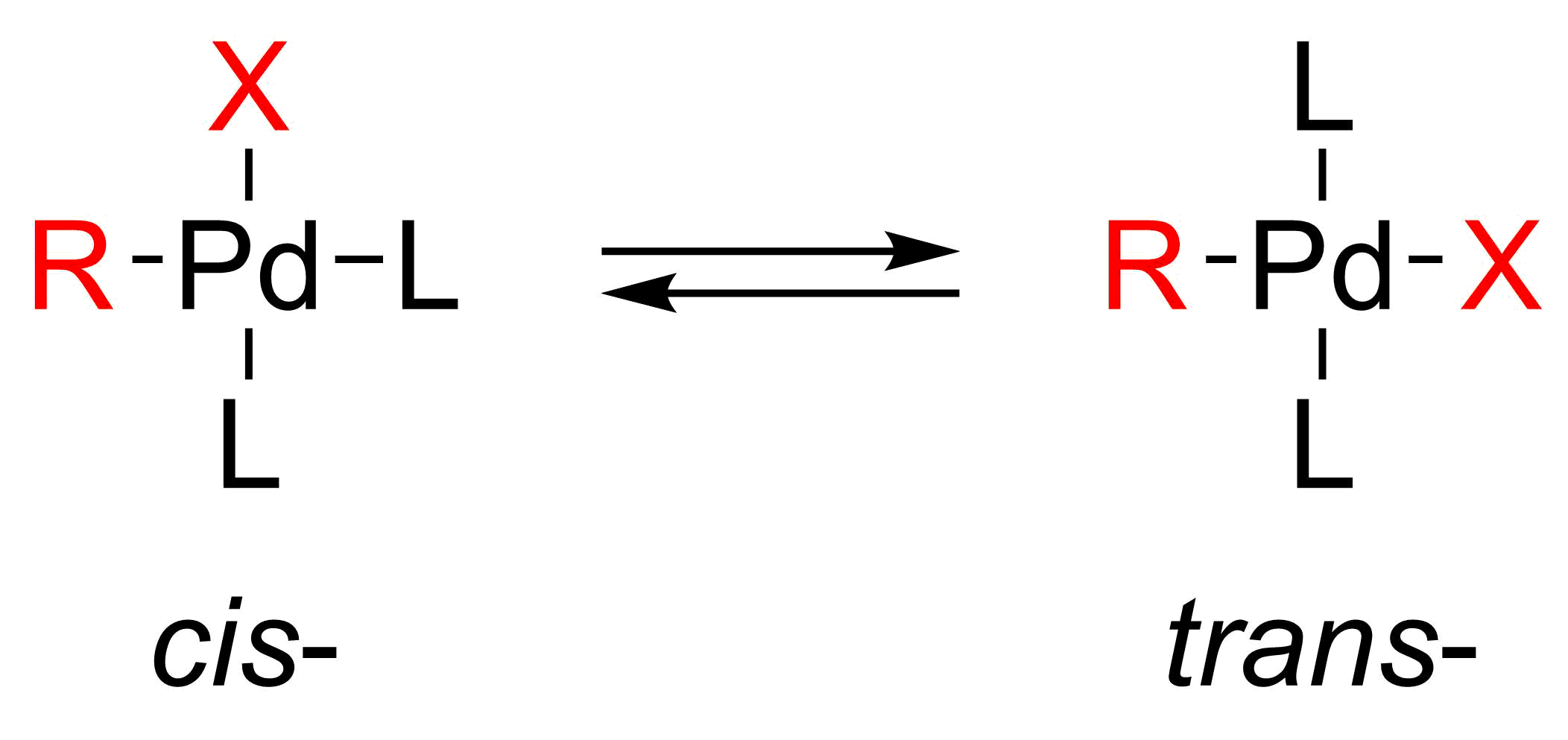
산화적 첨가는 비닐 할라이드의 입체 화학을 유지하면서 진행되는 반면, 알릴 및 벤질 할라이드는 반전을 보인다.[13] 산화적 첨가는 처음에는 시스-팔라듐 착물을 형성하며, 이는 빠르게 이성질화되어 트랜스 착물로 변환된다.[14]
스즈키-미야우라 반응은 유기붕소 시약 또는 할라이드 모두에서 이중 결합에 대한 배위를 유지하면서 일어난다.[23] 그러나, 해당 이중 결합의 배위, 즉 ''시스'' 또는 ''트랜스''는 트랜스 팔라듐 착물이 지배적인 형태인 산화적 첨가 단계에서 팔라듐 착물의 ''시스''에서 ''트랜스''로의 이성질화에 의해 결정된다. 유기붕소가 이중 결합에 부착되고 알케닐 할라이드와 결합되면 아래 그림과 같이 생성물은 다이엔이 된다.
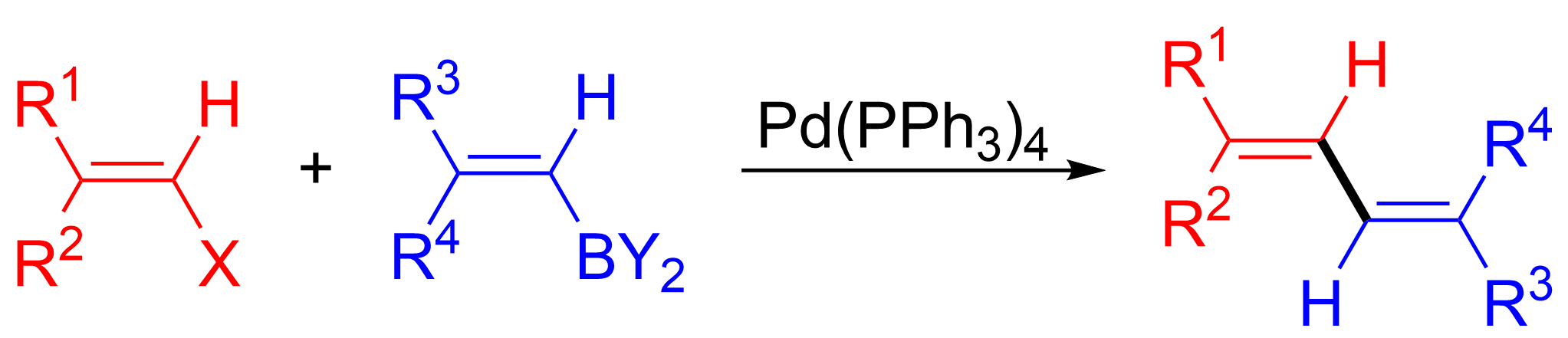
전이 금속화는 한 종에서 다른 종으로 리간드가 이동하는 유기 금속 반응이다. 스즈키 반응의 경우, 리간드는 유기 붕소 종 '''D'''에서 팔라듐(II) 착물 '''C'''로 이동하며, 이전 단계에서 첨가된 염기는 유기 붕소 종의 R2 치환체와 교환되어 새로운 팔라듐(II) 착물 '''E'''를 생성한다. 스즈키 반응의 전이 금속화에 대한 정확한 메커니즘은 아직 밝혀지지 않았다. 유기 붕소 화합물은 염기가 없을 때는 전이 금속화를 거치지 않으며, 따라서 염기의 역할은 유기 붕소 화합물을 활성화하고, 산화적 부가 생성물 R1-Pdll-X ('''B''')에서 R1-Pdll-O''t''Bu 중간체 ('''C''')의 형성을 촉진하는 것으로 널리 알려져 있다.[12]
환원성 제거는 팔라듐(II) 착물 ('''E''')이 생성물 ('''3''')을 제거하고 팔라듐(0) 촉매 ('''A''')를 재생하는 마지막 단계이다. 중수소 표지를 사용하여 Ridgway 등은 환원성 제거가 입체 화학을 유지하면서 진행된다는 것을 보여주었다.[15]
리간드는 스즈키 반응에서 중요한 역할을 한다. 일반적으로, 포스핀 리간드는 스즈키 반응에 사용된다. 포스핀 리간드는 착물의 금속 중심에서의 전자 밀도를 증가시키고, 따라서 산화적 첨가 단계를 돕는다. 또한, 포스핀 리간드의 치환기의 부피는 환원성 제거 단계를 돕는다. 그러나, 스즈키 반응 조건에서 포스핀 리간드의 불안정성 때문에 최근에는 ''N''-헤테로고리 카벤 리간드가 이 교차 결합에 사용되었다.[16] ''N''-헤테로고리 카벤은 포스핀 리간드보다 전자가 풍부하고 부피가 크다. 따라서, ''N''-헤테로고리 카벤 리간드의 입체 및 전자 요인 모두 활성 Pd(0) 촉매를 안정화하는 데 도움이 된다.[17]
3. 2. 염기의 역할
스즈키-미야우라 반응에서 염기는 오랫동안 그 역할이 완전히 이해되지 않았지만, 최근 연구를 통해 세 가지 중요한 역할이 밝혀졌다. 첫째, 염기는 트라이알킬보레인(BR3)과 알콕사이드(−OR)의 반응에서 트라이알킬 보레이트(R3B-OR) 형성을 돕는다. 이 종은 더 친핵성을 띠며, 전이 금속화 단계에서 팔라듐 착물에 대해 더 반응성이 크다.[11][9][10] 둘째, 염기는 팔라듐 착물 [ArPd(OR)L2] 형성에 관여한다. 셋째, 염기는 알콕사이드와 팔라듐 착물의 반응을 통해 환원성 제거 단계를 가속화한다.[11]구체적으로, 염기는 붕산 시약과 반응하여 붕소-에이트 착물을 생성하고, 이는 전이 금속화[8]를 통해 유기팔라듐 종을 형성하는 데 기여한다. 또한, 염기는 리간드로서 유기팔라듐 중간체 상의 할로겐과 치환되어 반응성을 높이는 역할도 한다.
3. 3. 리간드의 역할
리간드는 스즈키 반응에서 중요한 역할을 한다. 일반적으로, 포스핀 리간드는 스즈키 반응에 사용된다. 포스핀 리간드는 착물의 금속 중심에서의 전자 밀도를 증가시키고, 따라서 산화적 첨가 단계를 돕는다. 또한, 포스핀 리간드의 치환기의 부피는 환원적 제거 단계를 돕는다. 그러나, 스즈키 반응 조건에서 포스핀 리간드의 불안정성 때문에 최근에는 ''N''-헤테로고리 카벤 리간드가 이 교차 결합에 사용되었다.[16] ''N''-헤테로고리 카벤은 포스핀 리간드보다 전자가 풍부하고 부피가 크다. 따라서, ''N''-헤테로고리 카벤 리간드의 입체 및 전자 요인 모두 활성 Pd(0) 촉매를 안정화하는 데 도움이 된다.[17]4. 유기 붕소 화합물
유기붕소화합물은 일반적인 유기금속화학물에 비해 물이나 공기 등에 대해 비교적 안정되어 취급이 용이한 경우가 많다. 유기붕소화합물은 종래에 대응하는 그리냐르 시약이나 유기 리튬 등의 금속 교환, 혹은 히드로 붕소화를 비롯한 첨가 반응에 의해 제조되었지만, 최근에는 보레인 유도체(R2BH)나 디보론(R2BBR2), 이리듐 촉매 등을 조합한 방향족 화합물의 직접 붕소화도 알려지게 되었다. 스즈키-미야우라 반응의 진보는 합성화학에 있어서 유기붕소화합물의 가치를 드높이게 됐다.
아릴 붕산은 다른 유기붕소 화합물에 비해 상대적으로 저렴하며 다양한 종류의 아릴 붕산이 상업적으로 이용 가능하다. 따라서 유기붕소 반응 파트너로서 스즈키 반응에 널리 사용되어 왔다. 아릴트리플루오로붕산염은 아릴 붕산에 비해 프로토데보로네이션이 덜 일어나기 때문에 자주 사용되는 또 다른 종류의 유기붕소 화합물이다. 이들은 합성하기 쉽고 쉽게 정제할 수 있다.[38] 아릴트리플루오로붕산염은 붕산을 플루오르화 수소 칼륨으로 처리하여 형성될 수 있으며, 이를 스즈키 커플링 반응에 사용할 수 있다.[39]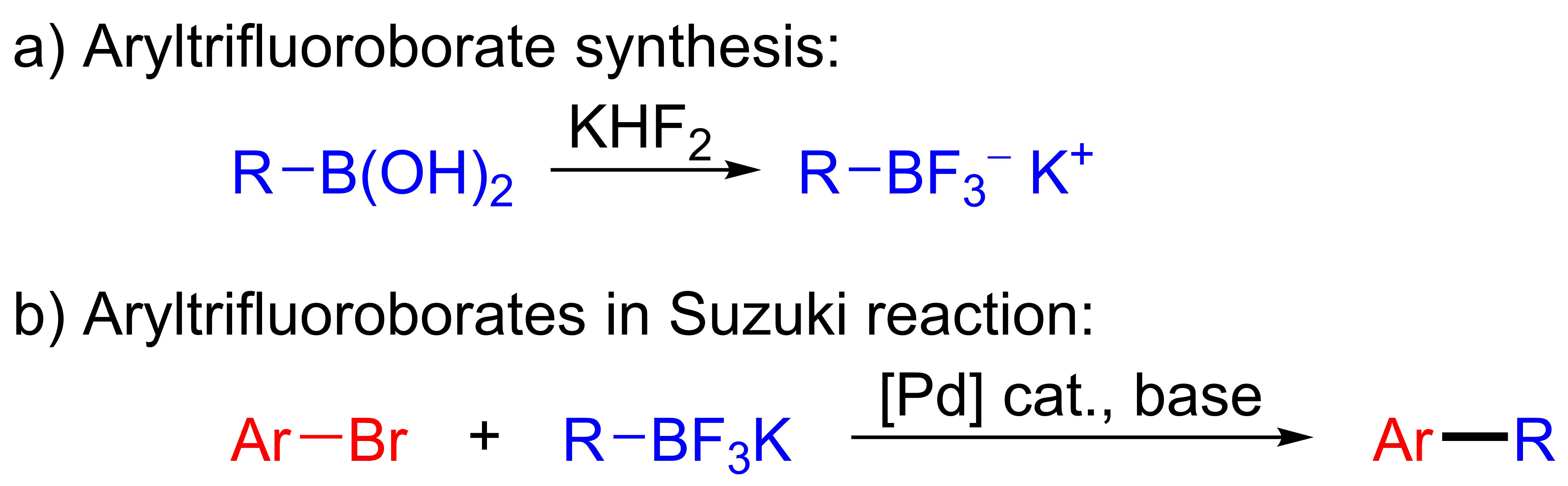
5. 촉매
스즈키-미야우라 반응에서는 팔라듐 외에도 다른 금속을 촉매로 사용하는 다양한 방법이 개발되었다.[28] 특히 니켈은 팔라듐의 좋은 대안으로 연구되어 왔다. 1995년 페르섹과 동료들은 아릴 메실레이트와 보론산을 사용한 최초의 니켈 촉매 교차 결합 반응을 보고하였다.[29]
니켈 촉매는 팔라듐 촉매에 비해 다음과 같은 장점을 가진다.
- 가격: 니켈은 팔라듐보다 훨씬 저렴하다.
- 반응성: 니켈 촉매는 팔라듐 촉매 시스템에서는 반응하기 어렵거나, 니켈 촉매 시스템에서 더 잘 반응하는 여러 화합물에 사용될 수 있다. 예를 들어, 페놀, 아릴 에테르, 에스테르, 인산염, 플루오라이드와 같은 기질은 팔라듐 촉매를 사용한 반응에서는 어려움을 겪지만, 니켈 촉매를 사용하면 반응이 가능하다.[28]
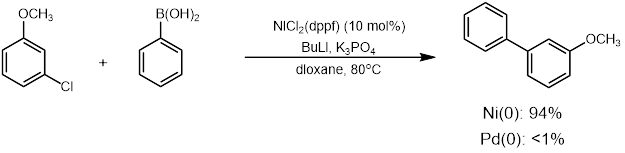
니켈 촉매 교차 결합 반응 연구는 계속 발전하여 반응 범위를 넓히고 있다. 2000년 미야우라와 이나다는 더 비싼 리간드 대신 트라이페닐포스핀(PPh3)을 사용하여 더 저렴한 니켈 촉매를 교차 결합에 사용할 수 있다고 보고했다.[30] 그러나 초기 니켈 촉매는 높은 촉매 로딩(3-10%), 과량의 리간드(1-5 당량)가 필요하고 공기와 수분에 민감하다는 단점이 있었다.[28] 이후 한과 동료들은 낮은 양의 니켈 촉매(<1 mol%)와 추가 리간드 없이 반응을 수행하는 방법을 개발하여 이러한 문제를 해결하고자 하였다.[31]
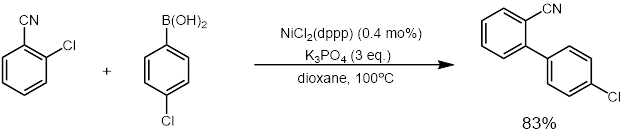
2011년 우와 동료들은 아릴 클로라이드의 교차 결합에 고활성 니켈 촉매를 사용할 수 있으며, 이는 0.01-0.1 mol%의 니켈 촉매만 필요하다고 보고했다. 또한 이 촉매는 촉매 활성의 손실 없이 최대 6번까지 재활용될 수 있음을 보여주었다. 이는 촉매가 덴드리머로 만들어진 포스핀 니켈 나노입자 촉매(G3DenP-Ni)이기 때문이었다.[32]
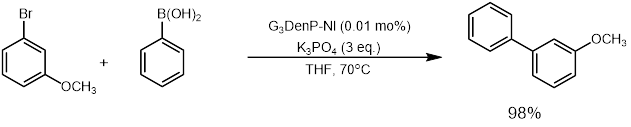
팔라듐 및 니켈 촉매 외에도 철, 구리[33], 루테늄[36]과 같은 금속도 스즈키 반응에 사용될 수 있다. 베드포드 연구 그룹[34]과 나카무라 연구 그룹[35]은 철 촉매 스즈키 결합 반응의 방법론 개발에 많은 노력을 기울였다.
5. 1. 팔라듐 촉매
팔라듐 외 다른 금속(특히 니켈)을 촉매로 사용하는 다양한 방법이 개발되었다.[28] 최초의 니켈 촉매 교차 결합 반응은 1995년 페르섹과 동료들이 아릴 메실레이트와 보론산을 사용하여 보고하였다.[29] 반응에 더 많은 양의 니켈 촉매가 필요했지만, 약 5 mol %의 니켈은 팔라듐만큼 비싸거나 귀금속이 아니다. 니켈 촉매 스즈키 결합 반응은 팔라듐 촉매 시스템에서는 작동하지 않거나 니켈 촉매 시스템보다 더 나쁘게 작동하는 여러 화합물을 허용했다.[28] 니켈 촉매의 사용은 페놀, 아릴 에테르, 에스테르, 인산염 및 플루오라이드와 같은 기질을 포함하여 팔라듐을 사용한 원래의 스즈키 결합에서 어려움을 겪었던 친전자체를 허용했다.[28]이러한 첫 번째 예가 제시된 후, 니켈 촉매 교차 결합에 대한 연구는 계속되었고 반응의 범위를 넓혀 연구 관심이 증가했다. 2000년 미야우라와 이나다는 더 비싼 리간드 대신 트리페닐포스핀(PPh3)을 사용하여 더 저렴한 니켈 촉매를 교차 결합에 사용할 수 있다고 보고했다.[30] 그러나 니켈 촉매 교차 결합은 여전히 높은 촉매 로딩(3-10%)을 필요로 했고, 과량의 리간드(1-5 당량)를 필요로 했으며 공기와 수분에 민감했다.[28] 한과 동료들의 발전은 낮은 양의 니켈 촉매(<1 mol%)와 추가 리간드 당량 없이 방법을 개발하여 이러한 문제를 해결하려고 시도했다.[31]
2011년 우와 동료들은 아릴 클로라이드의 교차 결합에 고활성 니켈 촉매를 사용할 수 있으며, 이는 0.01-0.1 mol%의 니켈 촉매만 필요하다고 보고했다. 그들은 또한 촉매가 촉매 활성의 손실 없이 최대 6번까지 재활용될 수 있음을 보여주었다.[32] 촉매는 덴드리머로 만들어진 포스핀 니켈 나노입자 촉매(G3DenP-Ni)이기 때문에 재활용이 가능했다.
장점과 단점은 팔라듐 및 니켈 촉매 스즈키 결합 반응 모두에 적용된다. Pd 및 Ni 촉매 시스템 외에도 철 및 구리와 같은 저렴하고 비독성 금속 소스[33]가 스즈키 결합 반응에 사용되었다. 베드포드 연구 그룹[34]과 나카무라 연구 그룹[35]은 철 촉매 스즈키 결합 반응의 방법론 개발에 광범위하게 노력해 왔다. 루테늄은 스즈키 결합 반응에 사용된 또 다른 금속 소스이다.[36]
5. 2. 기타 금속 촉매
팔라듐 외에도 다른 금속(특히 니켈)을 이용한 다양한 촉매 반응이 개발되었다.[28] 최초의 니켈 촉매 교차 결합 반응은 1995년 페르섹과 동료들이 아릴 메실레이트와 보론산을 사용하여 보고하였다.[29] 반응에 더 많은 양의 니켈 촉매가 필요했지만, 약 5 mol %의 니켈은 팔라듐만큼 비싸거나 귀금속이 아니다. 니켈 촉매 스즈키 결합 반응은 팔라듐 촉매 시스템에서는 작동하지 않거나 니켈 촉매 시스템보다 더 나쁘게 작동하는 여러 화합물을 허용했다.[28] 니켈 촉매의 사용은 페놀, 아릴 에테르, 에스테르, 인산염 및 플루오라이드와 같은 기질을 포함하여 팔라듐을 사용한 원래의 스즈키 결합에서 어려움을 겪었던 친전자체를 허용했다.[28]니켈 촉매 교차 결합에 대한 연구는 이러한 첫 번째 예가 제시된 후 계속되었고 반응의 범위를 넓혀 연구 관심이 증가했다. 2000년 미야우라와 이나다는 더 비싼 리간드 대신 트라이페닐포스핀(PPh3)을 사용하여 더 저렴한 니켈 촉매를 교차 결합에 사용할 수 있다고 보고했다.[30] 그러나 니켈 촉매 교차 결합은 여전히 높은 촉매 로딩(3-10%)을 필요로 했고, 과량의 리간드(1-5 당량)를 필요로 했으며 공기와 수분에 민감했다.[28] 한과 동료들의 발전은 낮은 양의 니켈 촉매(<1 mol%)와 추가 리간드 당량 없이 방법을 개발하여 이러한 문제를 해결하려고 시도했다.[31]
또한 2011년 우와 동료들은 아릴 클로라이드의 교차 결합에 고활성 니켈 촉매를 사용할 수 있으며, 이는 0.01-0.1 mol%의 니켈 촉매만 필요하다고 보고했다. 그들은 또한 촉매가 촉매 활성의 손실 없이 최대 6번까지 재활용될 수 있음을 보여주었다.[32] 촉매는 덴드리머로 만들어진 포스핀 니켈 나노입자 촉매(G3DenP-Ni)이기 때문에 재활용이 가능했다.
장점과 단점은 팔라듐 및 니켈 촉매 스즈키 결합 반응 모두에 적용된다. Pd 및 Ni 촉매 시스템 외에도 철 및 구리와 같은 저렴하고 비독성 금속 소스[33]가 스즈키 결합 반응에 사용되었다. 베드포드 연구 그룹[34]과 나카무라 연구 그룹[35]은 철 촉매 스즈키 결합 반응의 방법론 개발에 광범위하게 노력해 왔다. 루테늄은 스즈키 결합 반응에 사용된 또 다른 금속 소스이다.[36]
6. 용매
스즈키-미야우라 반응은 다른 커플링 반응과는 달리 유기 용매와 물의 2상 혼합, 물 단독, 또는 용매를 사용하지 않고도 반응을 진행할 수 있다는 점에서 차이가 있다. 이러한 특징은 다양한 수용성 염기, 촉매 시스템 및 시약을 유기 용매에 대한 용해도에 대한 걱정 없이 사용할 수 있게 하여 커플링 반응의 범위를 넓혔다. 용매 시스템으로 물을 사용하는 것은 경제적이고 안전하다는 장점 때문에 매력적이다. 스즈키-미야우라 반응에 사용되는 용매 시스템으로는 톨루엔, THF, 다이옥산, 및 DMF가 있다. 가장 흔히 사용되는 염기로는 K2CO3, KO''t''Bu, Cs2CO3, K3PO4, NaOH, 및 NEt3이 있다.
7. 응용
스즈키-미야우라 반응은 작용기 허용성이 높고 입체 장애에 강하며, 원료인 유기붕소화합물이 물과 공기에 안정적이고 취급이 용이하다는 장점이 있다. 또한 함수 용매에서도 반응이 진행되며, 부산물이 수용성이어서 제거하기 쉽고 독성이 낮아 실험실뿐만 아니라 산업 현장에서도 폭넓게 응용되고 있다.[56]
7. 1. 산업적 응용
스즈키-미야우라 반응은 의약품 또는 정밀 화학 물질의 중간체 합성에 사용하기에 확장 가능하고 비용 효율적이다.[21] 스즈키 반응은 한때 높은 수준의 촉매와 붕산의 제한적인 사용 가능성으로 제한되었으나, 할로겐화물 대체물이 발견되어 할로겐화물 또는 유사 할로겐화물의 결합 파트너 수를 늘렸다. 확장된 반응은 트리플레이트 및 붕산 결합 파트너를 사용한 CI-1034와 같은 여러 중요한 생물학적 화합물의 합성에 대해 수행되었으며, 이는 80킬로그램 규모로 95% 수율로 수행되었다.[22]또 다른 예는 3-피리딜보란과 1-브로모-3-(메틸설포닐)벤젠의 결합으로, 잠재적인 중추신경계 작용제의 합성에 사용된 중간체를 형성했다. 중간체를 형성하는 결합 반응은 278킬로그램을 92.5% 수율로 생산했다.[23][21]
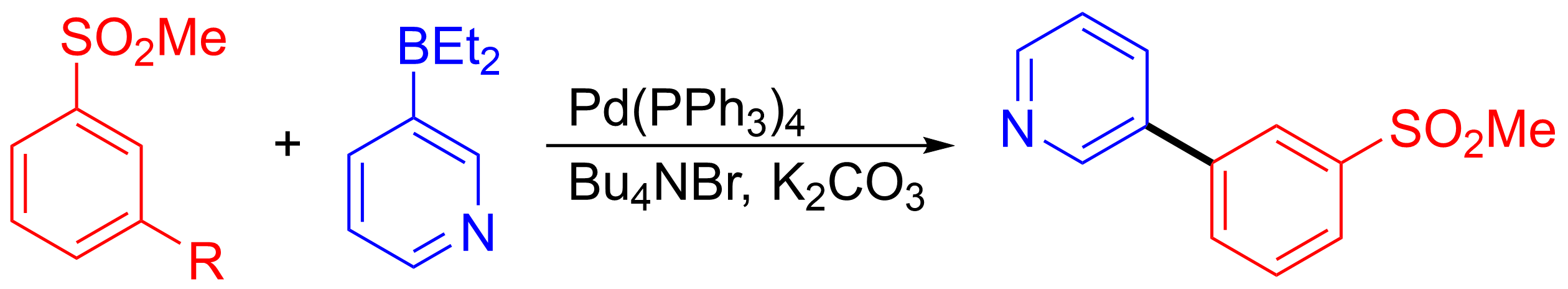
스즈키 CC 반응에 대한 불균일 촉매 개발에 상당한 노력이 투입되었으며, 이는 산업 공정의 성능 향상(기질로부터의 촉매 분리 제거)에 의해 동기가 부여되었다. 최근에는 Pd 단일 원자 불균일 촉매가 업계 기본 균일 Pd(PPh3)4 촉매보다 성능이 우수한 것으로 나타났다.[24]
7. 2. 학술적 응용
스즈키-미야우라 반응은 복잡한 화합물의 합성에 자주 사용된다.[25][26] 스즈키-미야우라 반응은 시트라넬알 유도체를 사용하여 백혈병에 매우 활성이 높은 천연물인 카파라트리엔을 합성하는 데 사용되었다.[27]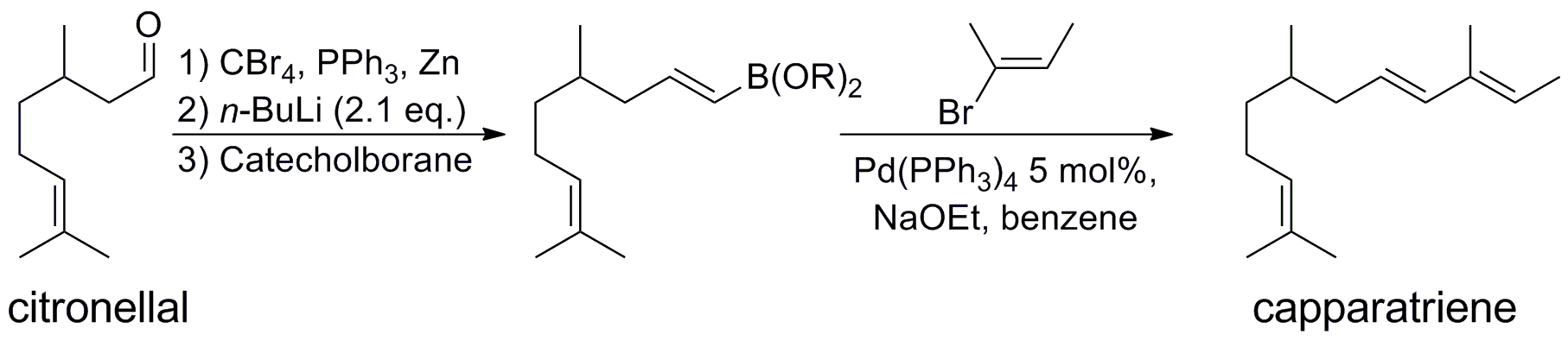
참조
[1]
논문
A new stereospecific cross-coupling by the palladium-catalyzed reaction of 1-alkenylboranes with 1-alkenyl or 1-alkynyl halides
http://eprints.lib.h[...]
[2]
논문
Stereoselective synthesis of arylated (E)-alkenes by the reaction of alk-1-enylboranes with aryl halides in the presence of palladium catalyst
[3]
논문
Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds
[4]
웹사이트
The Nobel Prize in Chemistry 2010
https://www.nobelpri[...]
Nobel Prize Foundation
2013-10-25
[5]
논문
Synthetic Studies via the cross-coupling reaction of organoboron derivatives with organic halides
[6]
논문
Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds
http://eprints.lib.h[...]
[7]
논문
Recent advances in the cross-coupling reactions of organoboron derivatives with organic electrophiles, 1995–1998
[8]
논문
Alkylboranes in the Suzuki−Miyaura Coupling: Stereochemical and Mechanistic Studies
[9]
논문
Mechanistic Studies of the Suzuki Cross-Coupling Reaction
1994-12-01
[10]
논문
Alkylboranes in the Suzuki−Miyaura Coupling: Stereochemical and Mechanistic Studies
1998-02-01
[11]
논문
Kinetic Data for the Transmetalation/Reductive Elimination in Palladium-Catalyzed Suzuki-Miyaura Reactions: Unexpected Triple Role of Hydroxide Ions Used as Base
2011-02-18
[12]
서적
Strategic Applications of Named Reactions in Organic Synthesis
Elsevier Academic Press
[13]
논문
Mechanisms of oxidative addition of organic halides to Group 8 transition-metal complexes
[14]
논문
On the Configuration Resulting from Oxidative Addition of RX to Pd(PPh3)4and the Mechanism of the cis-to-transIsomerization of \PdRX(PPh3)2] Complexes (R = aryl, X = halide)†
[15]
논문
Transmetalation of Alkylboranes to Palladium in the Suzuki Coupling Reaction Proceeds with Retention of Stereochemistry
[16]
웹사이트
Science of Synthesis: Best methods. Best results – Thieme Chemistry
https://science-of-s[...]
2021-04-14
[17]
논문
An overview of N-heterocyclic carbenes
https://www.nature.c[...]
2014-06
[18]
논문
Boronic Acids: New Coupling Partners in Room-Temperature Suzuki Reactions of Alkyl Bromides. Crystallographic Characterization of an Oxidative-Addition Adduct Generated under Remarkably Mild Conditions
[19]
논문
Recyclable Polymer-Supported Nanometal Catalysts in Water
[20]
논문
Palladium-Catalyzed Suzuki−Miyaura Cross-Coupling Reactions Employing Dialkylbiaryl Phosphine Ligands
[21]
뉴스
Fine Chemicals
2004-09-06
[22]
논문
Development of a Scalable Process for CI-1034, an Endothelin Antagonist
2004-03-01
[23]
서적
Advanced Organic Chemistry
https://archive.org/[...]
Springer
[24]
논문
A heterogeneous single-atom palladium catalyst surpassing homogeneous systems for Suzuki coupling
http://eprints.white[...]
[25]
논문
Total Synthesis of(–)-Epothilone A
[26]
논문
A concise synthesis of the molecular framework of pleuromutilin
[27]
논문
An expedient total synthesis of (+/−)-caparratriene
[28]
논문
Transition-metal-catalyzed Suzuki–Miyaura cross-coupling reactions: a remarkable advance from palladium to nickel catalysts
2013-01-01
[29]
논문
Aryl Mesylates in Metal Catalyzed Homocoupling and Cross-Coupling Reactions. 2. Suzuki-Type Nickel-Catalyzed Cross-Coupling of Aryl Arenesulfonates and Aryl Mesylates with Arylboronic Acids
1995
[30]
논문
Synthesis of Biaryls via Cross-Coupling Reaction of Arylboronic Acids with Aryl Chlorides Catalyzed by NiCl2/Triphenylphosphine Complexes
[31]
논문
A Highly Practical and Reliable Nickel Catalyst for Suzuki-Miyaura Coupling of Aryl Halides
2011-06-01
[32]
논문
A Highly Active and Recyclable Catalyst: Phosphine Dendrimer-Stabilized Nickel Nanoparticles for the Suzuki Coupling Reaction
2011-06-01
[33]
논문
Copper-Catalyzed Cross-Coupling Reaction of Organoboron Compounds with Primary Alkyl Halides and Pseudohalides
[34]
논문
Simple mixed Fe–Zn catalysts for the Suzuki couplings of tetraarylborates with benzyl halides and 2-halopyridines
[35]
논문
Iron-Catalyzed Alkyl-Alkyl Suzuki-Miyaura Coupling
[36]
논문
Ruthenium-Catalyzed Heck-Type Olefination and Suzuki Coupling Reactions: Studies on the Nature of Catalytic Species
[37]
논문
Nickel-catalysed Suzuki–Miyaura coupling of amides
[38]
논문
Palladium-Catalyzed Suzuki−Miyaura Cross-Coupling Reactions of Potassium Aryl- and Heteroaryltrifluoroborates
[39]
서적
Organic Synthesis Using Transition Metals
Wiley
[40]
논문
Stereospecific Suzuki, Sonogashira, and Negishi Coupling Reactions of N-Alkoxyimidoyl Iodides and Bromides
[41]
논문
Palladium-catalyzed alkylations in aqueous media
[42]
논문
Suzuki–Miyaura Cross-Coupling under Solvent-Free Conditions
2013
[43]
논문
Palladium catalyzed ligand-free Suzuki cross-coupling reaction
[44]
논문
Versatile Catalysts for the Suzuki Cross-Coupling of Arylboronic Acids with Aryl and Vinyl Halides and Triflates under Mild Conditions
[45]
논문
Highly Efficient Pd/C-Catalyzed Suzuki Coupling Reaction ofp-(un)Substituted Phenyl Halide with (p-Substituted phenyl) Boronic Acid
[46]
논문
Alkyl−Alkyl Suzuki Cross-Couplings of Unactivated Secondary Alkyl Halides at Room Temperature
[47]
논문
Synthesis and Characterization of R2PNP(iBuNCH2CH2)3N: A New Bulky Electron-Rich Phosphine for Efficient Pd-Assisted Suzuki−Miyaura Cross-Coupling Reactions
[48]
논문
Ferrocenyl Monophosphine Ligands: Synthesis and Applications in the Suzuki−Miyaura Coupling of Aryl Chlorides
[49]
논문
Facile synthesis of highly stable gold nanoparticles and their unexpected excellent catalytic activity for Suzuki-Miyaura cross-coupling reaction in water
[50]
논문
Room-Temperature Suzuki−Miyaura Couplings in Water Facilitated by Nonionic Amphiphiles†
[51]
논문
A new stereospecific cross-coupling by the palladium-catalyzed reaction of 1-alkenylboranes with 1-alkenyl or 1-alkynyl halides
https://hdl.handle.n[...]
[52]
문서
[53]
논문
Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds
https://hdl.handle.n[...]
[54]
저널 인용
A new stereospecific cross-coupling by the palladium-catalyzed reaction of 1-alkenylboranes with 1-alkenyl or 1-alkynyl halides
http://eprints.lib.h[...]
2015-01-27
[55]
문서
[56]
저널 인용
Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds
http://eprints.lib.h[...]
2015-01-27
[57]
저널 인용
Transmetalation of Alkylboranes to Palladium in the Suzuki Coupling Reaction Proceeds with Retention of Stereochemistry
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com