친핵체
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
친핵체는 원자핵과 상호작용하여 전자쌍을 제공하는 화학종으로, 1933년 잉골드에 의해 명명되었다. 친핵체의 세기는 친핵성으로 표현되며, 주기율표에서 같은 족 내에서 염기성이 강할수록 친핵성이 크다. 친핵체는 다양한 종류가 있으며, 음이온, 비공유 전자쌍을 가진 화합물, 유기 금속 시약, 엔올, 황 화합물, 질소 화합물, 금속 중심 등이 있다. 친핵체와 친전자체의 반응은 정전기적 상호작용과 궤도 상호작용에 의해 제어되며, 경질 친핵체와 연질 친핵체로 분류된다. 유기 합성에서 탄소-탄소 결합을 형성하는 데 중요한 역할을 한다.
더 읽어볼만한 페이지
| 친핵체 | |
|---|---|
| 개요 | |
| 정의 | 전자쌍을 제공하는 화학 종 |
| 관련성 | 친전자체와 반응 |
| 반응 유형 | 치환 반응, 첨가 반응 |
| 성질 | 염기성과 유사하나, 반응 속도론적 개념에 더 가깝다. |
| 친핵성 | |
| 정의 | 친핵체가 탄소 등의 양전하를 띤 원자를 공격하는 능력 |
| 영향 요인 | 전하 원자 크기 용매 전기 음성도 |
| 주기적 경향 | 주기율표에서 왼쪽으로 갈수록 증가 주기율표에서 아래로 갈수록 증가 |
| 친핵체의 예시 | |
| 음이온 | 수산화 이온(OH−) 알콕사이드(RO−) 사이안화 이온(CN−) 할로젠화 이온(Cl−, Br−, I−) |
| 중성 분자 | 물(H2O) 알코올(ROH) 암모니아(NH3) |
| 반응 메커니즘 | |
| SN1 반응 | 1단계: 카보양이온 형성 2단계: 친핵체의 공격 |
| SN2 반응 | 친핵체가 동시에 공격하며 전이 상태를 거침 |
| 첨가 반응 | 친핵체가 불포화 탄소에 결합 |
| 기타 정보 | |
| 관련 용어 | 친전자체 루이스 염기 리간드 |
| 주의사항 | 친핵성은 반응 조건에 따라 달라질 수 있음 |
2. 역사 및 어원
"친핵체"와 "친전자체"라는 용어는 1933년 크리스토퍼 켈크 잉골드에 의해 처음 사용되었으며,[2] 1925년 A. J. 래프워스가 제안한 "음이온성" 및 "양이온성"이라는 용어를 대체했다.[3] "친핵체"라는 단어는 원자핵을 의미하는 "nucleus"와 친구를 의미하는 그리스어 -phil- |φιλος, philosgrc에서 유래되었다.
일반적으로 주기율표에서 같은 족 내에서 이온이 염기성일수록 (공액산의 pKa가 높을수록) 친핵체로서 더 반응성이 크다. 공격하는 원소가 같은 일련의 친핵체 내에서 친핵성의 순서는 염기성을 따른다. 일반적으로 황은 산소보다 더 좋은 친핵체이다.[17]
3. 성질
구핵 반응에서 한 분자에서 다른 분자로 전자가 이동하여 반응이 일어난다. 이때 전자쌍을 받아들이는 화학종을 친전자체, 제공하는 것을 친핵체라고 한다.[17] 따라서 친핵체는 적어도 한 쌍의 고립 전자쌍을 가지며, 이를 통해 친핵체는 루이스 염기로, 친전자체는 루이스 산으로 간주할 수 있다.[18] 이러한 반응은 루이스 산-염기의 결합 반응으로 볼 수 있다.[19]
친핵체로 반응성이 높은 화학종은 대부분 고립 전자쌍을 가지며, 음이온인 경우가 많다. 예를 들어, 각종 카르바니온, 아민 또는 그 짝염기(아미드), 알코올 또는 그 짝염기(알콕시드), 할로겐화물 이온 등이 있다.[17]
친핵체의 반응성은 용매 효과, 치환기 효과, 또는 입체 효과 (입체 장애) 등의 영향을 받을 수 있다.[20]
3. 1. 친핵성
친핵체의 상대적인 세기를 '''친핵성'''이라고 한다. 친핵성은 속도론적인 현상을 가리키며, 산성·염기성에 적용되는 열역학적인 지표와는 다르다[20]。
상대적인 친핵성 강도를 정량화하려는 많은 시도들이 있었다. 이러한 시도들은 다양한 친핵체와 친전자체를 포함하는 반응의 반응 속도를 측정하여 얻은 경험적 데이터를 기반으로 한다. 소위 알파 효과를 나타내는 친핵체는 일반적으로 이러한 처리에서 제외된다.[20]
카르보닐기나 인산기는 전자 부족 상태가 되어 LUMO가 높아진다. 따라서, 이것들은 양전하나 극성을 가진 딱딱한 친전자체에 해당한다[23]. 이것들은 딱딱한 친핵체와 빠르게 반응하며[24], 이 때, 반응은 전하에 의한 쿨롱력에 강하게 영향을 받아 궤도 상호작용의 영향이 작아진다[25]。 이 경우, 매우 딱딱한 친전자체인 프로톤과의 친핵성 반응에서의 평형 정도인, 친핵체의 짝산의 pKa가 친핵성을 나타내는 좋은 지표가 된다[24][26][27]。
반대로, 이탈기를 가진 포화 탄소 등은 카르보닐기 등에 비해 극성이 작고, 부드러운 친전자체로 작용한다[25][23][28]。 따라서, SN2 반응에서의 친핵성은 HOMO의 에너지 준위에도 주목할 필요가 있다. 비교 실험에 따르면, SN2 반응에서의 메탄올 중의 친핵성은 주기율표의 왼쪽으로 갈수록 높아지는 것과 같은 염기성과의 상관 관계가 있으면서도, 고주기 원소일수록 친핵성이 높아지는 등 염기성과 상반되는 결과가 나타난다[20]。 이는 HOMO의 에너지 높이와 관계가 있으며, 고주기 쪽이 고립 전자쌍 궤도의 에너지가 높기 때문이라고 여겨진다[25]。
단, 할로겐화물 이온에서는 비양성자성 용매 중에서의 SN2 반응의 친핵성이 염기성과 마찬가지로 저주기일수록 강해지며, 양성자성 용매 중에서 친핵성이 역전되는 것은 고주기일수록 용매화를 덜 받기 때문이기도 하다[20]。
또한, SN1 반응에서는 속도 결정 단계가 이탈이므로 반응 속도에 친핵체가 관여하지 않고, 생성물의 종류와 생성비에만 영향을 미친다[29]。 또한, 입체 장애가 큰 친핵체는 친핵성이 작고[20], 부피가 큰 강염기일 경우 탈리 반응이 우선적으로 일어난다[30]。
다양한 조건을 고려하여 친핵성을 나타내는 정량적인 파라미터로는, SN2 반응 속도를 기반으로 한 스웨인-스콧의 n값이나, 카보 양이온과 친핵체의 반응 속도 분석에 의한 마이어의 파라미터 등이 있다.
3. 1. 1. 스웨인-스콧 방정식 (Swain–Scott equation)
1953년에 유도된 스웨인-스콧 방정식(
:
이 자유 에너지 관계식은 특정 친핵체가 물보다 얼마나 더 빠르게 반응하는지를 나타낸다.
이러한 처리는 다음과 같은 전형적인 친핵성 음이온에 대한 값을 제공한다.
일반적인 기질 상수는 다음과 같다.
| 기질 | s 값 |
|---|---|
| 에틸 토실산염 | 0.66 |
| β-프로피오락톤 | 0.77 |
| 2,3-에폭시프로판올 | 1.00 |
| 벤질 클로라이드 | 0.87 |
| 벤조일 클로라이드 | 1.43 |
이 방정식은 벤질 클로라이드에 대한 친핵성 치환 반응에서 아자이드 음이온이 물보다 3000배 더 빠르게 반응한다고 예측한다.
3. 1. 2. 리치 방정식 (Ritchie equation)
리치 방정식(Ritchie equation)은 1972년에 도출된 자유 에너지 관계식으로 다음과 같다.[6][7][8]:
여기서 ''N''+는 친핵체 의존적인 매개변수이고, ''k''0는 물의 반응 속도 상수이다. 이 방정식에는 Swain-Scott 방정식에서 ''s''와 같은 기질 의존적인 매개변수가 없다. 즉, 두 친핵체가 친전자체의 성질에 관계없이 동일한 상대적 반응성을 갖는다는 의미이며, 이는 반응성-선택성 원리를 위반한다는 비판을 받는다. 이러한 이유로 이 방정식은 "상수 선택성 관계"라고도 불린다.
원래 출판물에서 데이터는 선택된 친핵체와 선택된 친전자성 카보 양이온 (예: 트로필륨 또는 다이아조늄 양이온)의 반응을 통해 얻어졌다.
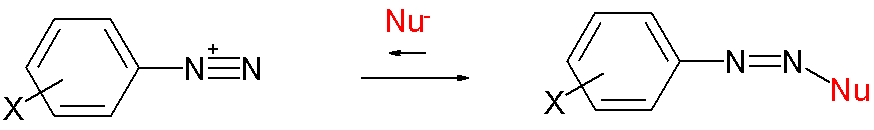
위 그림은 다이아조늄 양이온 반응에서의 리치 방정식을 나타낸다. 그 이후 많은 다른 반응 유형이 설명되었다.
일반적인 Ritchie ''N''+ 값 (메탄올에서)은 다음과 같다.
상대적인 양이온 반응성에 대한 값은 말라카이트 그린 양이온의 경우 -0.4, 벤젠다이아조늄 양이온의 경우 +2.6, 트로필륨 양이온의 경우 +4.5이다.
3. 1. 3. 마이어-패츠 방정식 (Mayr–Patz equation)
1994년에 발표된 마이어-패츠 방정식은 다음과 같다.[9]:
여기서 ''k''는 특정 반응의 20 °C에서의 2차 반응 속도 상수를 나타낸다. ''N''은 친핵성 매개변수, ''E''는 친전자성 매개변수, ''s''는 친핵체에 의존하는 기울기 매개변수이다. 상수 ''s''는 친핵체로 2-메틸-1-펜텐을 사용하여 1로 정의된다.
이 방정식에 사용되는 많은 상수들은 벤즈히드릴리움 이온을 친전자체로 사용하여 유도되었다.[10]
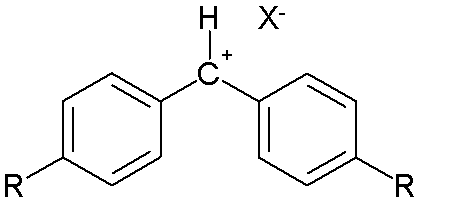
다양한 π-친핵체들을 이용하였다.
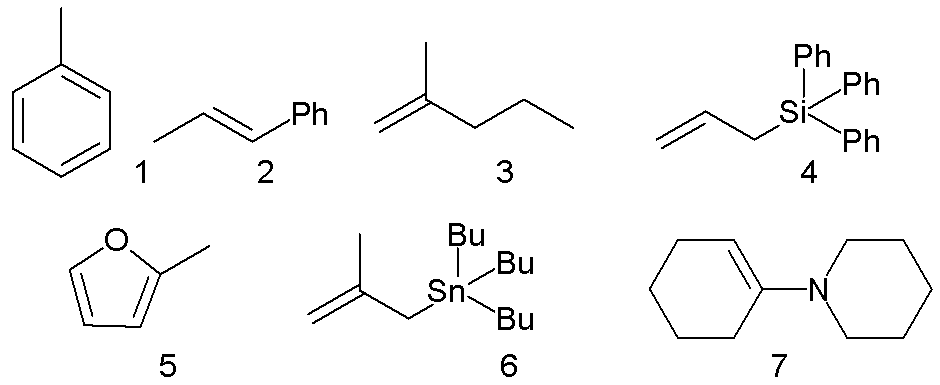
전형적인 E 값은 R = 염소에 대해 +6.2, R = 수소에 대해 +5.90, R = 메톡시에 대해 0, 그리고 R = 디메틸아민에 대해 -7.02이다.
전형적인 N 값은 괄호 안에 s 값을 포함하며, 친전자성 방향족 치환 반응에서 톨루엔에 대해 −4.47 (1.32), 1-페닐-2-프로펜에 대한 친전자성 부가 반응에 대해 −0.41 (1.12), 2-메틸-1-펜텐에 대한 부가 반응에 대해 0.96 (1), 트리페닐알릴실란과의 반응에 대해 −0.13 (1.21), 2-메틸푸란과의 반응에 대해 3.61 (1.11), 이소부테닐트리부틸스탄난과의 반응에 대해 +7.48 (0.89) 및 에나민과의 반응에 대해 +13.36 (0.81)이다.[11]
유기 반응의 범위는 SN2 반응도 포함한다.[12]
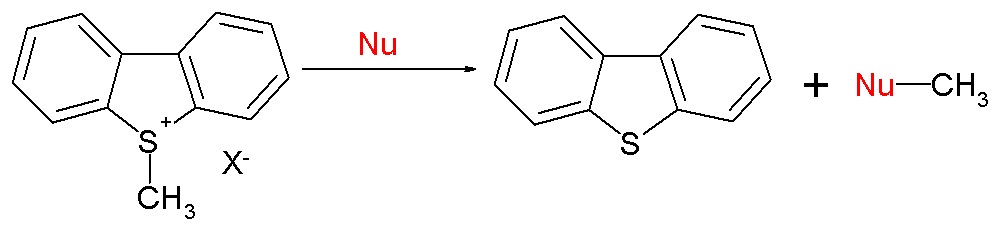
''S-메틸디벤조티오페늄 이온''에 대한 E = −9.15일 때, 전형적인 친핵체 값 N (s)는 피페리딘에 대해 15.63 (0.64), 메톡시드에 대해 10.49 (0.68), 물에 대해 5.20 (0.89)이다. 요약하자면, sp2 또는 sp3 중심에 대한 친핵성은 동일한 패턴을 따른다.
마이어-패츠 방정식은 친핵성 매개변수 ''N'', 친전자성 매개변수 ''E'', 기울기 매개변수 ''s''를 사용하여 반응 속도를 예측하며, 다양한 유기 반응에 적용될 수 있다.
3. 1. 4. 통합 방정식 (Unified equation)
상대적인 친핵성 강도를 정량화하려는 많은 시도들이 이루어졌다. 여러 친핵체와 친전자체를 포함하는 반응의 반응 속도를 측정하여 얻은 경험적 데이터를 활용한다. 소위 알파 효과를 나타내는 친핵체는 일반적으로 이러한 처리에서 제외된다.[20]다양한 조건을 고려하여 친핵성을 나타내는 정량적인 파라미터로는, SN2 반응 속도를 기반으로 한 Swain-Scott의 n값이나, 카보 양이온과 친핵체의 반응 속도 분석에 의한 Mayr의 파라미터 등이 있다. Mayr의 파라미터에서는 친핵성 파라미터 과 친전자성 파라미터 를 제안하고 있으며, 속도 상수 에 대해 다음과 같은 식이 성립한다.
:
(단, sN은 친핵체 의존적인 파라미터이다.)
이것에 의해, 반응 중심이 탄소인 반응 속도의 반정량적인 추정이 가능해진다.
4. 친핵체의 종류
일반적으로 주기율표에서 같은 족 내에서 이온이 염기성일수록(공액산의 pKa가 높을수록) 친핵체로서 더 반응성이 크다. 공격하는 원소가 같을 경우, 친핵성의 순서는 염기성을 따른다. 일반적으로 황은 산소보다 더 좋은 친핵체이다.
친핵체의 예로는 Cl-와 같은 음이온, 암모니아(NH3), PR3와 같이 비공유 전자쌍을 가진 화합물이 있다.[17] 카르바니온, 아민 또는 그 짝염기(아미드), 알코올 또는 그 짝염기(알콕시드), 할로겐화물 이온 등도 친핵체로 작용한다.[17]
친핵체의 상대적인 세기를 '''친핵성'''이라고 한다. 친핵성은 속도론적인 현상을 가리키며, 산성·염기성에 적용되는 열역학적인 지표와는 다르다.[20]
4. 1. 양쪽성 친핵체 (Ambident Nucleophile)
싸이오시아네이트 이온(SCN−)과 같이 두 개 이상의 위치에서 공격할 수 있어 두 개 이상의 생성물을 생성하는 친핵체를 말한다. 예를 들어 SCN−은 황 또는 질소로부터 공격할 수 있다. 이러한 이유로 알킬 할라이드와 SCN−의 SN2 반응은 종종 알킬 싸이오시아네이트(R-SCN)와 알킬 아이소싸이오시아네이트(R-NCS)의 혼합물을 생성한다. 콜베 니트릴 합성에도 유사한 고려 사항이 적용된다.4. 2. 할로젠
할로젠 원소는 이원자 분자 형태(예: I2는 친핵체가 아님)에서는 친핵성이 없지만, 음이온 형태일 때는 좋은 친핵체이다. 극성, 양성자성 용매에서는 F-가 가장 약한 친핵체이고 I-가 가장 강한 친핵체이지만, 극성, 비양성자성 용매에서는 이 순서가 반전된다.[20]할로겐화물 이온에서 비양성자성 용매 중에서의 SN2 반응의 친핵성은 염기성과 마찬가지로 저주기일수록 강해지며, 양성자성 용매 중에서 친핵성이 역전되는 것은 고주기일수록 용매화를 덜 받기 때문이기도 하다.[20]
4. 3. 탄소
카바니온은 탄소 친핵체의 대표적인 예시이다. 유기금속 시약인 그리냐르 반응, 블레이즈 반응, 레포르마츠키 반응, 바르비에 반응 또는 유기리튬 시약 및 아세틸리드를 포함하는 반응에서 탄소 친핵체가 자주 발견된다. 이러한 시약들은 친핵성 첨가 반응을 수행하는데 종종 사용된다.엔올 또한 탄소 친핵체이다. 엔올의 형성은 산 촉매 또는 염기에 의해 촉매된다. 엔올은 양쪽성 친핵체이지만, 일반적으로 알파 탄소 원자에서 친핵성을 띤다. 엔올은 축합 반응에 일반적으로 사용되며, 클라이젠 축합 및 알돌 축합 반응을 포함한다.[20]
4. 4. 산소
물(H2O), 수산화물, 알코올, 알콕사이드, 과산화 수소, 카복실산염 음이온 등이 산소 친핵체의 예이다.[20] 분자간 수소 결합 동안에는 친핵성 공격이 일어나지 않는다.4. 5. 황
황화 수소와 그 염, 티올(RSH), 티올레이트 음이온(RS−), 티올카르복실산 음이온(RC(O)-S−), 디티오카르보네이트 음이온(RO-C(S)-S−)과 디티오카바메이트 음이온(R2N-C(S)-S−)이 황 친핵체로 자주 사용된다.[20]일반적으로 황은 크기가 커서 매우 친핵성이 강하다. 이는 황이 쉽게 편극될 수 있게 하고, 황의 비공유 전자쌍에 쉽게 접근할 수 있게 하기 때문이다.
4. 6. 질소
암모니아, 아자이드, 아민, 아질산염, 하이드록실아민, 히드라진, 카바자이드, 페닐히드라진, 세미카바자이드, 아미드 등이 질소 친핵체이다.[20]4. 7. 금속 중심
대부분의 금속 중심(예: Li+, Zn2+, Sc3+ 등)은 양이온성이며 친전자성(루이스 산)을 띠지만, 특정 금속 중심(특히 낮은 산화 상태이거나 음전하를 띠는 경우)은 기록상 가장 강력한 친핵체에 속하며, 때로는 "슈퍼친핵체"라고 불리기도 한다.[14] 예를 들어, 메틸 요오다이드를 기준 친전자체로 사용할 때, Ph3Sn–은 I–보다 약 10000배 더 친핵성이 강하며, 비타민 B12의 Co(I) 형태 (비타민 B12s)는 약 107배 더 친핵성이 강하다.[14] 다른 슈퍼친핵성 금속 중심으로는 낮은 산화 상태의 카르보닐 금속산 음이온(예: CpFe(CO)2–)이 있다.[15]5. 친핵체와 친전자체의 반응
친핵체와 친전자체의 반응은 전자쌍을 주고받는 과정으로, 루이스 염기인 친핵체가 루이스 산인 친전자체에게 전자쌍을 제공한다[18]. 이 반응은 루이스 산-염기의 결합 반응으로 볼 수 있다[19].
친핵체와 친전자체의 반응은 정전기적 상호작용과 궤도 상호작용이라는 두 가지 요인에 의해 결정된다. 이온이나 극성 분자 간에는 정전기적 상호작용이 중요하며, HOMO와 LUMO 간 에너지 준위 차이가 작을 때는 궤도 상호작용이 중요해진다[21].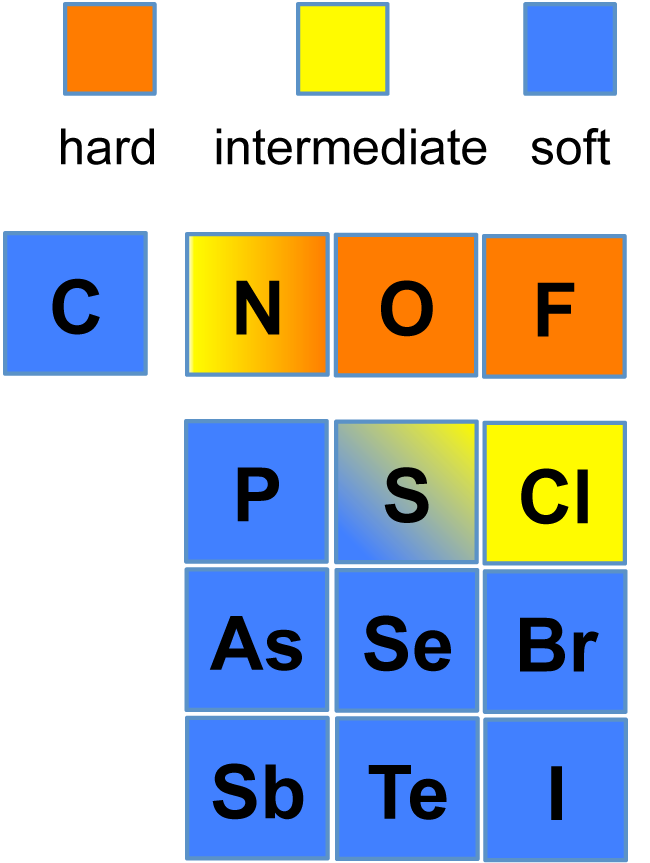
원자 반지름이 작고 전자 밀도가 높은 친핵체를 경질(하드) 친핵체라 하며, 정전기적 상호작용을 통해 반응한다. 반면, 원자 반지름이 크고 전자의 속박이 약한 친핵체는 연질(소프트) 친핵체라 하며, 궤도 상호작용을 통해 반응한다[25]. HSAB 규칙에 따르면, 경질 친핵체는 경질 친전자체와, 연질 친핵체는 연질 친전자체와 반응하기 쉽다[19].
카르보닐기나 인산기는 전자 부족 상태로 인해 LUMO가 높아져 경질 친전자체가 된다[23]. 이들은 경질 친핵체와 빠르게 반응하며, 반응은 쿨롱력에 크게 영향을 받는다[25]. 이 경우 친핵체의 짝산의 pKa가 친핵성을 나타내는 좋은 지표가 된다[24][26][27].
반면, 이탈기를 가진 포화 탄소 등은 극성이 작아 연질 친전자체로 작용한다[25][23][28]. SN2 반응에서의 친핵성은 주기율표 상에서 왼쪽으로 갈수록, 그리고 고주기 원소일수록 높아지는 경향을 보인다[20]. 이는 고립 전자쌍 궤도의 에너지와 관련이 있다[25].
할로겐화물 이온의 경우, 비양성자성 용매에서는 저주기일수록 친핵성이 강해지지만, 양성자성 용매에서는 고주기일수록 용매화를 덜 받기 때문에 친핵성이 역전된다[20].
SN1 반응에서는 속도 결정 단계가 이탈 단계이므로 친핵체가 반응 속도에 영향을 주지 않고, 생성물의 종류와 생성비에만 영향을 미친다[29]. 입체 장애가 큰 친핵체는 친핵성이 낮고[20], 부피가 큰 강염기는 탈리 반응을 우선적으로 일으킨다[30].
6. 유기 합성에서의 응용
그리냐르 시약이나 유기 리튬 화합물을 대표로 하는 각종 유기 금속 시약은 다양한 기질에 대해 높은 반응성을 나타내므로, 유기 합성에서 탄소-탄소 결합을 형성할 때 사용되는 중요한 친핵체이다.[32] 특히 입체 특이적인 친핵성 치환 반응(SN2 반응)이나 친핵성 부가 반응은 선택적 입체 제어를 가능하게 하므로 불균등 합성에 많이 사용된다.
참조
[1]
논문
Nucleophilicity—Periodic Trends and Connection to Basicity
https://chemistry-eu[...]
2006-01-23
[2]
논문
266. Significance of tautomerism and of the reactions of aromatic compounds in the electronic theory of organic reactions
[3]
논문
Replaceability of Halogen Atoms by Hydrogen Atoms
1925
[4]
논문
Quantitative Correlation of Relative Rates. Comparison of Hydroxide Ion with Other Nucleophilic Reagents toward Alkyl Halides, Esters, Epoxides and Acyl Halides 1
https://pubs.acs.org[...]
1953-01-00
[5]
서적
The IUPAC Compendium of Chemical Terminology
[6]
서적
The IUPAC Compendium of Chemical Terminology
[7]
논문
Nucleophilic reactivities toward cations
https://pubs.acs.org[...]
1972-10-01
[8]
논문
Cation-anion combination reactions. XIII. Correlation of the reactions of nucleophiles with esters
https://pubs.acs.org[...]
1975-03-00
[9]
논문
Scales of Nucleophilicity and Electrophilicity: A System for Ordering Polar Organic and Organometallic Reactions
[10]
논문
Reference Scales for the Characterization of Cationic Electrophiles and Neutral Nucleophiles
[11]
웹사이트
http://www.cup.uni-m[...]
[12]
논문
Towards a General Scale of Nucleophilicity?
[13]
간행물
Chem 2401 Supplementary Notes
Dalhousie University Chemistry Department
[14]
논문
The nucleophilicity of vitamin B(sub 12s)
1968-04-00
[15]
논문
Organometallic Electrochemistry. VII. 1 The Nucleophilicities of Metallic and Metalloidal Anions Derived from Metals of Groups IV, V, VI, VII, and VIII
1966-11-00
[16]
웹사이트
Chapter 8: Nucleophiles
http://www.chem.ucal[...]
University of Calgary
2024-04-15
[17]
서적
ウォーレン有機化学(上)
東京化学同人
2015
[18]
서적
ボルハルト・ショアー現代有機化学(上)
化学同人
2011
[19]
서적
大学院講義有機化学 (1)分子構造と反応・有機金属化学
東京化学同人
2019
[20]
서적
ボルハルト・ショアー現代有機化学(上)
化学同人
2011
[21]
서적
大学院講義有機化学 (1)分子構造と反応・有機金属化学
東京化学同人
2019
[22]
서적
ウォーレン有機化学(上)
東京化学同人
2015
[23]
서적
フロンティア軌道理論入門 有機化学への応用
講談社
1978
[24]
서적
フロンティア軌道理論入門 有機化学への応用
講談社
1978
[25]
서적
ウォーレン有機化学(上)
東京化学同人
2015
[26]
문서
共役酸のpKaが高いほど求核剤にプロトンが付加しやすく、よい求核剤とみなせる。
[27]
문서
ただし、カルボニル基との反応は軌道相互作用にも支配される。
[28]
문서
ただし、この場合は静電相互作用と軌道相互作用どちらも小さく、Hudsonが提示した規則から軟らかい求電子剤とみなせる。
[29]
서적
ボルハルト・ショアー現代有機化学(上)
化学同人
2011
[30]
서적
ボルハルト・ショアー現代有機化学(上)
化学同人
2011
[31]
웹사이트
Prof. H. Mayr, LMU München
https://www.cup.uni-[...]
Herbert Mayr
2021-02-25
[32]
서적
ウォーレン有機化学(上)
東京化学同人
2015
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com