칼모듈린
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
칼모듈린(Calmodulin, CaM)은 약 148개의 아미노산으로 구성된 작은 단백질로, 네 개의 EF-hand 모티프를 통해 칼슘 이온(Ca2+)과 결합한다. Ca2+는 세포 내 신호 전달에서 이차 전달자 역할을 하며, 칼모듈린은 다양한 세포 유형에서 발현되어 염증, 대사, 세포자멸사, 근육 수축, 기억, 면역 반응 등 중요한 생물학적 과정을 조절한다. 칼모듈린은 구조적 유연성을 통해 다양한 표적 단백질을 인식하며, 칼슘 결합 시 구조 변화를 겪는다. 칼모듈린은 또한 마그네슘(Mg2+)과 같은 다른 금속 이온과도 결합할 수 있으며, 식물에서는 칼모듈린 관련 단백질(CML) 패밀리를 포함하여 발달, 환경 스트레스 반응 및 미생물과의 상호 작용에 관여한다.
칼모듈린은 약 148개의 아미노산으로 구성된 작고 보존성이 높은 단백질(16.7 kDa)이다. EF 핸드 모티프[5]를 4개 포함하며, 각각의 모티프는 칼슘(Ca2+) 이온과 결합하는 두 개의 거의 대칭적인 구형 도메인(N-도메인과 C-도메인)으로 구성된다. 이들은 유연한 연결 부위로 분리되어 있다.[6] 칼슘은 확산 가능한 이차전령자로 작용하여 내세포 신호전달에 관여한다.
칼모듈린은 염증, 대사작용, 세포자살, 평활근 수축, 세포 내 이동, 단기기억, 장기기억, 그리고 면역 반응과 같은 중요한 작용을 매개한다. 많은 수의 단백질들이 칼슘을 스스로 결합할 수 없기 때문에, 칼모듈린은 칼슘 수용체 및 신호 변환자로 사용된다. 또한 소포체와 근소포체에서 칼슘을 저장하는 역할을 할 수 있으며, 인산화, 아세틸화, 메틸화, 단백질 가수분해 자르기 등 번역 후 조절을 겪을 수 있다.
2. 구조
Ca2+가 없을 때는 네 개의 EF 핸드를 구성하는 α-나선이 밀집된 구조로 붕괴되고 중앙 연결 부위는 무질서해진다.[5][6][7][8] Ca2+가 포화되면 EF 핸드 α-나선은 서로 거의 수직으로 열린 구조를 취하고, 중앙 연결 부위는 결정 구조에서 신장된 α-나선을 형성하지만[5][6] 용액에서는 대부분 무질서하게 유지된다.[9] C-도메인은 N-도메인보다 Ca2+ 결합 친화력이 더 높다.[10][11]
칼모듈린은 네 개의 EF 핸드 모티프를 가진 또 다른 Ca2+ 결합 단백질인 트로포닌 C와 구조적으로 매우 유사하다.[5][12]
2. 1. EF-hand 모티프
칼모듈린은 대략 148개의 아미노산(16,706 달톤)으로 이루어져 있다. 칼모듈린은 4개의 EF-hand 모티프를 가지고 있으며, 각각의 EF-hand 모티프는 Ca2+ 이온과 결합한다.[5] 단백질은 대칭적인 구형 도메인을 가지고 있다. Ca2+가 없는 상태에서 네 개의 EF-hand를 형성하는 α-나선은 밀집된 구조로 붕괴되고 중앙 연결 부위는 무질서하다.[5][6][7][8] Ca2+로 포화된 상태에서 EF-hand α-나선은 서로 거의 수직으로 열린 구조를 취하고, 중앙 연결 부위는 결정 구조에서 신장된 α-나선을 형성하지만[5][6] 용액에서는 대부분 무질서하게 남아 있다.[9] C-도메인은 N-도메인보다 Ca2+에 대한 결합 친화도가 더 높다.[10][11]
칼모듈린은 네 개의 EF-hand 모티프를 포함하는 또 다른 Ca2+ 결합 단백질인 트로포닌 C와 구조적으로 매우 유사하다.[5][12] 그러나 트로포닌 C는 N-말단에 추가적인 α-나선을 포함하고 있으며, 그 표적 단백질인 트로포닌 I에 구성적으로 결합되어 있다. 따라서 칼모듈린과 같은 다양한 표적 인식을 보이지는 않는다.
2. 2. 도메인 구조
칼모듈린은 약 148개 아미노산 길이(16,706 달톤)의 단백질로, 4개의 EF-hand 모티프를 가지며 각각은 Ca2+ 이온과 결합한다. 단백질은 대칭적인 구형 도메인을 가지고 있으며, 칼슘은 확산 가능한 이차전령자로서 내세포 신호전달 역할을 한다.
칼모듈린은 4개의 EF 핸드 모티프[5]를 포함하는 두 개의 거의 대칭적인 구형 도메인(N-도메인과 C-도메인)으로 구성되며, 각 도메인에 2개씩 총 4개의 Ca2+ 결합 부위가 유연한 연결 부위에 의해 분리되어 있다.[6] Ca2+가 없는 상태에서는 4개의 EF 핸드를 형성하는 α-나선이 밀집된 구조로 붕괴되고 중앙 연결 부위는 무질서하다.[5][6][7][8] Ca2+로 포화된 상태에서는 EF 핸드 α-나선이 서로 거의 수직으로 열린 구조를 취하고, 중앙 연결 부위는 결정 구조에서 신장된 α-나선을 형성하지만[5][6] 용액에서는 대부분 무질서하게 남아 있다.[9] C-도메인은 N-도메인보다 Ca2+에 대한 결합 친화도가 더 높다.[10][11]
칼모듈린은 트로포닌 C와 구조적으로 매우 유사하며, 트로포닌 C 또한 4개의 EF 핸드 모티프를 포함하는 Ca2+ 결합 단백질이다.[5][12] 그러나 트로포닌 C는 N-말단에 추가적인 α-나선을 포함하고 트로포닌 I에 구성적으로 결합되어 있어 칼모듈린과 같은 다양한 표적 인식을 보이지는 않는다.
2. 3. 유연성
칼모듈린이 매우 다양한 표적 단백질을 인식할 수 있는 능력은 주로 구조적 유연성 때문이다.[13] 중앙 연결 도메인의 유연성 외에도, N- 및 C-도메인은 Ca2+ 결합 상태에서 열림-닫힘 구조 변화 순환을 거친다.[9] 또한 칼모듈린은 표적에 결합할 때 상당한 구조적 변이를 보이며, 상당한 구조 변동을 겪는다.[14][15][16] 칼모듈린과 대부분의 표적 사이의 결합은 주로 소수성이기 때문에 광범위한 표적 단백질 서열을 인식할 수 있다.[14][17] 이러한 특징들이 종합적으로 작용하여 칼모듈린은 다양한 CaM 결합 서열 모티프를 나타내는 약 300개의 표적 단백질을 인식할 수 있다.[18]
3. 메커니즘
칼모듈린의 작동 방식은 다음과 같다.
칼모듈린에 의한 칼슘 결합은 상당한 협동성을 보이며,[5][11] 단량체(단일 사슬) 협동 결합 단백질의 특이한 예이다. 또한, 표적 결합은 Ca2+ 이온에 대한 칼모듈린의 결합 친화도를 변화시켜,[20][21][22] Ca2+ 및 표적 결합 상호작용 사이의 복잡한 알로스테릭 상호작용을 가능하게 한다.[23] 이러한 표적 결합에 대한 Ca2+ 친화도의 영향은 소전도성 Ca2+ 활성화 칼륨(SK) 채널과 같이 칼모듈린에 구성적으로 결합된 단백질의 Ca2+ 활성화를 가능하게 하는 것으로 여겨진다.[24]
칼모듈린은 주로 Ca2+ 결합 단백질로 작용하지만, 다른 금속 이온도 조절한다. 예를 들어, 일반적인 세포 내 Mg2+ 농도(0.5mM~)와 정지 상태 Ca2+ 농도(100 nM)에서 칼모듈린의 Ca2+ 결합 부위는 적어도 부분적으로 Mg2+로 포화된다.[25] 이 Mg2+는 신호 전달 과정에서 생성된 더 높은 농도의 Ca2+에 의해 치환된다. 마찬가지로, Ca2+ 자체는 Ca2+보다 칼모듈린 결합 포켓과 더 강하게 결합하는 삼가 란타나이드와 같은 다른 금속 이온에 의해 치환될 수 있다.[26][27] 이러한 이온은 칼모듈린의 구조를 왜곡하지만[28][29] ''생체 내'' 희귀성으로 인해 일반적으로 생리적으로 관련이 없기 때문에[30][31][26] 칼모듈린의 구조와 기능을 나타내는 지표로 널리 과학적으로 사용되어 왔다.
3. 1. 칼슘 결합
칼모듈린은 많은 수의 단백질이 칼슘을 스스로 결합할 수 없기 때문에, 칼슘 수용체 및 신호 변환기로 사용된다. 칼모듈린은 소포체와 근소포체에서 칼슘을 저장하는 역할을 할 수 있다. 칼모듈린은 대략 148아미노산 길이(16706 달톤)를 가지며, 네 가지 EF-hand 모티프를 가지고 있는데, 각각은 Ca2+ 이온과 결합한다. 단백질은 대칭적인 구형 도메인을 가지고 있다. 칼슘은 확산 가능한 이차전령자 역할을 하며 내세포 신호전달 역할을 한다.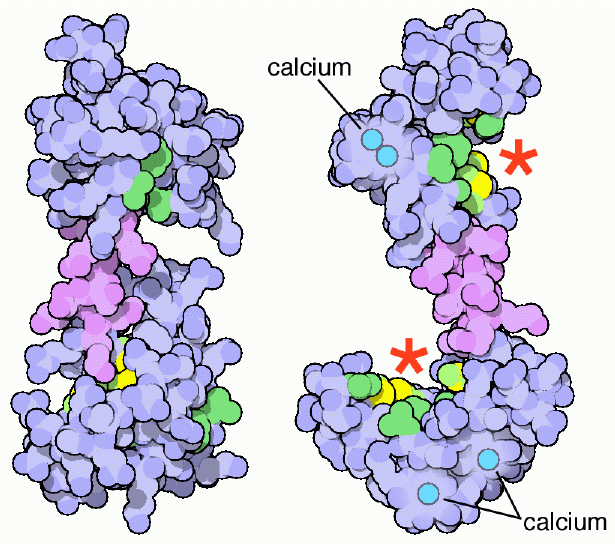
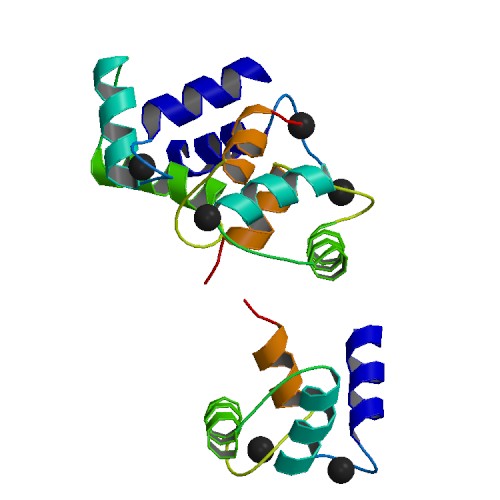
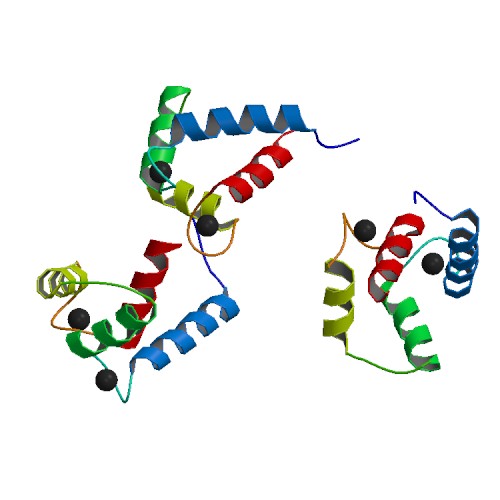
EF-핸드에 의한 Ca2+ 결합은 N- 및 C-도메인의 열림을 유발하여 소수성 표적 결합 표면을 노출시킨다.[6] 이러한 표면은 표적 단백질의 상보적인 비극성 부위와 상호작용하는데, 일반적으로 10~16개의 극성 및/또는 염기성 아미노산으로 분리된 부피가 큰 소수성 아미노산 그룹으로 구성된다.[18][14] 칼모듈린의 유연한 중앙 도메인 덕분에 단백질이 표적 주위를 감쌀 수 있지만, 다른 결합 방식도 알려져 있다. 미오신 경쇄 키나아제 및 CaMKII와 같은 칼모듈린의 "정형적인" 표적은 Ca2+가 결합된 단백질에만 결합하는 반면, NaV 채널 및 IQ 모티프 단백질과 같은 일부 단백질은 Ca2+가 없는 상태에서도 칼모듈린에 결합한다.[14] 칼모듈린 결합은 "상호 유도 적합"을 통해 표적 단백질에서 구조적 재배열을 유도하여[19] 표적 단백질 기능 변화를 초래한다.
칼모듈린에 의한 칼슘 결합은 상당한 협동성을 나타내며,[5][11] 단량체(단일 사슬) 협동 결합 단백질의 특이한 예이다. 또한, 표적 결합은 Ca2+ 이온에 대한 칼모듈린의 결합 친화도를 변화시켜,[20][21][22] Ca2+ 및 표적 결합 상호작용 사이의 복잡한 알로스테릭 상호작용을 가능하게 한다.[23] 이러한 표적 결합이 Ca2+ 친화도에 미치는 영향은 소전도성 Ca2+ 활성화 칼륨(SK) 채널과 같이 칼모듈린에 구성적으로 결합된 단백질의 Ca2+ 활성화를 가능하게 하는 것으로 여겨진다.[24]
칼모듈린은 주로 Ca2+ 결합 단백질로 작용하지만, 다른 금속 이온도 조절한다. 예를 들어, 일반적인 세포 내 Mg2+ 농도(0.5~1.0 mM)와 정지 상태 Ca2+ 농도(100 nM)에서 칼모듈린의 Ca2+ 결합 부위는 적어도 부분적으로 Mg2+로 포화된다.[25] 이 Mg2+는 신호 전달 과정에서 생성된 더 높은 농도의 Ca2+에 의해 치환된다. 마찬가지로, Ca2+ 자체는 Ca2+보다 칼모듈린 결합 포켓과 더 강하게 결합하는 삼가 란타나이드와 같은 다른 금속 이온에 의해 치환될 수 있다.[26][27] 이러한 이온은 칼모듈린의 구조를 왜곡하지만,[28][29] ''생체 내'' 희귀성으로 인해 일반적으로 생리적으로 관련이 없기 때문에[30][31][26] 칼모듈린의 구조와 기능을 나타내는 지표로 널리 과학적으로 사용되어 왔다.
3. 2. 표적 단백질과의 상호작용
칼모듈린은 염증, 대사작용, 세포자살, 평활근 수축, 세포 내 이동, 단기기억, 장기기억, 그리고 면역 반응 등 생체 내 여러 중요 작용을 매개한다.[13] 많은 수의 단백질들은 칼슘을 스스로 붙일 수 없기 때문에, 칼모듈린을 칼슘 수용체 및 신호 변환자로 사용한다. 칼모듈린은 소포체와 근소포체에서 칼슘을 저장하는 역할을 할 수 있다.
칼모듈린이 매우 다양한 표적 단백질을 인식할 수 있는 능력은 주로 구조적 유연성 때문이다.[13] 중앙 연결 도메인의 유연성 외에도, N- 및 C-도메인은 Ca2+ 결합 상태에서 열림-닫힘 구조 변화 순환을 거친다.[9] 또한 칼모듈린은 표적에 결합할 때 상당한 구조적 변이를 보이며, 표적 단백질과의 결합에 따라 구조가 크게 변한다.[14][15][16] 칼모듈린과 대부분의 표적 사이의 결합은 주로 소수성이기 때문에 광범위한 표적 단백질 서열을 인식할 수 있다.[14][17] 이러한 특징들이 종합적으로 작용하여 칼모듈린은 다양한 CaM 결합 서열 모티프를 나타내는 약 300개의 표적 단백질을 인식할 수 있다.[18]
EF-손(EF-hand)에 의한 Ca2+ 결합은 N- 및 C-도메인의 열림을 유발하여 소수성 표적 결합 표면을 노출시킨다.[6] 이러한 표면은 표적 단백질의 상보적인 비극성 부위와 상호 작용하는데, 일반적으로 10~16개의 극성 및/또는 염기성 아미노산으로 분리된 부피가 큰 소수성 아미노산 그룹으로 구성된다.[18][14] 칼모듈린의 유연한 중앙 도메인을 통해 단백질이 표적 주위를 감쌀 수 있지만, 대체 결합 방식도 알려져 있다. 미오신 경쇄 키나아제 및 CaMKII와 같은 칼모듈린의 "정형적인" 표적은 Ca2+가 결합된 단백질에만 결합하는 반면, NaV 채널 및 IQ 모티프 단백질과 같은 일부 단백질은 Ca2+가 없는 상태에서도 칼모듈린에 결합한다.[14] 칼모듈린의 결합은 "상호 유도 적합"을 통해 표적 단백질에서 구조적 재배열을 유도하여[19] 표적 단백질 기능의 변화를 초래한다.
칼모듈린에 의한 칼슘 결합은 상당한 협동성을 나타내며,[5][11] 단량체(단일 사슬) 협동 결합 단백질의 특이한 예이다. 또한, 표적 결합은 Ca2+ 이온에 대한 칼모듈린의 결합 친화도를 변화시키며,[20][21][22] Ca2+ 및 표적 결합 상호 작용 사이의 복잡한 알로스테릭 상호 작용을 가능하게 한다.[23] 이러한 표적 결합에 대한 Ca2+ 친화도의 영향은 소전도성 Ca2+ 활성화 칼륨(SK) 채널과 같이 칼모듈린에 구성적으로 결합된 단백질의 Ca2+ 활성화를 가능하게 하는 것으로 여겨진다.[24]
3. 3. 협동성
칼모듈린에 의한 칼슘 결합은 상당한 협동성을 나타내며,[5][11] 단량체(단일 사슬) 협동 결합 단백질의 특이한 예이다. 또한, 표적 결합은 Ca2+ 이온에 대한 칼모듈린의 결합 친화도를 변화시키며,[20][21][22] Ca2+ 및 표적 결합 상호 작용 사이의 복잡한 알로스테릭 상호 작용을 가능하게 한다.[23] 이러한 표적 결합에 대한 Ca2+ 친화도의 영향은 소전도성 Ca2+ 활성화 칼륨(SK) 채널과 같이 칼모듈린에 구성적으로 결합된 단백질의 Ca2+ 활성화를 가능하게 하는 것으로 여겨진다.[24]
칼모듈린은 주로 Ca2+ 결합 단백질로 작용하지만 다른 금속 이온도 조정한다. 예를 들어, 일반적인 세포 내 Mg2+ 농도(0.5mM~)와 정지 상태의 Ca2+ 농도(100nM)에서 칼모듈린의 Ca2+ 결합 부위는 적어도 부분적으로 Mg2+로 포화된다.[25] 이 Mg2+는 신호 전달 과정에 의해 생성된 더 높은 농도의 Ca2+에 의해 치환된다. 마찬가지로, Ca2+ 자체는 Ca2+보다 칼모듈린의 결합 포켓과 더 강하게 결합하는 삼가 란타나이드와 같은 다른 금속 이온에 의해 치환될 수 있다.[26][27] 이러한 이온은 칼모듈린의 구조를 왜곡하지만[28][29] ''생체 내'' 희귀성으로 인해 일반적으로 생리적으로 관련이 없기 때문에[30][31][26] 칼모듈린의 구조와 기능을 나타내는 지표로 널리 과학적으로 사용되어 왔다.
4. 생물학적 역할
칼모듈린은 염증, 대사작용, 세포자살, 평활근 수축, 세포 내 이동, 단기기억, 장기기억, 면역 반응 등 다양한 생물학적 과정에서 중요한 역할을 한다.[32][33] 칼슘 이온(Ca2+)은 세포 내 신호 전달 과정에서 2차 신호 전달자로 작용하며, 다양한 효소, 이온 채널, 아쿠아포린 등에 결합한다.[4] 칼모듈린은 대부분의 세포에서 발견되며, 세포질, 세포 소기관, 세포막 등 다양한 위치에 존재한다.[33] 칼모듈린은 칼슘과 결합하여 신호를 전달하며, 소포체와 근소포체에 칼슘을 저장하는 역할도 한다. 또한 인산화, 아세틸화, 메틸화, 단백질 가수분해 절단 등 번역 후 변형을 통해 기능이 조절된다.
식물에서 칼모듈린은 발달과 환경 적응에 필수적이다. 특히 세포벽과 세포막 구조 유지에 중요한 칼슘 신호 전달 과정에 관여한다.
4. 1. 동물의 칼모듈린
칼모듈린은 염증, 대사작용, 세포자살, 평활근 수축, 세포 내 이동, 단기기억, 장기기억, 면역 반응 등 여러 중요한 작용을 매개한다.[32][33] 많은 세포 종류에서 발현되며, 칼슘 결합 능력이 없는 단백질들은 칼모듈린을 칼슘 수용체 및 신호 변환 장치로 이용한다. 칼모듈린은 소포체와 근소포체에 칼슘을 저장하는 역할도 한다. 또한 인산화, 아세틸화, 메틸화, 단백질 가수분해 절단 등 번역 후 조절을 거칠 수 있다.[33]4. 1. 1. 평활근 수축
칼모듈린은 흥분-수축 연합(EC 연합) 및 평활근에서 횡다리 순환의 개시에 중요한 역할을 하며, 궁극적으로 평활근 수축을 유발한다.[34] 평활근 수축을 활성화하기 위해서는 미오신 경쇄의 머리가 인산화되어야 한다. 이 인산화는 미오신 경쇄(MLC) 키나아제에 의해 수행된다. 이 MLC 키나아제는 칼슘에 결합된 칼모듈린에 의해 활성화되므로, 칼모듈린의 결합과 MLC 키나아제의 활성화를 통해 평활근 수축이 칼슘의 존재에 의존하게 된다.[34]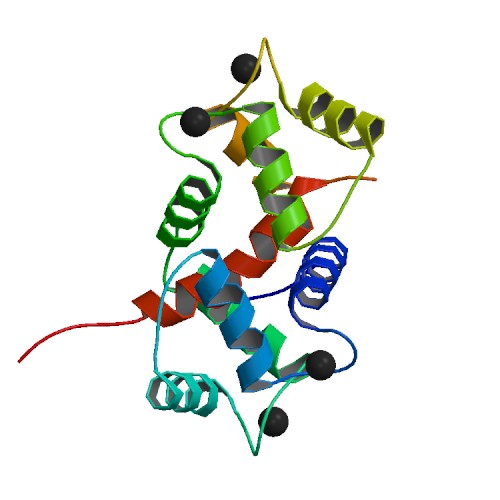
칼모듈린이 근육 수축에 영향을 미치는 또 다른 방법은 세포와 사르코플라스믹 망 막 모두를 가로질러 Ca2+의 이동을 조절하는 것이다. Ca2+ 채널 (예: 사르코플라스믹 망의 리아노딘 수용체)은 칼슘에 결합된 칼모듈린에 의해 억제될 수 있으므로, 세포 내 칼슘의 전반적인 수준에 영향을 미친다.[35] 칼슘 펌프는 세포질에서 칼슘을 제거하거나 소포체에 저장하며, 이러한 조절은 많은 하류 과정을 조절하는 데 도움이 된다.
이는 칼모듈린의 매우 중요한 기능이다. 왜냐하면 소화 및 동맥 수축(혈액 분포 및 혈압 조절에 도움이 됨)과 같이 평활근 수축의 영향을 받는 모든 생리적 과정에 간접적으로 관여하기 때문이다.[36]
4. 1. 2. 대사 조절
칼모듈린은 염증, 신진대사, 세포자멸사, 평활근 수축, 세포 내 이동, 단기 기억, 장기 기억 및 면역 반응과 같은 많은 중요한 과정을 매개한다.[32][33] 칼슘은 초기 자극에 대한 확산성 제2 메신저로 작용하여 세포 신호 전달 시스템에 참여하며, 세포 내 다수의 효소, 이온 채널, 아쿠아포린 및 기타 단백질을 포함한 다양한 표적에 결합한다.[4] 칼모듈린은 많은 세포 유형에서 발현되며, 세포질 내부, 세포 소기관 내부 또는 세포막이나 세포 소기관 막과 관련되는 등 다양한 세포 내 위치를 가질 수 있지만, 항상 세포 내에서 발견된다.[33] 칼모듈린이 결합하는 많은 단백질은 스스로 칼슘에 결합할 수 없으며, 칼슘 센서 및 신호 전달체로 칼모듈린을 사용한다. 칼모듈린은 소포체와 근소포체의 칼슘 저장소도 활용할 수 있다. 칼모듈린은 인산화, 아세틸화, 메틸화 및 단백질 분해 절단과 같은 번역 후 변형을 거칠 수 있으며, 이러한 각 변형은 칼모듈린의 작용을 조절할 가능성이 있다.칼모듈린은 포스포릴라아제 키나아제의 활성화에 중요한 역할을 하며, 이는 궁극적으로 글리코겐 포스포릴라아제에 의해 글리코겐으로부터 포도당이 분해되는 과정으로 이어진다.[37]
칼모듈린은 또한 칼시토닌에 영향을 미침으로써 지질 대사에서 중요한 역할을 한다. 칼시토닌은 혈중 Ca2+ 수치를 낮추고 Gs 단백질 캐스케이드를 활성화시켜 cAMP를 생성하는 폴리펩타이드 호르몬이다. 칼모듈린의 작용을 억제하면 칼시토닌의 작용을 차단할 수 있는데, 이는 칼모듈린이 칼시토닌 활성화에 중요한 역할을 한다는 것을 시사한다.[37]
4. 1. 3. 기억 형성
칼모듈린은 염증, 신진대사, 세포자멸사, 평활근 수축, 세포 내 이동, 단기 기억, 장기 기억 및 면역 반응과 같은 많은 중요한 과정을 매개한다.[32][33] 칼슘은 초기 자극에 대한 확산성 제2 메신저로 작용하여 세포 신호 전달 시스템에 참여하며, 세포 내 다수의 효소, 이온 채널, 아쿠아포린 및 기타 단백질을 포함한 다양한 표적에 결합한다.[4] 칼모듈린은 많은 세포 유형에서 발현되며, 세포질 내부, 세포 소기관 내부 또는 세포막이나 세포 소기관 막과 관련된 등 다양한 세포 내 위치를 가질 수 있지만, 항상 세포 내에서 발견된다.[33] 칼모듈린이 결합하는 많은 단백질은 스스로 칼슘에 결합할 수 없으며, 칼슘 센서 및 신호 전달체로 칼모듈린을 사용한다. 칼모듈린은 소포체와 근소포체의 칼슘 저장소도 활용할 수 있다.Ca2+/칼모듈린 의존성 단백질 키나아제 II(CaMKII)는 칼슘/칼모듈린의 존재를 필요로 하는 장기강화(LTP)로 알려진 시냅스 가소성의 한 유형에서 중요한 역할을 한다. CaMKII는 AMPA 수용체의 인산화에 기여하며, 이는 AMPA 수용체의 민감도를 증가시킨다.[38] 연구에 따르면 CaMKII를 억제하면 LTP가 방해받는다.[38]
4. 1. 4. 기타 기능
칼모듈린은 염증, 대사작용, 세포자살, 평활근 수축, 세포내이동, 단기기억, 장기기억, 면역반응과 같은 중요한 작용을 매개한다.[32][33] 칼슘은 초기 자극에 대한 확산성 제2 메신저로 작용하여 세포 신호 전달 시스템에 참여하며, 세포 내 다수의 효소, 이온 채널, 아쿠아포린 및 기타 단백질을 포함한 다양한 표적에 결합한다.[4]칼모듈린은 많은 세포 유형에서 발현되며, 세포질 내부, 세포 소기관 내부 또는 세포막이나 세포 소기관 막과 관련된 등 다양한 세포 내 위치를 가질 수 있지만, 항상 세포 내에서 발견된다.[33] 칼모듈린이 결합하는 많은 단백질은 스스로 칼슘에 결합할 수 없으며, 칼슘 센서 및 신호 전달체로 칼모듈린을 사용한다. 칼모듈린은 소포체와 근소포체의 칼슘 저장소도 활용할 수 있다. 칼모듈린은 인산화, 아세틸화, 메틸화 및 단백질 분해 절단과 같은 번역 후 변형을 거칠 수 있으며, 이러한 각 변형은 칼모듈린의 작용을 조절할 가능성이 있다.
4. 2. 식물의 칼모듈린
식물은 일반적인 칼모듈린(CaM) 외에도 칼모듈린 관련 단백질(CML)을 포함하고 있다. CML은 일반적인 칼모듈린과 아미노산 서열이 약 15% 정도 유사하다. 애기장대(''Arabidopsis thaliana'')는 약 50개의 서로 다른 CML 유전자를 가지고 있는데,[41] 이는 이 다양한 단백질들이 세포 기능에서 어떤 역할을 하는지에 대한 의문을 제기한다. 모든 식물 종에서 이러한 CML 유전자의 다양성이 나타난다. 서로 다른 칼모듈린과 CML은 ''생체 내''에서 칼모듈린 조절 효소에 결합하고 활성화하는 친화도가 다르며, 서로 다른 세포 소기관에 위치하기도 한다.4. 2. 1. 식물 생장 및 발달
칼슘은 세포벽의 구조적 무결성과 세포의 막 시스템에서 중요한 역할을 한다. 그러나 높은 칼슘 수치는 식물의 세포 에너지 대사에 독성이 될 수 있으므로 세포질의 Ca2+ 농도는 세포질 Ca2+를 세포벽간극 또는 세포 내 소기관의 내강으로 제거하여 서브마이크로몰 수준으로 유지된다. 유입과 유출의 증가로 인해 생성된 Ca2+ 펄스는 호르몬, 빛, 중력, 비생물적 스트레스 요인 및 병원체와의 상호 작용과 같은 외부 자극에 대한 세포 신호로 작용한다.[40]
효모는 단 하나의 CaM 유전자만 가지고 있는 반면, 식물과 척추동물은 진화적으로 보존된 형태의 CaM 유전자를 가지고 있다. 식물과 동물의 Ca2+ 신호 전달의 차이점은 식물이 진화적으로 보존된 형태 외에도 CaM의 확장된 패밀리를 포함하고 있다는 것이다.[39] 칼모듈린은 식물의 발달과 환경 자극에 대한 적응에 필수적인 역할을 한다.
애기장대에서 DWF1 단백질은 식물의 생장에 필수적인 스테로이드 호르몬인 브라시노스테로이드(brassinosteroid) 생합성에서 효소적 역할을 한다. CaM과 DWF1 사이에는 상호작용이 있으며, DWF1이 CaM과 결합하지 못하면 식물에서 정상적인 생장 표현형을 생성할 수 없다. 따라서 CaM은 식물 생장에서 DWF1 기능에 필수적이다.
CaM 결합 단백질은 식물의 생식 발달을 조절하는 것으로도 알려져 있다. 예를 들어, 담배의 CaM 결합 단백질 키나제는 개화의 음성 조절자 역할을 한다. 그러나 이러한 CaM 결합 단백질 키나제는 담배의 꼭대기 생장점에도 존재하며, 생장점에서 이러한 키나제의 농도가 높으면 식물의 개화 전이가 지연된다.
S-유전자 수용체 키나제(SRK)는 CaM과 상호 작용하는 또 다른 단백질 키나제이다. SRK는 배추속(Brassica)에서 꽃가루-암술 상호 작용에 관여하는 자가 불화합성 반응에 관여한다.
애기장대의 CaM 표적 또한 꽃가루 발달과 수정에 관여한다. Ca²⁺ 수송체는 꽃가루관 생장에 필수적이다. 따라서 수정 과정 중 신장 동안 꽃가루관의 끝 부분에 일정한 Ca²⁺ 기울기가 유지된다. 마찬가지로, CaM 또한 꽃가루관 끝 부분에서 필수적인데, 주요 역할은 꽃가루관 생장의 유도에 있다.
애기장대(*Arabidopsis thaliana*) 연구에서 수백 가지의 서로 다른 단백질들이 식물에서 칼모듈린(CaM)에 결합할 가능성을 보여주었다.[45]
4. 2. 2. 미생물과의 상호작용
칼슘(Ca2+) 신호 전달은 식물이 병원균에 대항하여 사용하는 다양한 방어 전략 중 하나이다. 세포질 내 자유 칼슘(Ca2+) 수치는 병원균 감염에 반응하여 증가한다. 이러한 특성의 칼슘(Ca2+) 신호는 일반적으로 방어 관련 유전자와 과민성 세포괴사를 유도하여 식물 방어 시스템을 활성화시킨다. 칼모듈린(CaMs), 칼모듈린 관련 단백질(CMLs), 그리고 칼모듈린 결합 단백질은 최근에 확인된 식물 방어 신호 전달 경로의 구성 요소 중 일부이다. 담배, 콩, 토마토에서 여러 CML 유전자는 병원균에 반응한다. CML43은 칼모듈린 관련 단백질로, 질병 저항성 ''아라비돕시스'' 잎의 APR134 유전자에서 분리되어 유전자 발현 분석을 위해 사용되었으며, 잎에 ''슈도모나스 시린가에(Pseudomonas syringae)''가 접종되면 빠르게 유도된다.[42] 이러한 유전자는 토마토(''솔라눔 라이코퍼시쿰(Solanum lycopersicum)'')에서도 발견된다. APR134의 CML43은 시험관 내에서 칼슘(Ca2+) 이온과 결합하는데, 이는 CML43과 APR134가 따라서 세균 병원균에 대한 식물 면역 반응 동안 칼슘(Ca2+) 의존성 신호 전달에 관여함을 보여준다.[42] ''아라비돕시스 탈리아나(Arabidopsis thaliana)''에서 CML9의 발현은 식물 병원성 세균, 플라젤린(flagellin), 살리실산에 의해 빠르게 유도된다.[43] 형질전환 담배와 ''아라비돕시스''에서 콩 SCaM4와 SCaM5의 발현은 병원균 저항성과 관련된 유전자의 활성화를 유발하고 광범위한 병원균 감염에 대한 저항성을 향상시킨다. 그러나 높은 보존성을 가진 칼모듈린 이성체인 콩 SCaM1과 SCaM2는 그렇지 않다. ''At''BAG6 단백질은 칼슘(Ca2+)이 없을 때만 칼모듈린과 결합하고 칼슘(Ca2+)이 있을 때는 결합하지 않는 칼모듈린 결합 단백질이다. ''At''BAG6는 병원균 감염의 확산을 방지하거나 병원균의 성장을 제한하기 위해 프로그램된 세포 사멸의 과민성 반응을 담당한다. 칼모듈린 결합 단백질의 돌연변이는 병원균 감염에 대한 식물의 방어 반응에 심각한 영향을 미칠 수 있다. 순환 뉴클레오티드-개폐 채널(CNGCs)은 칼모듈린 결합 부위가 겹치는 세포막의 기능성 단백질 채널로, 칼슘(Ca2+)과 같은 2가 양이온을 수송한다. 그러나 식물 방어를 위한 이 경로에서 CNGCs의 위치에 대한 정확한 역할은 아직 불분명하다.Ca2+는 콩과식물의 근류 형성에 중요한 역할을 한다. 질소는 식물에 필요한 필수 원소이며, 많은 콩과식물은 독립적으로 질소를 고정할 수 없어 질소를 암모니아로 환원하는 질소고정 박테리아와 공생 관계를 맺는다. 이러한 콩과식물-'''뿌리혹박테리아속(Rhizobium)''' 상호작용의 확립에는 '''뿌리혹박테리아속'''(Rhizobium) 박테리아가 생성하는 Nod 인자가 필요하다. Nod 인자는 콩과식물의 근류 형성에 관여하는 뿌리털 세포에 의해 인식된다. 다양한 특징을 가진 Ca2+ 반응이 Nod 인자 인식에 관여하는 것으로 특징지어진다. 초기에는 뿌리털 끝에서 Ca2+ 유입이 발생한 후 세포질에서 Ca2+의 반복적인 진동이 일어나고, 핵 주변에서도 Ca2+ 급증이 발생한다. Nod 인자 신호 전달에 필수적인 유전자인 DMI3는 Ca2+ 급증 신호 하류에서 기능하며, Ca2+ 신호를 인식할 수도 있다. 또한, '''자주개자리속(Medicago)'''와 '''토끼풀속(Lotus)'''에서 여러 CaM 및 CML 유전자가 근류에서 발현된다.
4. 2. 3. 환경 스트레스 반응
칼슘은 세포벽의 구조와 세포막 시스템에 중요한 역할을 한다. 그러나 높은 칼슘 수치는 식물의 세포 에너지 대사에 독성이 있을 수 있어, 세포질의 Ca2+ 농도는 세포질 Ca2+를 세포벽간극 또는 세포 내 소기관으로 보내는 방식으로 낮게 유지된다. 이러한 칼슘 이온(Ca2+)의 이동은 호르몬, 빛, 중력, 여러 스트레스 요인과 병원체 간의 상호작용과 같은 외부 자극에 대한 세포 신호로 작용한다.[40]세포 내 Ca2+ 농도 변화는 기계적 자극, 삼투 및 염 처리, 저온 및 고온 충격에 대한 다양한 반응의 지표로 사용된다. 뿌리 세포 유형에 따라 삼투 및 염 스트레스에 대해 서로 다른 Ca2+ 반응을 보이는데, 이는 Ca2+ 패턴이 세포마다 특이적으로 나타난다는 것을 의미한다. 외부 스트레스에 대한 반응으로, 칼모듈린(CaM)은 L-글루탐산을 GABA로 전환하는 글루탐산 탈카르복실라아제(GAD)를 활성화한다. GABA 합성의 엄격한 조절은 식물 발달에 중요하며, GABA 수치의 증가는 식물 발달에 영향을 줄 수 있다. 따라서 외부 스트레스는 식물의 성장과 발달에 영향을 줄 수 있으며, CaM은 이러한 효과를 조절하는 과정에 관여한다.
수수는 고온 건조 환경에 적응할 수 있는 모델 생물이다. 이러한 이유로 수수는 식물에서 칼모듈린의 역할을 연구하는 모델로 사용된다.[45] 수수에는 글리신이 풍부한 RNA 결합 단백질인 SbGRBP를 발현하는 묘목이 있다. 이 단백질은 열을 스트레스 요인으로 사용하여 조절할 수 있다. 세포핵과 세포질에서의 독특한 위치는 Ca2+을 필요로 하는 칼모듈린과의 상호 작용을 보여준다.[44] 식물을 다양한 스트레스 조건에 노출시키면 식물 세포가 환경 변화를 견딜 수 있도록 하는 다양한 단백질이 억제될 수 있다. 이러한 조절된 스트레스 단백질은 CaM과 상호 작용하는 것으로 나타났다. 수수에서 발현되는 ''CaMBP'' 유전자는 고온 및 가뭄 스트레스에 대한 내성을 연구하기 위한 "모델 작물"로 묘사된다.
5. 칼모듈린 유사 단백질 (CML)
식물은 일반적인 칼모듈린(CaM) 단백질 외에도 칼모듈린 유사 단백질(CML, CaM-related proteins)을 포함하고 있다. CML은 일반적인 칼모듈린과 약 15%의 아미노산 유사성을 가지고 있다. 애기장대( ''Arabidopsis thaliana'')는 약 50개의 서로 다른 CML 유전자를 가지고 있는데,[41] 이는 이러한 다양한 단백질들이 세포 기능에서 어떤 역할을 하는지에 대한 의문을 제기한다. 모든 식물 종에서 이러한 CML 유전자의 다양성이 나타난다. 서로 다른 칼모듈린과 CML은 ''생체 내''에서 칼모듈린 조절 효소에 결합하고 활성화하는 친화도가 다르다. 칼모듈린 또는 CML은 또한 서로 다른 세포 소기관 구획에 위치하는 것으로 밝혀졌다.
6. 관련 질환
칼모듈린은 많은 세포 종류에서 발현되며 염증, 대사작용, 세포자살, 평활근 수축, 세포내이동, 단기기억, 장기기억, 면역 반응과 같은 중요한 작용을 매개한다. 많은 수의 단백질들은 칼슘을 스스로 결합할 수 없기 때문에, 칼모듈린을 칼슘 수용체와 신호 변환체로 사용한다. 칼모듈린은 소포체와 근소포체에서 칼슘 저장 역할을 할 수 있다. 또한 인산화, 아세틸화, 메틸화, 단백질 가수분해 절단과 같은 번역 후 조절을 겪을 수 있다.
6. 1. 심혈관 질환
칼모듈린은 염증, 대사작용, 세포자살, 평활근 수축, 세포내이동, 단기기억, 장기기억, 면역 반응과 같은 중요한 작용을 매개한다. 많은 수의 단백질들은 칼슘을 스스로 붙일 수 없기 때문에, 칼모듈린을 칼슘의 수용체와 신호 변환체로 사용한다. 칼모듈린은 소포체와 근소포체에서 칼슘을 저장하는 역할을 할 수 있다. 또한 칼모듈린은 인산화, 아세틸화, 메틸화, 단백질 가수분해 절단과 같은 번역 후 조절을 겪을 수 있다.6. 2. 신경계 질환
칼모듈린은 염증, 대사작용, 세포자살, 평활근 수축, 세포 내 이동, 단기 기억, 장기 기억, 면역 반응 등 중요한 작용을 매개한다. 많은 단백질은 칼슘을 스스로 붙일 수 없기 때문에 칼모듈린을 칼슘 수용체 및 신호 변환기로 사용한다. 칼모듈린은 소포체와 근소포체에서 칼슘 저장 역할을 할 수 있다. 칼모듈린은 인산화, 아세틸화, 메틸화, 단백질 가수분해 자르기 등 번역 후 조절을 겪을 수 있다.[1]6. 3. 암
칼모듈린은 염증, 대사작용, 세포자살, 평활근 수축, 세포내 이동, 단기 기억, 장기 기억, 면역 반응과 같은 중요한 작용을 매개한다. 많은 수의 단백질들은 칼슘을 스스로 붙일 수 없기 때문에, 칼모듈린을 칼슘의 수용체와 신호 변환기로 사용한다. 칼모듈린은 소포체와 근소포체에서 칼슘을 저장하는 역할로 사용될 수 있으며, 인산화, 아세틸화, 메틸화, 단백질 가수분해 자르기 등 번역 후 조절을 겪을 수 있다. 칼모듈린은 많은 세포 종류에서 발현된다.7. 한국의 칼모듈린 연구 현황
(내용 없음)
8. 칼모듈린 패밀리
Calmodulin family영어는 칼슘 결합 단백질인 칼모듈린과 관련된 단백질군이다.
- 칼모듈린 1
- 칼모듈린 2
- 칼모듈린 3
- 칼모듈린 1 유사유전자 1
- 칼모듈린 유사 3
- 칼모듈린 유사 4
- 칼모듈린 유사 5
- 칼모듈린 유사 6
9. 다른 칼슘 결합 단백질
칼모듈린은 EF 핸드 단백질이라고 불리는 두 가지 주요 칼슘 결합 단백질 중 하나에 속한다. 다른 그룹인 애넥신은 칼슘과 인지질(예: 리포코르틴)에 결합한다. 세포 내에서 칼슘 결합이 주요 기능으로 여겨지지는 않더라도, 많은 다른 단백질들이 칼슘에 결합한다.
참조
[1]
논문
Calmodulin: an introduction
1983-08-01
[2]
논문
Calmodulin: a prototypical calcium sensor
2000-08-01
[3]
서적
Neuroscience
Sinauer Associates
2012-01-01
[4]
웹사이트
CALM1 – Calmodulin – Homo sapiens (Human) – CALM1 gene & protein
https://www.uniprot.[...]
2016-02-23
[5]
논문
Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs
2007-07-01
[6]
논문
Calmodulin: a prototypical calcium sensor
2000-08-01
[7]
논문
Solution structure of calcium-free calmodulin
1995-09-01
[8]
논문
Calcium-induced conformational transition revealed by the solution structure of apo calmodulin
1995-09-01
[9]
논문
Solution structure of Ca(2+)-calmodulin reveals flexible hand-like properties of its domains
2001-11-01
[10]
논문
Obtaining site-specific calcium-binding affinities of calmodulin
2003-08-01
[11]
논문
Calcium binding to calmodulin and its globular domains
1991-05-01
[12]
논문
Structures of four Ca2+-bound troponin C at 2.0 A resolution: further insights into the Ca2+-switch in the calmodulin superfamily
1997-12-01
[13]
논문
Calmodulin's flexibility allows for promiscuity in its interactions with target proteins and peptides
2004-05-01
[14]
논문
Structural diversity of calmodulin binding to its target sites
2013-11-01
[15]
논문
Conformational entropy in molecular recognition by proteins
2007-07-01
[16]
논문
A coupled equilibrium shift mechanism in calmodulin-mediated signal transduction
2008-05-01
[17]
논문
Protein-peptide interaction studies demonstrate the versatility of calmodulin target protein binding
2006-01-01
[18]
웹사이트
Calmodulin Target Database
http://calcium.uhnre[...]
2020-07-27
[19]
논문
Protein recognition and selection through conformational and mutually induced fit
2013-12-01
[20]
논문
Effects of myosin light chain kinase and peptides on Ca2+ exchange with the N- and C-terminal Ca2+ binding sites of calmodulin
1996-01-01
[21]
논문
Target recognition by calmodulin: dissecting the kinetics and affinity of interaction using short peptide sequences
1996-07-01
[22]
논문
The neuronal voltage-dependent sodium channel type II IQ motif lowers the calcium affinity of the C-domain of calmodulin
2008-01-01
[23]
논문
An allosteric model of calmodulin explains differential activation of PP2B and CaMKII
2008-08-01
[24]
논문
Structural basis for calmodulin as a dynamic calcium sensor
2012-05-01
[25]
논문
Insights into modulation of calcium signaling by magnesium in calmodulin, troponin C and related EF-hand proteins
2011-05-01
[26]
논문
Terbium (III) emission as a probe of calcium(II) binding sites in proteins
1976-12-01
[27]
논문
Terbium as luminescent probe of calmodulin calcium-binding sites; domains I and II contain the high-affinity sites
1980-07-01
[28]
논문
Coordination to lanthanide ions distorts binding site conformation in calmodulin
2018-04-01
[29]
논문
Activation of calmodulin by various metal cations as a function of ionic radius
https://molpharm.asp[...]
1984-07-01
[30]
논문
Lanthanide ion luminescence probes of the structure of biological macromolecules
1981-12-01
[31]
논문
Characterization of lanthanide (III) ion binding to calmodulin using luminescence spectroscopy
1985-11-01
[32]
웹사이트
Home Page for Calmodulin
http://structbio.van[...]
2016-02-23
[33]
웹사이트
Calmodulin
https://www.ebi.ac.u[...]
2016-02-23
[34]
논문
Ca(2+)-dependent phosphorylation of myosin light chain kinase decreases the Ca2+ sensitivity of light chain phosphorylation within smooth muscle cells
http://www.jbc.org/c[...]
1994-04-01
[35]
논문
Calmodulin and the regulation of smooth muscle contraction
1994-06-01
[36]
저널
Regulation of calcium channels in smooth muscle: new insights into the role of myosin light chain kinase
2014-10-31
[37]
저널
Calcium/calmodulin-mediated action of calcitonin on lipid metabolism in rats
1988-10-01
[38]
저널
Calcium/calmodulin-dependent kinase II and long-term potentiation enhance synaptic transmission by the same mechanism
1995-11-01
[39]
저널
Plant calmodulins and calmodulin-related proteins: multifaceted relays to decode calcium signals
2006-05-01
[40]
저널
Abiotic stress responses in plants: roles of calmodulin-regulated proteins
2015
[41]
저널
Genome-wide analysis of the peanut CaM/CML gene family reveals that the AhCML69 gene is associated with resistance to Ralstonia solanacearum
2024-02-21
[42]
저널
Calmodulin-like proteins from Arabidopsis and tomato are involved in host defense against Pseudomonas syringae pv. tomato
2005-08-01
[43]
저널
CML9, an Arabidopsis calmodulin-like protein, contributes to plant innate immunity through a flagellin-dependent signalling pathway
2012-09-01
[44]
저널
A temperature-responsive gene in sorghum encodes a glycine-rich protein that interacts with calmodulin
2017-06-01
[45]
저널
Mapping QTLs associated with drought resistance in sorghum (Sorghum bicolor L. Moench)
2002-01-01
[46]
저널
Calmodulin: an introduction
[47]
저널
Calmodulin: a prototypical calcium sensor
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com