장기강화
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
장기 강화(LTP)는 신경세포 간의 시냅스 연결 강도가 장기간 증가하는 현상으로, 학습과 기억의 생물학적 메커니즘 중 하나로 여겨진다. 19세기 말, 기억이 새로운 신경세포 생성에 의한 것이 아니라는 연구 결과에 따라, 기존 신경세포 간의 연결 강화로 기억을 설명하려는 시도가 있었고, 1966년 테레 뢰모에 의해 토끼의 해마에서 장기 강화가 처음 발견되었다. LTP는 입력 특이성, 연관성, 협동성 등의 특징을 가지며, NMDA 수용체 의존성, 비-헤비안, 안티-헤비안 메커니즘 등 다양한 종류가 존재한다. LTP는 전기 장기 강화와 후기 장기 강화의 두 단계로 나뉘며, 시냅스 후 세포의 칼슘 농도 증가, 단백질 키나아제 활성화, 유전자 전사 및 단백질 생합성 등 다양한 메커니즘을 통해 일어난다. 또한 역행성 신호, 시냅스 태깅과 같은 가설을 통해 LTP의 특성을 설명하려는 연구가 진행되고 있다. LTP는 공간 기억, 억제성 회피 학습과 같은 행동 학습에 기여하며, 알츠하이머병, 약물 의존증 등 다양한 신경 질환과 관련이 있는 것으로 알려져 있다.
더 읽어볼만한 페이지
- 행동신경과학 - 식사장애
식사장애는 체중, 체형, 음식 섭취에 대한 과도한 집착과 비정상적인 식사 행동을 보이는 정신 질환으로, 신경성 식욕부진증, 신경성 폭식증, 폭식 장애 등 다양한 유형이 있으며, 유전적, 심리적, 환경적 요인이 복합적으로 작용하여 발생하고 심각한 합병증과 높은 사망률을 유발할 수 있어 조기 진단과 치료가 중요하다. - 행동신경과학 - 성별 불일치의 원인
성별 불일치의 원인은 유전적, 호르몬적, 심리적, 사회적 요인 등 다양한 측면에서 연구되며, 뇌 구조의 차이, 블랜차드의 유형학 등이 관련 연구로 제시된다. - 기억 - 마음
마음은 의식, 사고, 지각, 감정, 동기, 행동, 기억, 학습 등을 포괄하는 심리적 현상과 능력의 총체이며, 다양한 분야에서 연구되고 인간 삶의 중추적인 역할을 한다. - 기억 - 잠재학습
잠재학습은 명확한 보상이나 처벌 없이 환경 정보를 습득하는 학습으로, 즉각적인 결과가 나타나지 않으며 인지적 요인이 중요하고, 쥐의 미로 실험과 유아의 모방 행동 연구를 통해 특성이 밝혀졌으며 특정 물질과 뇌 신경 물질의 영향에 대한 연구가 진행되고 있다. - 신경생리학 - 신경가소성
신경가소성은 뇌의 구조와 기능이 경험, 학습, 손상에 따라 변화하는 능력이며, 시냅스 가소성, 구조적 가소성으로 나뉘어 뇌졸중, 학습 장애 등의 치료와 재활, 명상, 예술 활동 등 다양한 분야에 응용된다. - 신경생리학 - 신경근 접합부
신경근 접합부는 운동 뉴런과 골격근 세포 사이의 시냅스로, 아세틸콜린을 매개로 신경 신호를 근육 수축으로 전환하며, 콜린에스터라제에 의해 신호가 종료되는 과정이 다양한 요인에 의해 영향을 받고 여러 질병과 관련되어 연구되고 있다.
| 장기강화 | |
|---|---|
| 개요 | |
| 유형 | 시냅스 가소성 |
| 관련 | 기억, 학습 |
| 반대 현상 | 장기 억압 |
| 상세 정보 | |
| 위치 | 해마, 대뇌 피질, 소뇌, 편도체 및 기타 뇌 영역 |
| 발견 | |
| 최초 발견 | 1973년 |
| 발견 장소 | 해마 |
2. 역사
19세기 말, 과학자들은 성인의 뇌세포 수가 나이가 들어도 크게 증가하지 않는다는 것을 알게 되었고, 기억이 새로운 신경세포 생성에 의한 것이 아니라고 여겼다.[120] 이로 인해 새로운 신경세포 형성 없이 기억 형성을 설명하는 이론이 필요하게 되었다.
스페인의 신경해부학자 산티아고 라몬 이 카할은 새로운 신경세포 형성을 가정하지 않고 학습 메커니즘을 주장한 최초의 인물 중 한 명이다. 1894년 크루니언 강연에서 그는 이미 존재하는 신경세포 간의 신호전달 효과가 향상됨으로써 신경세포 결합이 강화되어 기억이 생긴다고 주장했다.[120] 도널드 헵은 1949년 헵의 법칙을 통해 신경세포 간 연결 변화가 학습의 അടിസ്ഥാന이라고 주장했다.
이러한 기억 형성 이론은 현재는 확립되었지만, 당시에는 주목받지 못했다. 19세기 후반부터 20세기 전반의 신경과학자와 심리학자들은 동물의 학습에 있어 생물학적 기초를 해명하는데 필요한 전기생리학 방법이 아직 확립되지 않았기 때문이다. 이러한 방법은 20세기 후반에 성립되었고, 마침 그 시기에 장기강화가 발견되었다.
1966년, 테레 뢰모는 노르웨이 오슬로의 페르 안데르센 연구실에서 토끼의 해마를 이용해 장기 강화를 처음 발견했다.[121] 뢰모는 마취 상태의 토끼의 단기기억에서 해마가 어떤 역할을 하는지 알아보기 위해 전기생리학 실험을 진행했다.
뢰모는 해마의 관통로(perforant pathway)와 치상회(dentate gyrus)를 연결하는 신경을 분리하여, 관통로에 자극을 주었을 때 치상회에서 어떤 전기생리학적 변화가 일어나는지 관찰했다. 예상대로 관통로 섬유(시냅스전 섬유)에 약한 전기 자극(단일 펄스)을 주면, 치상회에서 흥분성 시냅스후 전위가 발생했다. 하지만 뢰모가 예상하지 못한 것은, 강한 자극(높은 빈도의 자극)을 주면 약한 자극에 대한 반응이 오랫동안 강해진다는 사실이었다. 즉, 강한 자극을 준 후에 약한 자극을 주면 시냅스후 뉴런의 흥분성 시냅스후 전위가 훨씬 강하고 오래 지속되었다. 이처럼 강한 자극으로 인해 약한 자극에 대한 시냅스후 뉴런의 반응성이 장기간 증가하는 현상을 처음에는 "Long-lasting potentiation"이라고 불렀다.[122][123]
1968년 안데르센의 연구실에 합류한 티모시 블리스[121]는 1973년 뢰모와 함께 토끼의 해마에서 나타나는 "long-lasting potentiation" 현상에 대한 논문을 처음 발표했다.[122] 또한, 블리스와 토리 가드너 메드윈(Tony Gardner-Medwin)은 마취하지 않은 깨어있는 동물에서도 같은 현상이 나타난다는 논문을 발표했다.[123] 1975년, 더글러스(Douglas)와 고더드(Goddard)는 "long-lasting potentiation" 대신 '''장기 강화'''('''Long-term potentiation''')라는 용어를 제안했다.[124]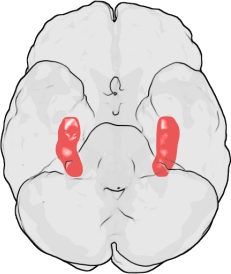
2. 1. 학습의 초기 이론
19세기 말, 과학자들은 성인의 뇌세포 수가 나이가 들어도 크게 증가하지 않는다는 것을 알게 되었고, 기억이 새로운 신경세포 생성에 의한 것이 아니라고 여겼다.[120] 이로 인해 새로운 신경세포 형성 없이 기억 형성을 설명하는 이론이 필요하게 되었다.스페인의 신경해부학자 산티아고 라몬 이 카할은 새로운 신경세포 형성을 가정하지 않고 학습 메커니즘을 주장한 최초의 인물 중 한 명이다. 1894년 크루니언 강연에서 그는 이미 존재하는 신경세포 간의 신호전달 효과가 향상됨으로써 신경세포 결합이 강화되어 기억이 생긴다고 주장했다.[120] 도널드 헵은 1949년 헵의 법칙을 통해 신경세포 간 연결 변화가 학습의 അടിസ്ഥാന이라고 주장했다.
이러한 기억 형성 이론은 현재는 확립되었지만, 당시에는 주목받지 못했다. 19세기 후반부터 20세기 전반의 신경과학자와 심리학자들은 동물의 학습에 있어 생물학적 기초를 해명하는데 필요한 전기생리학 방법이 아직 확립되지 않았기 때문이다. 이러한 방법은 20세기 후반에 성립되었고, 마침 그 시기에 장기강화가 발견되었다.
2. 2. 장기 강화의 발견
1966년, 테레 뢰모는 노르웨이 오슬로의 페르 안데르센 연구실에서 토끼의 해마를 이용해 장기 강화를 처음 발견했다.[121] 뢰모는 마취 상태의 토끼의 단기기억에서 해마가 어떤 역할을 하는지 알아보기 위해 전기생리학 실험을 진행했다.뢰모는 해마의 관통로(perforant pathway)와 치상회(dentate gyrus)를 연결하는 신경을 분리하여, 관통로에 자극을 주었을 때 치상회에서 어떤 전기생리학적 변화가 일어나는지 관찰했다. 예상대로 관통로 섬유(시냅스전 섬유)에 약한 전기 자극(단일 펄스)을 주면, 치상회에서 흥분성 시냅스후 전위가 발생했다. 하지만 뢰모가 예상하지 못한 것은, 강한 자극(높은 빈도의 자극)을 주면 약한 자극에 대한 반응이 오랫동안 강해진다는 사실이었다. 즉, 강한 자극을 준 후에 약한 자극을 주면 시냅스후 뉴런의 흥분성 시냅스후 전위가 훨씬 강하고 오래 지속되었다. 이처럼 강한 자극으로 인해 약한 자극에 대한 시냅스후 뉴런의 반응성이 장기간 증가하는 현상을 처음에는 "Long-lasting potentiation"이라고 불렀다.[122][123]
1968년 안데르센의 연구실에 합류한 티모시 블리스[121]는 1973년 뢰모와 함께 토끼의 해마에서 나타나는 "long-lasting potentiation" 현상에 대한 논문을 처음 발표했다.[122] 또한, 블리스와 토리 가드너 메드윈(Tony Gardner-Medwin)은 마취하지 않은 깨어있는 동물에서도 같은 현상이 나타난다는 논문을 발표했다.[123] 1975년, 더글러스(Douglas)와 고더드(Goddard)는 "long-lasting potentiation" 대신 '''장기 강화'''('''Long-term potentiation''')라는 용어를 제안했다.[124]
3. 장기 강화의 종류
장기 강화는 뇌의 여러 영역에서 다양한 형태로 나타난다. 장기 강화의 종류는 생물의 연령, 신호 전달 경로, 뇌의 부위 등에 따라 달라진다.[127][22][79][80]
- 생물의 연령: 미성숙한 해마의 장기 강화 분자 메커니즘은 성체의 해마와 다르다.[127][22][80]
- 신호 전달 경로: 특정 세포가 이용하는 신호 전달 경로에 따라 서로 다른 종류의 장기 강화가 일어난다. 예를 들어, 해마의 장기 강화는 NMDA 글루탐산 수용체에 의한 것, 대사형 글루탐산 수용체(mGluR)에 의한 것, 또는 완전히 다른 수용체에 의한 것들이 있다.[126][79]
- 뇌의 부위: 장기 강화에 기여하는 다양한 신호 전달 경로와 뇌에서의 광범위한 분포는 장기 강화의 종류가 관찰되는 뇌의 부위에 따라 달라지는 이유이다. 예를 들어, 해마의 샤퍼 측부 경로에서 일어나는 장기 강화는 NMDA 글루탐산 수용체와 관련이 있는 반면, 이끼섬유 경로에 의한 장기 강화는 NMDA 글루타민산 수용체에 의존하지 않는다.[128][81][24]
헤브의 가설에 따라 이름을 붙인 헤비안(Hebbian), 비-헤비안(non-Hebbian), 그리고 안티-헤비안(anti-Hebbian) 메커니즘으로 장기 강화를 분류할 수 있다.
- 헤비안 LTP: 유도를 위해 동시적인 전 및 시냅스 후 탈분극을 필요로 한다.[25]
- 비-헤비안 LTP: 전 및 시냅스 후 세포의 그러한 동시 탈분극을 필요로 하지 않는 LTP의 한 유형이다. 이러한 예는 이끼섬유 해마 경로에서 발생한다.[26]
- 안티-헤비안 LTP: 유도를 위해 명시적으로 동시적인 전 시냅스 탈분극과 상대적인 시냅스 후 과분극을 필요로 한다.[27]
도입이 용이하다는 이유로, 해마의 CA1에 의한 장기 강화는 포유류의 장기 강화 연구의 기본적인 것이 되었다. 특히 성체의 해마의 CA1에 의한 NMDA 글루탐산 수용체 의존성 장기 강화는 가장 널리 연구되어있는 장기 강화이다.[126][79]
4. 장기 강화의 특성
NMDA 수용체 의존성 장기 강화는 주로 입력 특이성, 연합성, 협동성 세 가지 특성을 나타낸다.
; 입력 특이성
: 일단 유도되면 한 시냅스에서의 장기 강화는 다른 시냅스로 확산되지 않는다. 즉, 장기 강화는 입력 특이적이다. 장기 강화는 연합성과 협동성에 의해서만 전파된다. 그러나 짧은 거리에서의 장기 강화의 입력 특이성은 완전하지 않다.
; 연관성
: 연합성은 한 시냅스에서의 자극이 장기 강화를 일으키기에 충분한 강도가 아니더라도, 다른 시냅스에서의 강한 자극이 동시에 일어남으로써 장기 강화가 일어난다는 특성이다.
; 협동성
: 장기 강화는 한 시냅스 경로의 강한 강장 자극 또는 여러 경로의 약한 자극이 협동적으로 수행됨으로써 일어난다. 약한 자극이 하나의 시냅스에서 일어나는 경우, 발생하는 탈분극은 장기 강화를 일으키기에는 불충분하다. 그러나 약한 자극이 여러 시냅스에서 시냅스 후 막의 일부에 집중적으로 일어나는 경우, 개별 탈분극이 모여 장기 강화를 일으키기에 충분한 탈분극이 일어난다. 후술할 시냅스 태깅은 연합성과 협동성의 근간을 이루는 공통된 기전으로 여겨진다.
특히, 브루스 맥노튼|Bruce McNaughton영어은 연합성과 협동성의 차이는 어휘의 문제에 불과하다고 주장한다.[30]
5. 장기 강화의 메커니즘
장기 강화(LTP)는 신경계의 여러 곳에서 다양한 메커니즘을 통해 일어난다. 따라서 모든 종류의 장기 강화를 하나로 설명하는 단일 메커니즘은 존재하지 않는다.
일반적으로 장기 강화는 단기 강화(STP), 전기 장기 강화(early LTP), 후기 장기 강화(late LTP)의 세 단계로 나뉜다.[101] 각 단계는 메디에이터(mediator)라고 불리는 작은 분자에 의해 조절된다.[79] 메디에이터에는 세포 외부의 사건에 반응하는 단백질 수용체, 세포 간의 화학 반응을 일으키는 효소, 한 단계에서 다음 단계로의 진행을 돕는 신호 전달 분자 등이 있다. 또한, 메디에이터와 상호작용하여 장기 강화를 최종 형태로 만드는 조절 분자(modulator molecule)도 존재한다.
전기 장기 강화(E-LTP)와 후기 장기 강화(L-LTP)는 유도(induction), 유지(maintenance), 발현(expression)의 세 가지 사건으로 나뉜다.[101] 유도는 장기 강화의 해당 단계가 시작되는 방아쇠가 되는 단기간의 신호 처리를 의미한다. 유지는 유도에 대한 반응으로 일어나는 지속적인 생화학적 변화를, 발현은 유지 신호의 활성화 결과로 나타나는 장기적인 세포 변화를 뜻한다.[101]
LTP의 물리적, 생물학적 메커니즘은 아직 완전히 밝혀지지 않았지만, 수상돌기 가시 연구와 BCM 이론과 같은 수학적 모델을 통해 세포 내 칼슘 농도와 시냅스 강도 사이의 관계를 밝히려는 노력이 이루어지고 있다.[17]
5. 1. 전기 장기 강화 (E-LTP)
전기 장기 강화(E-LTP)는 유도, 유지, 발현의 세 단계로 구성된다.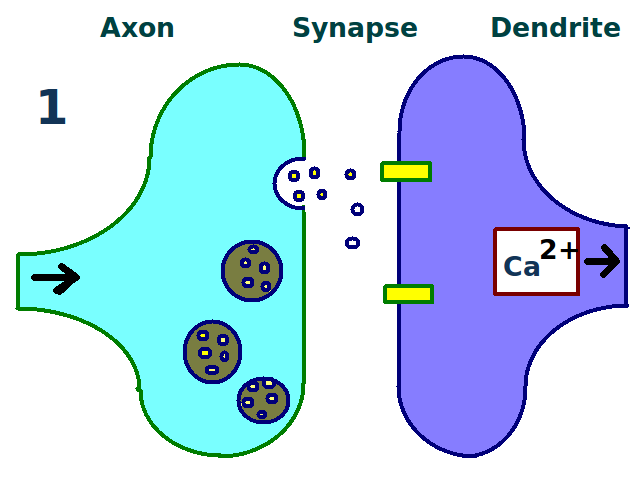
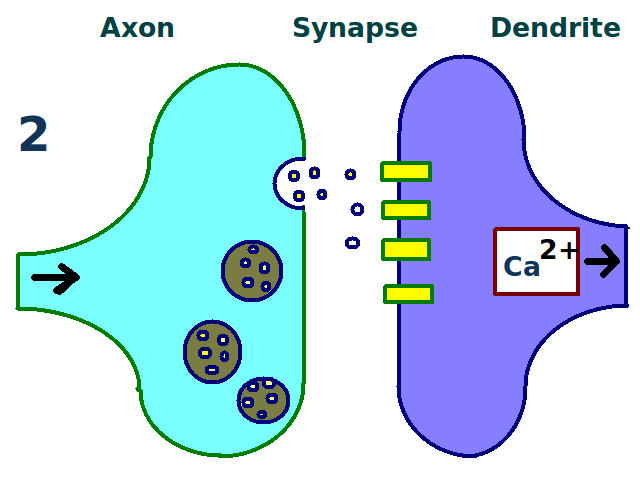
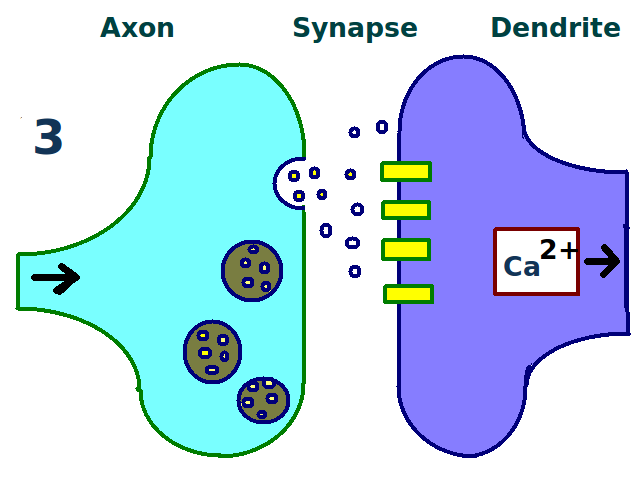
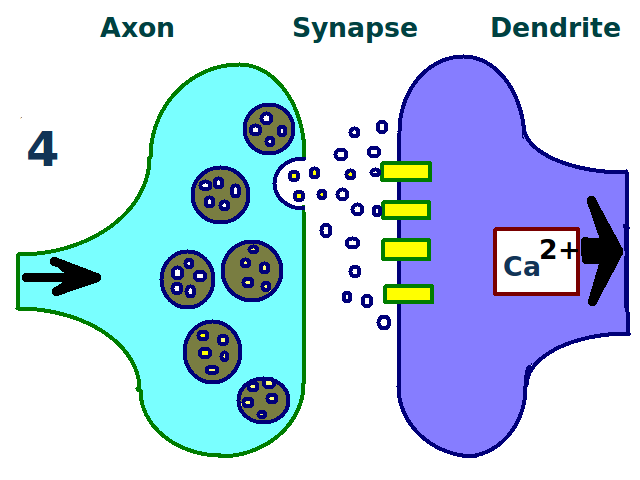
- 유도: 시냅스 후 세포 내 칼슘 농도가 특정 수준 이상으로 증가하면 유도된다. NMDA형 글루탐산 수용체가 칼슘 농도 변화에 중요하며, 고빈도 자극을 통해 실험적으로 유도할 수 있다.
- 유지: CaMKII와 PKC의 활성화는 유도 과정을 수반하지만, E-LTP의 유지에는 이들의 '지속적인' 활성화가 필요하다. 이 단계에서 칼슘에 의존하지 않는 PKMζ가 자율적으로 활성화되어 인산화 현상을 일으킨다.
- 발현: 인산화는 AMPA 수용체의 활성을 증가시키고, 시냅스 후 막에 추가적인 AMPA 수용체 삽입을 유도한다. 이는 단백질 생합성과는 독립적으로 일어난다. 또한, 시냅스 전 세포에서도 변화가 일어나 역행성 메신저(retrograde messenger)의 합성을 유발할 수 있다.
LTP의 물리적, 생물학적 메커니즘은 아직 완전히 밝혀지지 않았지만, 수상돌기 가시 연구와 BCM 이론과 같은 수학적 모델이 개발되어 연구가 진행 중이다.[17]
5. 1. 1. 유도
장기 강화(LTP)는 시냅스 후 세포 내 칼슘 농도가 특정 수준 이상으로 증가했을 때 유도된다.[83] NMDA형 글루탐산 수용체 의존성 장기 강화는 칼슘 농도 변화에 NMDA형 글루탐산 수용체가 필요하며, 두 신경 세포 간의 결합에 고빈도 자극을 여러 번 가함으로써 실험적으로 유도할 수 있다.[83][84]
일반적인 시냅스 전달 과정을 통해, 테타누스 자극으로 전기 장기 강화가 유도되는 방식을 이해할 수 있다. 화학 시냅스는 신경계 곳곳에 존재하는 신경 세포 간의 기능적 결합이다. 시냅스 전 세포에 펄스 자극을 가하면 신경 전달 물질 (예: 글루탐산)이 시냅스 후 막으로 방출된다. 방출된 글루탐산은 시냅스 후 막에 있는 AMPA형 글루탐산 수용체 (AMPAR)에 결합한다. AMPA형 글루탐산 수용체는 뇌의 주요 흥분성 수용체 중 하나이며, 즉각적인 흥분성 활동을 일으킨다.[85] 글루탐산이 AMPA형 글루탐산 수용체에 결합하면 시냅스 후 세포로 나트륨 이온이 유입되어 흥분성 시냅스 후 전위 (EPSP)라는 짧은 시간의 탈분극이 일어난다.
탈분극 강도는 전기 장기 강화가 시냅스 후 세포에서 유도되는지 여부를 결정한다. 고빈도의 반복된 자극은 흥분성 시냅스 후 전위의 시간적 가중(EPSP summation)을 일으켜 점진적으로 강한 탈분극을 유발할 수 있다. 흥분성 시냅스 후 전위의 가중은, 이전 흥분성 시냅스 후 전위에 의한 탈분극이 감소되기 전에 다음 흥분성 시냅스 후 전위가 시냅스 후 세포에 도착하여 더욱 강한 탈분극을 일으키는 현상이다.
NMDA형 글루탐산 수용체 의존성 장기 강화를 보이는 시냅스에서는, 충분한 탈분극에 의해 NMDA형 글루탐산 수용체 (NMDAR)가 해제되고, 글루탐산이 결합했을 때 칼슘의 세포 내 유입이 일어난다. 대부분의 NMDA형 글루탐산 수용체는 정지 막 전위에서 마그네슘 이온에 의해 차단되어 칼슘 유입이 저해된다. 흥분성 시냅스 후 전위 가중에 의한 충분한 탈분극은 NMDA형 글루탐산 수용체를 마그네슘 차단으로부터 해제하여 칼슘 유입을 유발한다.
세포 내 칼슘 농도의 급격한 상승은 전기 장기 강화 유도를 매개하는 효소의 단기간 활성화를 유발한다. 특히 칼슘/칼모듈린 의존성 단백질 키나아제 II (CaMKII)나 단백질 키나아제 C (PKC) 등의 단백질 키나아제가 중요하다.[101] 단백질 키나아제 A (PKA)나 분열 촉진 인자 활성화 단백질 키나아제 (MAPK)도 전기 장기 강화 유도에 기여한다.[101]
CaMKII와 PKC의 "일시적인" 활성화는 전기 장기 강화 유도 결과로 나타난다. 이 효소들의 "지속적인" 활성화는 전기 장기 강화 유지에 관여한다. 이 단계에서는 칼슘 비의존성 프로테인 키나아제 Mζ (PKMz)가 자율적으로 활성화되어 전기 장기 강화 발현에 필요한 인산화가 일어난다.[101]
5. 1. 2. 유지
CaMKII와 PKC의 '일시적인' 활성화는 유도 과정을 수반하지만, E-LTP(초기 형태 LTP)의 유지에는 이들의 '지속적인' 활성화가 특징이다. 이 단계 동안 칼슘에 의존하지 않는 PKMζ가 자율적으로 활성화된다. 결과적으로, 이 효소들은 E-LTP 발현의 기초가 되는 인산화 현상을 수행할 수 있다.[51]인산화는 작은 인산기가 다른 분자에 추가되어 해당 분자의 활성을 변화시키는 화학 반응이다. 자율적으로 활성화되는 CaMKII와 PKC는 인산화를 사용하여 E-LTP 발현의 근본적인 두 가지 주요 메커니즘을 수행한다. 첫째, 그리고 가장 중요한 것은 기존의 AMPA 수용체를 인산화하여 활성을 증가시킨다.[21] 둘째, 시냅스 후 막에 추가적인 AMPA 수용체의 삽입을 매개하거나 조절한다.[21] 중요하게도, E-LTP 동안 시냅스로의 AMPA 수용체 전달은 단백질 생합성과는 독립적이다. 이는 시냅스 후 막에 인접한 비시냅스 AMPA 수용체 풀을 갖는 것으로 달성된다. 적절한 LTP 유도 자극이 도착하면, 비시냅스 AMPA 수용체는 단백질 키나아제의 영향을 받아 시냅스 후 막으로 빠르게 이동한다.[34] AMPA 수용체는 뇌에서 가장 풍부한 글루탐산 수용체이며, 뇌 흥분 활성의 대부분을 매개한다. 시냅스에서 AMPA 수용체의 효율성과 수를 증가시킴으로써, 미래의 흥분 자극은 더 큰 시냅스 후 반응을 생성한다.
위의 E-LTP 모델은 유도, 유지 및 발현에 대한 완전히 시냅스 후 메커니즘을 설명하지만, 발현의 추가적인 구성 요소는 시냅스 전에 발생할 수 있다.[35] 이러한 시냅스 전 촉진의 한 가설은 E-LTP 동안 시냅스 후 세포에서 지속적인 CaMKII 활성이 나중에 논의될 "역행성 메신저"의 합성을 유발할 수 있다는 것이다. 이 가설에 따르면, 새로 합성된 메신저는 시냅스 틈새를 가로질러 시냅스 후 세포에서 시냅스 전 세포로 이동하여, 후속 자극에 대한 시냅스 전 반응을 촉진하는 일련의 사건을 유발한다. 이러한 사건에는 신경 전달 물질 소포 수, 소포 방출 확률 또는 둘 다의 증가가 포함될 수 있다. 초기 장기 기억 강화에서 시냅스 전 발현의 근본적인 역행성 메신저 외에도, 역행성 메신저는 후기 LTP의 발현에도 역할을 할 수 있다.
전기 장기 증강 유도의 결과, CaMKII와 PKC의 "일시적인" 활성화가 일어난다. 전기 장기 강화의 유지에서는 이들 효소의 "지속적인" 활성화가 이루어진다. 이 단계에서는 칼슘 비의존성 Protein kinase Mζ|label=프로테인 키나아제 Mζ영어(PKMζ)가 자율적으로 활성화된다. 그 결과, 전기 장기 강화 발현에 필요한 인산화가 일어난다.[101]
인산화는 작은 인산기가 다른 분자에 결합하여 해당 분자의 활성을 변화시키는 화학 반응이다. 자율적으로 활성화된 CaMKII와 PKC에 의한 인산화로 인해, 초기 장기 강화의 발현에 대한 두 가지 주요 메커니즘이 실행된다. 먼저, 가장 중요한 과정으로, 이 두 효소에 의한 AMPA 수용체의 인산화로 활성이 상승한다.[79] 다음으로, 이 두 효소에 의해 매개되거나 조절되어 AMPA 수용체의 시냅스 후 막 삽입이 일어난다.[79] 중요한 것은, 초기 장기 강화에서의 AMPA 수용체의 시냅스 수송은 단백질 생합성에 의존하지 않는다는 것이다. 이 현상은 시냅스 후 막 근처에 저장된 소포체 내의 AMPA 수용체에 의해 일어난다. 초기 장기 강화를 유발하기 위한 적절한 자극이 도착하면, 소포체에 있는 AMPA 수용체는 프로테인 키나아제의 영향을 받아 즉시 시냅스 후 막으로 수송된다.[86] AMPA 수용체는 뇌에서 가장 풍부한 글루탐산 수용체이며, 대부분의 흥분성 활동을 매개한다. AMPA 수용체의 활성이나 막 상의 수를 증가시킴으로써, 다음 흥분성 자극은 시냅스 후 세포에서 강한 반응을 일으킨다.
위에서 제시된 모델은 초기 장기 강화의 유도, 유지, 발현에 대한 시냅스 후 막에서의 변화를 설명하지만, 시냅스 전 막에서도 발현 단계에서 변화가 일어난다.[87] 시냅스 전 세포의 반응에 대한 가설로, 초기 장기 강화 시 CaMKII의 지속적인 활성화에 의해 뒤에서 설명할 역행성 메신저 (retrograde messenger)의 생합성이 일어난다는 것이 있다. 이 가설에 따르면, 새롭게 합성된 메신저가 시냅스 후 세포에서 시냅스 전 세포로 시냅스 간극을 가로질러, 다음 자극에 대한 시냅스 전 세포의 반응성을 높이는 여러 반응을 일으킨다. 이러한 반응은 신경 전달 물질 소포체의 수나 신경 전달 물질의 방출 확률 증가 등일 수 있다. 역행성 메신저는 초기 장기 강화 외에도 후기 장기 강화의 발현에서도 역할을 한다고 여겨진다.
5. 1. 3. 발현
인산화는 작은 인산기가 다른 분자에 결합하여 해당 분자의 활성을 변화시키는 화학 반응이다. 자율적으로 활성화되는 CaMKII와 PKC는 인산화를 사용하여 초기 장기 강화(E-LTP) 발현의 두 가지 주요 메커니즘을 수행한다. 첫째, 기존의 AMPA 수용체를 인산화하여 활성을 증가시킨다.[21] 둘째, 시냅스 후 막에 추가적인 AMPA 수용체의 삽입을 매개하거나 조절한다.[21] E-LTP 동안 시냅스로의 AMPA 수용체 전달은 단백질 생합성과는 독립적이다. 이는 시냅스 후 막에 인접한 비시냅스 AMPA 수용체 풀을 갖는 것으로 달성된다. 적절한 LTP 유도 자극이 도착하면, 비시냅스 AMPA 수용체는 단백질 키나아제의 영향을 받아 시냅스 후 막으로 빠르게 이동한다.[34] AMPA 수용체는 뇌에서 가장 풍부한 글루탐산 수용체이며, 뇌 흥분 활성의 대부분을 매개한다. 시냅스에서 AMPA 수용체의 효율성과 수를 증가시킴으로써, 미래의 흥분 자극은 더 큰 시냅스 후 반응을 생성한다.위의 E-LTP 모델은 유도, 유지 및 발현에 대한 완전히 시냅스 후 메커니즘을 설명하지만, 발현의 추가적인 구성 요소는 시냅스 전에 발생할 수 있다.[35] 이러한 시냅스 전 촉진의 한 가설은 E-LTP 동안 시냅스 후 세포에서 지속적인 CaMKII 활성이 "역행성 메신저"의 합성을 유발할 수 있다는 것이다. 이 가설에 따르면, 새로 합성된 메신저는 시냅스 틈새를 가로질러 시냅스 후 세포에서 시냅스 전 세포로 이동하여, 후속 자극에 대한 시냅스 전 반응을 촉진하는 일련의 사건을 유발한다. 이러한 사건에는 신경 전달 물질 소포 수, 소포 방출 확률 또는 둘 다의 증가가 포함될 수 있다. 초기 장기 기억 강화에서 시냅스 전 발현의 근본적인 역행성 메신저 외에도, 역행성 메신저는 후기 LTP의 발현에도 역할을 할 수 있다.
5. 2. 후기 장기 강화 (L-LTP)
후기 장기 강화(L-LTP)는 초기 장기 강화(E-LTP)의 연장선상에 있는 현상이다. 초기 장기 강화가 단백질 합성과 무관하게 일어나는 반면, 후기 장기 강화는 시냅스 후 세포에서 유전자 전사와 단백질 생합성을 필요로 한다는 특징이 있다.[36][37]후기 장기 강화는 두 단계로 나눌 수 있다. 첫 번째 단계는 단백질 합성에 의존하며, 두 번째 단계는 유전자 전사와 단백질 생합성 모두에 의존한다.[33] 이 단계들은 각각 LTP2와 LTP3로 불리기도 하며, 이 경우 초기 장기 강화는 LTP1으로 지칭된다.
5. 2. 1. 유도
MAPK (특히 ERK) 등 단백질 키나아제의 지속적인 활성화가 중요하다.[33][43][51] 이는 cAMP 반응 요소 결합 단백질 (CREB) 등 전사 인자의 활성화를 유도한다.[38] CRTC1 (TORC1)과 같은 분자적 일치(molecular coincidence)는 LTP의 연관성을 설명할 수 있다.[38]5. 2. 2. 유지
세포외 신호 조절 키나아제(ERK)는 여러 세포질 및 핵 분자를 인산화하여 CREB 등의 전사 인자를 활성화시킨다.[83][101] 이는 장기 강화(L-LTP) 유지에 필요한 단백질 합성을 유도한다.[33]단백질 키나제 Mζ(PKMζ)는 장기 강화 유도 후 합성이 증가하는 지속적으로 활성화된 키나아제이다.[91][92] PKMζ는 조절 서브유닛이 없어 지속적으로 활성화되는 PKC의 비정형 이소형으로,[91] 장기 기억 유지에 중요한 역할을 할 수 있다.[92] 쥐의 해마에 PKMζ 억제제를 투여하면 단기 기억에는 영향을 주지 않고 역행성 기억 상실을 일으킨다.[92] 최근 연구에서는 PKMζ가 시냅스 골격 내 단백질의 이동 및 재구성을 지시하여 L-LTP 유지를 돕는다는 것이 밝혀졌다.[91] 다만, PKMζ가 없는 형질전환 마우스에서도 정상적인 LTP가 나타나 PKMζ의 필요성에 대한 의문도 제기되었다.[41]
장기적인 시냅스 변화의 안정화는 축삭 단추, 수상 돌기 가시, 시냅스 후 밀도와 같은 구조의 증가로 결정된다.[42] 분자 수준에서는 시냅스 확장의 안정화와 PSD-95, Homer1c와 같은 시냅스 후 골격 단백질 증가의 상관관계가 나타났다.[42]
5. 2. 3. 발현
L-LTP 동안 합성되는 몇몇 단백질의 정확한 종류는 알려져 있지 않다. 하지만, 이 단백질들은 수상돌기 가시 수, 표면적, 그리고 신경 전달 물질에 대한 시냅스 후 민감성을 증가시키는 데 기여한다고 생각된다.[33] 후자는 L-LTP 동안 AMPA 수용체의 합성이 향상되기 때문에 부분적으로 발생할 수 있다.[33] 후기 LTP는 또한 시냅토태그민의 시냅스 전 합성과 시냅스 소포 수의 증가와 관련이 있는데, 이는 L-LTP가 시냅스 후 세포뿐만 아니라 시냅스 전 세포에서도 단백질 합성을 유도한다는 것을 시사한다.[33] 시냅스 후 LTP 유도가 시냅스 전 단백질 합성을 초래하기 위해서는 시냅스 후 세포에서 시냅스 전 세포로의 전달이 있어야 한다. 이것은 역행성 전달 물질의 합성을 통해 발생할 수 있다.시냅스 후 사건으로 제한된 연구에서도, 연구자들은 L-LTP의 근간이 되는 단백질 합성이 어디에서 일어나는지 결정하지 못했다. 구체적으로, 단백질 합성이 시냅스 후 세포체에서 발생하는지 또는 수상돌기에서 발생하는지 불분명하다.[43] 1960년대부터 수상돌기에서 리보솜(단백질 합성 기계의 주요 구성 요소)을 관찰했음에도 불구하고, 일반적인 생각은 세포체가 뉴런에서 단백질 합성의 주요 부위라는 것이었다.[43] 이러한 추론은 1980년대에 연구자들이 세포체와의 연결이 끊어진 수상돌기에서 단백질 합성을 관찰했다고 보고하기 전까지는 심각하게 이의가 제기되지 않았다.[43] 최근에 연구자들은 이러한 유형의 국소 단백질 합성이 일부 유형의 LTP에 필요하다는 것을 입증했다.[44][45]
5. 3. 역행성 신호 (Retrograde signaling)
역행성 시그널링은 시냅스 후 뉴런(신경세포)에서 유도, 발현된 장기 강화가 시냅스 전 뉴런에서도 발현되는 현상을 설명하는 가설이다.[126][130][131] 이 가설의 이름은, 일반적인 시냅스 전달이 시냅스 전 뉴런에서 시냅스 후 뉴런으로 일방적으로 전달되는 것에서 유래되었다. 시냅스 후 뉴런에서 장기 강화가 유도되고 시냅스 전 뉴런에서도 장기 강화가 발현되기 위해서는, 어떠한 신호가 시냅스 후 뉴런에서 시냅스 전 뉴런으로 '역행'해야 한다. 그 신호에 의해 시냅스 전 뉴런에서 반응 연쇄가 시작되어, 신경 전달 물질의 방출 확률 증가 등 시냅스 전 뉴런에서의 장기 강화 발현이 일어난다고 여겨진다.[132]장기 강화 발현에 시냅스 전 세포가 기여하는 것을 인정하지 않는 연구자들에게 역행성 시그널링은 논쟁의 대상이 되고 있다.[126] 가설 지지자들 사이에서도 역행성 전달 물질의 종류에 대한 논쟁이 존재한다. 초기에는 일산화 질소에 초점이 맞춰졌지만, 최근 연구에서는 세포 접착 단백질의 중요성이 부각되고 있다.[126]
5. 4. 시냅스 태깅 (Synaptic tagging)
시냅스 태깅 가설은 장기 강화(LTP) 유도 자극을 받은 시냅스에서 "시냅스 태그"가 합성되어, 세포체에서 합성되어 세포 전체로 운반되는 가소성 관련 단백질을 포착한다는 가설이다.[48] 이 가설은 장기 강화의 입력 특이성, 연합성, 협동성을 설명한다.군소 ''Aplysia californica''(바다달팽이)에서 LTP 연구는 시냅스 태깅이 LTP의 입력 특이성을 위한 메커니즘임을 보여준다.[49][50] 두 개의 멀리 떨어진 시냅스가 있을 때, 한 시냅스에서 LTP를 유도하는 자극은 세포 핵에서 유전자 발현을 시작하는 여러 신호 전달 연쇄 반응을 유도한다. 이와 동시에 자극을 받은 시냅스에서는 국소 단백질 합성을 통해 수명이 짧은(3시간 미만) 시냅스 태그를 생성한다. 유전자 발현 산물은 세포 전체로 운반되지만, 시냅스 태그를 발현하는 시냅스에서만 포착된다. 따라서 LTP 유도 자극을 받은 시냅스만 강화되어, LTP의 입력 특이성이 나타난다.
시냅스 태그 가설은 LTP의 연합성 및 협동성도 설명한다.
- 연합성: 한 시냅스가 LTP 유도 자극으로 흥분되고, 다른 시냅스는 약하게 자극될 때 관찰된다. 약한 자극만으로는 두 시냅스 모두에서 LTP를 유도하기에 충분하지 않지만, 실제로는 두 시냅스 모두 LTP를 겪는다. 약한 자극은 세포체에서 단백질 합성을 유도할 수 없지만, 시냅스 태그 합성은 촉진할 수 있다. 세포체 단백질 합성을 유도할 수 있는 별도의 경로에 대한 동시적인 강한 자극은 가소성 관련 단백질 생성을 촉진하며, 이 단백질은 세포 전체로 운반된다. 두 시냅스 모두 시냅스 태그를 발현하면, 두 시냅스 모두 단백질 생성물을 포착하여 강하게 자극된 경로와 약하게 자극된 경로 모두에서 LTP를 발현하게 된다.
- 협동성: 개별적으로 자극될 때 LTP를 유도할 수 없는 약한 자극으로 두 시냅스가 활성화될 때 관찰된다. 그러나 동시적인 약한 자극을 받으면, 두 시냅스 모두 협동적으로 LTP를 겪는다. 시냅스 태깅은 여러 약한 자극이 어떻게 LTP를 유도하기에 충분한 집합적 자극을 초래할 수 있는지 설명하지 않지만, 독립적으로 LTP를 생성할 수 없는 약하게 자극된 시냅스가 집합적으로 시작된 단백질 합성 산물을 수용하는 능력을 설명한다. 이는 약한 시냅스 자극 후 국소 시냅스 태그 합성을 통해 달성될 수 있다.
6. 장기 강화의 조절
장기 강화는 매개체와 조절자라는 두 가지 주요 분자에 의해 조절된다. 매개체는 장기 강화 생성에 필수적인 분자이며, NMDAR와 칼슘 등이 이에 해당한다. 반면 조절자는 장기 강화에 영향을 주지만, 반드시 필요하지는 않은 분자이다.[21]
해마의 장기 강화는 다양한 조절 인자에 의해 영향을 받는다. 예를 들어, 스테로이드 호르몬인 에스트라디올은 CREB 인산화를 유도하고 수지상 돌기 성장을 촉진하여 장기 강화를 향상시킨다.[52] 노르에피네프린과 같은 β-아드레날린 수용체 작용제는 단백질 합성에 의존하는 장기 강화의 후기 단계를 변화시킬 수 있다.[53] 산화 질소 합성 효소 활성은 구아닐릴 사이클라제 및 PKG 활성화를 유도한다.[54] 도파민 수용체 활성화는 cAMP/PKA 신호 전달 경로를 통해 장기 강화를 향상시킬 수 있다.[55][56]
| 조절 인자 | 표적 |
|---|---|
| β-아드레날린 수용체 | cAMP, MAPK 증폭 |
| 산화 질소 합성 효소 | 구아닐릴 사이클라제, PKG, NMDAR |
| 도파민 수용체 | cAMP, MAPK 증폭 |
| 대사성 글루탐산 수용체 | PKC, MAPK 증폭 |
7. 행동학적 기억과의 관련
세포 배양에서의 시냅스 장기 강화(LTP)는 학습과 기억의 기질을 제공하는 것처럼 보이지만, LTP가 행동 학습(전체 유기체 수준에서의 학습)에 기여하는 바를 시험관 내 연구에서 단순히 추론할 수는 없다. 이러한 이유로, LTP가 살아있는 동물에서의 학습과 기억에 필수적인지 여부를 밝히는 데 상당한 노력이 기울여졌다. LTP는 공포 처리에도 중요한 역할을 한다.
7. 1. 공간 기억 (Spatial memory)

1986년 리처드 G. 모리스는 장기 강화(LTP)가 ''in vivo''에서 기억 형성에 필요하다는 최초의 증거를 제시했다.[57] 그는 쥐의 해마를 약리학적으로 변형하여 공간 학습에서의 역할을 확인하고, 공간 기억을 시험했다. 쥐는 모리스 수중 미로에서 훈련을 받았다. 이 과제는 쥐가 표면 아래에 숨겨진 플랫폼을 찾을 때까지 탁한 물이 있는 수영장에서 헤엄치는 공간 기억 과제이다. 훈련 동안, 정상적인 쥐는 숨겨진 플랫폼의 위치를 미로 둘레의 특정 위치에 배치된 중요한 단서와 연관시킨다. 훈련 후, 쥐의 한 집단은 NMDA 수용체 차단제인 APV에 해마를 담갔고, 다른 집단은 대조군으로 사용되었다. 두 그룹 모두 물 미로 공간 기억 과제를 수행했다. 대조군의 쥐는 플랫폼을 찾아 수영장에서 탈출할 수 있었지만, APV 처리된 쥐의 수행 능력은 현저하게 손상되었다. 또한, 두 그룹에서 해마 조각을 채취했을 때, LTP는 대조군에서는 쉽게 유도되었지만 APV 처리된 쥐의 뇌에서는 유도할 수 없었다. 이는 NMDA 수용체, 그리고 LTP가 적어도 일부 유형의 학습과 기억에 필요하다는 초기 증거를 제공했다.
마찬가지로, 도네가와 스스무는 1996년에 해마의 CA1 영역이 살아있는 쥐의 공간 기억 형성에 매우 중요하다는 것을 입증했다.[58] 이 영역에 위치한 ''장소 세포''는 쥐가 환경의 특정 위치(장소 필드)에 있을 때만 활성화된다. 이러한 장소 필드는 환경 전체에 분포되어 있으므로, 장소 세포 그룹이 해마에 지도를 형성한다는 해석이 가능하다. 이러한 지도의 정확성은 쥐가 환경에 대해 얼마나 잘 배우는지, 그리고 그 환경을 얼마나 잘 탐색할 수 있는지를 결정한다. 도네가와 스스무는 NMDA 수용체를 손상시켜, 특히 CA1 영역에서 NR1 서브유닛을 유전자적으로 제거함으로써, 생성된 장소 필드가 대조군보다 상당히 덜 구체적이라는 것을 발견했다. 즉, 쥐는 NMDA 수용체가 손상되었을 때 결함이 있는 공간 지도를 생성했다. 예상대로, 이러한 쥐들은 대조군에 비해 공간 과제에서 매우 저조한 성적을 보였으며, 이는 공간 학습에서 LTP의 역할을 뒷받침했다.
해마에서 향상된 NMDA 수용체 활동은 향상된 LTP와 공간 학습의 전반적인 개선을 생성하는 것으로 나타났다. 1999년, 탕 등(Tang ''et al''.)은 해마에서 NR2B 서브유닛을 과발현시켜 NMDA 수용체 기능이 향상된 쥐 계통을 생산했다.[59][60] 그 결과, 두기 하우저를 따서 "두기 쥐"라는 별명이 붙은 이 쥐들은 더 큰 LTP를 보였고 공간 학습 과제에서 뛰어났으며, 이는 해마 의존적 기억 형성에 있어 LTP의 중요성을 강화했다.
7. 2. 억제성 회피 (Inhibitory avoidance)
2006년, 조나단 화이트록과 동료들은 장기 강화(LTP)가 행동 기억에서 중요한 역할을 한다는 강력한 증거를 제시하는 일련의 실험 결과를 보고했다. 이들은 LTP가 행동 학습의 기반이 된다는 결론을 내리기 위해서는 두 과정이 서로 모방하고 차단해야 한다고 주장했다.[61] 연구자들은 억제성 회피 학습 패러다임을 사용하여 쥐를 밝은 방과 어두운 방으로 구성된 2개의 구획 장치에서 훈련시켰다. 어두운 방에는 쥐가 들어갈 때 발에 전기 충격을 가하는 장치가 설치되어 있었다. CA1 해마 시냅스 분석 결과, 억제 회피 훈련은 LTP ''in vitro''에서 관찰되는 것과 동일한 유형의 ''in vivo'' AMPA 수용체 인산화를 유도했으며, 즉 억제 회피 훈련은 LTP를 모방했다. 또한, 훈련 중에 강화된 시냅스는 그렇지 않았다면 LTP를 유도했을 실험 조작을 통해 더 이상 강화될 수 없었으며, 즉 억제 회피 훈련은 LTP를 차단했다. 이 논문에 대한 답변에서 티모시 블리스와 동료들은 이 연구와 관련된 실험들이 "기억의 신경 기전으로서 LTP의 사례를 실질적으로 발전시켰다"고 언급했다.[62] [111]억제성 회피 학습 과제는 쥐가 밝은 방과 어두운 방 두 개의 방이 있는 헛간에서, 쥐가 보통 선호하는 어두운 방에 들어가면 발에 약한 전기 자극이 흐르는 것을 학습시키는 실험이다. 그 결과, 해마의 CA1 시냅스에서 억제성 회피 과제에 의해 생체 외 장기 강화에서 일어나는 것과 유사한 AMPA형 글루탐산 수용체의 인산화가 생체 내에서도 일어나고 있다는 것이 밝혀졌다. 또한, 과제 중에 강화된 시냅스는 실험 조작에 의해 추가적인 장기 강화를 일으킬 수 없다는 것도 나타났다. 이 논문에 대해 티모시 블리스 등은 "이 일련의 실험은 장기 강화가 기억의 신경 기반임을 보여주는 새로운 발걸음이다"라고 언급했다.[112]
8. 임상적 중요성
LTP가 질병에서 하는 역할은 시냅스 가소성의 기본적인 메커니즘에서의 역할만큼 명확하지 않다. 그러나 LTP의 변화는 우울증, 파킨슨병, 뇌전증, 신경병성 통증을 포함한 여러 신경 질환의 원인이 될 수 있다.[63] 손상된 LTP는 알츠하이머병 및 약물 중독에도 관여할 수 있다.
8. 1. 알츠하이머병 (Alzheimer's disease)
장기 강화(LTP)는 현저한 인지 기능 저하와 치매를 유발하는 신경 퇴행성 질환인 알츠하이머병 (AD)을 연구하는 사람들 사이에서 많은 관심을 받아왔다. 이러한 악화의 대부분은 해마와 다른 내측 측두엽 구조의 퇴행성 변화와 관련하여 발생한다. 해마가 LTP에서 확립된 역할을 하기 때문에, 일부 학자들은 AD를 앓고 있는 개인에게서 나타나는 인지 기능 저하가 손상된 LTP의 결과일 수 있다고 제안했다.
2003년 문헌 검토에서, 로완 등은 AD에서 LTP가 어떻게 영향을 받을 수 있는지에 대한 한 가지 모델을 제시했다.[64] AD는 적어도 부분적으로는 아밀로이드 전구 단백질 (APP)의 오처리 과정의 결과로 나타나는 것으로 보인다. 이러한 비정상적인 처리 과정의 결과는 아밀로이드 β (Aβ)라고 불리는 이 단백질의 조각들이 축적되는 것이다. Aβ는 가용성 및 섬유 형태 모두로 존재한다. APP의 오처리 과정은 로완의 가설에 따르면 해마 LTP를 손상시키고 AD 초기에 나타나는 인지 기능 저하로 이어질 수 있는 가용성 Aβ의 축적을 초래한다.
AD는 Aβ와는 다른 메커니즘을 통해 LTP를 손상시킬 수도 있다. 예를 들어, 한 연구에서는 효소 PKMζ가 AD의 병리학적 지표인 신경섬유 엉킴에 축적된다는 것을 보여주었다. PKMζ는 후기 LTP의 유지에 매우 중요한 효소이다.[65]
8. 2. 약물 의존증 (Drug addiction)
약물 의존성 연구는 장기 강화에 주목한다. 약물 의존증에서 기억과 학습이 강하게 형성된다는 가설 때문이다.[115] 의존증은 복잡한 신경 행동학적 현상이며, 복측 피개영역(VTA)이나 측좌핵(NAc) 등 많은 뇌 부위가 관여한다. 복측 피개영역과 측좌핵의 시냅스에서 장기 강화가 일어나는 것이 밝혀졌으며,[115] 이러한 장기 강화가 의존증 특유의 행동을 유발한다고 생각된다.[116]참조
[1]
서적
Neuroscience: Exploring the Brain
https://archive.org/[...]
Lippincott Williams & Wilkins
[2]
논문
Plasticity in the human central nervous system
2006-07
[3]
논문
A synaptic model of memory: long-term potentiation in the hippocampus
1993-01
[4]
논문
The control of neuron number
[5]
논문
The Croonian Lecture: La Fine Structure des Centres Nerveux
[6]
서적
The Organization of Behavior: A NEUROPSYCHOLOGICAL THEORY
JOHN WILEY if SONS, Inc.
[7]
서적
Organization of Behavior: a Neuropsychological Theory
https://archive.org/[...]
John Wiley
[8]
논문
Heterosynaptic facilitation in neurones of the abdominal ganglion of Aplysia depilans
1965-11
[9]
논문
The historical significance of the discovery of long-term potentiation: an overview and evaluation for nonexperts.
https://researchport[...]
2018-10
[10]
논문
The discovery of long-term potentiation
2003-04
[11]
논문
Frequency potentiation of excitatory synaptic activity in the dentate area of the hippocampal formation
[12]
논문
Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path
1973-07
[13]
논문
Long-lasting potentiation of synaptic transmission in the dentate area of the unanaestetized rabbit following stimulation of the perforant path
1973-07
[14]
문서
[15]
논문
Long-term potentiation of the perforant path-granule cell synapse in the rat hippocampus
1975-03
[16]
논문
A prelude to long-term potentiation
2003-04
[17]
논문
An alternative to the LTP orthodoxy: a plasticity-pathology continuum model
1996-06
[18]
논문
A synaptic basis for memory storage in the cerebral cortex.
1996
[19]
논문
Mechanisms underlying LTP of inhibitory synaptic transmission in the deep cerebellar nuclei.
2000
[20]
논문
Synaptic plasticity in fear conditioning circuits: induction of LTP in the lateral nucleus of the amygdala by stimulation of the medial geniculate body
1990-08
[21]
논문
LTP and LTD: an embarrassment of riches
2004-09
[22]
논문
A developmental switch in the signaling cascades for LTP induction
2003-01
[23]
논문
Excitatory amino acids in synaptic transmission in the Schaffer collateral-commissural pathway of the rat hippocampus
1983-01
[24]
논문
Long-term potentiation of guinea pig mossy fiber responses is not blocked by N-methyl D-aspartate antagonists
1986-09
[25]
논문
Postsynaptic control of hippocampal long-term potentiation
[26]
논문
Induction of hebbian and non-hebbian mossy fiber long-term potentiation by distinct patterns of high-frequency stimulation
1996-07
[27]
논문
Roles of distinct glutamate receptors in induction of anti-Hebbian long-term potentiation
2008-03
[28]
논문
Synaptic tagging and long-term potentiation
1997-02
[29]
논문
Underlying Mechanisms of Cooperativity, Input Specificity, and Associativity of Long-Term Potentiation Through a Positive Feedback of Local Protein Synthesis
2018-05-01
[30]
논문
Long-term potentiation, cooperativity and Hebb's cell assemblies: a personal history
2003-04
[31]
논문
A spike-timing-dependent plasticity rule for dendritic spines
2020-08
[32]
논문
How long will long-term potentiation last?
2003-04
[33]
논문
Long-term potentiation and memory
https://zenodo.org/r[...]
2004-01
[34]
논문
AMPA receptor trafficking and long-term potentiation
2003-04
[35]
논문
Optical quantal analysis reveals a presynaptic component of LTP at hippocampal Schaffer-associational synapses
2003-06
[36]
논문
Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro
1996-02
[37]
논문
Anisomycin, an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro
1988-06
[38]
논문
TORC1 is a calcium- and cAMP-sensitive coincidence detector involved in hippocampal long-term synaptic plasticity
2007-03
[39]
논문
Persistent phosphorylation by protein kinase Mzeta maintains late-phase long-term potentiation
2005-02
[40]
논문
Storage of spatial information by the maintenance mechanism of LTP
2006-08
[41]
논문
PKM-ζ is not required for hippocampal synaptic plasticity, learning and memory
2013-01
[42]
논문
Balance and stability of synaptic structures during synaptic plasticity
2014-04
[43]
논문
Translational regulatory mechanisms in persistent forms of synaptic plasticity
2004-09
[44]
논문
A requirement for local protein synthesis in neurotrophin-induced hippocampal synaptic plasticity
1996-09
[45]
논문
A cellular mechanism for targeting newly synthesized mRNAs to synaptic sites on dendrites
2001-06
[46]
논문
Presynaptic protein kinase activity supports long-term potentiation at synapses between individual hippocampal neurons
2000-06
[47]
논문
Presynaptic BDNF required for a presynaptic but not postsynaptic component of LTP at hippocampal CA1-CA3 synapses
2003-09
[48]
논문
Synaptic tagging and long-term potentiation
1997-02
[49]
논문
Synapse-specific, long-term facilitation of aplysia sensory to motor synapses: a function for local protein synthesis in memory storage
1997-12
[50]
논문
A transient, neuron-wide form of CREB-mediated long-term facilitation can be stabilized at specific synapses by local protein synthesis
1999-10
[51]
논문
Toward a molecular explanation for long-term potentiation
[52]
논문
CREB activation mediates plasticity in cultured hippocampal neurons
[53]
논문
Involvement of beta-adrenergic receptors in protein synthesis-dependent late long-term potentiation (LTP) in the dentate gyrus of freely moving rats: the critical role of the LTP induction strength
[54]
논문
Nitric oxide signaling contributes to late-phase LTP and CREB phosphorylation in the hippocampus
1999-12
[55]
논문
The effect of dopaminergic D1 receptor blockade during tetanization on the expression of long-term potentiation in the rat CA1 region in vitro
1991-08
[56]
논문
D1/D5 dopamine receptor activation increases the magnitude of early long-term potentiation at CA1 hippocampal synapses
1996-12
[57]
논문
Selective impairment of learning and blockade of long-term potentiation by an N-methyl-D-aspartate receptor antagonist, AP5
[58]
논문
Impaired hippocampal representation of space in CA1-specific NMDAR1 knockout mice
1996-12
[59]
논문
Genetic enhancement of learning and memory in mice
http://www.nature.co[...]
[60]
논문
Differential effects of enrichment on learning and memory function in NR2B transgenic mice
[61]
논문
Learning induces long-term potentiation in the hippocampus
2006-08
[62]
논문
Neuroscience. ZAP and ZIP, a story to forget
2006-08
[63]
논문
Plasticity in the human central nervous system
2006-07
[64]
논문
Synaptic plasticity in animal models of early Alzheimer's disease
2003-04
[65]
논문
Atypical protein kinase C in neurodegenerative disease I: PKMzeta aggregates with limbic neurofibrillary tangles and AMPA receptors in Alzheimer disease
2006-04
[66]
논문
Synaptic plasticity and addiction
2007-11
[67]
논문
LTP may trigger addiction
2003-08
[68]
논문
Plasticity in the human central nervous system
[69]
서적
Medical Physiology: A Cellular And Molecular Approaoch
Elsevier/Saunders
[70]
논문
The control of neuron number
http://www.nervenet.[...]
[71]
논문
The Croonian Lecture: La Fine Structure des Centres Nerveux
[72]
논문
The discovery of long-term potentiation
http://www.pubmedcen[...]
[73]
논문
Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path
http://www.pubmedcen[...]
[74]
논문
Long-lasting potentiation of synaptic transmission in the dentate area of the unanaestetized rabbit following stimulation of the perforant path
http://www.pubmedcen[...]
[75]
문서
[76]
논문
Long-term potentiation of the perforant path-granule cell synapse in the rat hippocampus
[77]
논문
A prelude to long-term potentiation
http://www.pubmedcen[...]
[78]
논문
Synaptic plasticity in fear conditioning circuits: induction of LTP in the lateral nucleus of the amygdala by stimulation of the medial geniculate body.
http://www.jneurosci[...]
1990-08-01
[79]
논문
LTP and LTD: an embarrassment of riches
[80]
논문
A developmental switch in the signaling cascades for LTP induction
[81]
논문
Long-term potentiation of guinea pig mossy fiber responses is not blocked by N-methyl D-aspartate antagonists
[82]
논문
Long-term potentiation, cooperativity and Hebb's cell assemblies: a personal history
http://journals.roya[...]
[83]
논문
Long-term potentiation and memory
http://physrev.physi[...]
[84]
논문
Recruitment of long-lasting and protein kinase A-dependent long-term potentiation in the CA1 region of hippocampus requires repeated tetanization
[85]
서적
Basic neurochemistry: molecular, cellular, and medical aspects
http://www.ncbi.nlm.[...]
Lippincott-Raven
[86]
논문
AMPA receptor trafficking and long-term potentiation
[87]
논문
Optical quantal analysis reveals a presynaptic component of LTP at hippocampal Schaffer-associational synapses
http://www.sciencedi[...]
[88]
논문
Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro
http://www.pubmedcen[...]
1996-01-01
[89]
논문
Anisomycin, an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro
[90]
논문
TORC1 is a calcium- and cAMP-sensitive coincidence detector involved in hippocampal long-term synaptic plasticity.
[91]
논문
Persistent phosphorylation by protein kinase Mzeta maintains late-phase long-term potentiation
[92]
논문
Storage of spatial information by the maintenance mechanism of LTP
[93]
논문
Translational regulatory mechanisms in persistent forms of synaptic plasticity
[94]
논문
A requirement for local protein synthesis in neurotrophin-induced hippocampal synaptic plasticity
[95]
논문
A cellular mechanism for targeting newly synthesized mRNAs to synaptic sites on dendrites
http://www.pnas.org/[...]
[96]
논문
Presynaptic protein kinase activity supports long-term potentiation at synapses between individual hippocampal neurons
[97]
논문
Presynaptic BDNF required for a presynaptic but not postsynaptic component of LTP at hippocampal CA1-CA3 synapses
[98]
논문
Synaptic tagging and long-term potentiation
[99]
논문
Synapse-specific, long-term facilitation of aplysia sensory to motor synapses: a function for local protein synthesis in memory storage
[100]
논문
A transient, neuron-wide form of CREB-mediated long-term facilitation can be stabilized at specific synapses by local protein synthesis
[101]
논문
Toward a molecular explanation for long-term potentiation
http://www.learnmem.[...]
[102]
논문
CREB activation mediates plasticity in cultured hippocampal neurons
[103]
논문
Involvement of beta-adrenergic receptors in protein synthesis-dependent late long-term potentiation (LTP) in the dentate gyrus of freely moving rats: the critical role of the LTP induction strength
[104]
논문
Nitric oxide signaling contributes to late-phase LTP and CREB phosphorylation in the hippocampus
[105]
논문
The effect of dopaminergic D1 receptor blockade during tetanization on the expression of long-term potentiation in the rat CA1 region in vitro
[106]
논문
D1/D5 dopamine receptor activation increases the magnitude of early long-term potentiation at CA1 hippocampal synapses
[107]
논문
Selective impairment of learning and blockade of long-term potentiation by an N-methyl-D-aspartate receptor antagonist, AP5
[108]
논문
Impaired hippocampal representation of space in CA1-specific NMDAR1 knockout mice
[109]
논문
Genetic enhancement of learning and memory in mice
http://www.nature.co[...]
[110]
논문
Differential effects of enrichment on learning and memory function in NR2B transgenic mice
[111]
논문
Learning induces long-term potentiation in the hippocampus
[112]
논문
Neuroscience. ZAP and ZIP, a story to forget
[113]
논문
Synaptic plasticity in animal models of early Alzheimer's disease
http://journals.roya[...]
[114]
논문
Atypical protein kinase C in neurodegenerative disease I: PKMzeta aggregates with limbic neurofibrillary tangles and AMPA receptors in Alzheimer disease
http://meta.wkhealth[...]
[115]
논문
Synaptic plasticity and addiction
[116]
논문
LTP may trigger addiction
http://molinterv.asp[...]
[117]
논문
Plasticity in the human central nervous system
[118]
서적
Medical Physiology: A Cellular And Molecular Approaoch
https://archive.org/[...]
Elsevier/Saunders
[119]
논문
The control of neuron number
http://www.nervenet.[...]
[120]
논문
The Croonian Lecture: La Fine Structure des Centres Nerveux
[121]
논문
The discovery of long-term potentiation
http://www.pubmedcen[...]
[122]
논문
Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path
http://www.pubmedcen[...]
[123]
논문
Long-lasting potentiation of synaptic transmission in the dentate area of the unanaestetized rabbit following stimulation of the perforant path
http://www.pubmedcen[...]
[124]
논문
Long-term potentiation of the perforant path-granule cell synapse in the rat hippocampus
[125]
논문
Synaptic plasticity in fear conditioning circuits: induction of LTP in the lateral nucleus of the amygdala by stimulation of the medial geniculate body.
http://www.jneurosci[...]
[126]
논문
LTP and LTD: an embarrassment of riches
[127]
논문
A developmental switch in the signaling cascades for LTP induction
[128]
논문
Long-term potentiation of guinea pig mossy fiber responses is not blocked by N-methyl D-aspartate antagonists
[129]
논문
Toward a molecular explanation for long-term potentiation
http://www.learnmem.[...]
[130]
논문
Optical quantal analysis reveals a presynaptic component of LTP at hippocampal Schaffer-associational synapses
http://www.sciencedi[...]
2011-12-17
[131]
논문
Presynaptic protein kinase activity supports long-term potentiation at synapses between individual hippocampal neurons
[132]
논문
Presynaptic BDNF required for a presynaptic but not postsynaptic component of LTP at hippocampal CA1-CA3 synapses
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com