효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
효소는 생명체 내에서 일어나는 화학 반응의 속도를 촉진하는 단백질 또는 RNA 분자이다. 18세기와 19세기에 위 분비물과 식물 추출물, 침에 의한 소화 및 녹말의 당 전환 현상이 알려지면서 효소 연구가 시작되었다. 1833년 앙셀름 파얜에 의해 다이아스테이스가 최초로 발견되었고, 1877년 빌헬름 퀴네가 그리스어에서 유래한 '효소'라는 용어를 만들었다. 1897년 에두아르트 부흐너는 효모 추출물로 설탕 발효를 발견하여 노벨 화학상을 수상했다. 효소는 기질이나 촉매하는 화학 반응을 기준으로 명명되며, 국제 생화학·분자생물학 연합(IUBMB)은 효소에 대한 EC 번호를 부여하여 분류한다. 효소는 일반적으로 구상 단백질로, 활성 부위에서 기질과 결합하여 화학 반응을 촉매하며, 자물쇠와 열쇠 모델과 유도 적합 모델을 통해 기질 결합 방식을 설명한다. 효소는 활성화 에너지를 낮추어 반응 속도를 증가시키며, 보조 인자를 필요로 하기도 한다. 효소 반응 속도론은 효소와 기질 간의 관계를 연구하며, 미하엘리스-멘텐 속도론을 통해 효소 반응 속도를 설명한다. 효소는 경쟁적, 비경쟁적, 불경쟁적 저해와 같은 다양한 저해제에 의해 조절될 수 있으며, 생물학적 기능으로 신호 전달, 근수축, 소화, 물질대사 등에 관여한다. 효소 활성은 유전자 발현, 번역 후 변형, 효소 양, 세포 내 분포, 기관의 전문화 등을 통해 조절된다. 효소의 이상은 유전 질환을 유발할 수 있으며, 산업적으로는 식품 가공, 세제, 의약품 등 다양한 분야에서 활용된다.
더 읽어볼만한 페이지
- 공정 화학 물질 - 항산화 물질
항산화 물질은 산소와의 반응을 억제하는 화학 물질로, 생체 내 활성 산소종과 반응하거나 항산화 효소를 통해 분해하여 산화 반응을 중지시키며, 식품, 의약품 개발, 노화 방지 등 다양한 분야에서 연구된다. - 공정 화학 물질 - 효소 다중기능성
효소 다중기능성은 하나의 효소가 여러 기능을 수행하는 현상으로, 효소 진화, 유전자 중복, 강건성, 가소성, 재구성 효소, 원시대사, 상동성, 생물 촉매 작용, 반응 유사성, 약물 결합 등과 관련되어 다양한 환경 적응 및 새로운 기능 획득에 기여하는 중요한 특성이다. - 촉매 반응 - 활성화 에너지
활성화 에너지는 화학 반응이 일어나기 위해 반응물이 넘어야 하는 최소 에너지 장벽으로, 반응 속도에 직접적인 영향을 미치며 촉매에 의해 조절될 수 있고, 아레니우스 식으로 표현되며, 다양한 화학 현상 이해에 필수적인 개념이다. - 촉매 반응 - 광촉매
광촉매는 빛을 받아 촉매 작용을 하는 물질로, 이산화티타늄이 주로 사용되며 유기물 분해, 수질 및 대기 정화 등에 응용되지만 가시광선 효율 향상 및 과장 광고 문제가 있다. - 효소 - 활성 부위
활성 부위는 효소 분자 내에서 기질과 결합하여 촉매 작용을 하는 특정 부위이며, 다양한 모델로 설명되고, 결합 부위, 촉매 부위, 보조인자를 포함하며, 저해제와 알로스테릭 부위와 관련되어 신약 개발에 활용된다. - 효소 - 제한 효소
제한 효소는 DNA의 특정 염기서열을 인식하여 절단하는 효소로, 유전체학과 생명공학 발전에 기여하여 노벨상을 수상했으며, 인식 서열 특이성 등에 따라 다양한 유형으로 분류되어 여러 연구 및 응용 분야에 활용된다.
| 효소 | |
|---|---|
 | |
| 작용 | |
| 역할 | 효소는 생체 내에서 화학 반응의 속도를 증가시키는 촉매 역할을 한다. |
| 촉매 메커니즘 | 효소는 특정 기질과 결합하여 활성화 에너지를 낮춤으로써 반응을 촉진한다. |
| 특이성 | 효소는 특정 기질에 대해서만 작용하는 높은 특이성을 가진다. |
| 구조 | |
| 주성분 | 대부분의 효소는 단백질로 구성되어 있으며, 일부는 RNA(리보자임)이다. |
| 보조 인자 | 일부 효소는 활성화를 위해 비단백질성 보조 인자(코팩터)를 필요로 한다. |
| 활성 부위 | 효소 분자 내에서 기질과 결합하고 촉매 작용이 일어나는 특정 부위이다. |
| 분류 | |
| 국제 분류법 | 효소는 국제 효소 위원회(EC)에서 정한 체계에 따라 분류된다. |
| 주요 종류 | 산화환원효소, 전이효소, 가수분해효소, 분해효소, 이성질화효소, 연결효소 등이 있다. |
| 활용 | |
| 생명 현상 | 효소는 소화, 대사, 신호 전달 등 생명 유지에 필수적인 다양한 반응에 관여한다. |
| 산업 | 식품, 세제, 의약품 등 다양한 산업 분야에서 광범위하게 활용된다. |
| 역사 | |
| 발견 | 19세기 후반부터 효소의 존재가 알려지기 시작했다. |
| 연구 발전 | 20세기 이후 효소의 구조와 기능에 대한 연구가 활발히 진행되었다. |
| 관련 용어 | |
| 기질 | 효소에 의해 촉매되는 반응의 대상 물질 |
| 활성 부위 | 효소 분자에서 기질과 결합하고 반응을 촉매하는 특정 부위 |
| 보조 인자 | 효소의 활성에 필요한 비단백질성 물질 (코엔자임, 금속 이온 등) |
| 저해제 | 효소의 활성을 억제하는 물질 |
| 추가 정보 | |
| 참고 자료 | 영어 위키백과 일본어 위키백과 |
2. 어원과 역사
18세기 말과 19세기 초, 위 분비물에 의한 고기의 소화[177] 및 식물 추출물과 침에 의해 녹말이 당으로 전환된다는 것은 알려져 있었지만, 정확한 메커니즘은 밝혀지지 않았다.[178] 1833년, 프랑스의 화학자 앙셀름 파얜은 다이아스테이스라는 효소를 최초로 발견하였다.[179]
효소의 이름은 일반적으로 기질이나 촉매하는 화학 반응에서 유래된 단어 끝에 접미사 "-에이스(-ase)"를 붙여 짓는다. 락테이스, 알코올 탈수소효소, DNA 중합효소 등이 그 예이다. 동일한 화학 반응을 촉매하는 서로 다른 효소들을 동질효소라고 한다.[170]
효소는 일반적으로 단독으로 또는 더 큰 복합체로 작용하는 구상 단백질이다. 아미노산의 서열은 효소의 촉매 활성을 결정하는 구조를 지정한다.[192] 구조가 기능을 결정하지만, 새로운 효소 활성은 아직 구조만으로는 예측할 수 없다.[193] 효소 구조는 가열하거나 화학적 변성 물질에 노출될 때 접힘이 풀리며(변성), 이러한 구조의 파괴는 전형적으로 효소 활성의 소실을 야기한다.[194] 효소의 변성은 일반적으로 효소의 최적 온도보다 높은 온도와 관련이 있다. 그 결과, 온천과 같은 화산 환경에 사는 세균으로부터 얻은 효소는 고온에서 기능을 할 수 있는 능력 때문에 매우 중요하며, 효소 촉매 반응을 매우 빠른 속도로 일어날 수 있게 한다.
효소는 일반적으로 단독으로 또는 더 큰 복합체로 작용하는 구상 단백질이다. 아미노산 서열은 효소의 촉매 활성을 결정하는 구조를 지정한다.[192] 구조가 기능을 결정하지만, 새로운 효소 활성은 아직 구조만으로는 예측할 수 없다.[193] 효소 구조는 가열하거나 화학적 변성 물질에 노출될 때 접힘이 풀리며(변성), 이러한 구조 파괴는 전형적으로 효소 활성 소실을 야기한다.[194] 효소 변성은 일반적으로 효소의 최적 온도보다 높은 온도와 관련이 있다. 그 결과, 온천과 같은 화산 환경에 사는 세균으로부터 얻은 효소는 고온에서 기능할 수 있는 능력 때문에 매우 중요하며, 효소 촉매 반응을 매우 빠른 속도로 일어날 수 있게 한다.
19세기 후반, 루이 파스퇴르는 효모에 의한 알코올 발효가 효모 세포 내 생명력에 의해 촉매된다고 주장하며, 이러한 일이 살아있는 생명체 내에서만 가능하다고 생각했다.[180] 그는 "알코올 발효는 세포의 죽음이나 부패가 아닌 효모 세포의 생명 및 구성과 상호연관된 작용이다"라고 기록했다.
1877년, 독일의 생리학자 빌헬름 퀴네는 이러한 과정을 설명하기 위해 그리스어 "ἔνζυμον" (독일어로 "leavened", 영어로 "in yeast")에서 유래한 "효소(enzyme)"라는 용어를 만들었다.[181] 효소(酵素)라는 단어는 "효모(酵母, yeast)에 들어있는 어떤 요소(要素)"라는 뜻이다. 이 단어는 나중에 펩신과 같은 살아있지 않은 것들을 지칭하는데 사용되었으며, 발효소(ferment)는 생명체에 의해 생성된 화학적 활성을 지칭하는데 사용되었다.[182]
1897년, 에두아르트 부흐너는 효모 추출물 연구에 대한 첫 번째 논문을 제출했다. 베를린 훔볼트 대학교에서 행해진 일련의 실험에서 부흐너는 혼합물에 살아있는 효모 세포가 없을 때에도 "효모 추출물에 의해" 당이 발효된다는 것을 발견했다.[183] 그는 설탕(수크로스)을 발효시키는 효소를 "치메이스(zymase)"라고 이름지었다.[184] 부흐너는 "그의 생화학적 연구와 무세포 발효의 발견"에 대한 공로로 1907년에 노벨 화학상을 수상했다. 부흐너의 예를 따라 효소는 일반적으로 그 효소가 수행하는 반응에 따라 명명된다. 보통 접미사 "-ase"는 기질의 이름 뒤에 붙이거나(예: 락테이스는 락토스(젖당) 분해효소이다), 반응의 유형(예: DNA 중합효소는 DNA 중합체를 형성한다)에 따른다.[185]
효소의 생화학적 정체는 1900년대 초까지 여전히 알려지지 않았다. 많은 과학자들은 효소의 활성이 단백질과 관련되어 있다고 지적했지만, 리하르트 빌슈테터 같은 몇몇 과학자들은 단백질이 효소의 운반체일 뿐이며, 단백질 자체는 촉매 작용을 할 수 없다고 주장했다.[186] 그러나 1926년에 제임스 B. 섬너는 유레이스(요소가수분해효소)가 순수 단백질이며 결정화할 수 있음을 밝혀냈고, 1937년에 카탈레이스도 마찬가지임을 보여주었다. 순수 단백질이 효소일 수 있다는 결론은 소화 효소인 펩신, 트립신, 키모트립신을 연구한 존 하워드 노스럽, 웬들 메러디스 스탠리에 의해 결정적으로 증명되었다. 제임스 B. 섬너, 존 하워드 노스럽, 웬들 메러디스 스탠리는 1946년에 노벨 화학상을 공동 수상했다.[187]
효소가 결정화될 수 있다는 발견으로 과학자들은 X선 결정학으로 효소의 구조를 밝혀낼 수 있게 되었다. 이러한 시도는 눈물, 침, 달걀 흰자에서 발견되며 일부 세균의 외막을 분해하는 효소인 라이소자임에 대해 처음으로 수행되었으며, 데이비드 칠턴 필립스가 이끈 연구진에 의해 밝혀졌고, 1965년에 발표되었다.[188] 이렇게 밝혀진 라이소자임의 고해상도 구조는 구조생물학의 시작과 효소가 원자 수준에서 어떻게 작동하는지 이해하려는 노력의 성과를 보여준다.[189]
1986년, 미국의 토머스 체크 등은 단백질 이외에서 처음으로 효소 작용을 나타내는 물질(리보자임)을 발견하였다.
3. 명명 규칙
국제 생화학·분자생물학 연합(IUBMB)은 효소에 대한 명명법인 EC 번호를 고안했다. 각각의 효소는 "효소 위원회(Enzyme Commission)"를 의미하는 "EC"가 앞에 붙는 일련의 4개의 숫자로 기술된다. 4개의 숫자 중 첫 번째 숫자는 효소의 반응 메커니즘에 따라 크게 분류되는 부류를 의미한다.[190]
최상위 분류 체계는 다음과 같다.EC 번호 효소 종류 설명 EC 1 산화 환원 효소 산화·환원 반응을 촉매한다. EC 2 전이 효소 한 기질의 작용기(예: 메틸기, 인산기)를 다른 기질로 옮기는 반응을 촉매한다. EC 3 가수 분해 효소 물을 첨가하여 기질을 분해하는 반응을 촉매한다. EC 4 분해 효소 가수분해와 산화 이외의 방법으로 다양한 결합을 분해하는 반응을 촉매한다. EC 5 이성질화 효소 단일 분자 내에서 원자 배열을 바꾸어 이성질체로 만드는 반응을 촉매한다. EC 6 연결 효소 에너지를 소비해서 두 개의 기질을 서로 연결시키는 반응을 촉매한다.
이러한 분류들은 기질, 생성물 및 반응 메커니즘과 같은 다른 특징들에 의해 보다 세분화된다. 효소는 4개의 숫자로 지정된다. 예를 들어, 헥소키네이스(EC 2.7.1.1)에서 첫 번째 숫자 2는 최상위 분류인 전이효소를, 두 번째 숫자 7은 인산기 전이효소를, 세 번째 숫자 1은 하이드록시기를 수용체로 가지는 인산기 전이효소를, 네 번째 숫자 1은 인산기의 수용체인 D-글루코스를 나타낸다.[191]
4. 구조
효소는 보통 기질보다 훨씬 더 크다. 효소의 크기는 단지 62개의 아미노산 잔기를 가지고 있는 단량체인 4-옥살로크로톤산 호변이성질화효소[195]로부터 2,500개가 넘는 아미노산 잔기를 가지고 있는 동물의 지방산 생성효소까지 다양하다.[196] 효소 구조의 작은 부분(약 2~4개의 아미노산)만이 촉매 작용에 직접적으로 관여하는데, 이 부위를 촉매 부위라고 한다.[197] 이러한 촉매 부위는 잔기들이 기질을 배향시키는 하나 이상의 결합 부위 옆에 위치한다. 촉매 부위와 결합 부위는 함께 효소의 활성 부위를 구성한다. 효소 구조의 나머지 대부분은 활성 부위의 정확한 방향 및 역학 관계를 유지하는 역할을 한다.[198]
일부 효소에서는 촉매 작용에 아미노산이 직접적으로 관여하지 않는 대신에 보조 인자와 결합하고 그 방향을 정하는 역할을 한다. 효소 구조는 또한 작은 분자의 결합이 효소의 활성을 증가 또는 감소시키는 입체구조적 변화를 일으키는 다른 자리 입체성 조절 부위를 포함할 수 있다.[199]
리보자임이라고 불리는 소수의 RNA 기반 생물학적 촉매가 존재하며, 리보자임은 단독으로 또는 단백질과 복합체를 형성하여 작용할 수 있다. 리보자임들 중 가장 일반적인 것은 촉매 기능을 가진 RNA와 단백질의 복합체인 리보솜이다.[170]
5. 반응 메커니즘
효소는 보통 기질보다 훨씬 더 크다. 효소 크기는 단지 62개의 아미노산 잔기를 가지고 있는 단량체인 4-옥살로크로톤산 호변이성질화효소[195]로부터 2,500개가 넘는 아미노산 잔기를 가지고 있는 동물의 지방산 생성효소까지 다양하다.[196] 효소 구조의 작은 부분(약 2~4개의 아미노산)만이 촉매 작용에 직접적으로 관여하는데, 이 부위를 촉매 부위라고 한다.[197] 이러한 촉매 부위는 잔기들이 기질을 배향시키는 하나 이상의 결합 부위 옆에 위치한다. 촉매 부위와 결합 부위는 함께 효소의 활성 부위를 구성한다. 효소 구조의 나머지 대부분은 활성 부위의 정확한 방향 및 역학 관계를 유지하는 역할을 한다.[198]
일부 효소에서는 촉매 작용에 아미노산이 직접적으로 관여하지 않는 대신에 보조 인자와 결합하고 그 방향을 정하는 역할을 한다. 효소 구조는 또한 작은 분자의 결합이 효소 활성을 증가 또는 감소시키는 입체구조적 변화를 일으키는 다른 자리 입체성 조절 부위를 포함할 수 있다.[199]
리보자임이라고 불리는 소수의 RNA 기반 생물학적 촉매가 존재하며, 리보자임은 단독으로 또는 단백질과 복합체를 형성하여 작용할 수 있다. 리보자임들 중 가장 일반적인 것은 촉매 기능을 가진 RNA와 단백질의 복합체인 리보솜이다.[170]
생체 내에서 효소의 역할은 생명체를 구성하는 유기 화합물과 무기 화합물을 흡수하여 필요한 화학 반응을 일으키는 것이다. 생명 현상은 많은 대사 경로를 포함하며, 각 대사 경로는 다단계 화학 반응으로 이루어져 있다.
세포 내에서는 다양한 화학 반응을 담당하는 다종다양한 효소가 작용하고 있다. 각 효소는 자신의 형태에 맞는 특정 원료 화합물(기질)을 외부에서 흡수하여 담당하는 화학 반응을 촉매하고, 생성물을 외부로 방출한다. 그리고 다시 다음 반응을 위해 기질을 흡수하여 목적 물질을 생성한다. 여기서 방출된 생성물은 다른 화학 반응을 담당하는 효소의 작용을 받아, 더욱 다른 생체 물질로 대사된다. 이러한 효소의 촉매 반응 반복으로 필요한 물질 생성과 불필요한 물질 분해가 진행되어 생명 활동이 유지된다.
효소는 생체 내 화학 반응을 질서 있게 진행하기 위해 고도의 기질 선택성과 반응 선택성을 가진다. 더불어 알로스테리즘 등에 의해 화학 반응 진행이 주변으로부터 제어되는 기전을 갖춘 효소도 있다. 이러한 선택성과 제어성을 가짐으로써, 효소는 혼란스러운 세포 내에서 필요할 때 필요한 원료를 선택하고, 목적 생성물만을 생성한다.
효소는 기질 특이성을 발휘하여, 표적 반응만의 활성화 에너지를 낮춘다. 구조 생물학 발전과 재조합 단백질 등의 변이 도입과 같은 여러 기법에 의해, 그 일면이 밝혀지고 있다.
예를 들어, 단백질 분해 효소 세린 프로테아제에서는, 효소와 복합체를 형성함으로써 기질은 전이 상태에 가까운 분자 구조로 속박되어 (반응계의 엔트로피 감소), 그 결과로 활성화 에너지 저하(반응 촉진)가 일어난다 ('''엔트로피 트랩'''). 효소와 결합한 기질은, 효소 활성 중심 부근에서 분자 구조가 규제되어 (유도 적합), 더욱 반응하기 쉬운 상태가 되어, 생성물로의 반응이 진행된다.
5. 1. 기질의 결합
효소는 화학 반응을 촉매하기 전에 기질과 결합해야 한다. 효소는 보통 어떤 기질과 결합하고, 기질의 화학 반응을 촉매하는데 있어서 특이성이 있다. 특이성이란 기질 및 기질과 경쟁하는 분자들을 식별할 수 있는 효소의 능력을 말한다. 특이성은 상보적인 구조, 전하 및 친수성/소수성을 갖는 포켓에 기질이 결합함으로써 충족된다. 따라서 효소는 화학선택성, 위치선택성, 입체특이성이 매우 비슷한 기질 분자들을 구별할 수 있다.[200]
가장 높은 특이성과 정확성을 보여주는 일부 효소들은 게놈의 복제 및 발현에 관여한다. 이들 효소들 중 일부는 "교정" 기작을 가지고 있다. 여기서 DNA 중합효소와 같은 효소는 첫 번째 단계에서 반응을 촉매한 다음, 두 번째 단계에서 생성물이 올바른지를 확인한다.[201] 이러한 두 단계 반응은 높은 정확도를 가지고 있는 포유류의 DNA 중합효소에서 평균적으로 1억 회의 반응당 오류 횟수가 1회 미만의 오류률을 나타내도록 한다.[170] 이와 유사한 교정 기작은 RNA 중합효소,[202] 아미노아실 tRNA 합성효소,[203] 리보솜[204]에서도 발견된다.
반대로, 일부 효소들은 광범위한 기질 특이성을 가지며, 다양한 생리학적 관련 기질들에 작용하는 효소 다중기능성(enzyme promiscuity)을 나타낸다. 많은 효소들은 우연하게 일어나는 작은 부차적인 활성(예: 분자진화의 중립설)을 가지고 있는데, 이것은 새로운 기능의 진화적 선택에 대한 출발점이 될 수 있다.[205][206]
5. 1. 1. 자물쇠와 열쇠 모델
에밀 피셔는 1894년에 효소와 기질이 서로 정확하게 들어맞는 상호보완적인 형태를 가지고 있다고 제안했다.[207] 이를 "자물쇠와 열쇠 모델"이라고 한다. 이 모델은 효소의 특이성은 설명하지만, 효소가 반응을 촉매하면서 달성되는 전이 상태의 안정성은 설명하지 못한다.[208]
5. 1. 2. 유도 적합 모델
1958년, 다니엘 코쉬랜드는 자물쇠와 열쇠 모델을 수정하여 유도 적합 모델을 제안했다. 효소는 상당히 유연한 구조이기 때문에, 기질이 효소와 상호작용함에 따라 활성 부위는 기질과의 상호작용에 의해 지속적으로 모양이 변형된다는 것이다.[41] 그 결과, 기질은 단순히 단단한 활성 부위에 결합하는 것이 아니라, 활성 부위를 구성하는 아미노산 곁사슬이 효소가 촉매 기능을 수행할 수 있도록 정확한 위치로 형성된다. 글리코시다아제와 같은 경우에는 기질 분자도 활성 부위로 들어갈 때 모양이 약간 변한다.[42] 기질이 완전히 결합될 때까지 활성 부위는 계속 변하며, 그 시점에서 최종 형태와 전하 분포가 결정된다.[43] 유도 적합은 구조적 교정 메커니즘을 통해 경쟁과 잡음이 있는 상황에서 분자 인식의 정확성을 높일 수 있다.[44]
5. 2. 촉매작용
효소는 여러 가지 방법으로 활성화 에너지를 낮춤으로써 반응 속도를 높일 수 있다.[213] 효소는 이러한 여러 가지 메커니즘을 동시에 사용할 수 있다.
# 전이 상태를 안정화시킴:[214]
#* 활성화 에너지를 낮추기 위해 전이 상태에서 상호보완적인 전하 분포로 환경을 조성한다.
# 대체 반응 경로를 제공함:[215]
#* 일시적으로 기질과 반응하여 공유 결합된 중간생성물을 형성하여 전이 상태에서의 활성화 에너지를 낮춘다.
# 기질의 바닥 상태를 불안정하게 만듦:[216]
#* 결합된 기질을 전이 상태의 형태로 변형시켜 전이 상태에 도달하는데 필요로 하는 에너지를 감소시킨다.
#* 기질을 반응이 일어날 수 있는 적절한 위치에 배치시켜 반응 엔트로피 변화를 감소시킨다.[217] 이 메커니즘이 촉매작용에 미치는 영향은 상대적으로 작다.[218]
효소는 이러한 여러 가지 메커니즘을 동시에 사용할 수 있다. 예를 들어, 트립신과 같은 프로테이스는 촉매 삼잔기를 사용하여 공유결합성 촉매작용을 수행하고, 산소 음이온 구멍을 사용하여 전이 상태에서 전하의 축적을 안정화시키며, 기질인 물을 사용하여 가수분해를 수행한다.[219]
5. 3. 동역학
효소는 경직되고 정적인 구조가 아니라, 내부에 복잡한 역동적인 움직임을 가지고 있다. 즉, 개별 아미노산 잔기, 단백질 루프 또는 이차 구조 단위를 형성하는 잔기 그룹, 또는 심지어 전체 단백질 도메인과 같은 효소 구조 일부분의 움직임을 말한다. 이러한 움직임은 평형 상태에서 서로 상호 전환되는 약간 다른 구조의 구조적 집합체를 생성한다. 이 집합체 내의 여러 상태는 효소 기능의 다양한 측면과 관련될 수 있다. 예를 들어, 효소 다이하이드로폴산 환원효소의 다양한 구조는 기질 결합, 촉매 작용, 보조 인자 방출 및 촉매 순환의 생성물 방출 단계와 관련이 있으며, 촉매 공명 이론과 일치한다.[52]
5. 4. 다른 자리 입체성 조절
다른 자리 입체성 조절 부위는 효소의 활성 부위와 구별되는 주머니로, 세포 환경의 분자들과 결합한다. 이러한 분자들은 효소의 입체 구조 변화를 일으켜 활성 부위로 전달되는 변형이나 동역학에 영향을 미치고, 결국 효소의 반응 속도를 조절한다.[221] 다른 자리 입체성 조절 상호작용은 효소를 저해하거나 활성화할 수 있다. 대사 경로에서 대사 산물의 이전 단계 또는 이후 단계와의 다른 자리 입체성 조절 상호작용은 피드백 조절을 유발하며, 나머지 대사 경로를 통한 흐름에 따라 효소의 활성을 변화시킨다.[222]
6. 보조 인자
대다수의 효소는 활성을 위해 보조 인자라고 불리는 비단백질성 분자를 필요로 한다.[223] 보조 인자는 무기 화합물(예: 금속 이온, 철-황 클러스터) 또는 유기 화합물(예: 플라빈, 헴)일 수 있다. 금속 이온과 같이 보조 인자는 활성 부위 내에서 친핵체를 안정화시키는 등의 여러 가지 역할을 수행한다.[224] 유기 보조 인자는 반응 후 효소의 활성 부위에서 분리되는 조효소이거나, 효소와 강하게 결합하는 보결분자단일 수 있다. 유기 보결분자단은 피루브산 카복실화효소에서의 비오틴과 같이 공유 결합을 통해 연결될 수 있다.[225]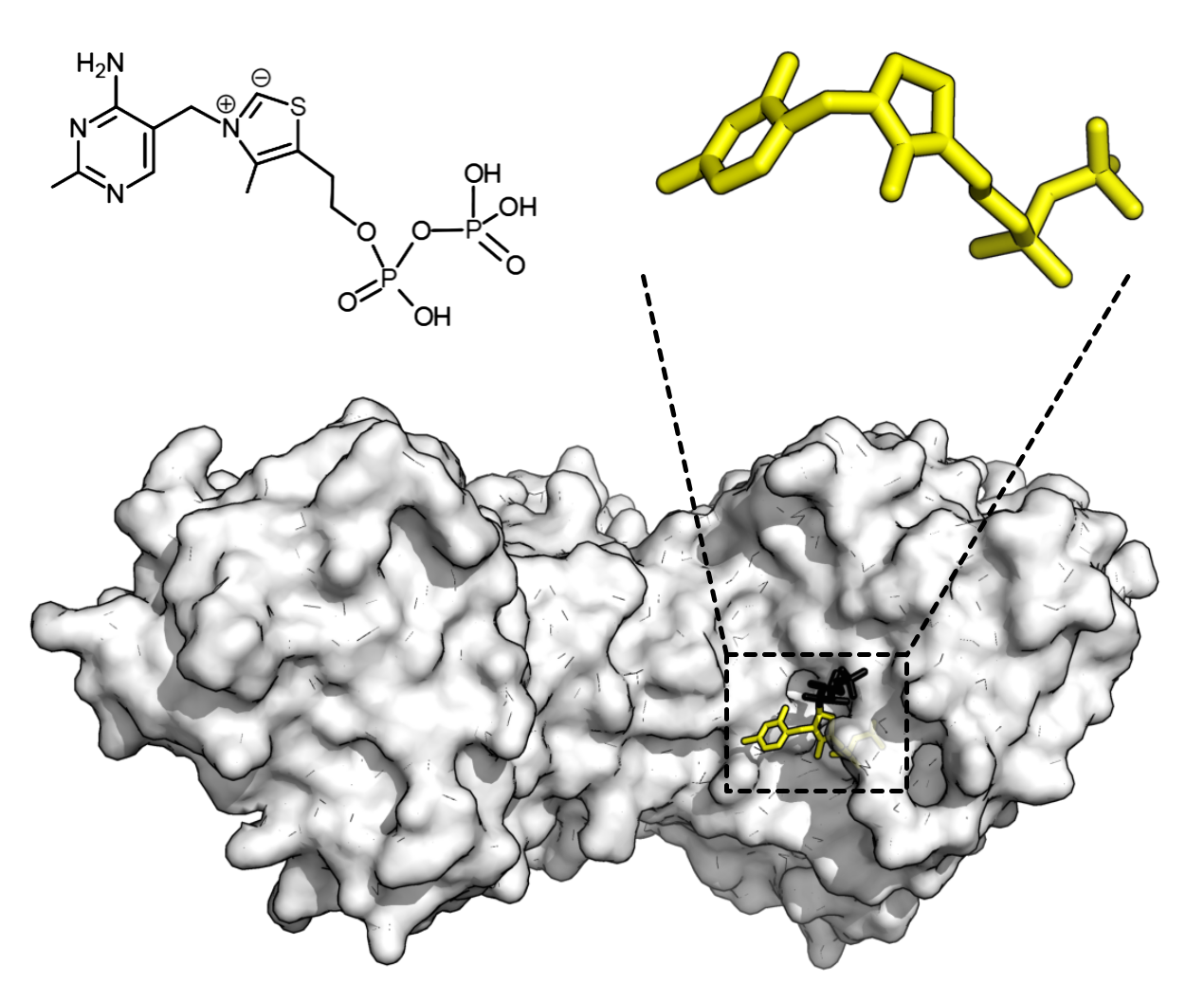
탄산무수화효소는 활성 부위에 아연 보조 인자가 결합된 효소의 예시이다.[226] 이처럼 강하게 결합된 이온 또는 분자는 주로 활성 부위에서 발견되며 촉매 작용에 관여한다.[170] 플라빈 및 헴 보조 인자는 산화환원 반응에 관여하는 대표적인 예이다.[170]
보조 인자를 필요로 하는 효소에서 보조 인자가 없는 단백질 부분을 주효소(主酵素, apoenzyme)라 하고, 주효소와 보조 인자가 결합하여 완전한 활성을 갖는 상태를 전효소(全酵素, holoenzyme)라고 한다. DNA 중합효소처럼 여러 단백질 소단위체로 구성된 효소의 경우, 전효소는 효소 활성에 필요한 모든 소단위체를 포함하는 완전한 복합체를 의미하기도 한다.[170]
6. 1. 조효소
조효소는 효소와 약하게 또는 강하게 결합할 수 있는 작은 유기 분자이다. 조효소는 한 효소에서 다른 효소로 작용기를 운반한다.[227] 니코틴아마이드 아데닌 다이뉴클레오타이드(NAD+), 니코틴아마이드 아데닌 다이뉴클레오타이드 인산(NADP+), 아데노신 삼인산(ATP) 등이 그 예이다. 플라빈 모노뉴클레오타이드(FMN), 플라빈 아데닌 다이뉴클레오타이드(FAD), 티아민 피로인산(TPP), 테트라하이드로폴산(THF)과 같은 일부 조효소는 비타민에서 유래한다. 이러한 조효소는 체내에서 신생합성으로 합성될 수 없으므로, 식단을 통해 섭취해야 하는 필수 화합물(비타민)과 밀접하게 관련되어 있다. 조효소가 운반하는 작용기는 다음과 같다.[170]| 조효소 | 운반하는 작용기 |
|---|---|
| NAD+ 또는 NADP+ | 수소화물(H−) |
| ATP | 인산기 |
| 조효소 A | 아세틸기 |
| 폴산 | 폼일기, 메테닐기, 메틸기 |
| S-아데노실메티오닌 | 메틸기 |
효소 작용의 결과 조효소가 화학적으로 변하기 때문에, 다양한 효소에 공통적인 기질 또는 두 번째 기질로 간주하는 것이 유용하다. 예를 들어 약 1,000가지 효소가 조효소로 NADH를 사용하는 것으로 알려져 있다.[228]
NADH 및 NADPH의 높은 가격은 산업적 생명공학 공정에서 보조 인자 의존성 효소를 사용하는 데 경제적 단점으로 작용한다. 따라서 값싼 합성 생체 모방 보조 인자 개발은 전략적으로 중요한 연구 과제이다.[229]
조효소는 대개 지속적으로 재생되며, 세포 내 농도는 일정 수준으로 유지된다. 예를 들어 NADPH는 오탄당 인산 경로와 메티오닌 아데노실트랜스퍼레이스에 의한 S-아데노실메티오닌을 통해 재생된다. 이러한 지속적인 재생 덕분에 소량의 조효소가 매우 집중적으로 사용될 수 있다. 일례로, 사람은 하루에 자신의 몸무게보다 많은 ATP를 사용한다.[230]
7. 열역학
모든 촉매와 마찬가지로 효소는 반응의 화학 평형에는 영향을 주지 않는다. 효소가 존재할 때도 효소가 없을 때와 마찬가지로 같은 방향으로 반응이 진행되며, 단지 반응 속도가 더 빨라진다.[170] 예를 들어 탄산무수화효소는 반응물의 농도에 따라 양방향으로 반응을 촉매한다.[231]
반응 속도는 생성물로 전환시키기 위한 전이 상태를 형성하는데 필요한 활성화 에너지에 따라 달라진다. 효소는 반응의 활성화 에너지를 낮춤으로써 반응 속도를 증가시킨다. 효소는 효소-기질 복합체(ES 복합체)를 형성하고, 효소가 없을 때의 반응에 비해 더 적은 에너지가 필요하도록 전이 상태를 안정화(ES‡)시킨다. 마지막으로 효소-생성물 복합체(EP 복합체)는 해리되어 생성물을 방출한다.[170]
효소는 두 개 이상의 반응들을 짝지을 수 있으므로 열역학적으로 유리한 반응을 이용하여 열역학적으로 불리한 반응을 진행시켜서 생성물의 결합된 에너지를 기질보다 낮출 수 있다. 예를 들어 ATP의 가수분해는 종종 다른 화학 반응을 일으키는데 사용된다.[232]
7. 1. 효소의 활성화 에너지
모든 촉매와 마찬가지로 효소는 반응의 화학 평형 위치를 변경하지 않는다. 효소가 존재할 때 반응은 효소가 없을 때와 같은 방향으로 진행되지만 더 빠르게 진행된다.[1] 예를 들어, 탄산탈수효소는 반응물의 농도에 따라 양방향으로 반응을 촉매한다.[64]
반응 속도는 생성물로 분해되는 전이 상태를 형성하는 데 필요한 활성화 에너지에 따라 달라진다. 효소는 전이 상태의 에너지를 낮춤으로써 반응 속도를 증가시킨다. 첫째, 결합을 통해 낮은 에너지의 효소-기질 복합체(ES)를 형성한다. 둘째, 효소는 전이 상태를 안정화시켜 비촉매 반응(ES‡)에 비해 달성하는 데 필요한 에너지를 줄인다. 마지막으로 효소-생성물 복합체(EP)가 해리되어 생성물을 방출한다.[1]
효소는 두 개 이상의 반응을 결합할 수 있으므로 열역학적으로 유리한 반응을 사용하여 열역학적으로 불리한 반응을 "추진"하여 생성물의 결합 에너지가 기질보다 낮게 만들 수 있다. 예를 들어, ATP의 가수분해는 종종 다른 화학 반응을 추진하는 데 사용된다.[65]
| 반응명 | 촉매/효소† | 에너지 값 (kcal/mol) |
|---|---|---|
| 과산화 수소(H2O2)의 분해 | (없음) | 18,000 |
| 백금 콜로이드 | 11,000 | |
| 카탈라아제† (간) | 5,000 | |
| 수크로스의 가수분해 | H+ | 26,500 |
| 사카라아제† (효모) | 11,500 | |
| 카제인의 가수분해 | 염산 수용액 | 20,000 |
| 키모트립신† (트립신) | 12,000 | |
| 초산에틸의 가수분해 | H+ | 13,200 |
| 리파아제† (췌장) | 4,200 |
일반적으로 화학 반응은 화학 퍼텐셜이 작아지는 방향(에너지를 소비하는 방향)으로 진행되며, 반응 속도는 반응의 활성화 에너지가 높은지 낮은지에 크게 좌우된다(화학평형, 반응속도론 참조).
효소 반응은 촉매 반응이며 화학 반응의 일종이므로 그 성질은 유사하다. 단, 일반적으로 촉매 반응은 화학 반응 중에서 활성화 에너지가 낮은 것이 보통이지만, 효소 반응의 활성화 에너지는 특히 낮은 경우가 많다. 활성화 에너지가 15,000cal/mol에서 10,000cal/mol로 감소하면 반응 속도 상수는 약 4.5×107배가 된다.
7. 2. 반응 속도
효소는 특정 화학 반응의 반응 속도를 증가시킨다. 반응 속도는 기질의 농도와 속도 상수에 의해 결정된다. 전이 상태 이론을 적용하면, 속도 상수와 활성화 에너지 사이의 관계를 나타내는 식이 유도된다. 효소는 활성화 에너지를 낮춤으로써 반응 속도를 증가시킨다.[235]모든 촉매와 마찬가지로 효소는 반응의 화학 평형 위치를 변경하지 않는다. 효소가 존재할 때, 반응은 효소가 없을 때와 같은 방향으로 진행되지만 더 빠르게 진행된다.[1] 예를 들어, 탄산탈수효소는 반응물의 농도에 따라 양방향으로 반응을 촉매한다.[64]
반응 속도는 생성물로 분해되는 전이 상태를 형성하는 데 필요한 활성화 에너지에 따라 달라진다. 효소는 전이 상태의 에너지를 낮춤으로써 반응 속도를 증가시킨다. 첫째, 결합은 낮은 에너지의 효소-기질 복합체(ES)를 형성한다. 둘째, 효소는 전이 상태를 안정화시켜 비촉매 반응(ES‡)에 비해 달성하는 데 필요한 에너지를 줄인다. 마지막으로 효소-생성물 복합체(EP)가 해리되어 생성물을 방출한다.[1]
효소는 두 개 이상의 반응을 결합할 수 있으므로 열역학적으로 유리한 반응을 사용하여 열역학적으로 불리한 반응을 "추진"하여 생성물의 결합 에너지가 기질보다 낮게 만들 수 있다. 예를 들어, ATP의 가수분해는 종종 다른 화학 반응을 추진하는 데 사용된다.[65]
효소 동역학은 효소가 기질에 어떻게 결합하여 생성물로 전환하는지 연구하는 것이다.[66] 동역학 분석에 사용되는 속도 데이터는 일반적으로 효소 분석에서 얻는다. 1913년 레오노르 미카엘리스와 모드 레오노라 멘텐은 효소 동역학에 대한 정량적 이론을 제안했는데, 이는 미카엘리스-멘텐 동역학이라고 한다.[67] 미카엘리스와 멘텐의 주요 공헌은 효소 반응을 두 단계로 생각한 것이다. 첫 번째 단계에서 기질은 효소에 가역적으로 결합하여 효소-기질 복합체를 형성한다. 이것은 때때로 그들의 이름을 따서 미카엘리스-멘텐 복합체라고 불린다. 그런 다음 효소는 반응에서 화학적 단계를 촉매하고 생성물을 방출한다. 이 연구는 G. E. 브리그스와 J. B. S. 할데인에 의해 더욱 발전되었으며, 오늘날에도 널리 사용되는 동역학 방정식을 도출했다.[68]
효소 속도는 용액 조건과 기질 농도에 따라 달라진다. 효소 반응의 최대 속도를 찾으려면 일정한 생성물 형성 속도가 관찰될 때까지 기질 농도를 증가시킨다. 기질 농도가 증가함에 따라 더 많은 자유 효소가 기질 결합 ES 복합체로 전환되기 때문에 포화가 발생한다. 효소의 최대 반응 속도(''V''max)에서 모든 효소 활성 부위는 기질에 결합되어 있으며 ES 복합체의 양은 총 효소량과 같다.[1]
''V''max는 몇 가지 중요한 동역학적 매개변수 중 하나일 뿐이다. 주어진 반응 속도를 달성하는 데 필요한 기질의 양도 중요하다. 이것은 미카엘리스 상수(''K''m)로 나타내며, 효소가 최대 반응 속도의 절반에 도달하는 데 필요한 기질 농도이다. 일반적으로 각 효소는 주어진 기질에 대해 특징적인 ''K''M을 가지고 있다. 또 다른 유용한 상수는 ''k''cat이며, 이는 회전율이라고도 하며, 1초당 하나의 활성 부위에서 처리되는 기질 분자의 수이다.[1]
효소의 효율은 ''k''cat/''K''m으로 표현할 수 있다. 이것은 특이성 상수라고도 하며, 첫 번째 비가역 단계까지 및 포함하여 반응의 모든 단계에 대한 속도 상수를 통합한다. 특이성 상수는 친화력과 촉매 능력을 모두 반영하므로 서로 다른 효소를 비교하거나 서로 다른 기질을 가진 동일한 효소를 비교하는 데 유용하다. 특이성 상수의 이론적 최대값은 확산 한계라고 하며 약 108~109(M−1 s−1)이다. 이 시점에서 기질과의 효소의 모든 충돌은 촉매 작용을 초래하며, 생성물 형성 속도는 반응 속도가 아니라 확산 속도에 의해 제한된다. 이러한 특성을 가진 효소는 ''촉매적으로 완벽한'' 또는 ''동역학적으로 완벽한'' 효소라고 한다. 이러한 효소의 예로는 트리오스인산 이성질화효소, 탄산탈수효소, 아세틸콜린에스터라제, 카탈라제, 푸마라제, β-락타마제, 슈퍼옥사이드 디스뮤타제가 있다.[1] 이러한 효소의 회전율은 초당 수백만 번의 반응에 도달할 수 있다.[1] 그러나 대부분의 효소는 완벽과 거리가 멀다. 과 의 평균값은 각각 약 과 이다.[69]
미카엘리스-멘텐 동역학은 자유 확산과 열역학적으로 구동되는 무작위 충돌의 가정에서 도출된 질량 작용의 법칙에 의존한다. 거대분자 혼잡과 제한된 분자 이동으로 인해 많은 생화학적 또는 세포 과정은 이러한 조건에서 크게 벗어난다.[70] 최근 더욱 복잡한 모델 확장은 이러한 효과를 수정하려고 시도한다.[71]
한국산업규격에 “'''효소는 선택적인 촉매 작용을 가진 단백질을 주성분으로 하는 생체 고분자 물질'''”(JIS K 3600:2000-1418[150])이라고 정의되어 있는 것처럼 촉매로 이용되지만, 화학공업 등에서 사용되는 전형적인 금속촉매와는 반응 특성이 다르다.
효소 반응의 경우, 기질 농도 [S]가 높아지면 '''반응속도가 포화'''하는 현상이 나타난다. 효소의 경우, 기질 농도를 높게 변화시키면 반응 속도는 '''포화 최대 속도 ''V'''''에 이르는 쌍곡선을 그린다. 한편, 금속 촉매의 경우, 반응 초기 속도 [ν]는 촉매 농도에 의존하지 않고 기질 농도 [S]의 1차식으로 결정된다.
이는 효소와 금속 촉매의 입자 상태의 차이로 설명할 수 있다. 금속 촉매의 경우, 촉매 입자의 표면은 금속 원자로 덮여 있으며, 무수한 촉매 부위가 존재한다. 그에 비해 효소의 경우, 효소 분자가 기질에 비해 거대한 경우가 많으며, 활성 중심을 많아야 몇 군데 정도만 갖는다. 따라서 금속 촉매에 비해 기질과 촉매(효소)가 충돌해도 (활성 중심에 적합하여) 반응이 일어나는 빈도가 작다. 그리고 기질 농도가 높아지면 적은 효소의 활성 중심을 기질이 서로 다투게 되므로 포화 현상이 발생한다. 이와 같이 효소 반응에서는 효소와 기질이 결합한 '''기질 복합체'''를 만드는 과정이 반응 속도를 결정하는 속도 결정 단계가 되는 것으로 생각된다.
| 반응명 | 촉매/효소† | 에너지 값 (kcal/mol) |
|---|---|---|
| 과산화수소(H2O2)의 분해 | (없음) | 18,000 |
| 백금 콜로이드 | 11,000 | |
| 카탈라아제(Catalase)† (간) | 5,000 | |
| 수크로스의 가수분해 | H+ | 26,500 |
| 사카라아제(Saccharase)† (효모) | 11,500 | |
| 카세인의 가수분해 | 염산 수용액 | 20,000 |
| 키모트립신(Chymotrypsin)† (트립신) | 12,000 | |
| 초산에틸의 가수분해 | H+ | 13,200 |
| 리파아제(Lipase)† (췌장) | 4,200 |
일반적으로 화학 반응의 진행 방향은 화학 퍼텐셜이 작아지는 방향(에너지를 소비하는 방향)으로 진행되며, 반응 속도는 반응의 활성화 에너지가 높은지 낮은지에 크게 좌우된다.
효소 반응은 촉매 반응이며 화학 반응의 일종이므로 그 성질은 유사하다. 단, 일반적으로 촉매 반응은 화학 반응 중에서 활성화 에너지가 낮은 것이 보통이지만, 효소 반응의 활성화 에너지는 특히 낮은 경우가 많다.
일반적으로 활성화 에너지가 15,000cal/mol에서 10,000cal/mol로 감소하면 반응 속도 상수는 약 4.5×107배가 된다.
7. 3. 결합 에너지
효소는 특이적인 효소-기질 복합체(ES 복합체)를 형성하여 반응의 활성화 에너지를 낮춘다. 이때 결합 에너지는 효소가 반응의 활성화 에너지를 낮추는 데 사용되는 자유 에너지의 중요한 공급원이다.[170]7. 3. 1. 결합 에너지의 효소 반응 메커니즘에 대한 역할
결합 에너지는 촉매 반응에 필요한 에너지를 공급하고 반응의 특이성을 확보하는 데에도 관련되어 있다. 기질이 효소에 결합함으로써 엔트로피가 감소한다.[233] 기질과 효소 사이에 약한 결합이 형성됨으로써 기질은 탈용매화된다. 전이 상태에서 형성되는 약한 상호작용에 의한 결합 에너지는 전자의 재배치에 의한 뒤틀림을 이용하여 기질이 반응하는 것을 열역학적으로 보상한다.8. 효소 반응속도론
효소 반응속도론은 효소가 기질과 어떻게 결합하고 기질을 생성물로 전환시키는지 연구하는 학문이다.[238] 효소 반응 속도론에 사용되는 속도 데이터는 일반적으로 효소 분석법에서 얻는다. 1913년 레오노르 미하엘리스와 모드 레오노라 멘텐은 미하엘리스-멘텐 속도론이라 불리는 효소 반응 속도론의 정량적인 이론을 제안했다.[239] 미하엘리스와 멘텐은 효소 반응이 두 단계로 나뉘어 일어난다고 보았다. 첫째, 기질은 효소와 가역적으로 결합하여 효소-기질 복합체를 형성한다. 이 효소-기질 복합체는 미하엘리스와 멘텐의 업적을 기리기 위해 때때로 미하엘리스-멘텐 복합체로도 불린다. 둘째, 효소는 반응에서 화학 반응을 촉매한 다음, 생성물을 방출한다. 조지 에드워드 브릭스와 존 버든 샌더슨 홀데인은 효소 반응 속도론에 대한 연구를 더욱 발전시켰으며, 오늘날에도 여전히 널리 사용되는 효소 반응 속도식을 도출해 냈다.[240]
효소가 촉매하는 반응 속도는 용액의 조건과 기질의 농도에 따라 달라진다. 효소 반응의 최대 속도를 찾기 위해 생성물이 일정한 속도로 생성될 때까지 기질의 농도를 증가시킨다. 이는 포화 곡선으로 나타나는데, 기질의 농도가 증가함에 따라 유리 효소가 효소-기질 복합체로 전환되기 때문에 포화가 일어난다. 효소의 최대 반응 속도(Vmax)에서 모든 효소의 활성 부위는 기질과 결합하고, 효소-기질 복합체의 총 개수는 효소의 총 개수와 같다.[170]
Vmax는 효소 반응 속도론의 중요한 매개 변수 중 하나이다. 주어진 반응 속도를 달성하기 위해 필요한 기질의 양도 중요한데, 이는 효소가 최대 반응 속도의 1/2에 도달하기 위해 필요한 기질의 농도인 미하엘리스-멘텐 상수(Km)로 주어진다. 일반적으로, 각각의 효소는 주어진 기질에 대한 고유한 Km을 가진다. 또 다른 유용한 상수는 전환수(turnover number)라고도 하는 kcat이며, 이는 효소가 기질로 포화되었을 때 단위 시간당 1개의 효소 분자에 의해 생성물로 바뀌는 기질 분자의 수를 의미한다.[170]
효소의 효율은 kcat/Km으로 나타낼 수 있다. kcat/Km은 특이성 상수라고도 하며, E+S가 E+P로 전환하는 속도 상수로 첫 번째 비가역적인 단계를 포함한 반응의 모든 단계에 대한 속도 상수를 포함한다. 특이성 상수는 친화도 및 촉매 능력을 모두 반영하기 때문에 서로 다른 효소들을 비교하거나 서로 다른 기질을 사용하는 동일한 효소를 비교하는데 유용하다. 특이성 상수에 대한 이론적 최대값을 확산 한계(diffusion limit)라고 하며, 약 108~109 M−1 s−1이다. 이때 효소는 기질과 충돌할 때마다 촉매 작용이 일어나며, 생성물의 형성 속도는 반응 속도가 아닌 확산 속도에 의해 제한된다. 이러한 효소를 촉매적으로 완벽하거나 반응속도론적으로 완벽(확산 지배 효소)하다고 한다. 확산 지배 효소에는 삼탄당 인산 이성질화효소, 탄산무수화효소, 아세틸콜린에스터레이스, 카탈레이스, 푸마레이스, β-락타메이스, 초과산화물 불균등화효소 등이 있다.[170] 이 효소들의 전환율은 초당 수백만 회의 반응에 이를 수 있다.[170] 그러나 대부분의 효소는 촉매적으로 완벽한 상태와는 거리가 멀다. 일반적인 효소들의 의 평균값은 약 이고, 의 평균값은 약 이다.[241]
미하엘리스-멘텐 반응 속도론은 자유 확산 및 열역학적으로 유도되는 무작위적 충돌의 가정으로부터 도출된 질량작용의 법칙에 기반한다. 그러나 많은 생화학적 또는 세포적 과정은 고분자 군집 및 제한된 분자 운동으로 인해 이러한 조건에서 크게 벗어난다.[242] 최근에는 이러한 효과를 수정하기 위한 복잡한 모델 확장 연구가 진행되고 있다.[243]
9. 저해
효소 반응 속도는 다양한 유형의 효소 저해제에 의해 감소될 수 있다.[72] 저해제는 효소의 기능을 조절하기 때문에 약물로 사용되기도 한다. 예를 들어 스타틴은 콜레스테롤 수치가 높은 환자에게, 프로테이스 저해제는 HIV 감염 환자에게 사용된다.[253][254] 아스피린은 염증 반응을 조절하는 프로스타글란딘을 생성하는 효소인 사이클로옥시제네이스(COX-1, COX-2)를 저해한다.[252]
사이안화물과 같은 독은 사이토크롬 c 산화효소의 활성 부위에 있는 구리 및 철과 결합하여 세포 호흡을 차단하는 비가역적 효소 저해제이다.[255]
많은 생물에서 저해제는 피드백 메커니즘의 일부로 작용하기도 한다.[170] 효소가 특정 물질을 너무 많이 생성하면, 그 물질이 해당 대사 경로의 초기 단계를 촉매하는 효소의 저해제로 작용하여 생성을 늦추거나 중단시키는 음성 피드백 방식이다. 시트르산 회로와 같은 주요 대사 경로가 이러한 메커니즘을 사용한다.
9. 1. 저해의 유형
효소의 반응 속도는 다양한 유형의 효소 저해제에 의해 감소될 수 있다.[72] 효소 저해는 기질과 구조가 비슷한 분자의 존재나, 알로스테릭 효과에 의해 일어날 수 있다.저해 작용의 종류에 따라 효소 반응 속도의 응답 양식('''저해 양식''')이 달라지며, 크게 다음과 같이 분류된다.
- 경쟁적 저해
- 경쟁적이지 않은 저해
- * 비경쟁적 저해
- * 불경쟁적 저해
- 혼합형 저해
이러한 저해 양식을 조사함으로써, 효소가 어떤 조절 작용을 받고 있는지 추측할 수 있다. 이는 효소 작용을 제어하여 증상을 개선하는 새로운 의약품 개발에 응용될 수 있다.
9. 1. 1. 가역적 저해
가역적 저해제는 효소와 일시적인 결합체만을 형성한다.[72] 가역적 저해에는 경쟁적 저해, 비경쟁적 저해, 무경쟁적 저해의 3가지 유형이 알려져 있다.[1]- 경쟁적 저해: 기질과 저해제가 효소에 동시에 결합할 수 없다.[73] 종종 경쟁적 저해제는 효소의 실제 기질과 매우 유사한 구조를 가진다. 예를 들어, 항암제인 메토트렉세이트는 다이하이드로폴산 환원효소의 경쟁적 저해제이다. 이 효소는 폴산을 테트라하이드로폴산으로 환원시키는 반응을 촉매하는데, 메토트렉세이트와 다이하이드로폴산의 구조는 매우 유사하다.[74] 높은 기질 농도에서는 경쟁적 저해를 극복할 수 있다. 어떤 경우에는 저해제가 기질 결합 부위가 아닌 다른 부위에 결합하여 알로스테릭 효과를 통해 결합 부위의 모양을 변화시키기도 한다.[75]
- 비경쟁적 저해: 기질이 결합하는 부위 이외의 부위에 저해제가 결합한다. 기질은 여전히 결합할 수 있으므로 Km (미하엘리스-멘텐 상수)는 변하지 않지만, 저해제가 효소의 촉매 효율을 감소시켜 Vmax (최대 반응 속도)가 감소한다. 경쟁적 저해와 달리, 비경쟁적 저해는 높은 기질 농도로 극복할 수 없다.[1]
- 무경쟁적 저해: 자유 효소에는 결합할 수 없고, 효소-기질 복합체에만 결합할 수 있다. 따라서 기질 농도가 높을 때 가장 효과적이다. 저해제가 결합하면 효소-기질 복합체는 비활성화된다.[1] 이러한 유형의 저해는 드물다.[76]
9. 1. 2. 비가역적 저해
비가역적 저해제는 대개 단백질과 공유 결합을 형성하여 효소를 영구적으로 불활성화시킨다.[77] 페니실린[78]과 아스피린[79]은 이러한 방식으로 작용하는 일반적인 약물이다.9. 2. 저해제의 기능
많은 생물에서 저해제는 피드백 메커니즘의 일부로 작용할 수 있다.[170] 효소가 생물에서 특정 물질을 너무 많이 생성시키면, 그 물질은 그 물질을 생성하는 대사 경로의 시작 단계를 촉매하는 효소의 저해제로 작용하여 특정 물질의 양이 충분할 경우에 그 물질의 생성을 늦추거나 중단시킬 수 있다. 이것은 음성 피드백의 한 형태이다. 시트르산 회로와 같은 주요 대사 경로들은 이러한 메커니즘을 사용한다.저해제는 효소의 기능을 조절할 수 있기 때문에 종종 약물로 사용된다. 그러한 많은 약물들은 메토트렉세이트와 같이 효소의 고유 기질과 비슷한 구조를 가지고 있는 가역적인 경쟁적 저해제이다. 경쟁적 저해제의 또 다른 잘 알려진 예로는 콜레스테롤 수치가 높은 환자들의 치료에 사용되는 스타틴[253] 및 HIV와 같은 레트로바이러스에 감염된 환자들의 치료에 사용되는 프로테이스 저해제 등이 있다.[254] 약물로 사용되는 비가역적 저해제의 예로는 염증 반응을 조절하는 프로스타글란딘을 생성하는 효소인 사이클로옥시제네이스-1(COX-1)과 사이클로옥시제네이스-2(COX-2)를 저해하는 아스피린이 있다.[252] 다른 효소 저해제들 중에는 독으로 작용하는 것도 있다. 예를 들어, 사이안화물 독은 사이토크롬 c 산화효소의 활성 부위에 있는 구리 및 철과 결합하여 세포 호흡을 차단하는 비가역적 효소 저해제이다.[255]
10. 생물학적 기능
효소는 살아있는 생물체 내에서 다양한 기능을 수행한다. 효소는 신호 전달과 세포 조절에 필수적이며, 주로 키네이스 및 포스파테이스를 통해 관여한다.[256] 근수축을 위해 ATP를 가수분해한 에너지를 이용하여 마이오신의 움직임을 발생시키며, 세포 골격의 일부로서 세포 주위로 물질을 운반한다.[257] 세포막에 있는 다른 ATPase는 능동수송에 관여하는 이온 펌프이다. 또한 효소는 반딧불이의 빛을 생성하는 루시퍼레이스와 같은 특이한 기능에도 관여한다.[258] 바이러스는 HIV 인테그레이스 및 역전사효소와 같이 세포를 감염시키기 위해 필요한 효소나, 인플루엔자 바이러스의 뉴라미니데이스와 같이 세포로부터 바이러스를 방출시키는데 필요한 효소를 함유할 수 있다.[259]
효소의 중요한 기능 중 하나는 동물의 소화계에서 소화 효소로 작용하는 것이다. 아밀레이스나 프로테이스와 같은 효소는 녹말이나 단백질과 같은 큰 분자를 작은 분자로 분해하여 소장에서 흡수될 수 있도록 돕는다. 반추동물은 장에 공생하는 미생물이 분비하는 셀룰레이스 덕분에 식물 세포벽의 성분인 셀룰로스를 분해할 수 있다.[260]
10. 1. 물질대사
여러 효소가 특정 순서로 함께 작용해서 대사 경로를 형성한다.[170] 대사 경로에서 어떤 효소는 다른 효소의 생성물을 기질로 사용한다. 촉매 반응 후 생성물은 다른 효소로 옮겨진다. 때로는 한 가지 이상의 효소가 동일한 반응을 동시에 촉매할 수 있는데, 이는 보다 복잡한 조절을 가능하게 한다. 예를 들어, 하나의 효소에 의해서는 일정한 수준의 낮은 활성을 가지지만, 두 번째 효소로부터 높은 활성이 유도될 수 있다.[261]효소는 대사 경로에서 어떤 단계를 일어나게 할지를 결정한다. 효소가 없다면 물질대사는 일어나지 않을 것이고, 세포의 필요를 충족시키기 위해 대사를 조절할 수도 없을 것이다. 대부분의 중심 대사 경로들은 주로 ATP의 가수분해 활성을 가지고 있는 효소들을 통해 몇 가지 핵심적인 단계에서 조절된다. ATP의 가수분해 반응은 많은 에너지를 방출하기 때문에 열역학적으로 불리한 반응을 ATP 가수분해와 짝지어서 일련의 연결된 대사 반응들을 일으킬 수 있다.[170]
10. 2. 효소 활성의 통제
세포 내에서 효소의 활성은 여러 방식으로 조절된다.- 다른 자리 입체성 조절: 효소의 활성 부위와는 다른 주머니(다른 자리 입체성 조절 부위)에 세포 환경의 분자들이 결합하여 효소의 구조를 변화시켜 활성을 조절한다. 이는 효소를 저해하거나 활성화시킬 수 있다. 대사 경로에서 대사 산물과의 상호작용은 피드백 조절을 일으켜 효소의 활성을 변화시킨다.[221][222]
- 조효소: 조효소는 효소와 결합하여 작용기를 운반하는 작은 유기 분자이다. 니코틴아마이드 아데닌 다이뉴클레오타이드(NAD+), 니코틴아마이드 아데닌 다이뉴클레오타이드 인산(NADP+), 아데노신 삼인산(ATP) 등이 대표적인 예시이다. 일부 조효소는 비타민으로부터 유래하며, 체내에서 합성될 수 없으므로 식사를 통해 섭취해야 한다.[227] 조효소는 대개 지속적으로 재생되며, 세포 내에서 일정 농도로 유지된다. 예를 들어, NADPH는 오탄당 인산 경로 및 메티오닌 아데노실트랜스퍼레이스에 의해 재생된다.[230]
- 결합 에너지: 효소는 반응의 활성화 에너지를 낮추는데, 이는 기질과 효소 사이의 약한 결합(비공유결합)에서 얻어지는 결합 에너지 덕분이다. 효소-기질 복합체에서 형성되는 약한 상호작용은 반응이 전이 상태가 되어서야 완전히 상보적인 결합을 형성하며, 이때 방출되는 결합 에너지의 일부가 에너지 장벽을 넘는 데 사용된다.[236]
- 효소 저해제: 효소 반응 속도는 효소 저해제에 의해 감소될 수 있다. 가역적 저해제는 효소와 일시적인 결합을 형성하며, 비가역적 저해제는 공유 결합을 형성하여 효소를 영구적으로 불활성화시킨다. 페니실린[251]과 아스피린[252]은 비가역적 저해제의 예시이다. 많은 생물에서 저해제는 피드백 메커니즘의 일부로 작용하여 특정 물질의 과잉 생성을 막는다.[170]
- 항상성 유지: 효소 활성의 엄격한 조절은 항상성에 필수적이며, 효소의 이상은 유전 질환을 일으킬 수 있다. 예를 들어, 헥소사미니데이스의 결핍은 테이-삭스병을 유발하고,[272][273] 페닐알라닌 하이드록실화효소의 돌연변이는 페닐케톤뇨증을 일으킨다.[274][275]
10. 2. 1. 조절
효소는 다른 분자에 의해 활성화되거나 저해될 수 있다. 예를 들어, 대사 경로의 최종 생성물은 종종 그 경로의 첫 번째 효소(보통 첫 번째 비가역적 단계, 즉 커밋 단계라고 함)의 저해제 역할을 하여 경로에 의해 생성되는 최종 생성물의 양을 조절한다. 이러한 조절 메커니즘을 음성 피드백 메커니즘이라고 하는데, 생성되는 최종 생성물의 양이 그 자체의 농도에 의해 조절되기 때문이다.[1] 음성 피드백 메커니즘은 세포의 요구에 따라 중간 대사체의 합성 속도를 효과적으로 조절할 수 있다. 이는 물질의 효율적인 할당과 에너지 절약에 도움이 되며, 최종 생성물의 과잉 생산을 방지한다. 다른 항상성 유지 장치와 마찬가지로 효소 작용의 조절은 생명체 내부 환경의 안정성 유지에 기여한다.[1]생체 내에서는 하나의 기질에 주목하더라도, 작용하는 효소가 다르면 생성물도 달라진다. 일반적으로 효소는 하나의 화학 반응만 촉매하는 성질을 가지고 있으며, 이것을 효소의 '''반응 특이성'''이라고 한다.
효소가 반응 특이성을 가지기 때문에, 소화 효소 등 몇 가지 예외를 제외하면, 일반적으로 하나의 효소는 생체 내 복잡한 대사 경로의 한 곳만 담당한다. 이것은 생체를 항상성 있게 유지하기 위한 중요한 성질이다.
어떤 대사 경로가 존재하는지는 그 대사 경로를 담당하는 고유한 효소가 존재하는지에 따라 달라지므로, 그 효소 단백질을 생산하는 유전자의 발현에 의해 조절할 수 있다. 또한, 대사산물 중 하나가 과잉이 된 경우, 그 대사 경로를 담당하는 고유한 효소의 활성에 피드백 저해가 일어나므로, 과잉 생산이 동적으로 조절된다.
효소는 각각 고유한 기질과 생화학 반응을 담당하지만, 같은 생체 내에서도 조직이나 세포의 종류가 다르면, 다른 종류의 효소가 같은 기질의 같은 생화학 반응을 담당하는 경우가 있다. 이러한 관계의 효소를 서로 아이소자임(isozyme)이라고 한다.
10. 2. 2. 번역 후 변형
Post-translational modification|번역 후 변형영어의 예로는 인산화, 미리스토일화, 글리코실화 등이 있다.[90] 예를 들어 인슐린에 대한 반응으로, 글리코겐 합성효소를 포함한 여러 효소들의 인산화는 글리코겐의 합성 또는 분해를 조절하고, 세포가 혈당 변화에 반응할 수 있도록 돕는다.[91] 번역 후 변형의 또 다른 예는 폴리펩타이드 사슬의 절단이다. 소화 효소인 키모트립신은 이자에서 비활성 형태인 키모트립시노겐으로 생성되어 위로 이동하여 활성화된다. 이는 효소가 장에 들어가기 전에 이자나 다른 조직을 소화하는 것을 막는다. 이러한 효소의 비활성 전구체는 지모겐[1] 또는 프로효소라고 불린다.10. 2. 3. 양
효소의 생성(전사 및 번역)은 세포 환경의 변화에 반응하여 세포에 의해 증가되거나 감소될 수 있다. 이러한 형태의 유전자 발현의 조절을 효소 유도라고 한다.[264] 효소의 양은 효소의 분해 속도를 변화시킴으로써 조절할 수도 있다.10. 2. 4. 세포 내 분포
효소는 구획화될 수 있으며, 서로 다른 세포 내 구획에서 서로 다른 대사 경로가 일어날 수 있다. 예를 들어, 지방산은 세포질, 소포체, 골지체에서 한 세트의 효소에 의해 합성되고, 다른 세트의 효소에 의해 미토콘드리아에서 베타 산화를 통해 에너지원으로 사용된다.[94] 또한, 서로 다른 구획으로 효소가 이동하면 양성자화 정도(예: 중성 세포질과 산성 리소좀) 또는 산화 상태(예: 산화성 주변질 또는 환원성 세포질)가 변화될 수 있으며, 이는 효소 활성에 영향을 미친다.[95] 막으로 둘러싸인 세포 소기관으로 분할되는 것과는 달리, 효소의 세포 내 국재화는 효소의 고분자화를 통해 세포질 필라멘트로 변화될 수도 있다.[96][97]10. 2. 5. 기관의 전문화
다세포 진핵생물에서 여러 기관과 조직의 세포들은 유전자 발현 패턴이 다르므로 대사 반응에 사용할 수 있는 효소(동질효소)의 집합도 다르다. 이는 유기체의 전체적인 대사를 조절하는 메커니즘을 제공한다. 예를 들어, 해당과정의 첫 번째 효소인 헥소키네이스는 간과 췌장에서 발현되는 글루코키나아제라는 특수한 형태를 가지고 있으며, 포도당에 대한 친화도는 낮지만 포도당 농도에는 더 민감하다.[98] 이 효소는 혈당을 감지하고 인슐린 생성을 조절하는 데 관여한다.[99]10. 3. 질병 관련
효소 활성의 엄격한 조절은 항상성에 필수적이기 때문에, 핵심적인 효소의 이상(돌연변이, 과잉생산, 과소생산 또는 결실)은 유전 질환을 일으킬 수 있다.[272][273] 인체에 존재하는 수천 가지의 효소들 중 한 가지 효소에 이상이 생겨도 치명적일 수 있다. 효소 결핍으로 인한 치명적인 유전 질환의 예로는 헥소사미니데이스의 결핍으로 유발되는 테이-삭스병이 있다.
페닐케톤뇨증은 효소 결핍으로 인한 질환의 가장 대표적인 예이다. 페닐알라닌 분해의 첫 번째 단계를 촉매하는 효소인 페닐알라닌 하이드록실화효소의 단일 아미노산 돌연변이는 페닐알라닌 및 관련 물질의 축적을 일으킨다. 일부 돌연변이는 효소의 활성 부위에서 일어나서 기질과의 직접적인 결합과 촉매 작용을 방해하지만, 많은 돌연변이들은 효소의 활성 부위에서 먼 곳에서 일어나 단백질의 구조를 불안정하게 만들거나 정확한 올리고머화에 영향을 미쳐 효소의 활성을 감소시킨다.[274][275] 이러한 질환을 적절하게 치료하지 못하면 지적 장애를 유발할 수 있다.[276] 또 다른 예로는 체내의 콜린 에스터 약물을 분해하는 능력이 저하되는 슈도콜린에스터레이스 결핍증이 있다.[277] 효소의 경구 투여는 외분비 이자기능부전[278] 및 젖당불내증[279]과 같은 일부 기능적 효소 결핍증을 치료할 수 있다.
효소 이상이 질병을 일으킬 수 있는 또 다른 방법은 DNA 복구 효소를 암호화하는 유전자에서 생식세포 돌연변이가 일어나는 것이다. 이러한 효소들의 결함은 세포가 게놈에서 일어나는 돌연변이를 제대로 복구할 수 없기 때문에 돌연변이가 천천히 축적되어 암을 발생시킬 수 있다. 이러한 유전성 암의 예로는 자외선에 대한 최소한의 노출에도 반응하여 피부암을 유발할 수 있는 색소성 건피증이 있다.[280][281]
11. 산업적 이용
효소는 화학공업 및 기타 산업 분야에서 매우 특정한 촉매가 필요할 때 사용된다. 효소는 일반적으로 유기 용매 및 고온에서 안정성이 떨어지기 때문에 산업적으로 이용할 수 있는 반응의 수는 제한된다.[282] 단백질공학은 연구가 활발한 영역이며, 합리적인 설계 또는 시험관 내에서의 진화를 통해 새로운 특성을 갖는 새로운 효소를 만들려는 시도를 포함한다.[282][283] 이러한 노력들은 성공하기 시작했고, 몇몇 효소들은 이제 자연에서 일어나지 않는 반응들을 촉매하기 위해 처음부터 설계되었다.[284]
| 적용 | 사용된 효소 | 용도 |
|---|---|---|
| 바이오 연료 산업 | 셀룰레이스 | 셀룰로스 에탄올을 생산하기 위해 셀룰로스를 발효될 수 있는 당으로 분해한다.[285] |
| 리그니네이스 | 바이오 연료의 생산을 위한 바이오매스의 전처리[285] | |
| 세탁 세제 | 프로테이스, 아밀레이스, 라이페이스 | 세탁물 및 식기류에서 단백질, 녹말, 지방 또는 오일의 얼룩을 제거한다.[286] |
| β-만노시데이스 | 일반 식품첨가물인 구아검에서 식품 얼룩을 제거한다.[286] | |
| 양조 산업 | 아밀레이스, 글루카네이스, 프로테이스 | 맥아에서 다당류와 단백질을 분해한다.[287] |
| β-글루카네이스 | 맥아즙과 맥주의 여과 특성을 향상시킨다.[287] | |
| 아밀레이스, 플루라네이스 | 저칼로리 맥주를 만들고 발효를 조절한다.[287] | |
| 아세토락트산 탈카복실화효소 | 다이아세틸의 생성을 줄임으로써 발효의 효율을 증가시킨다.[288] | |
| 조리에 사용 | 파파인 | 요리를 위해 고기를 부드럽게 만든다.[289] |
| 낙농 산업 | 키모신 (레닌) | 치즈의 제조 과정에서 단백질을 가수분해한다.[290] |
| 라이페이스 | 로크포르와 같은 카망베르 치즈 및 블루 치즈를 생산한다.[291] | |
| 식품 가공 | 아밀레이스 | 고과당 옥수수 시럽을 만드는 것과 같이 녹말로부터 당을 만드는데 사용한다.[292] |
| 프로테이스 | 비스킷 제조에서 밀가루의 단백질 수치를 낮춘다.[293] | |
| 트립신 | 저자극성 이유식을 제조하는데 사용한다.[293] | |
| 셀룰레이스, 펙티네이스 | 과일 주스를 투명하게 하는데 사용한다.[294] | |
| 분자생물학 | 뉴클레이스, DNA 연결효소 및 중합효소 | 재조합 DNA를 만들기 위해 제한효소와 중합효소 연쇄 반응을 이용한다. |
| 제지 산업 | 자일라네이스, 헤미셀룰레이스, 리그닌 과산화효소 | 크라프트 펄프에서 리그닌을 제거한다.[295] |
| 퍼스널 케어 | 프로테이스 | 콘택트 렌즈의 단백질을 제거하여 감염을 예방한다.[296] |
| 녹말 산업 | 아밀레이스 | 녹말을 포도당과 다양한 시럽으로 전환한다.[297] |
참조
[1]
서적
Biochemistry
https://www.ncbi.nlm[...]
W.H. Freeman
[2]
학술지
Bio-Zombie: the rise of pseudoenzymes in biology
2017-04-00
[3]
학술지
A robust methodology to subclassify pseudokinases based on their nucleotide-binding properties
2014-01-00
[4]
학술지
BRENDA in 2013: integrated reactions, kinetic data, enzyme function data, improved disease classification: new options and contents in BRENDA
2013-01-00
[5]
학술지
A proficient enzyme
1995-01-00
[6]
학술지
OMP decarboxylase--An enigma persists
2007-12-00
[7]
학술지
Observations sur la digestion des oiseaux
https://gallica.bnf.[...]
[8]
서적
A History of Science: in Five Volumes''. ''Volume IV: Modern Development of the Chemical and Biological Sciences
http://etext.lib.vir[...]
Harper and Brothers
[9]
학술지
Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels
https://books.google[...]
[10]
학술지
Louis Pasteur (1822–1895)--chance and the prepared mind
1995-12-00
[11]
학술지
Über das Verhalten verschiedener organisirter und sog. ungeformter Fermente
https://books.google[...]
[12]
서적
The Oxford Companion to the History of Modern Science
Oxford University Press
[13]
웹사이트
Eduard Buchner
http://nobelprize.or[...]
Nobelprize.org
2015-02-23
[14]
웹사이트
Eduard Buchner – Nobel Lecture: Cell-Free Fermentation
http://nobelprize.or[...]
2015-02-23
[15]
서적
Traité de microbiologie: Diastases, toxines et venins
https://books.google[...]
Masson and Co
[16]
학술지
Faraday lecture. Problems and methods in enzyme research
1927
[16]
학술지
So do we understand how enzymes work?
2000-04-00
[17]
웹사이트
Nobel Prizes and Laureates: The Nobel Prize in Chemistry 1946
http://nobelprize.or[...]
2015-02-23
[18]
학술지
Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Angstrom resolution
1965-05-00
[19]
학술지
David Phillips and the origin of structural enzymology
1999-07-00
[20]
웹사이트
Recommendations of the Nomenclature Committee of the International Union of Biochemistry and Molecular Biology on the Nomenclature and Classification of Enzymes by the Reactions they Catalyse
https://www.qmul.ac.[...]
2021-08-28
[21]
웹사이트
EC 2.7.1.1
http://www.chem.qmul[...]
School of Biological and Chemical Sciences, Queen Mary, University of London
2015-03-06
[22]
서적
eLS
John Wiley & Sons, Ltd
2007-09-28
[23]
학술지
Non-homologous isofunctional enzymes: a systematic analysis of alternative solutions in enzyme evolution
2010-04-00
[24]
학술지
Principles that govern the folding of protein chains
1973-07-00
[25]
학술지
Enzyme function discovery
2008-11-00
[26]
서적
Protein structure and function
New Science
2003
[27]
학술지
4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer
1992-09-00
[28]
학술지
The animal fatty acid synthase: one gene, one polypeptide, seven enzymes
1994-12-00
[29]
웹사이트
The Catalytic Site Atlas
http://www.ebi.ac.uk[...]
The European Bioinformatics Institute
2007-04-04
[30]
서적
How Enzymes Work: From Structure to Function
CRC Press
[31]
서적
Biochemistry of Signal Transduction and Regulation
Wiley-VCH
2003
[32]
학술지
Enantioselective biocatalysis optimized by directed evolution
2004-08-00
[33]
학술지
The 3' 5' exonucleases
2002-05-00
[34]
학술지
Transcript-assisted transcriptional proofreading
2006-07-00
[35]
학술지
Aminoacyl-tRNA synthesis
[36]
논문
Fidelity of aminoacyl-tRNA selection on the ribosome: kinetic and structural mechanisms
[37]
논문
Enzyme promiscuity: a mechanistic and evolutionary perspective
[38]
논문
Catalytic promiscuity and the evolution of new enzymatic activities
1999-04-00
[39]
논문
Einfluss der Configuration auf die Wirkung der Enzyme
http://gallica.bnf.f[...]
[40]
서적
The Cell: a Molecular Approach
https://archive.org/[...]
ASM Press
2000-00-00
[41]
논문
Application of a Theory of Enzyme Specificity to Protein Synthesis
1958-02-00
[42]
논문
Glycosidase mechanisms
2002-10-00
[43]
서적
Concepts in Biochemistry
John Wiley & Sons, Inc.
[44]
논문
Conformational proofreading: the impact of conformational changes on the specificity of molecular recognition
2007-05-00
[45]
서적
Enzyme Structure and Mechanism
W.H. Freeman
[46]
논문
Electrostatic basis for enzyme catalysis
2006-08-00
[47]
서적
Lehninger Principles of Biochemistry
W.H. Freeman
2013-00-00
[48]
논문
A perspective on enzyme catalysis
2003-08-00
[49]
서적
Catalysis in Chemistry and Enzymology
Dover
[50]
논문
How important are entropic contributions to enzyme catalysis?
2000-10-00
[51]
논문
The catalytic triad of serine peptidases
2005-10-00
[52]
논문
Protein conformational populations and functionally relevant substates
2014-01-00
[53]
논문
Strategies and tools for the biotechnological valorization of glycerol to 1, 3-propanediol: Challenges, recent advancements and future outlook
2023-09-00
[54]
논문
Phospholipase D: enzymology, functionality, and chemical modulation
2011-10-00
[55]
논문
Protein allostery, signal transmission and dynamics: a classification scheme of allosteric mechanisms
2009-03-00
[56]
논문
Allosteric mechanisms of signal transduction
2005-06-00
[57]
웹사이트
Glossary of Terms Used in Bioinorganic Chemistry: Cofactor
http://www.chem.qmul[...]
International Union of Pure and Applied Chemistry
[58]
서적
Fundamentals of Biochemistry
John Wiley & Sons, Inc.
[59]
논문
The enzymatic biotinylation of proteins: a post-translational modification of exceptional specificity
1999-09-00
[60]
논문
Structural and kinetic characterization of active-site histidine as a proton shuttle in catalysis by human carbonic anhydrase II
2005-02-00
[61]
서적
Vitamins and Coenzymes
Krieger Pub Co
[62]
웹사이트
BRENDA The Comprehensive Enzyme Information System
http://www.brenda-en[...]
Technische Universität Braunschweig
[63]
논문
Opening and closing the metabolite gate
2008-12-00
[64]
서적
Essentials of Exercise Physiology
Lippincott Williams & Wilkins
2006-00-00
[65]
서적
Bioenergetics 3
Academic
[66]
서적
Enzyme kinetics : principles and methods
Wiley-VCH
[67]
논문
Die Kinetik der Invertinwirkung
[67]
논문
The original Michaelis constant: translation of the 1913 Michaelis-Menten paper
2011-10-00
[68]
논문
A Note on the Kinetics of Enzyme Action
[69]
논문
The moderately efficient enzyme: evolutionary and physicochemical trends shaping enzyme parameters
2011-05-00
[70]
논문
Macromolecular crowding: obvious but underappreciated
2001-10-00
[71]
논문
Fractal reaction kinetics
1988-09-01
[72]
서적
Fundamentals of Enzyme Kinetics
Portland Press
2004-01-01
[73]
논문
What is meant by 'competitive inhibition'?
[74]
논문
The molecular perspective: methotrexate
1999-08-01
[75]
논문
Allosteric small-molecule kinase inhibitors
https://backend.orbi[...]
2015-12-01
[76]
논문
Why is uncompetitive inhibition so rare? A possible explanation, with implications for the design of drugs and pesticides
1986-07-01
[77]
논문
A Perspective on the Kinetics of Covalent and Irreversible Inhibition
2017-01-01
[78]
논문
Bacterial resistance to beta-lactam antibiotics: compelling opportunism, compelling opportunity
2005-02-01
[79]
논문
Strategies for discovering and derisking covalent, irreversible enzyme inhibitors
2010-06-01
[80]
논문
The discovery and development of HMG-CoA reductase inhibitors
1992-11-01
[81]
논문
Inhibitors of HIV-1 protease: a major success of structure-assisted drug design
1998-01-01
[82]
논문
Infrared evidence of cyanide binding to iron and copper sites in bovine heart cytochrome c oxidase. Implications regarding oxygen reduction
1990-05-01
[83]
서적
Fundamentals of biochemistry
S. Chand and Co
1999-05-01
[84]
논문
Protein kinases and phosphatases: the yin and yang of protein phosphorylation and signaling
1995-01-01
[85]
논문
A millennial myosin census
2001-04-01
[86]
논문
Molecular biology of bacterial bioluminescence
1991-03-01
[87]
논문
Highlights in the development of new antiviral agents
2002-04-01
[88]
논문
Recent advances in rumen microbial ecology and metabolism: potential impact on nutrient output
1990-10-01
[89]
논문
Cyclooxygenases: structural and functional insights
2009-04-01
[90]
서적
How Enzymes Work: From Structure to Function
CRC Press
[91]
논문
GSK-3: tricks of the trade for a multi-tasking kinase
2003-04-01
[92]
논문
Molecular basis of beta-lactamase induction in bacteria
1993-02-01
[93]
서적
Introduction to Drug Metabolism
Nelson Thornes Publishers
2001-01-01
[94]
논문
Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling
1997-04-01
[95]
서적
How Enzymes Work: From Structure to Function
CRC Press
[96]
논문
Identification of novel filament-forming proteins in Saccharomyces cerevisiae and Drosophila melanogaster
2010-08-01
[97]
논문
Metabolic regulation via enzyme filamentation
2015-01-01
[98]
논문
Structural basis for allosteric regulation of the monomeric allosteric enzyme human glucokinase
2004-03-01
[99]
논문
Familial hyperglycemia due to mutations in glucokinase. Definition of a subtype of diabetes mellitus
1993-03-01
[100]
논문
Tay-Sachs disease: generalized absence of a beta-D-N-acetylhexosaminidase component
1969-08-01
[101]
웹사이트
Learning About Tay–Sachs Disease
http://www.genome.go[...]
U.S. National Human Genome Research Institute
2015-03-01
[102]
논문
The structural basis of phenylketonuria
1999-10-01
[103]
논문
Structural Insight into the Aromatic Amino Acid Hydroxylases and Their Disease-Related Mutant Forms
1999-08-01
[104]
서적
Genes and Disease [Internet]
National Center for Biotechnology Information (US)
[105]
웹사이트
Pseudocholinesterase deficiency
http://ghr.nlm.nih.g[...]
U.S. National Library of Medicine
2013-09-05
[106]
논문
Enzyme replacement therapy for pancreatic insufficiency: present and future
2011
[107]
논문
Lactose malabsorption and intolerance: pathogenesis, diagnosis and treatment
2013-06-00
[108]
논문
Defective repair replication of DNA in xeroderma pigmentosum
1968-05-00
[109]
서적
Andrews' Diseases of the Skin: Clinical Dermatology
Saunders/ Elsevier
2011
[110]
논문
Can homologous proteins evolve different enzymatic activities?
1993-11-00
[111]
논문
Evolution, dynamics and dysregulation of kinase signalling
2018-02-00
[112]
논문
Rational design of thermally stable proteins: relevance to bionanotechnology
2005-11-00
[113]
논문
Engineered enzymes for improved organic synthesis
2003-08-00
[114]
논문
De novo computational design of retro-aldol enzymes
2008-03-00
[115]
논문
Hydrolysis of lignocellulosic materials for ethanol production: a review
2002-05-00
[116]
논문
Industrial enzyme applications
2002-08-00
[117]
서적
Malts and Malting
Blackie Academic
1998
[118]
논문
Improved performances and control of beer fermentation using encapsulated alpha-acetolactate decarboxylase and modeling
[119]
서적
Ingredients in Meat Products Properties, Functionality and Applications
Springer
2008
[120]
웹사이트
Chymosin – GMO Database
http://www.gmo-compa[...]
European Union
2010-07-10
[121]
논문
Review: Compounds Involved in the Flavor of Surface Mold-Ripened Cheeses: Origins and Properties
1996-02-00
[122]
논문
Amylolytic enzymes and products derived from starch: a review
1995-09-00
[123]
웹사이트
Protease – GMO Database
http://www.gmo-compa[...]
European Union
2010-07-10
[124]
논문
Industrial applications of pectic enzymes: a review
1998-01-00
[125]
논문
Application of enzymes in the pulp and paper industry
1999-03-00
[126]
논문
An analysis of contact lens enzyme cleaners
1990-03-00
[127]
서적
Starch Chemistry and Technology
Academic
2009
[128]
논문
Bio-Zombie: the rise of pseudoenzymes in biology
[129]
논문
A robust methodology to subclassify pseudokinases based on their nucleotide-binding properties
[130]
논문
Enzymes Application in Diagnostic Prospects
[131]
논문
Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels
https://books.google[...]
[132]
웹사이트
Theodor Schwann
http://www.britannic[...]
2007
[133]
웹사이트
enzyme
http://www.etymonlin[...]
[134]
논문
Über das Verhalten verschiedener organisirter und sog. ungeformter Fermente
https://books.google[...]
[135]
서적
酵素
日立デジタル平凡社
1998
[136]
논문
Einfluss der Configuration auf die Wirkung der Enzyme
http://gallica.bnf.f[...]
[137]
웹사이트
1946 Nobel prize for Chemistry laureates
https://www.nobelpri[...]
[138]
웹사이트
The Nobel Prize in Chemistry 1946
https://www.nobelpri[...]
NobelPrize.org
2018-11-04
[139]
웹사이트
1989 Nobel prize for Chemistry laureates
https://www.nobelpri[...]
[140]
논문
Enzyme dynamics during catalysis
[141]
논문
Role of protein dynamics in reaction rate enhancement by enzymes.
[142]
논문
Intrinsic dynamics of an enzyme underlies catalysis
[143]
논문
Entropy and Enzyme Catalysis
[144]
논문
Application of a Theory of Enzyme Specificity to Protein Synthesis
[145]
서적
新生化学ガイドブック
南江堂
[146]
논문
Selenium as a Component of Glutathione Peroxidase Isolated from Ovine Erythrocytest
http://pubs.acs.org/[...]
[147]
서적
理化学辞典
岩波書店
[148]
서적
レーニンジャーの新生化学[上]
廣川書店
[149]
웹사이트
Molecule of the Month
[150]
간행물
[151]
서적
新生化学ガイドブック
南江堂
[152]
서적
理化学辞典
岩波書店
[153]
서적
味噌
農山漁村文化協会
[154]
논문
The role of enzyme supplementation in digestive disorders
https://altmedrev.co[...]
2008-12
[155]
웹사이트
タカヂアスターゼ
https://www.pharm.or[...]
[156]
웹사이트
消化酵素製剤解説 処方薬辞典
https://medical.nikk[...]
日経メディカル
2018-07-26
[157]
논문
膵頭部癌術後の消化吸収障害に対する高力価・腸溶性膵消化酵素剤投与の有用性についての検討
https://doi.org/10.2[...]
2013-04-25
[158]
논문
慢性膵炎の栄養療法
https://doi.org/10.1[...]
2007-12-05
[159]
논문
Use and effectiveness of papain in the wound healing process: a systematic review
https://doi.org/10.1[...]
2012-09
[160]
웹사이트
Risk Assessments
https://www.heraproj[...]
HERA
2018-11-04
[161]
서적
酵素の化学
朝倉書店
[162]
서적
高機能バイオセンサー
化学工業日報社
[163]
서적
ゲノム 新しい生命情報システムへのアプローチ
メディカル・サイエンス・インターナショナル
[164]
논문
Possivble involvement of Escherichia coli 23S ribosomal RNA in peptide bond formation
[165]
논문
Reconstitution of peptide bond formation with Escherichia coli 23S ribosomal RNA domains
[166]
논문
Ribozymes: structure and mechanism in RNA catalysis
[167]
논문
The evolution of chromosomes. II. Molecular mechanisms
[168]
논문
Proteins, RNAs and chaperones in enzyme evolution: a folding perspective
[169]
논문
Old enzymes, new tricks
[170]
서적
Biochemistry Chapter10 Regulatory Strategies: Enzymes and Hemoglobin P403L1
W.H.FREEMAN&COMPANY
[171]
서적
Biochemistry
https://www.ncbi.nlm[...]
W.H. Freeman
[172]
논문
Bio-Zombie: the rise of pseudoenzymes in biology
[173]
논문
A robust methodology to subclassify pseudokinases based on their nucleotide-binding properties
[174]
논문
BRENDA in 2013: integrated reactions, kinetic data, enzyme function data, improved disease classification: new options and contents in BRENDA
2013-01
[175]
논문
A proficient enzyme
1995-01
[176]
저널
OMP decarboxylase—An enigma persists
2007-12-01
[177]
저널
Observations sur la digestion des oiseaux
[178]
서적
A History of Science: in Five Volumes''. ''Volume IV: Modern Development of the Chemical and Biological Sciences
http://etext.lib.vir[...]
Harper and Brothers
[179]
저널
Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels
https://books.google[...]
[180]
저널
Louis Pasteur (1822–1895)–chance and the prepared mind
1995-12-01
[181]
저널
Über das Verhalten verschiedener organisirter und sog. ungeformter Fermente
https://books.google[...]
[182]
서적
The Oxford Companion to the History of Modern Science
Oxford University Press
[183]
웹인용
Eduard Buchner
http://nobelprize.or[...]
Nobelprize.org
2015-02-23
[184]
웹인용
Eduard Buchner – Nobel Lecture: Cell-Free Fermentation
http://nobelprize.or[...]
2015-02-23
[185]
서적
Traité de microbiologie: Diastases, toxines et venins
https://books.google[...]
Masson and Co
[186]
저널
Faraday lecture. Problems and methods in enzyme research
1927
[186]
저널
So do we understand how enzymes work?
http://cmgm3.stanfor[...]
2019-09-19
[187]
웹인용
Nobel Prizes and Laureates: The Nobel Prize in Chemistry 1946
http://nobelprize.or[...]
2015-02-23
[188]
저널
Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Ångström resolution
1965-05-01
[189]
저널
David Phillips and the origin of structural enzymology
[190]
웹인용
Classification and Nomenclature of Enzymes by the Reactions they Catalyse
http://www.chem.qmul[...]
School of Biological and Chemical Sciences, Queen Mary, University of London
2015-03-06
[191]
웹인용
EC 2.7.1.1
http://www.chem.qmul[...]
School of Biological and Chemical Sciences, Queen Mary, University of London
2015-03-06
[192]
저널
Principles that govern the folding of protein chains
1973-07-01
[193]
저널
Enzyme function discovery
2008-11-01
[194]
서적
Protein structure and function
New Science
2003
[195]
저널
4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer
1992-09-01
[196]
저널
The animal fatty acid synthase: one gene, one polypeptide, seven enzymes
1994-12-01
[197]
웹인용
The Catalytic Site Atlas
http://www.ebi.ac.uk[...]
The European Bioinformatics Institute
2007-04-04
[198]
서적
How Enzymes Work: From Structure to Function
CRC Press
[199]
서적
Biochemistry of Signal Transduction and Regulation
Wiley-VCH
2003
[200]
저널
Enantioselective biocatalysis optimized by directed evolution
2004-08-01
[201]
저널
The 3' 5' exonucleases
2002-05-01
[202]
저널
Transcript-assisted transcriptional proofreading
2006-07-01
[203]
저널
Aminoacyl-tRNA synthesis
[204]
저널
Fidelity of aminoacyl-tRNA selection on the ribosome: kinetic and structural mechanisms
[205]
저널
Enzyme promiscuity: a mechanistic and evolutionary perspective
[206]
저널
Catalytic promiscuity and the evolution of new enzymatic activities
1999-04-01
[207]
저널
Einfluss der Configuration auf die Wirkung der Enzyme
http://gallica.bnf.f[...]
[208]
서적
The Cell: a Molecular Approach
ASM Press
2000
[209]
저널
Application of a Theory of Enzyme Specificity to Protein Synthesis
1958-02-01
[210]
저널
Glycosidase mechanisms
2002-10-01
[211]
서적
Concepts in Biochemistry
https://archive.org/[...]
John Wiley & Sons, Inc.
[212]
저널
Conformational proofreading: the impact of conformational changes on the specificity of molecular recognition
http://www.weizmann.[...]
2010-08-22
[213]
서적
Enzyme Structure and Mechanism
W.H. Freeman
[214]
저널
Electrostatic basis for enzyme catalysis
2006-08-00
[215]
서적
Lehninger Principles of Biochemistry
https://archive.org/[...]
W.H. Freeman
2013-00-00
[216]
저널
A perspective on enzyme catalysis
2003-08-00
[217]
서적
Catalysis in Chemistry and Enzymology
Dover
[218]
저널
How important are entropic contributions to enzyme catalysis?
2000-10-00
[219]
저널
The catalytic triad of serine peptidases
2005-07-07
[220]
저널
Protein conformational populations and functionally relevant substates
[221]
저널
Protein allostery, signal transmission and dynamics: a classification scheme of allosteric mechanisms
http://orbilu.uni.lu[...]
2019-09-19
[222]
저널
Allosteric mechanisms of signal transduction
2005-06-00
[223]
웹사이트
Glossary of Terms Used in Bioinorganic Chemistry: Cofactor
http://www.chem.qmul[...]
International Union of Pure and Applied Chemistry
2007-10-30
[224]
서적
Fundamentals of Biochemistry
https://archive.org/[...]
John Wiley & Sons, Inc.
[225]
저널
The enzymatic biotinylation of proteins: a post-translational modification of exceptional specificity
[226]
저널
Structural and kinetic characterization of active-site histidine as a proton shuttle in catalysis by human carbonic anhydrase II
2005-02-00
[227]
서적
Vitamins and Coenzymes
https://archive.org/[...]
Krieger Pub Co
[228]
웹사이트
BRENDA The Comprehensive Enzyme Information System
http://www.brenda-en[...]
Technische Universität Braunschweig
2015-02-23
[229]
저널
Characterization of Biomimetic Cofactors According to Stability, Redox Potentials, and Enzymatic Conversion by NADH Oxidase from Lactobacillus pentosus
https://chemistry-eu[...]
2017-10-05
[230]
저널
Opening and closing the metabolite gate
2008-12-00
[231]
서적
Essentials of Exercise Physiology
Lippincott Williams & Wilkins
2006-00-00
[232]
서적
Bioenergetics 3
https://archive.org/[...]
Academic
[233]
서적
Lehninger principles of biochemistry 4th
W. H. Freeman
[234]
서적
Lehninger principles of biochemistry 4th
W. H. Freeman
[235]
서적
상게서
[236]
서적
Lehninger principles of biochemistry 4th
W. H. Freeman
[237]
서적
상게서
[238]
서적
Enzyme kinetics : principles and methods
[239]
저널
Die Kinetik der Invertinwirkung
[239]
저널
The original Michaelis constant: translation of the 1913 Michaelis-Menten paper
[240]
저널
A Note on the Kinetics of Enzyme Action
[241]
저널
The moderately efficient enzyme: evolutionary and physicochemical trends shaping enzyme parameters
[242]
저널
Macromolecular crowding: obvious but underappreciated
2001-10-00
[243]
저널
Fractal reaction kinetics
1988-09-00
[244]
저널
The Molecular Perspective: Methotrexate
http://theoncologist[...]
2019-09-19
[245]
서적
Fundamentals of Enzyme Kinetics
Portland Press
2004-00-00
[246]
저널
What is meant by 'competitive inhibition'?
[247]
저널
The Molecular Perspective: Methotrexate
http://theoncologist[...]
2019-09-19
[248]
저널
Allosteric small-molecule kinase inhibitors
http://orbit.dtu.dk/[...]
2015-12-01
[249]
저널
Why is uncompetitive inhibition so rare? A possible explanation, with implications for the design of drugs and pesticides
1986-07-01
[250]
저널
A Perspective on the Kinetics of Covalent and Irreversible Inhibition
2017-01-01
[251]
저널
Bacterial resistance to beta-lactam antibiotics: compelling opportunism, compelling opportunity
2005-02-01
[252]
저널
Strategies for discovering and derisking covalent, irreversible enzyme inhibitors
2010-06-01
[253]
저널
The discovery and development of HMG-CoA reductase inhibitors
http://www.jlr.org/c[...]
2019-09-19
[254]
저널
Inhibitors of HIV-1 protease: a major success of structure-assisted drug design
1998-01-01
[255]
저널
Infrared evidence of cyanide binding to iron and copper sites in bovine heart cytochrome c oxidase. Implications regarding oxygen reduction
1990-05-01
[256]
저널
Protein kinases and phosphatases: the yin and yang of protein phosphorylation and signaling
1995-01-01
[257]
저널
A millennial myosin census
2001-04-01
[258]
저널
Molecular biology of bacterial bioluminescence
1991-03-01
[259]
저널
Highlights in the development of new antiviral agents
[260]
저널
Recent advances in rumen microbial ecology and metabolism: potential impact on nutrient output
1990-10-01
[261]
저널
Cyclooxygenases: structural and functional insights
[262]
서적
How Enzymes Work: From Structure to Function
CRC Press
[263]
저널
GSK-3: tricks of the trade for a multi-tasking kinase
2003-04-01
[264]
저널
Molecular basis of beta-lactamase induction in bacteria
[265]
서적
Introduction to Drug Metabolism
https://archive.org/[...]
Nelson Thornes Publishers
2001-01-01
[266]
저널
Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling
1997-04-01
[267]
서적
How Enzymes Work: From Structure to Function
CRC Press
[268]
저널
Identification of novel filament-forming proteins in Saccharomyces cerevisiae and Drosophila melanogaster
2010-08-01
[269]
저널
Metabolic regulation via enzyme filamentation
2015-01-01
[270]
저널
Structural basis for allosteric regulation of the monomeric allosteric enzyme human glucokinase
2004-03-01
[271]
저널
Familial hyperglycemia due to mutations in glucokinase. Definition of a subtype of diabetes mellitus
1993-03-01
[272]
저널
Tay–Sachs disease: generalized absence of a beta-D-N-acetylhexosaminidase component
1969-08-01
[273]
웹인용
Learning About Tay–Sachs Disease
http://www.genome.go[...]
U.S. National Human Genome Research Institute
2015-03-01
[274]
저널
The structural basis of phenylketonuria
1999-10-01
[275]
저널
Structural Insight into the Aromatic Amino Acid Hydroxylases and Their Disease-Related Mutant Forms
1999-08-01
[276]
서적
Genes and Disease [Internet]
National Center for Biotechnology Information (US)
[277]
웹인용
Pseudocholinesterase deficiency
http://ghr.nlm.nih.g[...]
U.S. National Library of Medicine
2013-09-05
[278]
저널
Enzyme replacement therapy for pancreatic insufficiency: present and future
2011-01-01
[279]
저널
Lactose malabsorption and intolerance: pathogenesis, diagnosis and treatment
2013-06-01
[280]
저널
Defective repair replication of DNA in xeroderma pigmentosum
1968-05-01
[281]
서적
Andrews' Diseases of the Skin: Clinical Dermatology
Saunders/ Elsevier
2011
[282]
저널
Rational design of thermally stable proteins: relevance to bionanotechnology
2005-11-00
[283]
저널
Engineered enzymes for improved organic synthesis
2003-08-00
[284]
저널
De novo computational design of retro-aldol enzymes
2008-03-00
[285]
저널
Hydrolysis of lignocellulosic materials for ethanol production: a review
2002-05-00
[286]
저널
Industrial enzyme applications
2002-08-00
[287]
서적
Malts and Malting
https://archive.org/[...]
Blackie Academic
1998
[288]
저널
Improved performances and control of beer fermentation using encapsulated alpha-acetolactate decarboxylase and modeling
[289]
서적
Ingredients in Meat Products Properties, Functionality and Applications
Springer
2008
[290]
웹사이트
Chymosin – GMO Database
http://www.gmo-compa[...]
European Union
2010-07-10
[291]
저널
Review: Compounds Involved in the Flavor of Surface Mold-Ripened Cheeses: Origins and Properties
1996-02-00
[292]
저널
Amylolytic enzymes and products derived from starch: a review
1995-09-00
[293]
웹사이트
Protease – GMO Database
http://www.gmo-compa[...]
European Union
2010-07-10
[294]
저널
Industrial applications of pectic enzymes: a review
1998-01-00
[295]
저널
Application of enzymes in the pulp and paper industry
1999-03-00
[296]
저널
An analysis of contact lens enzyme cleaners
1990-03-00
[297]
서적
Starch Chemistry and Technology
Academic
2009
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com


