황산 니켈
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
황산 니켈은 황산에 니켈, 산화 니켈, 탄산 니켈 등을 녹여 제조하며, 니켈의 전기도금, 니켈 기반 촉매 및 안료의 전구체로 사용된다. 육수화물, 칠수화물, 일수화물 등 다양한 수화물 형태가 존재하며, 가열 시 분해되어 삼산화 황과 산화 니켈(II)를 생성한다. 피부 첩포 검사에서 흔한 알레르겐이며, 호흡기 암 위험을 증가시킬 수 있어 인체 발암 물질로 분류된다.
더 읽어볼만한 페이지
- 니켈 화합물 - 염화 니켈(II)
염화 니켈(II)는 화학식 NiCl₂를 갖는 니켈과 염소의 화합물로 니켈의 중요한 염 중 하나이며, 배위 착물 형성에 사용되고 유기 합성에서 환원, 커플링 반응, 루이스 산 촉매 등으로 활용되지만, 섭취, 흡입, 피부 접촉 시 자극을 유발하고 장기간 노출 시 암 위험을 증가시키므로 주의가 필요하다. - 니켈 화합물 - 보조 인자 F430
보조 인자 F430은 메탄 생성 박테리아 내 니켈 함유 효소로서 메탄 생성 과정에서 메틸 그룹 전달 및 활성화에 중요한 역할을 하며, 콜핀 고리를 통해 니켈 이온과 결합하여 메틸-조효소 M 환원 효소의 활성 부위에서 작용하고, 메탄 생성 억제 및 친환경 에너지 기술 개발 분야에서 연구되고 있다. - 황산염 - 황산 칼슘
황산 칼슘은 칼슘의 황산염으로 수화 정도에 따라 다양한 결정 구조를 가지며 건설, 식품, 치의학 등 여러 산업 분야에서 활용되는 광물이다. - 황산염 - 황산 나트륨
황산 나트륨은 다양한 형태의 이온성 황산염으로, 자연에서 광물로 산출되거나 화학적 공정의 부산물로 얻어지며, 제지, 유리, 섬유 산업 등에서 활용되고, 특히 십수화물은 글라우버염으로 불리며 완하제나 한약재로도 사용된다. - IARC 1군 발암 물질 - 토륨
토륨은 은백색의 방사성 악티늄족 금속 원소로, 높은 녹는점과 끓는점을 가지며 지구 지각에 풍부하게 존재하고 핵연료로서의 잠재력을 지니지만, 방사능으로 인해 사용이 감소하고 있다. - IARC 1군 발암 물질 - 황화 카드뮴
황화 카드뮴은 카드뮴 염을 황 이온으로 침전시켜 제조하며, 반도체, 안료 등으로 사용되지만 독성이 있어 흡입 시 위험하고 발암 물질로 분류된다.
| 황산 니켈 - [화학 물질]에 관한 문서 | |
|---|---|
| 기본 정보 | |
 | |
 | |
 | |
| IUPAC 명칭 | 황산 니켈(II) |
| 다른 이름 | 아황산 니켈 황산 니켈(II) |
| 식별 | |
| ChemSpider ID | 22989 |
| PubChem CID | 24586 |
| UNII | 4FLT4T3WUN (무수물) JC9WZ4FK68 (육수화물) 596IDD57NR (칠수화물) |
| InChI | 1/Ni.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
| InChIKey | LGQLOGILCSXPEA-NUQVWONBAG |
| ChEBI | 53001 |
| SMILES | "[Ni+2].[O-]S([O-])(=O)=O" (무수물) "[OH2+][Ni-4]([OH2+])([OH2+])([OH2+])([OH2+])[OH2+].[O-]S(=O)(=O)[O-]" (육수화물) |
| 표준 InChI | 1S/Ni.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
| 표준 InChIKey | LGQLOGILCSXPEA-UHFFFAOYSA-L |
| CAS 등록번호 | 7786-81-4 (무수물) 10101-97-0 (육수화물) 10101-98-1 (칠수화물) |
| EINECS | 232-104-9 |
| RTECS | QR9600000 |
| 성질 | |
| 화학식 | NiSO4 |
| 몰 질량 | 154.75 g/mol (무수물) 262.85 g/mol (육수화물) 280.86 g/mol (칠수화물) |
| 외형 | 노란색-녹색 고체 (무수물) 청록색 결정 (육수화물) 청록색 결정 (칠수화물) |
| 냄새 | 무취 |
| 밀도 | 4.01 g/cm3 (무수물) 2.07 g/cm3 (육수화물) 1.948 g/cm3 (칠수화물) |
| 용해도 | 65 g/100 mL (20 °C) 77.5 g/100 mL (30 °C) (칠수화물) |
| 용해성 (기타) | 무수물 육수화물 칠수화물 |
| 녹는점 | 1210 °C (무수물, 고압에서) 53 °C (육수화물) |
| 끓는점 | 640 °C 이상 (무수물, 분해) 100 °C (육수화물, 분해) |
| 굴절률 | 1.511 (육수화물) 1.467 (칠수화물) |
| pKa | 4.5 (육수화물) |
| 자기 감수율 | +4005.0·10−6 cm3/mol |
| 구조 | |
| 결정 구조 | 사방정계 (무수물) 정방정계 (육수화물) 능면체 (칠수화물) |
| 위험성 | |
| 외부 MSDS | 외부 MSDS |
| GHS 그림 문자 | |
| GHS 신호어 | 위험 |
| H 문구 | H302+H332, H315, H317, H334, H341, H350, H360D, H372, H410 |
| P 문구 | P201, P261, P273, P280, P308+313, P501 |
| NFPA 704 | NFPA-H: 3 NFPA-F: 0 NFPA-R: 0 |
| 인화점 | 불연성 |
| LD50 | 264 mg/kg |
| 유럽 연합 지침 (EU 지침) | EU 색인: 028-009-00-5 EU 분류: Carc. Cat. 1, Muta. Cat. 3, Repr. Cat. 2, 유독 (T), 유해 (Xn), 자극성 (Xi), 환경에 위험 (N) |
| R 문구 | R49, R61, R20/22, R38, R42/43, R48/23, R68, R50/53 |
| S 문구 | S53, S45, S60, S61 |
| 관련 화합물 | |
| 다른 양이온 | 황산 코발트(II) 황산 구리(II) 황산 철(II) |
2. 제법
황산 니켈은 황산에 니켈, 산화 니켈, 탄산 니켈 등을 녹여 제조하며, 연간 1만 톤이 생산된다. 황산 니켈은 일반적으로 구리 정련의 부산물로 얻어지며, 황산에 니켈 금속 또는 니켈 산화물을 용해하여 생산할 수도 있다.
니켈(II)의 황산염은 최소 7가지가 알려져 있다. 이 염들은 수화물 또는 결정 습성 면에서 서로 다르다.
니켈 전기도금에 사용된다.[6] 생화학 및 분자 생물학에서 폴리히스티딘 태그에 사용되는 컬럼을 재생하는 데에도 쓰인다.
황산 니켈은 희귀 광물인 레트게르사이트[7]로 자연적으로 발생하며, 이는 육수화물이다. 두 번째 육수화물은 니켈헥사하이드라이트로 알려져 있으며, 이는 레트게르사이트의 단사정형 동질이상이다. 공기 중에서 비교적 불안정한 칠수화물은 모레노사이트로 자연적으로 발생한다. 일수화물은 매우 희귀한 광물인 드보르니키트로 자연적으로 발생한다.
[1]
서적
Nickel Compounds
Wiley-VCH, Weinheim
2005
황산 니켈 수용액은 탄산 나트륨과 반응하여 탄산 니켈을 침전시키는데, 이는 니켈 기반 촉매 및 안료의 전구체이다.[6] 황산 니켈 농축 수용액에 황산 암모늄을 첨가하면 Ni(NH4)2(SO4)2*6H2O영어가 침전된다. 이 파란색 고체는 모어 염(Fe(NH4)2(SO4)2*6H2O영어)과 유사하다.[1]
3. 구조
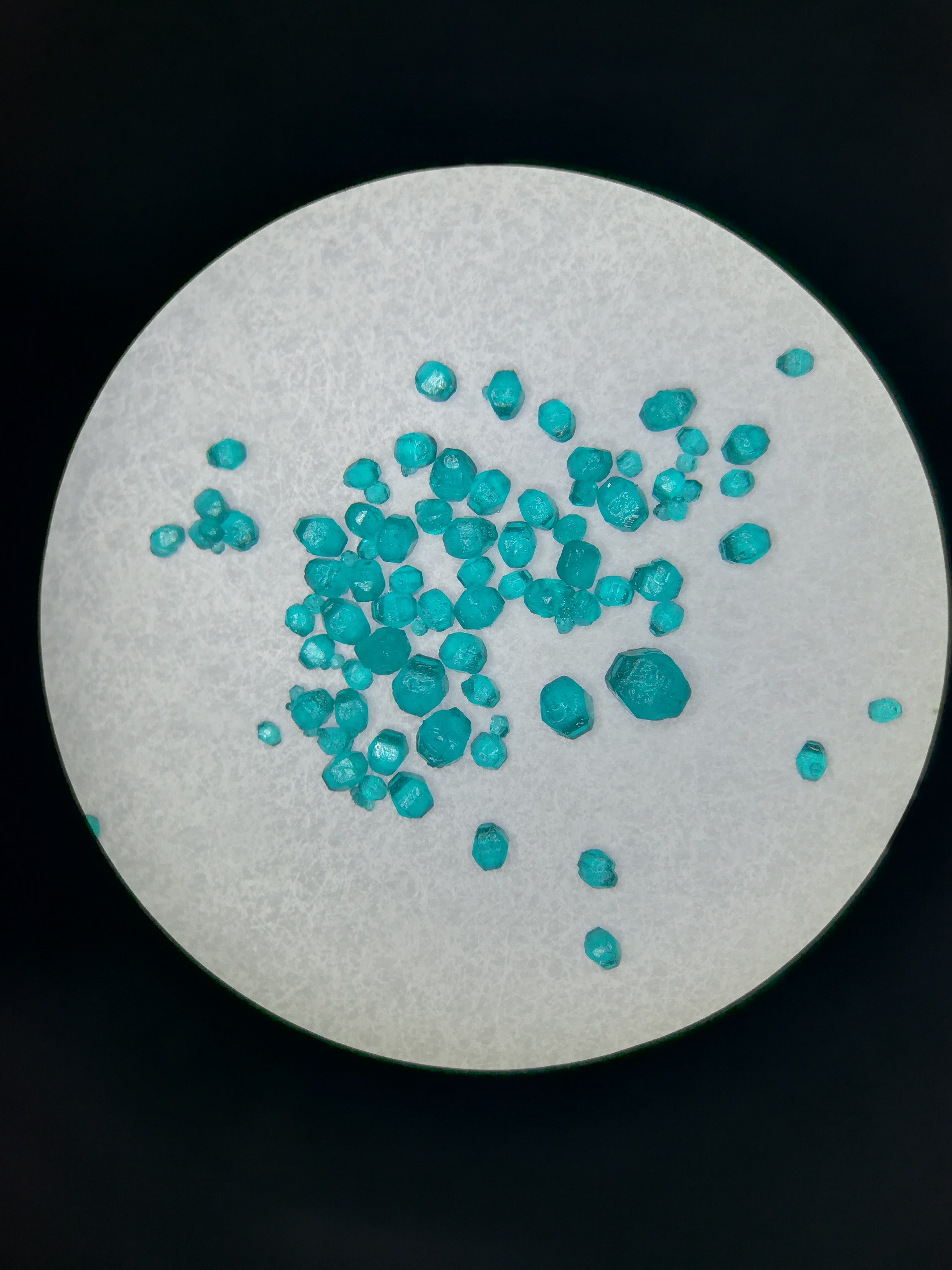
니켈(II)의 황산염은 최소 7가지가 알려져 있다. 이 염들은 수화물 또는 결정 습성 면에서 서로 다르다.
흔한 정방정계 육수화물은 30.7°C~53.8°C 사이의 수용액에서 결정화된다. 이 온도 이하에서는 7수화물이 결정화되고, 이 온도 이상에서는 사방정계 육수화물이 형성된다. 노란색 무수 형태인 NiSO4는 사방정계 결정계에서 결정화되며[2], 표준 압력에서 640°C 이상의 온도에서 NiO로 분해되며, 녹는점에 도달하기 전이다.[3] 높은 시스템 압력에서만 녹으며, 일정한 부피 방식을 사용하여 녹는점은 1210°C로 밝혀졌다.[4] 무수 황산염은 330°C 이상에서 수화물을 가열하여 생성된다.
X선 결정학 측정 결과 NiSO4·6H2O는 팔면체 Ni(H2O)6|Ni(H2O)6영어2+ 이온으로 구성되어 있는 것으로 나타났다. 이 이온들은 다시 황산 이온과 수소 결합을 한다.[5] 염을 물에 용해시키면 아쿠오 착물 Ni(H2O)6|Ni(H2O)6영어2+을 포함하는 용액이 생성된다.
모든 황산 니켈은 상자성이다.
4. 성질 및 반응
흔한 정방정계 육수화물은 30.7°C~53.8°C 사이의 수용액에서 결정화된다. 이 온도 이하에서는 7수화물이 결정화되고, 이 온도 이상에서는 사방정계 육수화물이 형성된다. 노란색 무수 형태인 NiSO4는 사방정계 결정계에서 결정화되며[2], 표준 압력에서 640°C 이상의 온도에서 NiO로 분해되며, 녹는점에 도달하기 전이다.[3] 높은 시스템 압력에서만 녹으며, 일정한 부피 방식을 사용하여 녹는점은 1210°C로 밝혀졌다.[4] 무수 황산염은 330°C 이상에서 수화물을 가열하여 생성된다.
X선 결정학 측정 결과 NiSO4·6H2O는 팔면체 Ni(HO)영어 이온으로 구성되어 있는 것으로 나타났다. 이 이온들은 다시 황산 이온과 수소 결합을 한다.[5] 염을 물에 용해시키면 아쿠오 착물 Ni(HO)을 포함하는 용액이 생성된다.
모든 황산 니켈은 상자성이다.
황산 니켈은 탄산 니켈을 침전시키는데, 이는 니켈 기반 촉매 및 안료의 전구체이다.[6] 황산 니켈의 농축 수용액에 황산 암모늄을 첨가하면 Ni(NH)(SO)*6HO 가 침전된다. 이 파란색 고체는 모어 염인 Fe(NH)(SO)*6HO 와 유사하다.[1]
NiSO4·6H2O 및 관련 수화물의 수용액은 암모니아와 반응하여 [Ni(NH)]SO 를 생성하고, 에틸렌디아민과 반응하여 착물 [Ni(HNCHCHNH)]SO 를 생성한다.
가열하면 분해되어 삼산화 황과 산화 니켈(II)를 생성한다.
:
5. 용도
6. 천연 존재
7. 안전성
2005~2006년, 황산 니켈은 피부첩포검사에서 가장 흔한 알레르겐이었다(19.0%).[8] 황산 니켈은 광석 제련소 작업자에 대한 역학 연구에서 호흡기 암 위험 증가가 관찰되어 인체 발암 물질로 분류된다.[9][10] F344 쥐와 B6C3F1 생쥐를 대상으로 한 2년간의 흡입 연구에서는 발암 활성의 증거는 없었지만, 폐 염증과 기관지 림프절 과형성이 관찰되었다.[12] 이러한 결과는 흡입을 통한 황산 니켈의 발암성에 대한 역치가 있음을 강력하게 시사한다. F344 쥐에게 황산 니켈 육수화물을 매일 경구 투여하는 2년간의 연구에서는 발암 활성 증가의 증거가 관찰되지 않았다.[13] 인간과 동물 데이터는 경구 노출 경로를 통한 발암성의 부재를 일관되게 나타내며, 니켈 화합물의 발암성을 흡입 후 호흡기 종양으로 제한한다.[14] 이러한 영향이 인간에게 관련이 있는지 여부는 불분명하며, 노출이 심한 여성 근로자에 대한 역학 연구에서는 유해한 발달 독성 영향이 나타나지 않았다.[15]
참조
[2]
논문
Morphology and structure of anhydrous nickel sulphate
https://scripts.iucr[...]
1957-04-10
[3]
논문
Thermal decomposition temperatures of metal sulfates
https://linkinghub.e[...]
1984-10
[4]
논문
Experimental studies on NiSO4 by thermal analysis and calorimetry
https://linkinghub.e[...]
2014-06
[5]
서적
Structural Inorganic Chemistry
Oxford: Clarendon Press
1984
[6]
간행물
Catalysts
AOCS Press, Urbana
1994
[7]
웹사이트
Retgersite
https://www.mindat.o[...]
[8]
논문
Patch-test results of the North American Contact Dermatitis Group 2005–2006
2009-05
[9]
간행물
Nickel and nickel compounds
2012
[10]
간행물
Report on Carcinogens
https://ntp.niehs.ni[...]
U.S. Department of Health and Human Services, Public Health Service
2016
[11]
간행물
Report of the International Committee on Nickel Carcinogenesis in Man
1990
[12]
간행물
Toxicology and Carcinogenesis Studies of Nickel Sulfate Hexahydrate (CAS NO. 10101-97-0) in F344/N Rats and B6CF1 Mice (Inhalation Studies)
US DHHS
1996
[13]
논문
Oral Carcinogenicity Study with Nickel Sulfate Hexahydrate in Fischer 344 Rats.
2007
[14]
논문
Preventable Exposures Associated With Human Cancers
2011
[15]
논문
Spontaneous abortions among nickel-exposed female refinery workers.
2008
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com