생화학
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
생화학은 생물체의 구성 요소, 구성 체제, 그리고 이들이 어떻게 결합하여 생물체가 되는지를 연구하는 학문이다. 19세기 또는 그 이전부터 시작되었으며, 효소, 발효, 물질대사에 대한 연구를 통해 발전했다. 주요 연구 분야로는 생체분자(탄수화물, 지질, 단백질, 핵산), 물질대사, 생화학 연구 방법 등이 있다. 생화학은 유전학, 분자생물학, 생물물리학 등 다른 분자 규모의 생물학과 밀접한 관련을 맺고 있으며, 생명 현상에 대한 이해를 높이는 데 기여하고 있다.
더 읽어볼만한 페이지
- 생물학에 관한 - 해부학
해부학은 생물체의 구조와 구성 요소를 연구하는 학문으로, 육안 해부학과 현미경 해부학으로 나뉘며, 인체 해부학 외에도 동물, 식물, 미술 해부학 등 다양한 분야가 존재한다. - 생물학에 관한 - 죽음
죽음은 생명 활동의 영구적 종식으로 의학, 법, 사회, 종교, 심리, 생물학 등 다양한 관점에서 해석되며, 전통적인 심폐사 외에 뇌사도 죽음으로 인정되고, 개발도상국은 전염병, 선진국은 노화 관련 질병이 주요 사망 원인이며, 문화와 종교에 따라 다양한 이해와 관습이 존재하고, 수명 연장, 냉동 보존술, 존엄사, 안락사 등에 대한 논의가 이루어지고 있다. - 생명공학 - 사이보그
사이보그는 인공 부위를 이식받아 신체 기능이 복원되거나 향상된 개조 생명체로, 보철, 인공 장기 등의 기술을 포함하며 의료, 윤리, 군사적 측면에서 다양한 논의를 낳고 있다. - 생명공학 - CRISPR
CRISPR은 세균과 고세균이 외래 유전 물질로부터 자신을 방어하는 적응 면역 시스템으로, CRISPR-Cas9 시스템은 유전자 편집 기술로 발전하여 노벨 화학상을 수상했으며, 유전 질환 치료, 농업 등 다양한 분야에 활용될 잠재력을 지닌다. - 분자생물학 - 단백질
단백질은 아미노산 중합체로 생체 구조 유지와 기능에 필수적이며, 아미노산 서열에 따라 고유한 3차원 구조를 형성하여 효소, 구조, 수송, 저장, 수축, 방어, 조절 단백질 등 다양한 기능을 수행하고, 인체 내에서 건강 유지와 질병 예방에 중요한 역할을 하는 필수 영양소이다. - 분자생물학 - 의학
의학은 질병의 진단, 예후, 치료, 예방을 연구하는 과학 및 실천 분야이며, 고대부터 발전하여 현대에는 다양한 전문 분야로 세분화되고 첨단 기술 발전에 따라 혁신적인 변화를 겪고 있다.
| 생화학 | |
|---|---|
| 개요 | |
| 학문 분야 | 생물학, 화학 |
| 연구 대상 | 생명체의 화학적 과정 |
| 관련 학문 | 분자생물학, 세포생물학, 유전학, 생리학, 면역학, 약리학 |
| 세부 분야 | |
| 주요 분야 | 효소학 대사 생화학 유전학 식물 생화학 구조 생물학 분자 생물학 |
| 응용 분야 | 의학 농업 영양학 |
| 역사 | |
| 기원 | 19세기 |
| 주요 발전 | 효소 발견 대사 경로 규명 DNA 구조 발견 |
| 연구 방법 | |
| 주요 기법 | 분광법 크로마토그래피 전기영동 질량 분석법 X선 결정학 핵자기 공명 분광법 |
2. 역사
생화학은 생명체의 구성 요소와 구조, 그리고 이들이 상호작용하여 생명 현상을 이루는 과정을 연구하는 학문이다. 넓은 의미에서 생화학의 역사는 생명 현상에 대한 탐구가 시작된 고대 그리스까지 거슬러 올라갈 수 있지만,[10][63][121] 독립적인 과학 분야로서의 생화학은 대략 19세기 무렵부터 형성되기 시작했다.
생화학의 구체적인 시작 시점에 대해서는 효소의 첫 발견(1833년, 앙셀름 파얜[11][67][122]), 세포 없이 알코올 발효 증명(1897년, 에두아르트 부흐너[12][13][68][69][70][123][124]), 물질대사에 대한 화학적 이론 제시(1842년, 유스투스 폰 리비히[10][63][121]), 또는 발효와 세포 호흡 연구(18세기, 앙투안 라부아지에[14][15][71][72][125][126]) 등 다양한 견해가 존재한다. '생화학(biochemistry)'이라는 용어는 19세기 중반 이후 등장했으며, 펠릭스 호페 자일러, 칼 노이베르크 등이 이 용어를 사용하고 정착시키는 데 기여했다.[18][19][75][76][129][130][20][21][22][77][78][79][131][132][133]
초기 생화학 발전의 중요한 전환점 중 하나는 1828년 프리드리히 뵐러의 요소 합성이었다.[26][27][83][84][137] 이는 생명체만이 유기 화합물을 만들 수 있다는 기존의 생기론적 관념에 도전하며 유기화학과 생화학의 발전을 촉진하는 계기가 되었다.[25][82][136] 20세기 들어 크로마토그래피, X선 결정학, 핵자기 공명 분광법 등 새로운 기술의 발달은 생화학 연구를 분자 수준으로 심화시켰다. 이를 통해 해당과정, 시트르산 회로와 같은 복잡한 대사 경로가 밝혀졌으며, 생명 현상에 대한 이해가 크게 확장되었다.
특히 DNA 구조 규명[29][86][140]과 유전자와 효소의 관계(1유전자 1효소설[30][87][141]), RNA 간섭 현상 발견[32][89][143] 등은 분자생물학의 발전을 이끌며 현대 생화학의 핵심적인 부분을 이루게 되었다. 이러한 생화학적 지식은 법과학[31][88][142] 등 다양한 응용 분야의 발전에도 기여하고 있다.
2. 1. 초기 역사

생화학을 가장 넓은 의미로 보면 생물체의 구성 요소와 구조, 그리고 이들이 어떻게 상호작용하여 생명 현상을 나타내는지를 연구하는 학문으로 정의할 수 있다. 이러한 관점에서 생화학의 역사는 고대 그리스 시대까지 거슬러 올라갈 수 있다.[10][63][121] 하지만 생화학이 하나의 독립된 과학 분야로 자리 잡기 시작한 시점은 언제로 보느냐에 따라 19세기 또는 그 이전으로 달라진다.
생화학의 시작을 언제로 볼 것인가에 대해서는 여러 견해가 있다. 18세기 후반 칼 빌헬름 셸레가 생물체에서 젖산(1780년)[64]과 구연산(1784년)[65]과 같은 유기 화합물을 분리했지만, 당시에는 이러한 물질들이 생명체 내에서만 만들어질 수 있다고 여겨졌다.[66] 어떤 이들은 1833년 앙셀름 파얜이 최초의 효소인 다이아스테이스(오늘날 아밀레이스로 불림)를 발견한 것을 생화학의 출발점으로 보기도 한다.[11][67][122] 또 다른 이들은 1897년 에두아르트 부흐너가 세포 없이 추출물만으로도 복잡한 생화학 반응인 알코올 발효가 일어날 수 있음을 증명한 것을 생화학의 탄생으로 간주한다.[12][13][68][69][70][123][124] 한편, 1842년 유스투스 폰 리비히가 그의 저서에서 물질대사에 대한 화학적 이론을 제시한 것을[10][63][121] 또는 더 이전인 18세기 앙투안 라부아지에의 발효와 세포 호흡에 대한 연구를 생화학의 시작으로 보는 시각도 있다.[14][15][71][72][125][126] 단백질 화학을 연구한 에밀 피셔[16][73][127]나 효소와 생화학의 동적인 측면을 연구한 프레더릭 가울랜드 홉킨스[17][74][128] 등 생화학의 복잡성을 밝히는 데 기여한 많은 초기 연구자들 역시 현대 생화학의 창시자로 여겨진다.
"생화학(biochemistry)"이라는 용어 자체는 생물학(biology)과 화학(chemistry)의 결합에서 유래했다. 이 용어는 1858년 빈첸츠 클레친스키가 "생화학 개론(Compendium der Biochemie)"이라는 책을 출판하며 처음 사용한 것으로 알려져 있다. 이후 1877년 펠릭스 호페 자일러는 《생리화학 저널》(Zeitschrift für Physiologische Chemie) 창간호 서문에서 생화학(독일어: biochemie)을 생리화학의 동의어로 사용하며, 이 분야를 전문적으로 연구하는 기관 설립의 필요성을 주장했다.[18][19][75][76][129][130] 하지만 독일의 화학자 칼 노이베르크가 1903년에 이 용어를 만들었다는 주장이 널리 알려져 있으며,[20][21][22][77][78][79][131][132][133] 프란츠 호프마이스터가 처음 사용했다는 설도 있다.[23][80][134]
과거에는 생명체와 생명체를 구성하는 물질에는 무생물과 구별되는 본질적인 힘이나 물질, 즉 "생기(vital principle)"가 존재하며, 생명의 분자는 오직 살아있는 생물체만이 만들 수 있다는 생기론이 널리 받아들여졌다.[25][82][136] 그러나 1828년 프리드리히 뵐러가 실험실에서 무기물인 시안산 칼륨과 황산 암모늄으로부터 유기 화합물인 요소를 합성하는 데 성공하면서 이러한 생각에 큰 변화를 가져왔다.[26][27][83][84][137] 뵐러의 합성은 생기론을 반증하고 유기화학 분야를 확립하는 중요한 계기가 되었다고 평가받지만, 이 합성이 생기론을 완전히 종식시켰는지에 대해서는 여전히 논쟁이 있다.[28][85]
뵐러의 요소 합성 이후 생화학은 꾸준히 발전했으며, 특히 20세기 중반 이후 크로마토그래피, X선 결정학, 핵자기 공명 분광법(NMR), 방사성 동위원소 표지법, 전자현미경, 분자동역학 시뮬레이션과 같은 새로운 기술들이 개발되면서 눈부신 발전을 이루었다. 이러한 기술들은 해당과정이나 시트르산 회로(크렙스 회로)와 같은 세포 내의 수많은 분자들과 대사 경로들을 발견하고 그 구조와 기능을 상세하게 분석하는 것을 가능하게 했으며, 생명 현상을 분자 수준에서 이해하는 길을 열었다.
생화학 역사에서 또 다른 중요한 전환점은 유전자의 발견과 세포 내 정보 전달에서의 역할 규명이다. 이는 흔히 분자생물학이라는 분야로 다루어진다.[139] 1950년대 제임스 D. 왓슨, 프랜시스 크릭, 로절린드 프랭클린, 모리스 윌킨스는 DNA의 이중나선 구조를 밝혀내고, 이것이 유전 정보를 어떻게 전달하는지에 대한 기초를 마련했다.[29][86][140] 이 발견은 생화학 및 생물학 전반에 혁명적인 영향을 미쳤다.
2. 2. 20세기 이후

20세기, 특히 중반 이후 생화학은 새로운 기술의 발달과 함께 크게 발전했다. 크로마토그래피, X선 결정학, 이중 분극 간섭계, 핵자기 공명분광법, 방사성 동위원소 표지법, 전자현미경, 분자동역학 시뮬레이션과 같은 기술들이 개발되면서, 세포 내의 많은 분자들과 대사 경로들을 발견하고 상세하게 분석하는 것이 가능해졌다. 예를 들어, 해당과정이나 시트르산 회로(크렙스 회로)와 같은 중요한 대사 과정들이 밝혀졌고, 이는 분자 수준에서 생명 현상을 이해하는 데 크게 기여했다. 또한 1963년 필립 랜들(Philip Randle)은 포도당과 지방산 대사 사이의 상호작용을 설명하는 랜들 회로(포도당-지방산 회로)를 발견하여 당뇨병 연구에 영향을 미쳤다.[138]
20세기 생화학의 또 다른 중요한 발전은 유전자의 발견과 세포 내 정보 전달에서의 역할 규명이었다. 이는 흔히 분자생물학이라는 분야로 다루어진다.[139] 1950년대에는 제임스 D. 왓슨, 프랜시스 크릭, 로절린드 프랭클린, 모리스 윌킨스의 연구를 통해 DNA의 이중 나선 구조가 밝혀졌고, 유전 정보가 어떻게 전달되는지에 대한 기초가 마련되었다.[140] 1958년에는 조지 비들과 에드워드 테이텀이 균류 연구를 통해 하나의 유전자가 하나의 효소를 만든다는 1유전자 1효소설을 증명하여 노벨 생리학·의학상을 수상했다.[141]
생화학적 지식은 다른 분야에도 영향을 미쳤다. 1988년, 콜린 피치포크(Colin Pitchfork)는 DNA 증거를 통해 살인 혐의로 유죄 판결을 받은 최초의 사례가 되었으며, 이는 법과학 분야의 발전을 가져왔다.[142] 2006년에는 앤드루 파이어와 크레이그 멜로가 RNA 간섭(RNAi) 현상을 발견하여 유전자 발현을 조절하는 새로운 메커니즘을 밝힌 공로로 노벨 생리학·의학상을 수상했다.[143]
3. 생체분자
생체분자의 4가지 주요 부류는 탄수화물, 지질, 단백질, 핵산이다.[145][35][92] 많은 생물학적 분자(생체분자)들은 중합체(폴리머)이다. 단위체(모노머)는 중합체로 알려진 큰 고분자를 생성하기 위해 서로 연결되어 있는 상대적으로 작은 분자들이다. 단위체가 서로 연결되어 생체고분자를 합성할 때는 탈수 반응(탈수축합)을 거치게 된다. 서로 다른 고분자들은 더 큰 복합체를 구성할 수 있으며, 이러한 복합체들은 종종 생물활성에 필요하다.
약 24가지(혹은 20여 종)의 화학 원소가 다양한 종류의 생물학적 생명에 필수적이다. 지구상에서 가장 희귀한 원소들은 생명체에 필요하지 않은 경우가 많다 (셀레늄과 요오드는 예외).[33][90] 반면에 몇몇 일반적인 원소들 (알루미늄과 티타늄)은 사용되지 않는다. 대부분의 생물은 원소 요구량을 공유하지만, 식물과 동물 사이에는 약간의 차이가 있다. 예를 들어, 해양 조류는 브롬을 사용하지만, 육상 식물과 동물은 필요하지 않은 것으로 보인다. 모든 동물은 나트륨을 필요로 하지만, 식물에는 필수적인 원소는 아니다. 식물은 붕소와 규소를 필요로 하지만, 동물은 필요하지 않거나 아주 소량만 필요할 수 있다.
단 여섯 가지 원소—탄소, 수소, 질소, 산소, 칼슘 및 인—는 인체를 포함한 생체 세포 질량의 거의 99%를 차지한다 (전체 목록은 인체 구성 원소 참조). 인체를 구성하는 주요 여섯 가지 원소 외에도 인간은 18가지 이상의 원소를 더 적은 양으로 필요로 한다.[34][91]
3. 1. 탄수화물


탄수화물은 주로 에너지 저장과 구조 제공이라는 두 가지 주요 기능을 수행한다. 당류는 탄수화물의 한 종류이지만, 모든 탄수화물이 당류인 것은 아니다. 지구상에는 다른 어떤 종류의 생체 분자보다 탄수화물이 더 많이 존재하며, 에너지 저장뿐만 아니라 세포 신호전달 및 세포 간 상호작용에 중요한 역할을 한다.
가장 단순한 형태의 탄수화물은 단당류이며, 일반적으로 탄소, 수소, 산소를 1:2:1의 비율로 포함한다 (일반식 CnH2nOn, 여기서 n은 3 이상). 포도당(C6H12O6)은 가장 중요한 탄수화물 중 하나이다. 과당(C6H12O6)은 과일의 단맛과 관련된 단당류이며,[146][36][93] 디옥시리보스(C5H10O4)는 DNA의 구성 성분이다. 단당류는 선형 또는 고리형으로 존재할 수 있다. 선형의 단당류는 카보닐기와 하이드록시기의 반응을 통해 산소 원자가 고리에 포함된 탄소 고리 형태를 형성할 수 있다. 이 고리형 분자는 원래의 선형 단당류가 알도스이면 헤미아세탈, 케토스이면 헤미케탈 구조를 가진다.[147][38][95]
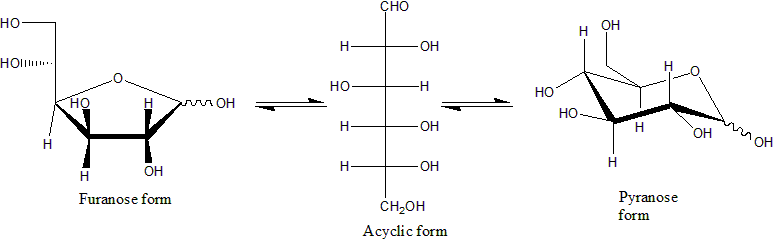
이러한 고리형 구조에서 고리는 보통 5개 또는 6개의 원자로 이루어진다. 5원자 고리형은 퓨란과 유사하여 푸라노스라고 하며, 6원자 고리형은 피란과 유사하여 피라노스라고 한다. 예를 들어, 알도헥소스인 포도당은 1번 탄소의 카보닐기와 4번 탄소의 하이드록시기 사이에 헤미아세탈 결합이 형성되면 글루코푸라노스라는 5원자 고리 구조를 생성할 수 있다. 같은 반응이 1번 탄소와 5번 탄소의 하이드록시기 사이에서 일어나면 글루코피라노스라는 6원자 고리 구조를 생성할 수 있다.
두 개의 단당류는 물 분자가 방출되는 탈수 반응을 통해 글리코사이드 결합을 형성하여 이당류를 생성할 수 있다. 이당류는 가수분해 반응을 통해 글리코사이드 결합이 분해되어 다시 두 개의 단당류로 나뉠 수 있다. 가장 잘 알려진 이당류는 포도당 1분자와 과당 1분자로 구성된 수크로스(설탕)이다. 또 다른 주요 이당류는 우유에서 발견되는 젖당(락토스)으로, 포도당 1분자와 갈락토스 1분자로 구성된다. 젖당은 락테이스 효소에 의해 가수분해될 수 있으며, 이 효소가 부족하면 젖당불내증이 발생한다.
몇 개(약 3~6개)의 단당류가 결합하면 올리고당("올리고(oligo-)"는 "소수(few)"를 의미)을 형성한다. 올리고당은 세포 표면의 표지나 신호 전달 등 다양한 기능을 수행한다.[148][39][96]
수많은 단당류가 중합되면 다당류를 형성한다. 다당류는 긴 선형 사슬 형태이거나 가지가 달린 분지 구조를 가질 수 있다. 대표적인 다당류로는 셀룰로스, 녹말, 글리코젠이 있으며, 이들은 모두 포도당 단위체가 반복적으로 결합하여 구성된다. 셀룰로스는 식물의 세포벽을 이루는 중요한 구조적 성분이며, 녹말은 식물의 에너지 저장 형태, 글리코젠은 동물의 에너지 저장 형태로 사용된다.
탄수화물은 환원 말단 또는 비환원 말단을 가질 수 있다. 탄수화물의 환원 말단은 선형의 알데하이드(알도스) 또는 케톤(케토스) 형태와 평형을 이룰 수 있는 탄소 원자를 의미한다. 만약 이 환원 말단의 탄소 원자에서 다른 당과의 결합이 일어나면, 피라노스 또는 푸라노스 형태의 자유 하이드록시기가 다른 당의 하이드록시기와 반응하여 완전한 아세탈을 형성한다. 이로 인해 고리 구조가 열려 알데하이드나 케톤 형태로 전환되는 것이 방지되며, 해당 잔기는 비환원성이 된다. 예를 들어, 젖당에서 포도당 잔기는 환원 말단을 가지고 있지만, 갈락토스 잔기는 포도당의 4번 탄소 하이드록시기와 완전한 아세탈 결합을 형성하여 비환원성이다. 수크로스는 포도당의 1번 탄소(알데하이드 유래)와 과당의 2번 탄소(케톤 유래) 사이에 완전한 아세탈 결합이 형성되어 환원 말단을 가지지 않는다.
3. 2. 지질

지질은 생물로부터 유래하며 비교적 물에 잘 녹지 않는 비극성 화합물들을 포괄적으로 이르는 말이다. 여기에는 왁스, 지방산, 그리고 지방산 유도체인 인지질, 스핑고지질, 당지질 및 테르페노이드(예: 레티노이드와 스테로이드) 등이 포함된다.[151][42] 지질 분자는 다양한 구조를 가지는데, 어떤 것은 선형의 지방족 화합물이고 다른 것은 고리 구조를 가진다. 또한 방향족 화합물인 것도 있고 아닌 것도 있으며, 유연한 분자도 있고 단단한 분자도 있다.[151][42]
지질은 대개 글리세롤 1분자에 다른 분자들이 결합하여 만들어진다. 대표적인 예로 트라이글리세라이드는 글리세롤 1분자와 지방산 3분자가 결합한 구조이다. 이때 결합하는 지방산은 탄소 사슬에 이중 결합이 없는 포화 상태이거나, 하나 이상의 이중 결합을 가진 불포화 상태일 수 있다.[152]
대부분의 지질은 전체적으로 비극성이지만, 분자의 일부분은 극성을 띠기도 한다. 일반적으로 지질 구조의 대부분은 비극성 또는 소수성(물을 밀어내는 성질)이어서 물과 같은 극성 용매와 잘 섞이지 않는다. 반면, 지질 구조의 다른 부분은 극성 또는 친수성(물과 친한 성질)이어서 물과 같은 극성 용매와 잘 상호작용한다. 이처럼 소수성 부분과 친수성 부분을 모두 가진 분자를 양친매성 분자라고 부른다.[153] 예를 들어 콜레스테롤의 극성 부위는 하이드록시기(-OH)이고,[153] 인지질의 경우 극성 부위는 인산을 포함하는 머리 부분이다.[153]
지질은 사람의 일상 식단에서 필수적인 부분을 차지한다. 우리가 흔히 섭취하는 기름, 버터, 치즈, 기와 같은 유제품들은 대부분 지방으로 이루어져 있다. 특히 식물성 기름에는 다양한 다불포화 지방산(PUFA)이 풍부하다. 지질을 함유한 식품은 체내에서 소화 과정을 거쳐 최종적으로 지방산과 글리세롤로 분해된다. 또한 지질, 특히 인지질은 다양한 의약품에서 공동가용화제(예: 비경구 투입)나 약물 전달체(예: 리포솜 또는 트랜스퍼솜)의 성분으로 활용되기도 한다.
3. 3. 단백질

단백질은 아미노산이라고 불리는 단위체(단량체)가 길게 연결되어 만들어진 매우 큰 분자, 즉 거대 생체 고분자이다.[99] 아미노산은 중심의 알파(α) 탄소 원자에 아미노기(–NH2), 카복시기(–COOH), 수소 원자(–H), 그리고 각 아미노산마다 다른 구조를 가지는 곁사슬(R기, –R)이 결합된 화합물이다. 생리적인 조건(체내 환경과 유사한 조건)에서는 아미노기와 카복시기가 각각 양전하를 띤 형태(–NH3+)와 음전하를 띤 형태(–COO−)로 존재한다.[43] 곁사슬(R기)의 화학적 특성은 단백질 전체의 3차원 구조와 기능에 큰 영향을 미친다. 글루탐산과 같이 아미노산 자체가 중요한 신경전달물질로 기능하는 경우도 있다.
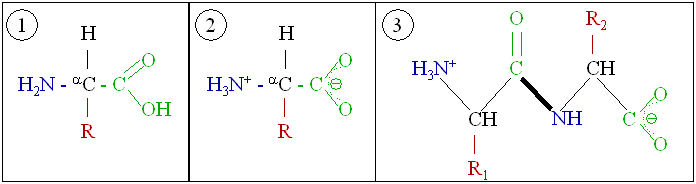
아미노산들은 펩타이드 결합을 통해 서로 연결될 수 있다. 이 과정은 탈수 반응으로, 한 아미노산의 아미노기와 다른 아미노산의 카복시기 사이에서 물 분자 하나가 빠져나가면서 결합이 형성된다. 이렇게 두 개의 아미노산이 연결된 분자를 다이펩타이드라고 부르며, 비교적 짧은 사슬(보통 30개 이하)의 아미노산 중합체는 펩타이드 또는 폴리펩타이드라고 한다. 단백질은 수십 개에서 수천 개의 아미노산으로 구성된 긴 폴리펩타이드 사슬 또는 여러 개의 폴리펩타이드 사슬이 모여 이루어진다. 예를 들어, 혈액 내 주요 단백질인 알부민은 585개의 아미노산 잔기로 구성되어 있다.[154][43]
단백질은 생명체 내에서 매우 다양한 구조적, 기능적 역할을 수행한다. 예를 들어, 세포 골격을 이루거나 액틴과 마이오신 단백질처럼 근육 수축을 일으키는 역할을 한다. 많은 단백질은 특정 분자나 분자 그룹에 매우 특이적으로 결합하는 능력을 가진다. 대표적인 예가 항체로, 외부 침입 물질(항원)의 특정 부위에 정확하게 결합하여 면역 반응을 유도한다. 항체는 보통 2개의 무거운 사슬(heavy chain)과 2개의 가벼운 사슬(light chain)이 이황화 결합 등으로 연결된 구조를 가지며, N-말단 부위 아미노산 서열의 다양성을 통해 특정 항원에 대한 특이성을 확보한다.[155][44] 항체를 이용하는 효소결합면역흡착검사(ELISA)는 특정 생체 분자를 매우 민감하게 검출할 수 있어 현대 의학 진단에 널리 사용된다.
아마도 가장 중요한 단백질은 효소일 것이다. 효소는 생체 내에서 일어나는 거의 모든 화학 반응을 촉진하는 촉매 역할을 한다. 효소는 특정 반응물(기질)을 인식하여 결합한 뒤, 반응이 더 쉽게 일어날 수 있도록 활성화 에너지를 낮춘다. 이를 통해 효소는 반응 속도를 수백만 배에서 수십억 배 이상 증가시킬 수 있다. 예를 들어, 효소가 없다면 수천 년이 걸릴 반응도 효소가 있으면 1초 이내에 완료될 수 있다.[101] 효소 자체는 반응 과정에서 소모되지 않고 반복적으로 사용될 수 있으며, 다양한 조절 물질에 의해 활성이 조절되어 세포 내 생화학 반응 전체를 정교하게 제어하는 데 기여한다.[68]
단백질의 구조는 보통 4단계의 계층으로 설명된다.
- '''1차 구조''': 아미노산이 펩타이드 결합으로 연결된 선형 서열 자체를 의미한다. 예를 들어 "알라닌-글리신-트립토판-세린-..."과 같은 아미노산의 배열 순서이다.
- '''2차 구조''': 아미노산 사슬의 특정 부분들이 국소적으로 형성하는 규칙적인 구조이다. 주변 아미노산 간의 수소 결합에 의해 안정화되며, 대표적으로 알파 나선(α-helix) 구조와 베타 병풍(β-sheet) 구조가 있다. 헤모글로빈 그림에서도 알파 나선 구조를 볼 수 있다.
- '''3차 구조''': 하나의 폴리펩타이드 사슬 전체가 3차원 공간에서 접혀 형성하는 고유한 입체 구조이다. 이 구조는 아미노산 서열(1차 구조)에 의해 결정되며, 곁사슬 간의 다양한 상호작용(소수성 상호작용, 이온 결합, 수소 결합, 이황화 결합 등)에 의해 안정화된다. 아미노산 하나가 바뀌는 것만으로도 전체 3차 구조가 변형되어 단백질의 기능에 심각한 영향을 미칠 수 있다. 예를 들어, 헤모글로빈의 베타(β) 사슬(146개 아미노산으로 구성)에서 6번째 아미노산인 글루탐산이 발린으로 바뀌면 헤모글로빈의 구조가 변형되어 낫 모양 적혈구 빈혈증을 유발한다.[156][45]
- '''4차 구조''': 두 개 이상의 폴리펩타이드 사슬(소단위체, subunit)이 모여 형성하는 복합체 구조를 의미한다. 예를 들어, 헤모글로빈은 4개의 소단위체(알파 사슬 2개, 베타 사슬 2개)로 구성된 4차 구조를 가진다. 모든 단백질이 4차 구조를 가지는 것은 아니다.[102]
우리가 섭취한 단백질은 소화 과정을 통해 소장에서 주로 개별 아미노산 또는 작은 펩타이드 형태로 분해되어 흡수된다. 흡수된 아미노산은 체내에서 새로운 단백질을 합성하거나 다른 필요한 분자를 만드는 데 사용된다. 생명체는 해당과정, 시트르산 회로, 오탄당 인산 경로와 같은 주요 대사 경로의 중간 산물들을 이용하여 단백질을 구성하는 20가지 표준 아미노산을 합성할 수 있다. 대부분의 세균과 식물은 20가지 아미노산을 모두 스스로 합성할 수 있지만, 인간을 포함한 포유류는 이 중 일부만 합성할 수 있다.
| 구분 | 아미노산 종류 |
|---|---|
| 필수 아미노산 (체내에서 합성되지 않거나 합성량이 부족하여 반드시 음식으로 섭취해야 하는 아미노산) | 아이소류신, 류신, 리신, 메싸이오닌, 페닐알라닌, 트레오닌, 트립토판, 발린 (+ 아르지닌, 히스티딘*) |
| 비필수 아미노산 (체내에서 다른 물질로부터 합성될 수 있는 아미노산) | 알라닌, 아스파라긴, 아스파르트산, 시스테인, 글루탐산, 글루타민, 글리신, 프롤린, 세린, 티로신 |
| * 참고: 아르지닌과 히스티딘은 성인의 경우 체내에서 합성될 수 있지만, 성장기 어린이의 경우 필요한 양만큼 충분히 합성하지 못하므로 준필수 아미노산 또는 조건부 필수 아미노산으로 분류되기도 한다. | |
아미노산이 분해될 때는 먼저 아미노기(-NH2)가 제거되어 α-케토산이라는 탄소 골격이 남게 된다. 아미노기 전이효소는 아미노산의 아미노기를 다른 α-케토산으로 옮기는 아미노기 전이반응을 촉매한다. 이 반응은 아미노산 합성과 분해 모두에서 중요한 역할을 한다. 아미노산에서 떨어져 나온 아미노기는 암모니아(NH3) 형태로 전환되는데, 암모니아는 체내에 축적되면 독성을 나타낸다. 따라서 생물은 독성이 낮은 형태로 전환하여 배설해야 한다. 단세포 생물이나 수중 생활을 하는 경골어류는 암모니아를 주변 환경으로 바로 방출하지만, 육상 포유류는 간에서 요소 회로를 통해 암모니아를 독성이 훨씬 낮은 요소로 전환시킨 후, 신장을 통해 소변으로 배설한다.[158]
과학자들은 두 단백질이 진화적으로 관련이 있는지(즉, 공통 조상으로부터 유래했는지, 상동성이 있는지)를 판단하기 위해 서열 정렬이나 구조 정렬과 같은 방법을 사용한다. 아미노산 서열이나 3차원 구조를 비교하여 유사성을 분석함으로써 단백질 간의 관계를 파악하고, 이를 통해 특정 단백질의 기능을 예측하거나 단백질 패밀리의 진화 과정을 연구할 수 있다.[159]
3. 4. 핵산
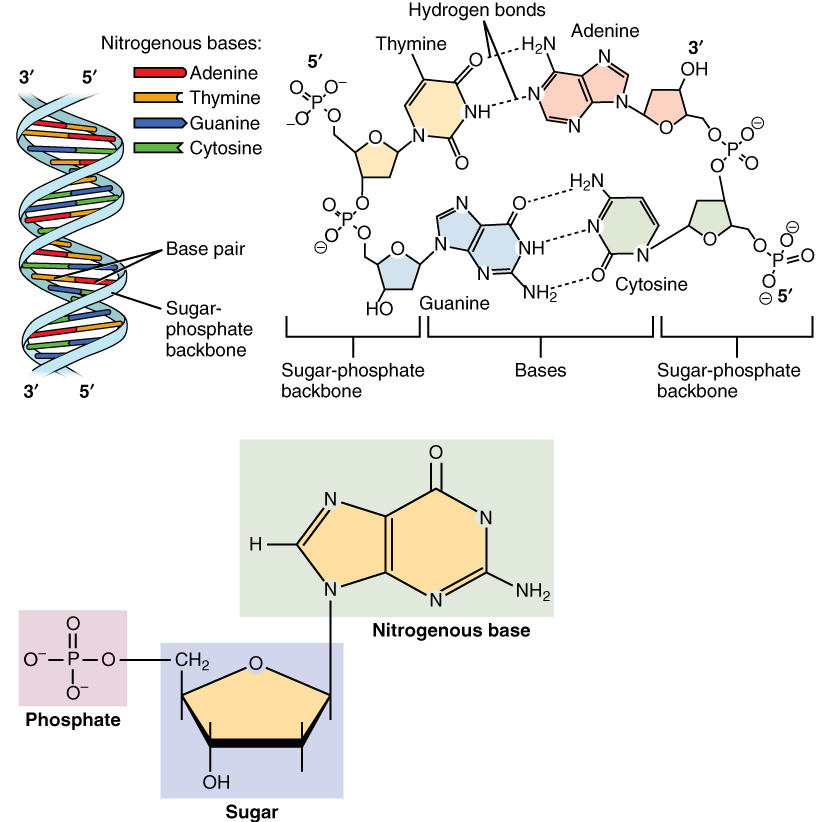
핵산은 주로 세포핵에서 발견되는 생명 활동에 필수적인 생체고분자이다. 모든 살아있는 세포와 바이러스에서 유전 정보를 전달하는 복잡한 고분자량의 생화학적 거대 분자이기도 하다.[113][2][53] 핵산은 뉴클레오타이드를 단량체로 하는 중합체이다. 뉴클레오타이드는 핵염기(퓨린 계열 또는 피리미딘 계열), 5탄당, 인산의 세 가지 성분으로 구성된다.[160][46][103]

가장 일반적인 핵산은 DNA와 RNA이다.[161] 각 뉴클레오타이드의 당과 인산은 서로 결합하여 핵산의 골격을 형성하며, 핵염기의 서열은 유전 정보를 저장한다. 가장 흔한 핵염기는 아데닌(A), 사이토신(C), 구아닌(G), 티민(T), 유라실(U)이다. 핵산의 각 가닥에 있는 핵염기들은 서로 상보적인 염기쌍을 형성하는데, 아데닌은 티민(DNA) 또는 유라실(RNA)과 수소 결합을 형성하고, 구아닌은 사이토신과 수소 결합을 형성한다. 아데닌-티민/유라실 쌍은 2개의 수소 결합을, 구아닌-사이토신 쌍은 3개의 수소 결합을 형성한다.
핵산은 세포의 유전 물질을 구성하는 것 외에도, 2차 전달자 역할을 하거나 모든 생명체에서 주요 에너지 운반 분자인 ATP를 형성하는 데 기여한다.[162] DNA와 RNA에서 발견되는 핵염기는 일부 차이가 있다. 아데닌, 사이토신, 구아닌은 DNA와 RNA 모두에 존재하지만, 티민은 DNA에서만 발견되고 유라실은 RNA에서만 발견된다.
4. 물질대사
물질대사( Metabolism영어 )는 생명체가 생명을 유지하고 성장하며 환경에 반응하기 위해 세포 내에서 수행하는 모든 화학 반응의 집합을 의미한다. 이러한 화학 반응들은 생명 활동에 필요한 에너지를 얻고, 세포를 구성하는 물질들을 합성하며, 노폐물을 제거하는 등 다양한 기능을 수행한다.
물질대사는 크게 두 가지 과정으로 나눌 수 있다.
- 이화작용( Catabolism영어 ): 복잡한 분자를 더 단순한 분자로 분해하면서 에너지를 방출하는 과정이다. 예를 들어, 세포 호흡 과정에서 포도당과 같은 영양소를 분해하여 세포 활동에 필요한 에너지 통화인 ATP를 생성하는 것이 대표적인 이화작용이다.
- 동화작용( Anabolism영어 ): 단순한 분자들을 이용하여 세포 구성에 필요한 단백질, 핵산, 다당류, 지질과 같이 더 크고 복잡한 분자를 합성하는 과정이다. 이 과정은 에너지를 필요로 하며, 주로 이화작용에서 얻은 ATP를 사용한다.
이 두 과정은 서로 긴밀하게 연결되어 있으며, 효소에 의해 촉매되는 수많은 대사 경로를 통해 조절된다. 생명체는 탄수화물, 지질, 단백질 등 다양한 유기물을 분해하여 에너지를 얻거나(이화작용), 이들을 이용하여 생체 분자를 합성한다(동화작용). 이러한 물질대사의 균형은 생명 유지에 필수적이다.
주요 에너지원인 탄수화물의 대사 과정에 대한 자세한 내용은 아래 섹션에서 다룬다.
4. 1. 탄수화물 대사
포도당은 대부분의 생명체에서 주요 에너지원으로 사용된다. 예를 들어, 글리코젠과 같은 다당류는 글리코젠 포스포릴레이스와 같은 효소에 의해 단량체인 포도당 잔기로 분해된다. 젖당이나 수크로스(설탕)와 같은 이당류는 구성 단당류로 분해되어 에너지원으로 활용될 수 있다.[163][47]포도당은 주로 해당과정이라는 10단계의 대사 경로를 통해 대사된다. 이 과정에서 포도당 한 분자는 두 분자의 피루브산으로 분해되며, 세포의 에너지 통화인 ATP 두 분자가 순생성되고, 2분자의 NAD+가 환원되어 2분자의 NADH가 만들어진다. 해당과정은 산소를 필요로 하지 않는다. 갈락토스나 과당과 같은 다른 단당류들도 해당과정의 중간 생성물로 전환되어 대사될 수 있다.[163][48][104]
세포 환경에 산소가 부족하거나 세포가 산소를 사용할 수 없는 경우(혐기성 조건), 피루브산은 발효 과정을 거친다. 사람의 근육 세포에서는 피루브산이 젖산으로 전환되고, 효모와 같은 일부 미생물에서는 에탄올과 CO2로 전환된다. 이 과정에서 NADH가 다시 NAD+로 산화되어 해당과정이 지속될 수 있도록 한다.[163][48][104]
반면, 대부분의 인간 세포처럼 산소가 충분한 환경(호기성 조건)에서는 피루브산이 미토콘드리아로 이동하여 추가적으로 대사된다. 먼저 피루브산은 아세틸-CoA로 비가역적으로 전환되면서 CO2 한 분자를 방출하고 NAD+를 NADH로 환원시킨다. 포도당 한 분자로부터 생성된 두 분자의 아세틸-CoA는 시트르산 회로(크렙스 회로)로 들어간다. 시트르산 회로에서는 아세틸-CoA가 완전히 산화되어 4분자의 CO2를 방출하고, 6분자의 NADH, 2분자의 FADH2, 그리고 2분자의 ATP를 생성한다.[164][49][105]
해당과정과 시트르산 회로에서 생성된 NADH와 FADH2는 전자전달계로 전자를 전달한다. 전자전달계는 미토콘드리아 내막(진핵세포의 경우)에 위치한 일련의 단백질 복합체로, 전자가 단계적으로 이동하면서 에너지를 방출한다. 이 에너지는 막을 경계로 양성자(H+)를 이동시켜 농도 기울기를 형성하는 데 사용된다. 최종적으로 전자는 산소(O2)에 전달되어 물(H2O)을 형성하며, 이 과정에서 소모된 산소는 우리가 호흡을 통해 얻는다. 형성된 양성자 기울기는 ATP 생성효소를 통해 ATP를 합성하는 데 사용되는데, 이를 산화적 인산화라고 한다. 이 과정을 통해 NADH와 FADH2는 다시 NAD+와 FAD로 산화되어 해당과정과 시트르산 회로에서 재사용될 수 있다. 포도당 한 분자가 세포 호흡을 통해 완전히 산화되면, 해당과정에서 2 ATP, 시트르산 회로에서 2 ATP, 그리고 산화적 인산화를 통해 약 28 ATP가 생성되어 총 약 32 ATP가 만들어진다.[164][49][105] 산소를 이용한 포도당 산화는 산소를 사용하지 않는 과정보다 훨씬 많은 에너지를 생산하므로, 복잡한 생명체의 진화에 중요한 역할을 했을 것으로 여겨진다.[49][105]
척추동물의 골격근은 역도나 단거리 달리기와 같이 격렬하게 수축할 때 필요한 산소를 충분히 공급받지 못할 수 있다. 이때 근육 세포는 혐기성 대사로 전환하여 포도당을 젖산으로 전환시킨다. 생성된 젖산은 혈액을 통해 간으로 운반되어 포도당신생합성 과정을 통해 다시 포도당으로 전환될 수 있다. 포도당신생합성은 해당과정의 단순한 역반응이 아니며, 해당과정에서 2 ATP를 생성하는 것과 달리 6 ATP를 소모하는 에너지 요구 과정이다.[165][51][107] 포도당신생합성은 젖산 외에도 아미노산, 글리세롤 등 다양한 비탄수화물 전구체를 이용하여 포도당을 합성할 수 있으며, 이는 기아 상태나 특정 내분비 질환 시 중요해진다.[50][106] 이렇게 생성된 포도당은 혈액으로 방출되어 에너지가 필요한 다른 조직에서 사용되거나, 글리코젠(식물의 경우 녹말) 형태로 저장될 수 있다. 근육에서의 해당과정과 젖산 생성, 혈액을 통한 젖산의 간 이동, 간에서의 포도당신생합성, 그리고 다시 혈액을 통해 포도당이 근육으로 돌아가는 이 순환 과정을 코리 회로라고 한다.[165][51][107]
5. 생화학 연구 방법
생화학 실험은 흔히 시험관 내 실험이라고도 불리듯이, 생체 세포의 세포소기관 내에서 일어나는 생화학 반응을 복잡한 대사 경로나 조절 기전으로부터 분리하여 시험관 내에서 재현함으로써 연구가 진전되어 왔다. 21세기에 들어서면서 표지 기술과 측정 기술의 발전으로 살아있는 세포 내에서 생화학 반응을 간접적으로 추적하는 것도 가능해졌지만, 생체 조직으로부터 목적 성분을 분리 정제하는 실험 기술은 생화학 연구에서 중요한 연구 기술이다.
일반적으로 소화 효소나 호르몬처럼 분비형 생체 물질이 아닌 한, 효소나 수용체를 포함하여 목적하는 생체 물질은 특정 조직 세포의 특정 세포 소기관에만 발현·존재한다. 따라서 생화학 실험은 표적 조직을 다량 채취하여 거기에서 목적하는 생체 물질을 분리 정제하는 것부터 시작한다.
DNA처럼 세포 파쇄 후 에탄올 침전만으로 포집할 수 있는 것도 있지만, 대부분의 경우 세포 파쇄 후 밀도 구배 원심분리법으로 목적하는 세포 내 소기관을 밀도에 따라 선택적으로 포집한다. 용액에는 염화 세슘 등이 사용된다. 이 상태에서는 대부분의 경우 효소나 수용체가 세포막에 흡수되어 있거나 막의 이중층에 묻혀 있으므로, 계면활성제를 사용하여 지질막과 분리〈가용화〉할 필요가 있다.
목적하는 생체 고분자의 정제에는 예전에는 반투막에 의한 투석이 행해졌지만, 20세기 후반부터는 겔 여과 크로마토그래피와 아피니티 크로마토그래피에 의해 목적 물질을 정제하는 것이 가능해졌다.[108][109]
대사에 의한 생체 내 물질의 이동이나 변화의 추적에는 추적자 물질이 이용된다. 예전부터 방사성 또는 비방사성 동위원소를 포함한 생체 내 물질이 널리 이용되었다. 그러나 동위원소 치환 생체 내 물질을 준비하는 것은 어려움을 수반하고, 방사성 추적자의 경우 방사성 동위원소 센터 등 전용 실험 시설이 필요하기 때문에, 오늘날에는 항체 염색이나 ELISA법 등 동위원소를 사용하지 않는 추적자가 널리 이용되고 있다.[110] 또한, 미량 기기 분석 기술의 발전에 따라 MALDI법 등 질량 분석으로 크로마토그래피 스폿(피크)에서 직접 표적 물질의 동정도 가능하다.[111]
이온 채널의 연구에서는 생체막에 유리 모세관을 밀착시킴으로써 관 내에 이온 채널을 가두어 생화학 실험을 수행하는 패치 클램프 실험 기술에 의해 위와 같이 생체 성분을 분리하지 않고 실험하는 기법도 개발되었다.
1990년대 이후에는 특정 무기 이온에 반응하여 형광을 발하는 표지 색소나 루시페레이스 유전자를 응용한 형질 도입에 의해 세포 밖에서 형광 현미경으로 발광 현상을 추적함으로써 간접적으로 생화학 반응을 추적하는 것도 가능해지고 있다.
6. 다른 분자 규모의 생물학과의 관계
생화학 연구자들은 생화학 특유의 기술을 사용하지만, 이들을 유전학, 분자생물학, 생물물리학 분야에서 개발된 기술이나 사고방식과 결합하는 경우가 많아지고 있다. 이들 분야 사이에는 명확한 경계선이 없다. 생화학은 분자의 생물학적 활성에 필요한 화학을 연구하고, 분자생물학은 분자의 생물학적 활성을 연구하며, 유전학은 게놈이 담당하는 분자의 유전 현상을 연구하는 학문이다. 각 분야의 관계는 다음과 같이 설명될 수 있다.
- '''생화학'''(biochemistry|영어)은 생체 내에서 일어나는 화학 물질과 생명 현상을 연구하는 학문이다. 생화학자는 생체분자의 역할, 기능 및 구조에 중점을 두고 있다. 생물학적 과정의 배경에 있는 화학 연구나 생물학적으로 활성인 분자의 합성은 생화학의 응용 분야이다. 생화학은 원자 및 분자 수준에서의 생명 연구이다.
- '''유전학'''(genetics|영어)이란 생물체에서 유전적인 차이가 가져오는 영향을 연구하는 학문이다. 많은 경우, 정상적인 구성 요소(예: 하나의 유전자)의 결여로부터 추측할 수 있다. 변이체, 즉 소위 야생형 또는 정상적인 표현형과 비교하여 하나 또는 여러 개의 기능적 구성 요소가 부족한 생물의 연구가 포함된다. 유전적 상호 작용(상위작용)은 이러한 "녹아웃" 연구의 단순한 해석을 종종 혼란스럽게 한다.
- '''분자생물학'''(molecular biology|영어)은 분자의 합성, 변형, 기전 및 상호 작용에 초점을 맞춘 생명 현상의 분자적 기반을 연구하는 학문이다. 유전 물질이 RNA로 전사되고, 더 나아가 단백질로 번역된다는 중심 원리는 단순화되기는 했지만, 이 분야를 이해하기 위한 좋은 출발점이 된다. 이 개념은 RNA의 새로운 역할의 등장으로 재검토되고 있다.[166]
- '''화학생물학'''(chemical biology|영어)은 저분자를 기반으로 새로운 도구를 개발하고, 생체계에 대한 영향을 최소화하면서 그 기능에 대한 상세한 정보를 제공하는 것을 목표로 하고 있다. 또한 화학생물학에서는 생체 분자와 합성 장치의 비천연 하이브리드를 만들어내기 위해 생체 시스템을 이용하고 있다(예를 들어, 유전자 치료나 약물 분자를 전달할 수 있는 빈 바이러스 캡시드).[167]
참조
[1]
웹사이트
Biological/Biochemistry
http://www.acs.org/c[...]
2016-01-04
[2]
서적
Voet
2005
[3]
서적
Karp
2009
[4]
서적
Miller
2012
[5]
서적
Astbury
1961
[6]
서적
Eldra
2007
[7]
서적
Marks
2012
[8]
서적
Finkel
2009
[9]
서적
UNICEF
2010
[10]
서적
Helvoort
2000
[11]
서적
Hunter
2000
[12]
서적
Hamblin
2005
[13]
서적
Hunter
2000
[14]
서적
Berg
1980
[15]
서적
Holmes
1987
[16]
서적
Feldman
2001
[17]
서적
Rayner-Canham
2005
[18]
서적
Ziesak
1999
[19]
서적
Kleinkauf
1988
[20]
서적
Ben-Menahem
2009
[21]
서적
Amsler
1986
[22]
서적
Horton
2013
[23]
서적
Kleinkauf
1988
[24]
서적
Edwards
1992
[25]
서적
Fiske
1890
[26]
논문
Ueber künstliche Bildung des Harnstoffs
http://dx.doi.org/10[...]
2021-05-04
[27]
서적
Kauffman
2001
[28]
논문
Wohler's preparation of urea and the fate of vitalism
http://dx.doi.org/10[...]
2021-05-04
[29]
서적
Tropp
2012
[30]
서적
Krebs
2012
[31]
서적
Butler
2009
[32]
서적
Chandan
2007
[33]
서적
Lehninger Principles of Biochemistry
Macmillan
2008
[34]
서적
Nielsen
1999
[35]
서적
Slabaugh
2007
[36]
서적
[37]
서적
[38]
서적
[39]
서적
[40]
서적
[41]
서적
[42]
웹사이트
Biochemistry, Lipids
http://www.ncbi.nlm.[...]
StatPearls Publishing
2023-11-30
[43]
서적
[44]
논문
How antibodies fold
[45]
서적
[46]
서적
[47]
웹사이트
Disaccharide
https://www.britanni[...]
2023-10-14
[48]
서적
[49]
서적
[50]
웹사이트
A Dictionary of Biology
https://www.oxfordre[...]
Oxford University Press
2020-04-29
[51]
서적
[52]
웹사이트
Biological/Biochemistry
http://www.acs.org/c[...]
2014-02-06
[53]
서적
[54]
서적
[55]
서적
[56]
서적
[57]
논문
A guide to enzyme kinetics in early drug discovery
2022-03
[58]
서적
[59]
서적
[60]
서적
[61]
서적
[62]
논문
Prion Diseases and Their Biochemical Mechanisms
[63]
서적
[64]
논문
Om Mjölk och dess syra
https://books.google[...]
[65]
논문
Anmärkning om Citron-Saft, samt sätt att crystallisera den samma
[66]
서적
生化学辞典第2版
[67]
서적
[68]
논문
Words of advice: teaching enzyme kinetics
[69]
서적
[70]
서적
[71]
서적
(추정)
[72]
서적
(추정)
[73]
서적
(추정)
[74]
서적
(추정)
[75]
서적
(추정)
[76]
서적
(추정)
[77]
서적
(추정)
[78]
서적
(추정)
[79]
서적
(추정)
[80]
서적
(추정)
[81]
서적
(추정)
[82]
서적
(추정)
[83]
학술지
Ueber künstliche Bildung des Harnstoffs
https://doi.org/10.1[...]
[84]
서적
(추정)
[85]
학술지
Wohler's preparation of urea and the fate of vitalism
https://doi.org/10.1[...]
[86]
서적
(추정)
[87]
서적
(추정)
[88]
서적
(추정)
[89]
서적
(추정)
[90]
서적
Lehninger Principles of Biochemistry
Macmillan
[91]
서적
(추정)
[92]
서적
(추정)
[93]
서적
(추정)
[94]
서적
(추정)
[95]
서적
(추정)
[96]
서적
(추정)
[97]
서적
(추정)
[98]
서적
(추정)
[99]
서적
(추정)
[100]
학술지
How antibodies fold
[101]
학술지
A Guide to the Michaelis‐Menten equation: Steady state and beyond
(추정)
2021-07-16
[102]
서적
(추정)
[103]
서적
(추정)
[104]
서적
(추정)
[105]
서적
(추정)
[106]
서적
A Dictionary of Biology
https://www.oxfordre[...]
Oxford University Press
2015-09-17
[107]
문서
Fromm and Hargrove
2012
[108]
학술지
Thirty years of affinity chromatography
https://doi.org/10.1[...]
1999
[109]
학술지
Modern Size-Exclusion Liquid Chromatography: Practice of Gel Permeation and Gel Filtration Chromatography, Second Edition
https://onlinelibrar[...]
[110]
간행물
The enzyme linked immunosorbent assay (ELISA). A guide with abstracts of microplate applications
Dynatech Europe, Borough House, Rue du Pre.
1979
[111]
학술지
The MALDI process and method
https://onlinelibrar[...]
Wiley Online Library
[112]
웹사이트
Biochemistry
http://www.acs.org/c[...]
[113]
문서
Voet
2005
[114]
문서
Karp
2009
[115]
문서
Miller
2012
[116]
문서
Astbury
1961
[117]
문서
Eldra
2007
[118]
문서
Marks
2012
[119]
문서
Finkel
2009
[120]
문서
UNICEF
2010
[121]
문서
Helvoort
2000
[122]
문서
Hunter
2000
[123]
문서
Hamblin
2005
[124]
문서
Hunter
2000
[125]
문서
Berg
1980
[126]
문서
Holmes
1987
[127]
문서
Feldman
2001
[128]
문서
Rayner-Canham
2005
[129]
문서
Ziesak
1999
[130]
문서
Kleinkauf
1988
[131]
문서
Ben-Menahem
2009
[132]
문서
Amsler
1986
[133]
문서
Horton
2013
[134]
문서
Kleinkauf
1988
[135]
문서
Edwards
1992
[136]
문서
Fiske
1890
[137]
문서
Kauffman
2001
[138]
문서
Ashcroft
2006
[139]
문서
Tropp
2012
[140]
문서
Tropp
2012
[141]
서적
[142]
서적
[143]
서적
[144]
서적
[145]
서적
[146]
서적
[147]
서적
[148]
서적
[149]
서적
[150]
서적
[151]
서적
[152]
서적
[153]
서적
[154]
서적
[155]
저널
How antibodies fold
[156]
서적
[157]
서적
[158]
서적
[159]
서적
[160]
서적
[161]
서적
[162]
서적
[163]
서적
[164]
서적
[165]
서적
[166]
서적
[167]
서적
[168]
서적
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
