18 전자 규칙
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
18 전자 규칙은 전이 금속 착물의 안정성을 예측하는 데 사용되는 규칙으로, 금속 착물이 18개의 전자를 가질 때 가장 안정적이라는 것을 의미한다. 이온형 방식과 공유형 방식 두 가지 방법으로 착화합물의 전자 수를 계산하며, 코발트 이온(CoCp₂⁺)과 같은 예시를 통해 규칙 적용을 설명한다. 18 전자 규칙은 16전자 규칙, 부피가 큰 리간드, 고스핀 착물, π-공여 리간드 등 다양한 예외가 존재하며, 18 전자 규칙을 따르는 화합물은 일반적으로 반응성이 낮고, 18개 미만의 전자를 가진 착물은 반응성이 높다. 유효 원자 번호 규칙과 12전자 규칙과 연관되어 금속 착물의 특성과 반응성을 이해하는 데 기여한다.
더 읽어볼만한 페이지
- 경험 법칙 - 무어의 법칙
무어의 법칙은 집적회로의 성능이 일정 기간마다 두 배로 증가한다는 경험적 관찰로, 반도체 산업 발전을 이끄는 지표였으나, 최근 성장 둔화에도 불구하고 기술 혁신을 통해 성능 향상이 지속되며 기술 혁신 과정 자체를 의미하는 개념으로 진화하고 있다. - 경험 법칙 - 옥텟 규칙
옥텟 규칙은 원자들이 화학 결합을 통해 최외각 전자껍질에 8개의 전자를 채워 비활성 기체와 같은 안정된 전자 배치를 이루려는 경향을 설명하는 규칙으로, 2주기 원소에 주로 적용되지만 예외가 많아 양자론적 접근이 필요하다. - 무기화학 - 알칼리
알칼리는 아랍어에서 유래하여 식물 재를 의미하며, 물에 녹아 수산화 이온을 생성하고 pH가 높으며 부식성이 있고 피부에 미끈거리는 특징을 보이는 물질을 지칭하며, 염기의 하위 집합으로 알칼리 금속 또는 알칼리 토금속의 염기성 염, 또는 물에 녹아 수산화 이온을 형성하는 염기를 포함한다. - 무기화학 - 동소체
동소체는 동일한 원소로 이루어졌으나 원자 배열의 차이로 물리화학적 성질이 다른 물질을 지칭하며, 탄소의 다이아몬드와 흑연, 산소의 산소와 오존 등이 대표적인 예시이다. - 화학 결합 - 원자가 전자
원자가 전자는 원자의 최외각 전자껍질에 존재하며 화학적 성질을 결정하는 데 중요한 역할을 하고, 주족 원소는 최외각 전자껍질의 전자로 정의되지만 전이 원소는 (n-1)d 궤도의 전자도 포함하며, 주기율표 족에 따라 예측 가능하지만 예외도 존재하고, 화학 결합, 산화 상태, 전기 전도도에 영향을 미친다. - 화학 결합 - 파울리 배타 원리
파울리 배타 원리는 1925년 볼프강 파울리가 제시한 양자역학 원리로, 동일한 페르미온은 동일한 양자 상태에 존재할 수 없으며, 원자의 전자 배치, 화학 결합, 천체 특성 등을 설명하는 데 중요한 역할을 한다.
| 18 전자 규칙 | |
|---|---|
| 개요 | |
| 명칭 | 18 전자 규칙 |
| 다른 명칭 | 유효 원자 번호 규칙 (EAN 규칙) 옥텟 규칙 (화학 분야에서 확장된 형태) |
| 설명 | 전이 금속 화합물에서 금속 중심이 18개의 원자가 전자를 갖는 경향을 설명하는 규칙 |
| 적용 대상 | 주로 유기 금속 화학 및 배위 화학 분야의 화합물 |
| 중요성 | 화합물의 안정성, 반응성 및 구조 예측에 유용하게 사용됨 |
| 규칙 상세 | |
| 내용 | 전이 금속 원자는 결합을 형성할 때 자신의 원자가 껍질에 있는 전자 외에 리간드로부터 전자를 받아 18개의 전자를 가지려고 함 이는 전이 금속의 (n-1)d 오비탈 5개, ns 오비탈 1개, np 오비탈 3개를 모두 채워 안정한 전자 배치를 이루려는 경향 때문임 |
| 유효 원자 번호 (EAN) 계산 | EAN = 금속 원자의 원자 번호 - 금속 이온의 전하 + 리간드로부터 제공된 전자 수 |
| 예외 | 모든 전이 금속 화합물이 18 전자 규칙을 따르는 것은 아님 일부 화합물은 16 전자 또는 20 전자 규칙을 따르기도 함 특히, 부피가 큰 리간드가 있는 경우나 금속이 높은 산화 상태에 있는 경우 예외가 자주 발생함 |
| 역사 | |
| 기원 | 길버트 N. 루이스의 옥텟 규칙에서 유래 이르빙 랭뮤어가 1921년 옥텟 규칙을 확장하여 유효 원자 번호 개념을 도입 |
| 발전 | 1938년 시드니 민턴 새지윅이 전이 금속 화합물에 적용하여 현재의 18 전자 규칙으로 발전시킴 |
| 적용 예시 | |
| 테트라카르보닐니켈 (Ni(CO)4) | 니켈 (원자 번호 28)은 4개의 카르보닐 리간드로부터 8개의 전자를 받아 총 36개의 전자 (크립톤의 전자 수)를 가짐 (28 - 0 + 8 = 36) |
| 철펜타카르보닐 (Fe(CO)5) | 철 (원자 번호 26)은 5개의 카르보닐 리간드로부터 10개의 전자를 받아 총 36개의 전자 (크립톤의 전자 수)를 가짐 (26 - 0 + 10 = 36) |
| 관련 개념 | |
| 옥텟 규칙 | 주족 원소 화합물에서 원자가 전자가 8개가 되려는 경향 |
| 유기 금속 화학 | 금속-탄소 결합을 포함하는 화합물을 다루는 학문 |
| 배위 화학 | 금속 이온과 리간드 간의 결합을 다루는 학문 |
2. 이온형 방식과 공유형 방식
18 전자 규칙을 따르는 착화합물의 전자 수를 계산하는 데는 이온형 방식과 공유형 방식 두 가지가 있다.[1] 이온형 방식은 전기음성도가 높은 리간드가 중심 금속에 전자를 제공한다고 가정하며, 공유형 방식은 리간드와 중심 금속이 각각 전자를 하나씩 제공하여 결합을 형성한다고 가정한다.
2. 1. 이온형 방식
전기음성도가 더 높은 리간드에서 중심 금속으로 전자를 제공한다고 가정한다. 이온형 방식을 이용하여 전자를 계산하는 순서는 다음과 같다.[1]# 전이금속화합물에 존재하는 리간드가 제공하는 전자의 수를 센다. 각 리간드는 중심 금속에 결합하기 전에 이미 8전자 규칙을 만족하는 상태로 간주한다.[1]
# 전체 금속 화합물이 중성인지 이온 상태인지에 따라 중심 금속의 산화수를 결정하고 중심 금속의 전자 수를 센다.[1]
# 1과 2의 전자 수를 합하여 18이 되는지 확인한다.[1]
2. 2. 공유형 방식
공유형 방식은 리간드와 중심 금속이 각각 1개의 전자를 제공하여 결합을 형성한다고 가정한다. 리간드와 중심 금속의 중성 상태 전자 수를 더한 후, 착화합물의 전하를 고려하여 전자 수를 계산한다.계산 순서는 다음과 같다.
# 전이 금속 화합물에 존재하는 리간드가 제공하는 전자의 수를 센다.
# 중성 상태의 중심 금속이 지니는 전자의 수를 센다.
# 1과 2의 전자 수를 더한다.
# 전체 금속 화합물이 중성인지 이온 상태인지에 따라 3의 전자 수에서 더하거나 뺀다. 이 4의 전자 수가 18이 되는지 확인한다.
3. 18전자 규칙의 적용 예시
18 전자 규칙은 Cr, Mn, Fe, Co 삼원소의 저스핀 착물의 화학식을 예측하는 데 유용하다. 페로센, 철 펜타카르보닐, 크롬 카르보닐, 니켈 카르보닐 등이 대표적인 예이다.[1]
착물 내 리간드는 18 전자 규칙의 적용 가능성을 결정한다. 일반적으로 규칙을 따르는 착물은 적어도 부분적으로 π-수용성 리간드(π-산)로 구성된다. 이러한 리간드는 강한 리간드장을 발휘하여 분자 궤도의 에너지를 낮춘다. 일반적인 리간드에는 올레핀, 포스핀, CO 등이 있다. π-산의 착물은 금속이 낮은 산화 상태를 갖는 경우가 많다.[1]
3. 1. CoCp2+
CoCp2+영어는 이온형 방식과 공유형 방식 모두에서 18전자 규칙을 만족한다.- 이온형 방식
# Cp 리간드는 -1의 전하를 띠며, 6개의 전자를 제공한다. 2개의 Cp 리간드가 존재하므로 총 12개의 전자를 제공한다.[1]
# 전체 화합물이 +1의 전하를 띠고, 2개의 Cp 리간드가 각각 -1의 전하를 띠므로, Co는 +3의 전하를 띤다. 중성 상태의 Co (0)는 d 오비탈에 9개의 전자를 가지므로 Co (III)은 6개의 전자를 지닌다.[1]
# 리간드가 12개의 전자를 제공하고, Co가 6개의 전자를 가지므로 전체 화합물은 18 전자 규칙을 만족한다.[1]
- 공유형 방식
# Cp 리간드는 중성으로 간주하며, 5개의 전자를 제공한다. 2개의 Cp 리간드가 존재하므로 총 10개의 전자를 제공한다.[1]
# 중성 상태의 Co는 9개의 전자를 지닌다.[1]
# 총 19개의 전자가 존재한다.[1]
# 전체 화합물이 +1의 전하를 띠므로, 19개에서 1개를 빼면 18개의 전자를 지니고 18전자 규칙을 만족한다.[1]
3. 2. 페로센, 철 펜타카르보닐, 크롬 카르보닐, 니켈 카르보닐
페로센, 철 펜타카르보닐, 크롬 카르보닐, 니켈 카르보닐 등은 18 전자 규칙을 따르는 대표적인 예시이다.[1]착물 내 리간드는 18 전자 규칙의 적용 가능성을 결정한다. 일반적으로, 규칙을 따르는 착물은 적어도 부분적으로 π-수용성 리간드(π-산이라고도 함)로 구성된다. 이러한 종류의 리간드는 매우 강한 리간드장을 발휘하여 결과적인 분자 궤도의 에너지를 낮추어 유리하게 점유되도록 한다. 일반적인 리간드에는 올레핀, 포스핀, CO 등이 있다. π-산의 착물은 일반적으로 금속이 낮은 산화 상태를 특징으로 한다. 산화 상태와 리간드의 특성 간의 관계는 π 역결합의 틀 내에서 합리화된다.[1]
4. 유효 원자 번호 규칙
금속 착물에서 중심 금속의 유효 원자 번호 (금속의 전자 수 + 리간드로부터 제공받은 전자 수)가 비활성 기체의 원자 번호와 같으면 착물이 안정하다는 규칙이다. 18 전자 규칙은 유효 원자 번호 규칙의 특수한 경우로 볼 수 있다.
금속 착체에서는 배위 결합에 의해 배위자의 전자가 중심 금속에 공여된다. 이 공여된 전자는 금속 원자의 원자가 궤도에 들어가게 된다. 따라서 금속 원자의 전자 배치는 (금속 자신이 가진 전자 수) + (배위자로부터 공여된 전자 수)의 원자 번호를 가진 원자의 전자 배치와 같은 것으로 생각할 수 있다. 그래서 (금속 자신이 가진 전자 수) + (배위자로부터 공여된 전자 수)를 해당 착체의 '''유효 원자 번호'''라고 한다.
'''유효 원자 번호 규칙'''은 금속 착체의 성질이 해당 착체의 유효 원자 번호와 원자 번호가 같은 원자의 성질과 유사하다는 것이다.
예를 들어, 헥사암민코발트(III) 이온은 유효 원자 번호가 36이므로 원자 번호 36의 크립톤과 유사하며, 비활성 기체처럼 안정성이 높다고 여겨진다. 한편, 테트라카르보닐코발트(0)인 Co(CO)4는 유효 원자 번호가 35이므로, 브로민과 유사하여 브로민화물 이온이 안정적인 것처럼 1전자 환원된 [Co(CO)4]-가 안정적이며, 또한 브로민이 2원자 분자를 형성하듯이 두 착체가 결합하여 Co2(CO)8이 생성된다.
금속 원자가 비활성 기체와 동일한 전자 배치를 가질 경우 착체가 안정하다는 것을 표현한 것으로 '''18 전자 규칙'''이 있다. 이는 d-블록 원소의 착체에서 (금속 자신이 가진 d 전자 수) + (배위자로부터 공여된 전자 수)가 18이 되는 착체가 안정성이 높다는 것이다. 18이라는 전자 수는 d-블록 원소의 원자가 궤도인 5개의 nd 궤도, 1개의 (n+1)s 궤도, 3개의 (n+1)p 궤도가 채워져 비활성 기체와 동일한 전자 배치가 되는 전자 수이다. 즉, 유효 원자 번호 규칙이 전자 배치 전체를 고려하는 데 반해, 18 전자 규칙은 원자가 궤도만의 전자 배치를 고려한 것으로, 동일한 내용을 다른 표현으로 나타낸 것이라고 할 수 있다.
5. 18전자 규칙의 예외
18전자 규칙은 경험적인 규칙이며, 항상 성립하는 것은 아니다. 금속 이온의 산화수가 증가함에 따라 그룹 아래로 증가하는 경향이 있는데, 강한 리간드장은 저스핀 착물을 생성하며, 이는 18전자 규칙에 대한 몇 가지 예외를 발생시킨다.
몇 가지 추가적인 예시는 다음과 같다.
- Cp*VOCl2 (14 e−)
- TiCl4 (8 e−)
5. 1. 16전자 규칙
d 오비탈에 8개의 전자를 지닌 d8 금속의 경우, 전자가 채워지지 않은 하나의 d 오비탈의 에너지가 더 높아서 18 전자 규칙이 아닌 16 전자 규칙을 만족할 때가 있다. 이런 예외적 경우는 평면사각형구조를 지닌 Ni(II), Pd(II), Pt(II) 등의 전이금속화합물에서 흔히 발견된다. 18 전자 규칙은 경험적인 규칙이다.18 전자 규칙을 위반하는 중요한 부류의 착물은 금속 d8 배치를 갖는 16 전자 착물이다. 모든 고스핀 d8 금속 이온은 팔면체 (또는 사면체)이지만, 저스핀 d8 금속 이온은 모두 사각 평면형이다.[2] 사각 평면형 저스핀 d8 금속 이온의 중요한 예로는 Rh(I), Ir(I), Ni(II), Pd(II) 및 Pt(II)가 있다.[2] 아래 그림은 저스핀 사각 평면 착물에서 d 부껍질의 분할을 보여준다.[2] 예시는 코발트 및 니켈 삼족의 유도체에서 특히 널리 퍼져있다.[2] 이러한 화합물은 전형적으로 사각 평면형이다.[2] 가장 유명한 예로는 바스카 착물 (IrCl(CO)(PPh3)2), [PtCl4]2− 및 자이세의 염 [PtCl3(''η''2-C2H4)]−이 있다.[2] 이러한 착물에서 d''z''2 오비탈은 이중으로 채워져 있고 비결합성이다.[2]
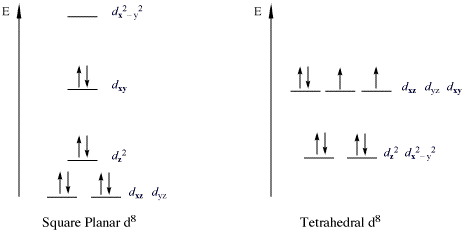
많은 촉매 사이클은 18 전자와 사각 평면 16 전자 배치를 번갈아 가며 사용하는 착물을 통해 작동한다.[3] 예로는 몬산토 초산 합성, 수소화 반응, 하이드로포밀화 반응, 올레핀 이성질화 반응 및 일부 알켄 중합 반응이 있다.[3]
다른 위반 사항은 금속 중심에 있는 리간드의 종류에 따라 분류할 수 있다.[3]
5. 2. 부피가 큰 리간드
부피가 큰 리간드는 금속이 18 전자 배치를 달성할 수 있도록 리간드의 접근을 막을 수 있다.| 예시 | 전자 수 |
|---|---|
| Ti(네오펜틸)4 | 8 e− |
| Cp*2Ti(C2H4) | 16 e− |
| V(CO)6 | 17 e− |
| Cp*Cr(CO)3 | 17 e− |
| Pt(PtBu3)2 | 14 e− |
| Co(노보르닐)4 | 13 e− |
| [FeCp2]+ | 17 e− |
때때로 이러한 착물은 부피가 큰 리간드의 탄화수소 골격과 아고스틱 상호작용을 한다. 예를 들어, W(CO)3[P(C6H11)3]2는 16 e−를 가지지만 하나의 C–H 결합과 W 중심 사이에 짧은 결합 접촉이 있다. Cp(PMe3)V(CHCMe3) (14 e−, 반자성)는 '알킬리덴-H'와 짧은 V–H 결합을 가지므로 화합물에 대한 설명은 Cp(PMe3)V(CHCMe3)와 Cp(PMe3)V(H)(CCMe3) 사이 어딘가에 있다.
5. 3. 고스핀 착물
고스핀 금속 착물은 단일 점유된 오비탈을 가지며, 리간드가 전자 밀도를 기증할 수 있는 비어있는 오비탈을 갖지 않을 수 있다. 일반적으로, 착물 내에는 π 산성 리간드가 거의 또는 전혀 없다. 이러한 단일 점유된 오비탈은 라디칼 리간드(예: 산소)의 단일 점유된 오비탈과 결합할 수 있으며, 또는 강한 장 리간드의 첨가는 전자 쌍을 형성하여 기증할 수 있는 비어있는 오비탈을 생성할 수 있다.예시:
- CrCl3(THF)3 (15 e−)
- [Mn(H2O)6]2+ (17 e−)
- [Cu(H2O)6]2+ (21 e−, 아래 주석 참조)
강하게 π-공여하는 리간드를 포함하는 착물은 종종 18전자 규칙을 위반한다. 이러한 리간드에는 플루오린화물(F−), 산화물(O2−), 질화물(N3−), 알콕사이드 (RO−), 그리고 이미드(RN2−)가 있다.
예시:
- [CrO4]2− (16 e−)
- Mo(=NR)2Cl2 (12 e−)
Mo(=NR)2Cl2의 경우, 질소의 고립 전자쌍이 Mo에 실질적으로 기증되므로, 화합물을 16 e− 화합물로도 설명할 수 있다. 이는 짧은 Mo–N 결합 길이와 거의 180°인 Mo–N–C(R) 각도에서 확인할 수 있다.
반례:
- ''trans''-WO2(Me2PCH2CH2PMe2)2 (18 e−)
- Cp*ReO3 (18 e−)
이러한 경우, M=O 결합은 상대적으로 긴 결합 거리에서 반영되듯이 "순수한" 이중 결합(즉, 산소의 고립 전자쌍이 금속에 기증되지 않음)이다.
5. 4. π-공여 리간드
π-공여체 리간드는 리간드장이 약해 t2g 궤도의 에너지를 증가시킨다. 이러한 분자 궤도 함수는 비결합 또는 약한 반결합 궤도 함수가 된다(Δoct가 작음). 따라서 전자의 첨가 또는 제거는 착물의 안정성에 거의 영향을 미치지 않는다. 이 경우 d-전자의 수에 제한이 없으며 12~22개의 전자를 가진 착물이 가능하다. 작은 Δoct는 eg*의 채움을 가능하게 하고(>18 e−), π-공여체 리간드는 t2g 반결합(<18 e−)을 만들 수 있다. 이러한 유형의 리간드는 분광화학적 계열의 낮음에서 중간 부분에 위치한다. 예를 들어, [TiF6]2− (Ti(IV), d0, 12 e−), [Co(NH3)6]3+ (Co(III), d6, 18 e−), [Cu(OH2)6]2+ (Cu(II), d9, 21 e−)이 있다.5. 5. 기타 예외
일부 착물은 18개 이상의 전자를 가지는 경우가 있다. 예를 들면 다음과 같다.- 코발토센 (19 e−)
- 니켈로센 (20 e−)
- 헥사아쿠아구리(II) 이온 [Cu(H2O)6]2+ (21 e−)
- ''TM''(CO)8− (''TM'' = Sc, Y) (20 e−)
착물이 18개 이상의 최외각 전자를 갖는 경우는 종종 정전기적 힘에 기인한다. 금속은 양전하를 상쇄하기 위해 리간드를 끌어당기며, 결과적으로 얻는 전자의 수는 중요하지 않다. 메탈로센의 경우, 사이클로펜타디에닐 리간드의 킬레이트화 특성이 금속과의 결합을 안정화시킨다. 코발토센은 강력한 전자 공여체로서, 18전자 코발토세늄 양이온을 쉽게 형성한다. 니켈로센은 기질과 반응하여 CpNiCl(PR3) 및 자유 CpH와 같은 18전자 착물을 생성하는 경향이 있다.
니켈로센의 경우, 추가된 두 개의 전자는 금속-탄소 반결합성 궤도에 위치한다. 이것이 니켈로센이 M–C 결합이 파괴되고 금속의 전자 수가 18개로 변하는 반응에 자주 참여하는 이유이다.[9]
20전자 시스템 TM(CO)8− (TM = Sc, Y)는 입방형 (''O''h) 평형 기하 구조와 싱글렛 (1A1g) 전자 바닥 상태를 갖는다. a2u 대칭성을 갖는 점유된 최외각 분자 궤도(MO)가 하나 있으며, 이는 금속 원자 궤도(AO)의 기여 없이 리간드 궤도만으로 형성된다. 그러나 부가물 TM(CO)8− (TM=Sc, Y)는 금속-리간드 결합 궤도를 점유하는 최외각 전자를 고려할 때 18전자 규칙을 충족한다.[10]
6. 18전자 규칙과 반응성
18 전자 규칙을 따르는 화합물은 일반적으로 "교환 불활성"이다. 예시로는 [Co(NH3)6]Cl3, Mo(CO)6, [Fe(CN)6]4− 등이 있다. 이러한 경우, 일반적으로 리간드 교환은 해리성 치환 메커니즘을 통해 발생하며, 반응 속도는 리간드의 해리 속도에 의해 결정된다. 반면에 18 전자 화합물은 양성자와 같은 친전자체에 대해 매우 반응성이 높을 수 있으며, 이러한 반응은 메커니즘상 부가 반응이며 산-염기 반응이다.
18개 미만의 원자가 전자를 가진 착물은 반응성이 향상되는 경향이 있다. 따라서 18 전자 규칙은 종종 화학량론적 또는 촉매 측면에서 비활성의 지침이 된다. 유효 원자 번호가 비활성 기체와 같은 착체는, 배위자가 더 부가되거나 탈리되면 유효 원자 번호가 비활성 기체와 달라지기 때문에 불안정해진다. 따라서 그러한 반응은 일어나기 어렵다. 그래서 '''배위 포화'''라고 불린다. 한편, 유효 원자 번호가 비활성 기체보다 짝수 개 적은 착체는, 배위자가 몇 개 더 부가되면 유효 원자 번호가 비활성 기체와 같아져 안정해진다. 따라서 배위자의 부가 반응이 일어나기 쉽다. 그래서 '''배위 불포화'''라고 불린다. 촉매 반응에서는 반응하는 기질이 더 배위할 여지가 있는 배위 불포화 착체의 존재가 중요한 경우가 많다.
7. 12전자 규칙
일부 계산 결과에 따르면 금속의 원자가 p-오비탈은 금속-리간드 결합에 약하게 참여하므로, 12전자 규칙이 적용될 수 있다.[3] 하지만, 자연 결합 오비탈의 맥락에서 Weinhold와 Landis는 금속 p-오비탈을 금속-리간드 결합에 포함시키지 않으며,[4] 이러한 오비탈은 여전히 편광 함수로 포함된다.
일반 화학계의 현재 합의는 주족 원소에 대한 단일 옥텟 규칙과 달리, 전이 금속은 12전자 규칙 또는 18전자 규칙을 엄격하게 따르지 않으며, 해당 규칙은 각각 원자가 전자 수의 하한과 상한을 설명한다는 것이다.[5][6] 따라서 전이 금속 d-오비탈 및 s-오비탈 결합은 쉽게 발생하지만, 에너지 준위가 높고 공간적으로 더 퍼져 있는 p-오비탈의 결합 참여는 중심 원자와 배위 환경에 따라 달라진다.[7][8]
참조
[1]
논문
Types of Valence
https://zenodo.org/r[...]
[2]
논문
The Origin of the 18-Electron Rule
2005
[3]
서적
The Chemical Bond: Chemical Bonding Across the Periodic Table
Wiley-VCH
2014-05
[4]
논문
Valence and extra-valence orbitals in main group and transition metal bonding
[5]
논문
The Nature of the Bonding in Transition-Metal Compounds
[6]
논문
Chemical Bonding and Bonding Models of Main-Group Compounds
[7]
논문
Prediction of the Geometries of Simple Transition Metal Polyhydride Complexes by Symmetry Analysis
[8]
논문
Structure and bonding in homoleptic transition metal hydride anions
[9]
서적
Synthesis and Technique in Inorganic Chemistry
University Science Books
[10]
논문
Octacarbonyl Anion Complexes of Group Three Transition Metals [TM(CO)8]− (TM=Sc, Y, La) and the 18-Electron Rule
2018-04-25
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com