베타 병풍
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
베타 병풍은 폴리펩타이드 사슬의 이차 구조 중 하나로, 1930년대에 윌리엄 애스버리에 의해 처음 제안되었고, 1951년 라이너스 폴링과 로버트 코리에 의해 개선되었다. 인접한 폴리펩타이드 사슬의 방향에 따라 평행 또는 역평행 구조로 나뉘며, 펩타이드 결합 사이의 수소 결합으로 넓게 펼쳐진 병풍 모양을 이룬다. 베타 병풍은 다양한 단백질 구조 모티프를 형성하며, 구상 단백질과 섬유상 단백질 모두에서 발견된다. 또한, 아밀로이드 베타와 같은 단백질의 병리학적 상태에서 β-시트가 풍부한 올리고머 구조 형성을 유도하여 알츠하이머병과 같은 질병의 원인이 되기도 한다.
더 읽어볼만한 페이지
| 베타 병풍 | |
|---|---|
| 개요 | |
| 유형 | 단백질 구조 모티프 |
| 설명 | 펩타이드 골격의 수소 결합을 통해 형성된 단백질 2차 구조의 한 유형 |
| 구조적 특징 | |
| 수소 결합 | 펩타이드 골격 간 수소 결합 형성 |
| 형태 | 주름진 형태 |
| 종류 | |
| 평행 베타 시트 | 인접 가닥이 같은 방향으로 배열 |
| 역평행 베타 시트 | 인접 가닥이 반대 방향으로 배열 |
| 혼합 베타 시트 | 평행 및 역평행 가닥이 혼합 |
| 관련 구조 | |
| 알파 나선 | 또 다른 일반적인 단백질 2차 구조 |
| 상호 작용 다이어그램 | |
 | |
 | |
 | |
2. 역사
1930년대 말 라이너스 폴링과 로버트 코리는 폴리펩타이드 사슬의 알파 나선 구조에 이어 두 번째로 반복 구조인 베타 병풍구조를 예측했다.[40]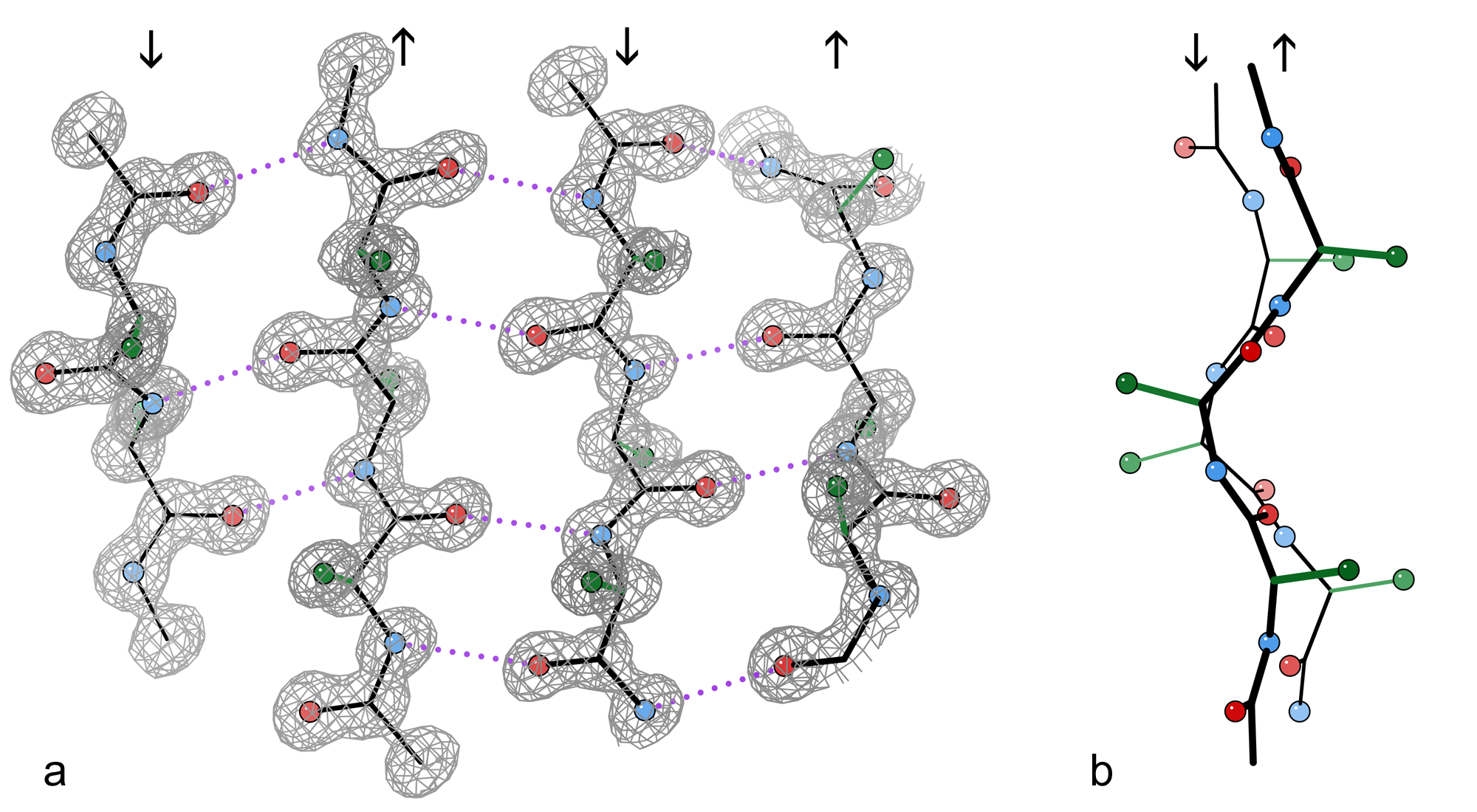
윌리엄 애스버리가 최초로 β-시트 구조를 제안했으나, 펩타이드 결합이 평면이라는 사실을 알지 못하는 등 아미노산 결합 기하학에 대한 데이터가 부족하여 정확한 모델을 제시하지는 못했다. 이후 1951년 폴링과 코리가 펩타이드 결합의 평면성을 고려한 개선된 모델을 제안하였다.[40]
2. 1. 초기 연구
윌리엄 애스버리는 1930년대에 최초로 β-시트 구조를 제안했다.[40] 그는 평행하거나 역평행하게 확장된 β-가닥의 펩타이드 결합 사이에 수소 결합을 한다는 아이디어를 제시했다. 그러나 애스버리는 아미노산의 결합 기하학에 대한 정확한 데이터를 가지고 있지 않았고, 특히 펩타이드 결합이 평면이라는 것을 알지 못했다.[40]2. 2. 폴링과 코리의 모델
1930년대 윌리엄 애스버리는 평행하거나 역평행하게 확장된 β-가닥의 펩타이드 결합 사이에 수소 결합을 한다는 아이디어를 바탕으로 최초의 β-시트 구조를 제안했다.[40] 그러나 애스버리는 정확한 모델을 구축하는 데 필요한 아미노산의 결합 기하학에 대한 데이터를 가지고 있지 않았고, 특히 펩타이드 결합이 평면이라는 것을 알지 못했다. 1951년 라이너스 폴링과 로버트 코리는 펩타이드 결합의 평면성을 포함하는 개선된 β-시트 모델을 제안했다.[40] 폴링과 코리는 케토-에놀 호변이성화를 통해 펩타이드 결합의 평면성을 설명했다.3. 구조
최초의 β-시트 구조는 1930년대 윌리엄 애스버리가 제안했다. 그는 평행하거나 역평행하게 확장된 β-가닥의 펩타이드 결합 사이에 수소 결합이 있다는 아이디어를 제시했다. 그러나 애스버리는 아미노산의 결합 기하학에 대한 정확한 데이터를 가지고 있지 않았고, 특히 펩타이드 결합이 평면이라는 것을 알지 못했다. 1951년 라이너스 폴링과 로버트 코리가 개선된 버전을 제안했는데, 그들의 모델은 펩타이드 결합의 평면성을 포함하고 있었다.[40]
3. 1. 기본 구조
폴리펩타이드 사슬의 방향(N말단에서 C말단으로의 방향)에 따라 같은 방향인 평행(parallel) 또는 반대 방향인 역평행(antiparallel) 베타 구조로 구별된다. 두 구조의 반복 간격은 다소 차이가 나는데 평행한 배열은 6.5Å인데 비해 역평행한 배열은 7Å로 평행한 배열의 구조가 짧고 수소결합의 양상도 복잡하다.역평행 배열에서는 각 아미노산의 아민기와 카복실기가 인접한 사슬의 짝이 되는 아미노산의 아민기와 카복실기에 각각 수소결합으로 연결되어 있다.[40] 평행 배열에서는 한 아미노산의 아민기는 인접한 아미노산의 카복실기와 수소결합을 하는데 반해 카복실기는 사슬의 방향을 따라 두 개의 잔기만큼 더 앞에 위치해 있는 아미노산의 아민기와 수소결합을 하고 있다.[40]
이러한 방식으로 결합을 하게 되면 마치 병풍처럼 넓게 펼쳐진 모양을 띄기 때문에 베타 병풍이라는 이름이 붙었다.
β-병풍의 대부분은 다른 가닥 옆에 배열되어 있으며, 이웃과 광범위한 수소 결합 네트워크를 형성한다. 이때 한 가닥의 주쇄에 있는 N−H 그룹은 인접한 가닥의 주쇄에 있는 C=O 그룹과 수소 결합을 형성한다. 완전히 펴진 β-가닥에서 연속적인 측쇄는 교대로 위와 아래를 가리킨다. β-시트의 "주름진" 모양은 Cα 원자에서의 사면체 화학 결합에서 비롯된다.
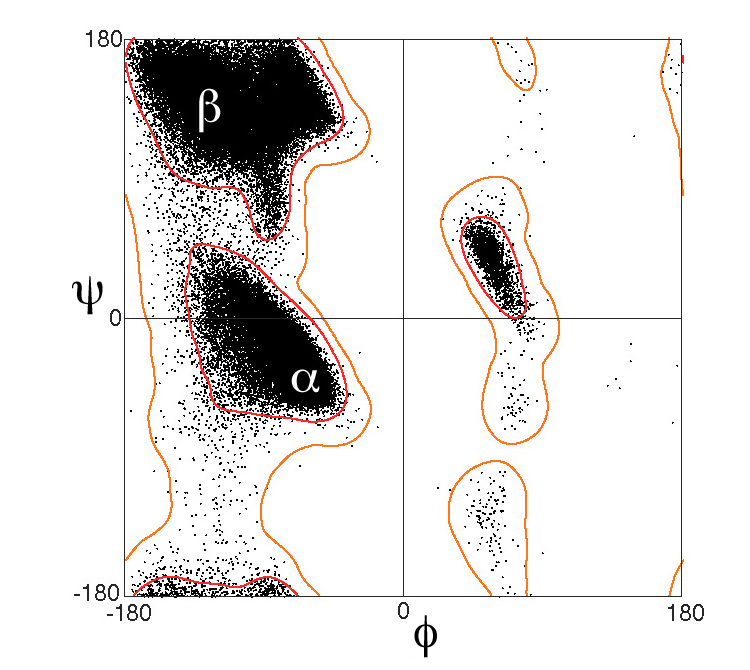
β-가닥은 거의 완벽하게 펴지지 않으며, 오히려 비틀림을 나타낸다. 에너지적으로 선호되는 이면각은 (''φ'', ''ψ'') = (–135°, 135°) 근처이며, (넓게는, 라마찬드란 플롯의 왼쪽 위 영역) 완전히 펴진 컨포메이션 (''φ'', ''ψ'') = (–180°, 180°)과 크게 다르다.[1]
펩타이드 사슬은 N-말단과 C-말단에 의해 방향성을 가지기 때문에 β-가닥도 방향성을 갖는다. 인접한 β-가닥은 역평행, 평행 또는 혼합 배열로 수소 결합을 형성할 수 있다.
역평행 배열에서 연속적인 β-가닥은 방향을 교대로 하여 한 가닥의 N-말단이 다음 가닥의 C-말단에 인접하도록 한다. 펩타이드 골격 이면각 (''φ'', ''ψ'')은 역평행 시트에서 약 (–140°, 135°)이다.
평행 배열에서 연속 가닥의 모든 N-말단은 동일한 방향으로 정렬된다. 이 방향은 가닥 간 수소 결합 패턴에 비평면성을 도입하기 때문에 약간 덜 안정적일 수 있다. 이면각 (''φ'', ''ψ'')은 평행 시트에서 약 (–120°, 115°)이다.
평행 β-시트 구조에서 두 개의 원자 Cα''i''와 Cα''j''가 두 개의 수소 결합된 β-가닥에서 인접해 있다면 서로 수소 결합을 하지 않는다. 대신 한 잔기는 다른 잔기를 둘러싼 잔기에 수소 결합을 형성한다(그러나 그 반대는 아니다).
β-가닥의 수소 결합은 완벽할 필요는 없지만 β-팽윤으로 알려진 국소적 방해를 나타낼 수 있다.
수소 결합은 시트의 평면에 대략 놓여 있으며, 펩타이드 카르보닐 그룹은 연속 잔기로 번갈아 가며 다른 방향을 향한다.

측쇄는 주름의 접힌 부분에서 바깥쪽으로 시트 평면에 거의 수직으로 뻗어 있다. 연속적인 아미노산 잔기는 시트의 교호적인 면에서 바깥쪽을 향하고 있다.
3. 2. 기하학적 특징
β-병풍은 대부분 다른 가닥 옆에 배열되어 이웃과 광범위한 수소 결합 네트워크를 형성하며, 여기서 한 가닥의 주쇄에 있는 N−H 그룹은 인접한 가닥의 주쇄에 있는 C=O 그룹과 수소 결합을 형성한다.[40] 완전히 펴진 β-가닥에서 연속적인 곁사슬(측쇄)은 교대로 위와 아래를 가리킨다. β-시트의 인접한 β-가닥은 Cα 원자가 인접하고 곁사슬이 같은 방향을 가리키도록 정렬된다. β-가닥의 "주름진" 모양은 Cα 원자에서의 사면체 화학 결합에서 비롯된다. 예를 들어, 곁사슬이 똑바로 위를 가리키면, C′으로의 결합은 약간 아래로 가리켜야 하는데, 그 결합각이 약 109.5°이기 때문이다. 주름짐은 Cα''i''와 Cα''i'' + 2 사이의 거리가 6Å으로, 완전히 펴진 두 개의 트랜스 펩타이드에서 예상되는 7.6Å보다 작게 만든다.[40] 수소 결합된 β-가닥에서 인접한 Cα 원자 사이의 "옆으로"의 거리는 대략 5Å이다.그러나 β-가닥은 거의 완벽하게 펴지지 않으며, 오히려 비틀림을 나타낸다. 에너지적으로 선호되는 이면각은 (''φ'', ''ψ'') = (–135°, 135°) 근처이며, (넓게는, 라마찬드란 플롯의 왼쪽 위 영역) 완전히 펴진 컨포메이션 (''φ'', ''ψ'') = (–180°, 180°)과 크게 다르다.[1] 비틀림은 종종 더 큰 시트에서 개별 β-가닥이 벌어지는 것을 방지하기 위해 이면각의 교대적인 변동과 관련이 있다. 강하게 비틀린 β-헤어핀의 좋은 예는 단백질 BPTI에서 볼 수 있다.
곁사슬은 주름의 접힌 부분에서 바깥쪽으로 향하며, 시트의 평면에 거의 수직으로 향한다. 연속적인 아미노산 잔류물은 시트의 교대적인 면에서 바깥쪽으로 향한다.
3. 3. 수소 결합 패턴
역평행 배열에서 연속적인 β-가닥은 방향을 교대로 하여 한 가닥의 N-말단이 다음 가닥의 C-말단에 인접하도록 한다. 이것은 가장 강력한 가닥 간 안정성을 생성하는 배열이며, 펩타이드 골격 이면각 (''φ'', ''ψ'')은 역평행 시트에서 약 (–140°, 135°)이다. 이 경우 두 개의 원자 C와 C가 두 개의 수소 결합된 β-가닥에서 인접해 있다면, 서로의 인접한 펩타이드 그룹에 대해 두 개의 상호 골격 수소 결합을 형성하는데, 이것을 '''닫힌 쌍'''의 수소 결합이라고 한다.[40]평행 배열에서 연속 가닥의 모든 N-말단은 동일한 방향으로 정렬된다. 이 방향은 가닥 간 수소 결합 패턴에 비평면성을 도입하기 때문에 약간 덜 안정할 수 있다. 이면각 (''φ'', ''ψ'')은 평행 시트에서 약 (–120°, 115°)이다.
평행 β-시트 구조에서 두 개의 원자 C와 C가 두 개의 수소 결합된 β-가닥에서 인접해 있다면 서로 수소 결합을 하지 않는다. 대신 한 잔기는 다른 잔기를 둘러싼 잔기에 수소 결합을 형성한다(그러나 그 반대는 아니다). 이것을 '''넓은 쌍'''의 수소 결합이라고 한다.
개별 가닥은 한쪽에는 평행 가닥, 다른 쪽에는 역평행 가닥이 있는 혼합 결합 패턴을 나타낼 수 있다. 이러한 배열은 무작위 방향 분포가 시사하는 것보다 덜 일반적이며, 이는 이 패턴이 역평행 배열보다 덜 안정함을 시사한다.
β-가닥의 수소 결합은 완벽할 필요는 없지만 β-팽윤으로 알려진 국소적 방해를 나타낼 수 있다.
3. 4. 아미노산 선호도
큰 방향족 잔기(티로신, 페닐알라닌, 트립토판)와 β-분지 아미노산(트레오닌, 발린, 이소류신)은 β-시트의 ''중간''에 있는 β-가닥에서 발견되는 경향이 있다. 프롤린과 같은 다양한 종류의 잔기는 β-시트의 ''가장자리'' 가닥에서 발견될 가능성이 있으며, 이는 단백질 간의 "가장자리 대 가장자리" 결합을 피하여 응집 및 아밀로이드 형성을 방지하기 위한 것으로 추정된다.[2]4. 일반적인 구조 모티프
베타 병풍의 일반적인 구조 모티프는 다음과 같다.
- '''β-헤어핀''': β-시트와 관련된 매우 간단한 구조 모티프이다.
- '''그리스 열쇠 모티프''': 네 개의 인접한 역평행 가닥과 이를 연결하는 루프로 구성된다.
- '''β-α-β 모티프''': 두 개의 평행 가닥 사이의 연결 루프는 거의 항상 오른쪽 교차 키랄성을 가진다.
- '''β-미앤더 모티프''': 두 개 이상의 연속적인 역평행 β-가닥이 베타 헤어핀 루프로 연결된 간단한 슈퍼세컨더리 단백질 토폴로지이다.
- '''Ψ-루프 모티프''': 두 개의 역평행 가닥과 이들 사이에 수소 결합으로 연결된 한 가닥으로 구성된다.
4. 1. β-헤어핀 (β-hairpin)

β-시트와 관련된 매우 간단한 구조 모티프는 β-헤어핀이다. β-헤어핀은 두 개의 역평행 가닥이 2~5개의 잔기로 이루어진 짧은 루프로 연결된 형태이며, 이 루프 중 하나는 종종 글리신 또는 프롤린이다. 글리신과 프롤린은 좁은 회전 또는 β-벌지 루프에 필요한 이면각 입체구조를 취할 수 있는 아미노산이다.[1] 개별 가닥은 α-나선을 포함할 수 있는 더 긴 루프로 더 정교하게 연결될 수도 있다.[1]
4. 2. 그리스 열쇠 모티프 (Greek key motif)

그리스 열쇠 모티프는 네 개의 인접한 역평행 가닥과 이를 연결하는 루프로 구성된다. 헤어핀으로 연결된 세 개의 역평행 가닥과, 첫 번째 가닥에 인접하고 더 긴 루프로 세 번째 가닥과 연결되는 네 번째 가닥으로 이루어진다. 이러한 구조는 단백질 접힘 과정에서 쉽게 형성된다.[3][4] 이 모티프의 이름은 그리스 장식 미술에서 흔히 사용되는 패턴(잔물결 무늬)에서 유래했다.
4. 3. β-α-β 모티프
모든 가닥은 구성 아미노산의 키랄성 때문에 대부분의 고차 β-병풍 구조에서 나타나는 오른쪽 나선형 뒤틀림을 나타낸다. 특히, 두 개의 평행 가닥 사이의 연결 루프는 거의 항상 오른쪽 교차 키랄성을 가지며, 이는 병풍의 고유한 뒤틀림에 의해 강하게 선호된다.[5] 이 연결 루프는 종종 나선형 영역을 포함하며, 이 경우 β-α-β 모티프라고 한다. β-α-β-α 모티프라고 하는 밀접하게 관련된 모티프는 가장 흔하게 관찰되는 단백질 3차 구조인 TIM 배럴의 기본 구성 요소를 형성한다.
4. 4. β-미앤더 모티프 (β-meander motif)
β-미앤더 모티프는 두 개 이상의 연속적인 역평행 β-가닥이 베타 헤어핀 루프로 연결된 간단한 슈퍼세컨더리 단백질 토폴로지이다.[7][8] 이 모티프는 β-시트에서 흔히 발견되며, β-배럴과 β-프로펠러를 포함한 여러 구조적 아키텍처에서 찾아볼 수 있다.
단백질 내 β-메안더 영역의 대부분은 다른 모티프 또는 폴리펩타이드 사슬의 다른 부분에 밀착되어, 전형적으로 접힌 구조의 형성을 유도하는 소수성 코어의 일부를 형성한다.[9] 그러나 몇 가지 주목할 만한 예외로, 전통적인 소수성 코어가 없는 상태에서 단일층 β-시트를 포함하는 Outer Surface Protein A (OspA) 변이체[6]와 Single Layer β-sheet Proteins (SLBPs)가 있다.[10] 이 β-풍부 단백질은 연장된 단일층 β-메안더 β-시트를 특징으로 하며, 이는 주로 개별 가닥을 연결하는 턴 영역에 존재하는 가닥 간 상호작용 및 소수성 상호작용을 통해 안정화된다.
4. 5. Ψ-루프 모티프 (Psi-loop motif)
Ψ-루프(psi-loop, Ψ-loop) 모티프는 두 개의 역평행 가닥과 이들 사이에 수소 결합으로 연결된 한 가닥으로 구성된다.[11] 단일 Ψ-루프에는 네 가지 가능한 가닥 토폴로지가 있다.[12] 이 모티프는 단백질 접힘 과정에서 형성될 가능성이 낮아 희귀하다. Ψ-루프는 아스파르트산 프로테아제 계열에서 처음 확인되었다.[12]5. 단백질 구조에서의 역할
베타 병풍 구조는 구상 단백질과 섬유상 단백질에서 모두 발견된다. 알파 나선 구조와 비교하면 더 부드럽고 유연한 성질을 보이며, 특히 실크를 구성하는 단백질인 파이브로인의 주요 구조이다.[40] 또한 베타 통 구조 등의 생화학적 구조물을 만드는데 영향을 준다.[41]
5. 1. 다양한 구조 형성
β-시트는 전-β, α+β, α/β 도메인에 존재하며, 전체적인 구조가 잘 정의되지 않은 많은 펩타이드 또는 작은 단백질에도 존재한다.[13][14] 전-β 도메인은 β-배럴, β-샌드위치, β-프리즘, β-프로펠러, β-나선을 형성할 수 있다.5. 2. 구조적 토폴로지
β-병풍의 토폴로지는 수소 결합된 β-가닥의 뼈대를 따라가는 순서를 설명한다. 예를 들어, 플라보독신 폴드는 토폴로지가 21345인 5가닥, 평행 β-병풍을 가지고 있다. 따라서 가장자리 가닥은 뼈대를 따라 β-가닥 2와 β-가닥 5이다. 명확히 설명하면, β-가닥 2는 β-가닥 1과 수소 결합을 하고, β-가닥 1은 β-가닥 3과 수소 결합을 하고, β-가닥 3은 β-가닥 4와 수소 결합을 하고, β-가닥 4는 β-가닥 5 (다른 가장자리 가닥)와 수소 결합을 한다. 같은 시스템에서, 위에 설명된 그리스 키 모티프는 4123 토폴로지를 갖는다. β-병풍의 이차 구조는 대략 가닥 수, 토폴로지, 그리고 수소 결합이 평행인지 반평행인지 여부를 통해 설명할 수 있다.β-병풍은 두 개의 가장자리 가닥을 갖는다는 의미에서 ''열린'' 구조일 수 있으며(예: 플라보독신 폴드 또는 면역글로불린 폴드), ''닫힌 β-배럴''일 수도 있다(예: TIM 배럴). β-배럴은 종종 ''엇갈림'' 또는 ''전단''으로 설명된다. 일부 열린 β-병풍은 매우 구부러져 자체적으로 접히거나(예: SH3 도메인) 말굽 모양을 형성한다(예: 리보뉴클레아제 억제제). 열린 β-병풍은 서로 마주 보게 조립될 수 있으며(예: β-프로펠러 도메인 또는 면역글로불린 폴드) 또는 가장자리 대 가장자리로 조립되어 하나의 큰 β-병풍을 형성할 수 있다.
5. 3. 동적 특징
β-병풍은 늘어난 β 가닥의 폴리펩타이드 사슬로 구성되며, 인접한 가닥끼리는 수소 결합으로 결합되어 있다.[33] 이처럼 늘어난 골격 구조를 가지므로 β 병풍은 늘어짐에 저항한다. 단백질의 β 병풍은 저주파 아코디언과 같은 운동을 할 가능성이 있으며, 이는 라만 분광법으로 관측되었고,[33] 준 연속체 모델로 해석되었다.[34]6. 평행 β-나선
β-나선은 짧은 루프로 연결된 2개 또는 3개의 짧은 β-가닥으로 구성된 반복적인 구조 단위로 형성된다. 이러한 단위는 나선형으로 서로 위에 "쌓여" 연속적인 동일한 가닥의 반복이 평행한 방향으로 서로 수소 결합을 한다.[17]
좌선형 β-나선에서 가닥 자체는 매우 곧고 비틀림이 없다. 그 결과 나선형 표면은 거의 평평하여 삼각 기둥 모양을 형성한다. 예로는 LpxA와 한 면에 Thr 측쇄가 규칙적으로 배열된 곤충 부동 단백질이 있다.[17] 
우선형 β-나선은 덜 규칙적인 단면을 가지며, 한쪽 면이 더 길고 들여쓰기되어 있다. 펙틴산 분해 효소 또는 P22 파지 테일스파이크 단백질이 대표적인 예시이다. 세 개의 링커 루프 중 하나는 일관되게 2개의 잔기로 짧고 다른 루프는 가변적이며 종종 결합 또는 활성 부위를 형성하도록 정교하게 만들어진다.[18] 
2면 β-나선(우선형)은 일부 세균성 금속 단백질 분해 효소에서 발견된다. 두 루프는 각각 6개의 잔기로 길고 GGXGXD 시퀀스 모티프의 골격과 Asp 측쇄 산소를 사용하여 구조의 무결성을 유지하기 위해 안정화 칼슘 이온을 결합한다.[19] 이 접힘은 SCOP 분류에서 β-롤이라고 한다.
7. 병리학적 연관성
아밀로이드 베타(아밀로이드 플라크 참조)와 같이, 단량체 상태에서는 무질서하거나 나선형으로 되어 있는 단백질 중에는 병리 과정에서 베타 시트에 풍부한 올리고머 구조를 형성하는 것이 있다. 알츠하이머의 원인으로, 아밀로이드 베타 단백질의 올리고머 형태가 관련되어 있다. 그 구조는 아직 완전히 해명되지 않았지만, 최근 데이터에서는 특이한 2본 가닥의 베타 나선과 유사할 가능성이 시사되고 있다.[20][38]
또한, 베타 시트 구조에 포함된 아미노산 잔기의 측쇄는 시트의 한쪽 면에 나타나는 측쇄의 대부분을 소수성으로 하고, 시트의 반대 면에서는 나타나는 측쇄의 대부분을 극성 또는 대전성(친수성)이 되도록 배치할 수도 있다.[21][39] 이는 시트가 극성(수성 환경)과 비극성(유성 환경)의 경계를 형성하는 경우에 유용하다.
참조
[1]
서적
Biochemistry
https://archive.org/[...]
Wiley
[2]
논문
Natural beta-sheet proteins use negative design to avoid edge-to-edge aggregation
2002-03
[3]
웹사이트
Tertiary Protein Structure and Folds: section 4.3.2.1
http://swissmodel.ex[...]
[4]
논문
The Greek key motif: extraction, classification and analysis
1993-04
[5]
서적
Anatomy and Taxonomy of Protein Structures
[6]
논문
Atomic structures of peptide self-assembly mimics
2006-11
[7]
웹사이트
SCOP: Fold: WW domain-like
http://scop.mrc-lmb.[...]
2007-06-01
[8]
웹사이트
PPS '96 – Super Secondary Structure
http://www.cryst.bbk[...]
2007-05-31
[9]
논문
Minimalist design of water-soluble cross-beta architecture
2010-02
[10]
논문
Structures of single-layer β-sheet proteins evolved from β-hairpin repeats
2019-09
[11]
논문
PROMOTIF--a program to identify and analyze structural motifs in proteins
1996-02
[12]
논문
HERA--a program to draw schematic diagrams of protein secondary structures
[13]
논문
SCOP: a structural classification of proteins database
1997-01
[14]
논문
SCOPe: Structural Classification of Proteins--extended, integrating SCOP and ASTRAL data and classification of new structures
2014-01
[15]
논문
Low-frequency modes in the Raman spectra of proteins
1982-07
[16]
논문
Low-frequency motions in protein molecules. Beta-sheet and beta-barrel
1985-08
[17]
논문
Mimicry of ice structure by surface hydroxyls and water of a beta-helix antifreeze protein
2000-07
[18]
서적
Introduction to Protein Structure
Garland
[19]
논문
Three-dimensional structure of the alkaline protease of Pseudomonas aeruginosa: a two-domain protein with a calcium binding parallel beta roll motif
1993-09
[20]
논문
Structure of the cross-beta pine of amyloid-like fibrils
2005-06
[21]
논문
Spontaneous assembly of a self-complementary oligopeptide to form a stable macroscopic membrane
1993-04
[22]
서적
Biochemistry
https://archive.org/[...]
Wiley
[23]
논문
Natural beta-sheet proteins use negative design to avoid edge-to-edge aggregation
2002-03
[24]
웹사이트
Tertiary Protein Structure and Folds: section 4.3.2.1
http://swissmodel.ex[...]
[25]
논문
The Greek key motif: extraction, classification and analysis
1993-04
[26]
서적
Anatomy and Taxonomy of Protein Structures
[27]
웹사이트
SCOP: Fold: WW domain-like
http://scop.mrc-lmb.[...]
2007-06-01
[28]
웹사이트
PPS '96 - Super Secondary Structure
http://www.cryst.bbk[...]
[29]
논문
PROMOTIF--a program to identify and analyze structural motifs in proteins
1996-02
[30]
논문
HERA--a program to draw schematic diagrams of protein secondary structures
[31]
논문
SCOP: a structural classification of proteins database
1997-01
[32]
논문
SCOPe: Structural Classification of Proteins--extended, integrating SCOP and ASTRAL data and classification of new structures
2014-01
[33]
논문
Low-frequency modes in the Raman spectra of proteins
1982-07
[34]
논문
Low-frequency motions in protein molecules. Beta-sheet and beta-barrel
1985-08
[35]
논문
Mimicry of ice structure by surface hydroxyls and water of a beta-helix antifreeze protein
2000-07
[36]
서적
Introduction to Protein Structure
Garland
[37]
논문
Three-dimensional structure of the alkaline protease of Pseudomonas aeruginosa: a two-domain protein with a calcium binding parallel beta roll motif
1993-09
[38]
논문
Structure of the cross-beta pine of amyloid-like fibrils
2005-06
[39]
논문
Spontaneous assembly of a self-complementary oligopeptide to form a stable macroscopic membrane
1993-04
[40]
웹인용
베타 병풍구조
https://terms.naver.[...]
2022-02-22
[41]
웹인용
베타 통형 구조
https://terms.naver.[...]
2022-02-22
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com