브래드퍼드 단백질 정량법
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
브래드퍼드 단백질 정량법은 쿠마시블루 G-250 염료의 흡광도 변화를 이용하여 단백질 농도를 측정하는 실험 기법이다. 산성 조건에서 염료는 단백질과 결합하여 파란색으로 변하며, 단백질-염료 복합체의 흡광도는 단백질 농도에 비례한다. 이 방법은 다른 단백질 정량법에 비해 간섭 물질의 영향이 적고, 간단하며 신속하게 실험할 수 있다는 장점이 있지만, 세제나 지질 등의 간섭을 받기 쉽고, 특정 단백질의 경우 정확도가 떨어질 수 있다. 실험 방법은 표준 용액과 미지 시료를 쿠마시블루 염료와 반응시킨 후 분광 광도계를 이용하여 흡광도를 측정하고, 표준 곡선을 통해 미지 시료의 단백질 농도를 계산하는 방식으로 진행된다.
더 읽어볼만한 페이지
- 화학 실험 - 뒤마법
뒤마법은 시료를 고온 연소시켜 질소를 측정하는 방법으로, 켈달법보다 빠르고 자동화가 용이하지만 초기 비용이 높고 비단백태 질소를 인식하는 한계가 있다. - 화학 실험 - 석회수
- 생화학 검출 반응 - 크산토프로테인 반응
크산토프로테인 반응은 단백질 내 방향족 아미노산이 진한 질산에 의해 니트로화되어 황색으로 변하고, 알칼리성 조건에서 등황색으로 변하는 단백질 검출 및 정성 분석에 사용되는 반응이다. - 생화학 검출 반응 - 산화효소 시험
산화효소 시험은 세균의 시토크롬 산화효소 유무를 확인하여 산소 이용 여부를 판단하고, 산화환원 지시약의 색상 변화로 결과를 판독하여 세균 분류 및 감염병 진단에 활용하는 생화학적 검사법이다. - 단백질 기법 - 녹색 형광 단백질
녹색 형광 단백질(GFP)은 해파리에서 발견된 단백질로, 특정 파장의 빛을 흡수하여 녹색 형광을 방출하며, 자체 발색단 형성 능력과 유전자 조작을 통한 개량형 개발로 생물학 연구에서 리포터 유전자로 널리 사용되지만, 실험 결과 해석 시 주의가 필요하고 대체 기술 또한 개발 중이다. - 단백질 기법 - 크산토프로테인 반응
크산토프로테인 반응은 단백질 내 방향족 아미노산이 진한 질산에 의해 니트로화되어 황색으로 변하고, 알칼리성 조건에서 등황색으로 변하는 단백질 검출 및 정성 분석에 사용되는 반응이다.
| 브래드퍼드 단백질 정량법 | |
|---|---|
| 개요 | |
| 이름 | 브래드포드 단백질 정량법 |
| 고안자 | 마리온 M. 브래드포드 |
| 개발 연도 | 1976년 |
| 원리 | 단백질-염료 결합 |
| 측정 | 분광광도법 |
| 파장 | 595 nm |
| 상세 정보 | |
| 목적 | 용액 내 단백질의 총 농도 측정 |
| 시약 | 쿠마시 브릴리언트 블루 G-250 염료 |
| 장점 | 빠르고 간편함 높은 감도 |
| 단점 | 단백질 종류에 따른 차이 계면활성제에 민감 |
| 응용 | 단백질 정제 효소 활성 측정 세포 용해물 분석 |
| 주의사항 | 표준 단백질 사용 권장 (BSA 등) |
| 원리 | |
| 염료 결합 | 쿠마시 브릴리언트 블루 G-250 염료가 단백질과 결합하여 색 변화 유발 |
| 색 변화 | 적색에서 청색으로 변화 |
| 흡광도 | 청색 형태의 염료 흡광도를 595 nm에서 측정 |
| 정량 | 흡광도와 단백질 농도는 비례 관계 |
| 방법 | |
| 준비 | 표준 단백질 용액 준비 (BSA 등) 브래드포드 시약 준비 |
| 반응 | 단백질 용액과 브래드포드 시약 혼합 후 일정 시간 반응 |
| 측정 | 분광광도계를 사용하여 595 nm에서 흡광도 측정 |
| 분석 | 표준 곡선을 이용하여 단백질 농도 계산 |
| 변형 | |
| 마이크로플레이트 분석 | 마이크로플레이트 리더를 사용하여 고처리량 분석 가능 |
| 개선된 시약 | 간섭 물질 최소화를 위한 다양한 시약 개발 |
| 참고 문헌 | |
| 원 논문 | Marion M. Bradford, Analytical Biochemistry, 72, 248-254 (1976) |
| 추가 자료 | 브래드포드 단백질 정량법 (영문 위키백과) |
2. 원리
브래드퍼드 정량법은 쿠마시블루 G-250이라는 염색약의 흡광도 차이를 이용한 실험 기법이다. 산성 조건에서는 붉은 색이였던 염색약이 푸른 색으로 바뀌게 되고, 단백질과 결합하게 된다. 이 쿠마시블루-단백질 복합체가 형성되는 도중에 붉은 형태의 쿠마시블루가 단백질의 이온화 가능한 부위에 전자를 준다. 이는 단백질의 중성 상태를 무너뜨리게 되면서 소수성 부위를 노출시키게 한다. 노출된 단백질의 소수성 부위는 염색약과 '''반데르발스 힘'''으로 비공유결합을 이루게 되며, 양전하를 띠는 아민(amine)기는 염색약의 음전하를 띠는 부위와 가깝게 위치를 조정한다. 아민기와 염색약의 음전하를 띠는 부위간의 이온 결합(ionic bond)은 염색약과 단백질의 결합을 더욱 강화시키는 역할을 한다. 단백질의 결합은 쿠마시블루 염색약의 파란 색 형태를 안정시키게 한다. 따라서 단백질-염색약 복합체의 수는 단백질 농도와 비례하며, 흡광도와 관련이 있게 된다.
단백질과 결합된 쿠마시블루 염색약은 595nm 파장의 빛을 가장 잘 흡수한다고 알려져 있다. 단백질과 결합하지 않은 양이온 형태의 염색약은 빨간색이나 초록색을 띤다. 단백질과 결합하게 되면 염색약은 음전하와 파란색을 띠게 된다. 595nm에서의 흡광도는 염색약과 단백질이 더욱 많이 결합할수록 높아지고, 이는 시료의 단백질 농도를 알려준다.
브래드퍼드 분석법은 색도 분석법 단백질 분석법으로, 염료 쿠마시 브릴리언트 블루 G-250의 흡광도 변화를 기반으로 한다. 쿠마시 브릴리언트 블루 G-250 염료는 음이온성(파란색), 중성(녹색), 양이온성(빨간색)의 세 가지 형태로 존재한다.[2] 산성 조건에서 염료의 빨간색 형태는 파란색 형태로 전환되어 분석 대상 단백질에 결합한다. 결합할 단백질이 없으면 용액은 갈색으로 유지된다. 염료는 반 데르 발스 힘을 통해 단백질의 카르복실기와 정전기적 상호 작용을 통해 아미노기와 강하고 비공유 결합 복합체를 형성한다.[3] 이 복합체 형성 과정에서 쿠마시 염료의 빨간색 형태는 먼저 자유 전자를 단백질의 이온화 가능한 그룹에 기증하여 단백질의 고유 상태를 파괴하고 그 결과 소수성 포켓을 노출시킨다. 단백질의 3차 구조에 있는 이 포켓은 첫 번째 결합 상호 작용(반 데르 발스 힘)을 통해 염료의 비극성 영역에 비공유 결합하며, 이로 인해 양전하를 띤 아민 그룹이 염료의 음전하와 근접하게 위치하게 된다. 결합은 두 번째 결합 상호 작용인 이온성 상호 작용에 의해 더욱 강화된다. 염료가 단백질에 결합하면 465 nm에서 595 nm로 이동하게 되며, 이것이 흡광도 측정이 595 nm에서 이루어지는 이유이다.[4]
양이온성(비결합) 형태는 녹색/빨간색이며, 역사적으로 465 nm에서 최대 흡수 스펙트럼을 갖는 것으로 알려져 있다. 소수성 및 이온성 상호 작용에 의해 함께 유지되는 염료의 음이온성 결합 형태는 역사적으로 595 nm에서 최대 흡수 스펙트럼을 갖는 것으로 알려져 있다.[5] 595 nm에서 흡광도 증가는 결합된 염료의 양, 즉 시료에 존재하는 단백질의 양(농도)에 비례한다.[6]
다른 단백질 분석법과 달리 브래드퍼드 단백질 분석법은 단백질 시료에 존재할 수 있는 여러 화학 물질, 예를 들어 나트륨, 칼륨 또는 수크로스와 같은 탄수화물의 간섭을 덜 받는다.[1] 주목할 만한 예외는 높은 농도의 세제이다. 일반적인 세제인 도데실황산나트륨 (SDS)은 막 지질 이중층을 파괴하여 세포를 용해하고 SDS-PAGE를 위해 단백질을 변성시키는 데 사용되기 때문에 단백질 추출물에서 발견될 수 있다. 다른 세제는 높은 농도에서 분석법을 방해하지만, SDS로 인한 간섭은 두 가지 다른 방식으로 발생하며, 각각 다른 농도에서 발생한다. SDS 농도가 쿠마시 염료 용액에서 임계 미셀 농도 (CMC, 0.00333%W/V ~ 0.0667%로 알려짐) 미만일 때 세제는 단백질과 강하게 결합하여 염료 시약에 대한 단백질 결합 부위를 억제하는 경향이 있다. 이로 인해 용액 내 단백질 농도가 과소평가될 수 있다. SDS 농도가 CMC 이상일 경우, 세제는 쿠마시 염료의 녹색 형태와 강하게 결합하여 평형을 이동시키고, 결과적으로 파란색 형태를 더 많이 생성한다. 이로 인해 단백질 존재 여부와 관계없이 595 nm에서 흡광도가 증가한다.[6]
다른 간섭은 단백질 시료를 준비할 때 사용되는 완충액에서 발생할 수 있다. 높은 농도의 완충액은 완충액의 공액 염기에서 용액으로부터 자유 양성자를 고갈시켜 단백질 농도를 과대평가하게 된다. 낮은 농도의 단백질(결과적으로 완충액)을 사용하면 이 문제는 발생하지 않는다.[6]
무색 화합물의 흡광도를 측정하려면 브래드퍼드 분석법을 수행해야 한다. 단백질과 같은 일부 무색 화합물은 트립토판, 티로신 및 페닐알라닌과 같은 방향족 고리의 존재로 인해 280 nm의 광학 밀도에서 정량화될 수 있지만, 이러한 아미노산이 존재하지 않으면 280 nm에서 흡수를 측정할 수 없다.[7]
2. 1. 염료와 단백질의 결합
브래드퍼드 정량법은 쿠마시블루 G-250 염색약의 흡광도 차이를 이용한 단백질 분석법이다.[2] 산성 조건에서 붉은색을 띠던 염료는 단백질과 결합하면 파란색으로 변한다.[3] 이 과정에서 붉은색 형태의 쿠마시블루는 단백질의 이온화 가능한 부위에 전자를 주어 단백질의 중성 상태를 무너뜨리고 소수성 부위를 노출시킨다. 노출된 소수성 부위는 염료와 '''반데르발스 힘'''으로 비공유결합을 하고, 양전하를 띠는 아민(amine)기는 염료의 음전하 부위와 이온 결합(ionic bond)을 하여 결합을 강화한다.[3][4]단백질과 결합한 쿠마시블루 염색약은 595nm 파장의 빛을 가장 잘 흡수한다.[4] 단백질과 결합하지 않은 양이온 형태는 빨간색이나 초록색을 띠지만,[5] 단백질과 결합하면 음전하를 띠며 파란색이 된다. 595nm에서의 흡광도 증가는 염색약과 단백질이 더 많이 결합할수록, 즉 시료 내 단백질 농도에 비례하여 높아진다.[6]
브래드퍼드 단백질 분석법은 나트륨, 칼륨, 수크로스 등의 화합물에는 큰 영향을 받지 않지만,[1] 높은 농도의 세제에는 영향을 받을 수 있다.[6] 특히 도데실황산나트륨 (SDS)은 낮은 농도에서는 단백질 결합을 방해하여 단백질 농도를 과소평가하게 하고, 높은 농도에서는 염료와 결합하여 흡광도를 증가시켜 단백질 농도와 관계없이 흡광도가 증가하는 결과를 초래할 수 있다.[6]
2. 2. 흡광도 변화
브래드퍼드 정량법은 쿠마시블루 G-250 염색약의 흡광도 변화를 이용한 색도 분석법 단백질 분석법이다.[2] 쿠마시블루 G-250 염색약은 음이온성(파란색), 중성(녹색), 양이온성(빨간색)의 세 가지 형태로 존재하는데,[2] 산성 조건에서 붉은색 형태였던 염색약이 단백질과 결합하면 파란색 형태로 전환된다.[3]이 과정에서 염색약은 자유 전자를 단백질의 이온화 가능한 그룹에 제공하여 단백질의 고유 상태를 파괴하고 소수성 포켓을 노출시킨다.[3] 단백질의 3차 구조 속 이 포켓은 반 데르 발스 힘을 통해 염료의 비극성 영역과 비공유결합을 형성한다.[3] 동시에 양전하를 띠는 아민(amine)기는 염료의 음전하 부위와 이온 결합(ionic bond)을 통해 결합을 강화한다.[3]
단백질과 결합한 쿠마시블루 염색약은 595nm 파장의 빛을 가장 잘 흡수하며, 이는 흡광도 측정이 595nm에서 이루어지는 이유이다.[4] 단백질과 결합하지 않은 양이온 형태의 염색약은 빨간색이나 초록색을 띠고 465nm에서 최대 흡수 스펙트럼을 갖는다. 반면, 단백질과 결합하여 음이온성과 파란색을 띠는 염색약은 595nm에서 최대 흡수 스펙트럼을 보인다.[5] 595nm에서의 흡광도 증가는 결합된 염료의 양, 즉 시료에 존재하는 단백질의 양(농도)에 비례한다.[6]
브래드퍼드 단백질 분석법은 나트륨, 칼륨, 수크로스와 같은 탄수화물의 간섭을 덜 받지만,[1] 높은 농도의 세제에는 영향을 받을 수 있다. 특히 도데실황산나트륨(SDS)은 낮은 농도에서는 단백질 결합을 억제하여 단백질 농도를 과소평가하게 하고, 높은 농도에서는 염료와 결합하여 흡광도를 증가시켜 단백질 농도와 관계없이 흡광도를 변화시킨다.[6]
3. 장단점
브래드퍼드 단백질 정량법은 다른 단백질 정량법에 비해 단백질 시료에 포함된 다른 화학 물질의 간섭을 덜 받는다.[27] 단백질 시료는 완충 용액, 방부제 등 다른 물질과 섞여 있는 경우가 많은데, 브래드퍼드 정량법은 이러한 불순물에 의한 방해를 받지 않고 단백질을 정량할 수 있다.[27] BCA 정량법 및 로우리 정량법과 같은 다른 단백질 정량법은 환원제와 같은 분자가 정량법을 방해하기 때문에 효과적이지 않지만,[15] 브래드퍼드 정량법은 이러한 분자와 호환되어 서로 방해하지 않으므로 유리하다.[16]
이 방법은 매우 쉽고 간단하다. 단백질 시료를 쿠마시블루 염색약과 섞은 후 분광 광도계를 이용하여 흡광도만 측정하면 된다.[8] 염료가 단백질에 결합하면 산성 용액에서 염료의 흡수 최대치가 465 nm에서 595 nm로 변하며, 5분간 배양 후, 595 nm에서 흡광도를 읽을 수 있다.[1][9] 휴대폰 카메라(RGBradford 방법)를 사용하여 정확하게 측정할 수도 있다.[9]
이 정량법은 단백질 정량 분석 방법 중 가장 빠른 방법 중 하나로 알려져 있다.[12] 대부분 30분 이내에 실험을 수행할 수 있으며,[13] 모든 실험 과정이 상온에서 진행될 수 있다.
또한, 이 방법은 매우 민감한 실험 기법으로, 1~20 μg의 소량의 단백질도 측정할 수 있다.[14]
브래드퍼드 정량법은 시료에 세제(detergent)가 섞여 있으면 정확한 측정이 불가능하다.[12] 반응액이 산성이기 때문에 지질이 대량으로 함유된 검액에서는 침전이 형성되어 측정의 정확도를 떨어뜨린다. 측정 가능한 단백질 농도 범위가 0 μg/mL에서 2000 μg/mL로 한정적이어서 시료를 희석해야 하는 경우가 많고, 이 과정에서 오차가 발생하여 선형 관계가 항상 정확하지 않을 수 있다.[12]
염기성 조건과 세제는 염료가 단백질의 측쇄를 통해 단백질에 결합하는 능력을 방해할 수 있다.[12] 시약은 시험관을 염색하는 경향이 있어 흡광도 측정에 영향을 주므로 동일한 시험관을 사용할 수 없다. 또한 시간에 민감하여, 둘 이상의 용액을 테스트할 때는 모든 샘플을 동일한 시간 동안 배양해야 정확하게 비교할 수 있다.[18]
쿠마시 기반 단백질 정량 염료는 서로 다른 단백질에서 색상 수율의 차이가 크다는 제한적인 요인이 있다.[19] 이러한 요인은 콜라겐이 풍부한 단백질 샘플에서 특히 두드러지는데, 로우리 정량법과 브래드퍼드 방법 모두 단백질 함량을 과소평가하는 경향을 보인다.
세제의 존재에 의해 반응이 저해되지만, 분석 혼합물에 사이클로덱스트린을 첨가하여 이 문제를 완화할 수 있다.[20]
비선형성의 대부분은 단백질 첨가로 방해를 받는 두 가지 다른 형태의 염료 사이의 평형에서 비롯된다. 595 nm와 450 nm에서의 흡광도 비율을 측정하면 브래드퍼드 분석은 선형화되며, 이 변형된 분석은 기존 분석보다 약 10배 더 민감하다.[21]
원래 브래드퍼드 방법에서 단백질에 결합하는 데 사용된 쿠마시 블루 G250 염료는 단백질의 아르기닌과 리신 그룹에 쉽게 결합한다. 이는 염료가 이러한 아미노산에 결합하는 선호도로 인해 서로 다른 단백질 간에 분석 반응이 달라질 수 있다는 단점이 된다. NaOH를 첨가하거나 더 많은 염료를 첨가하여 pH를 증가시키는 등의 방법으로 이러한 변동을 수정할 수 있지만, 수정된 방법은 민감도가 낮아지고 샘플을 방해할 수 있는 세제에 민감해진다.[22]
3. 1. 장점
브래드퍼드 단백질 정량법은 다른 단백질 정량법에 비해 단백질 시료에 포함된 다른 화학 물질의 간섭을 덜 받는다.[27] 단백질 시료는 완충 용액, 방부제 등 다른 물질과 섞여 있는 경우가 많은데, 브래드퍼드 정량법은 이러한 불순물에 의한 방해를 받지 않고 단백질을 정량할 수 있다.[27] BCA 및 로우리(Lowry)와 같은 다른 단백질 정량법은 환원제와 같은 분자가 정량법을 방해하기 때문에 효과적이지 않지만,[15] 브래드퍼드 정량법은 이러한 분자와 호환되어 서로 방해하지 않으므로 유리하다.[16]이 방법은 매우 쉽고 간단하다. 단백질 시료를 쿠마시블루 염색약과 섞은 후 분광 광도계를 이용하여 흡광도만 측정하면 된다.[8] 염료가 단백질에 결합하면 산성 용액에서 염료의 흡수 최대치가 465 nm에서 595 nm로 변하며, 5분간 배양 후, 595 nm에서 흡광도를 읽을 수 있다.[1][9] 휴대폰 카메라(RGBradford 방법)를 사용하여 정확하게 측정할 수도 있다.[9]
이 정량법은 단백질 정량 분석 방법 중 가장 빠른 방법 중 하나로 알려져 있다.[12] 대부분 30분 이내에 실험을 수행할 수 있으며,[13] 모든 실험 과정이 상온에서 진행될 수 있다.
또한, 이 방법은 매우 민감한 실험 기법으로, 1~20 μg의 소량의 단백질도 측정할 수 있다.[14]
3. 2. 단점
브래드퍼드 정량법은 시료에 세제(detergent)가 섞여 있으면 정확한 측정이 불가능하다.[12] 반응액이 산성이기 때문에 지질이 대량으로 함유된 검액에서는 침전이 형성되어 측정의 정확도를 떨어뜨린다. 측정 가능한 단백질 농도 범위가 0 μg/mL에서 2000 μg/mL로 한정적이어서 시료를 희석해야 하는 경우가 많고, 이 과정에서 오차가 발생하여 선형 관계가 항상 정확하지 않을 수 있다.[12]염기성 조건과 세제는 염료가 단백질의 측쇄를 통해 단백질에 결합하는 능력을 방해할 수 있다.[12] 시약은 시험관을 염색하는 경향이 있어 흡광도 측정에 영향을 주므로 동일한 시험관을 사용할 수 없다. 또한 시간에 민감하여, 둘 이상의 용액을 테스트할 때는 모든 샘플을 동일한 시간 동안 배양해야 정확하게 비교할 수 있다.[18]
쿠마시 기반 단백질 정량 염료는 서로 다른 단백질에서 색상 수율의 차이가 크다는 제한적인 요인이 있다.[19] 이러한 요인은 콜라겐이 풍부한 단백질 샘플에서 특히 두드러지는데, 로우리(Lowry) 방법과 브래드퍼드 방법 모두 단백질 함량을 과소평가하는 경향을 보인다.
세제의 존재에 의해 반응이 저해되지만, 분석 혼합물에 사이클로덱스트린을 첨가하여 이 문제를 완화할 수 있다.[20]
비선형성의 대부분은 단백질 첨가로 방해를 받는 두 가지 다른 형태의 염료 사이의 평형에서 비롯된다. 595 nm와 450 nm에서의 흡광도 비율을 측정하면 브래드퍼드 분석은 선형화되며, 이 변형된 분석은 기존 분석보다 약 10배 더 민감하다.[21]
원래 브래드퍼드 방법에서 단백질에 결합하는 데 사용된 쿠마시 블루 G250 염료는 단백질의 아르기닌과 리신 그룹에 쉽게 결합한다. 이는 염료가 이러한 아미노산에 결합하는 선호도로 인해 서로 다른 단백질 간에 분석 반응이 달라질 수 있다는 단점이 된다. NaOH를 첨가하거나 더 많은 염료를 첨가하여 pH를 증가시키는 등의 방법으로 이러한 변동을 수정할 수 있지만, 수정된 방법은 민감도가 낮아지고 샘플을 방해할 수 있는 세제에 민감해진다.[22]
4. 실험 방법
실험 방법은 크게 두 가지로 나뉜다.
- 0.15 M NaCl로 희석된 일련의 표준 용액을 0 (공백 = 단백질 없음), 250, 500, 750 및 1500 μg/mL의 최종 농도로 준비한다. 또한 측정할 미지의 시료를 연속 희석하여 준비한다.
- 각 용액 100 μL를 별도의 시험관(또는 분광 광도계 튜브, Spectronic 20 사용 시)에 넣는다.
- 각 튜브에 쿠마시 블루 용액 5.0 mL를 넣고 볼텍스 또는 반전으로 혼합한다.
- 단백질이 없는 튜브(공백)를 사용하여 분광 광도계를 595 nm 파장으로 조정한다.
- 5분 동안 기다린 후, 각 표준 용액과 각 시료를 595 nm 파장에서 측정한다.
- 표준 용액의 흡광도를 농도에 따라 그래프로 나타낸다. 소멸 계수를 계산하고 미지 시료의 농도를 계산한다.
다른 방법으로는,
- 단백질 표준 용액을 1, 5, 7.5 및 10 μg/mL 농도로 준비한다. NaCl 용액만 사용하여 블랭크를 준비한다. 일련의 시료 희석액을 준비한다.
- 각 용액 100 μL를 별도의 튜브(마이크로 원심분리 튜브 사용)에 넣고, 각 튜브에 쿠마시 블루 시약 1.0 mL를 첨가한다.
- 분광 광도계를 켜고 파장을 595 nm로 조정한 다음, 1.5 mL 큐벳을 사용하거나 모바일 스마트폰 카메라(RGBradford 방법)를 사용하여 분광 광도계를 블랭크 처리한다.[9]
- 2분 동안 기다린 후, 각 표준 용액 및 시료의 흡광도를 595 nm에서 측정한다.
- 표준 용액의 흡광도를 농도에 따라 그래프로 나타낸다. 소멸 계수를 계산하고 미지 시료의 농도를 계산한다.
4. 1. 표준 검량선 작성
소 혈청 알부민(BSA) 단백질을 이용하여 표준 검량선을 그린다. 표준 검량선은 단백질의 농도를 x축에, 흡광도를 y축으로 설정하여 그린다. 이 표준 검량선은 미지 단백질의 농도를 구하는데 사용된다.[9] 자료를 선형 회귀 분석법(Linear regression)으로 데이터를 이용하여 표준 곡선을 그린다. 이때 R2 값이 1에 가까워야 이상적이다. 차트에 나와 있는 표준 곡선의 방정식에 측정된 흡광도를 y값에 대입하여 단백질의 농도(x값)을 도출해낸다.[9]0.15 M NaCl로 희석된 일련의 표준 용액을 0 (공백 = 단백질 없음), 250, 500, 750 및 1500 μg/mL의 최종 농도로 준비한다. 또한 측정할 미지의 시료를 연속 희석하여 준비한다. 각 용액 100 μL를 별도의 시험관(또는 분광 광도계 튜브, Spectronic 20 사용 시)에 넣는다. 각 튜브에 쿠마시 블루 용액 5.0 mL를 넣고 볼텍스 또는 반전으로 혼합한다. 단백질이 없는 튜브(공백)를 사용하여 분광 광도계를 595 nm 파장으로 조정한다. 5분 동안 기다린 후, 각 표준 용액과 각 시료를 595 nm 파장에서 측정한다. 표준 용액의 흡광도를 농도에 따라 그래프로 나타낸다. 소멸 계수를 계산하고 미지 시료의 농도를 계산한다.[9]
단백질 표준 용액을 1, 5, 7.5 및 10 μg/mL 농도로 준비한다. NaCl 용액만 사용하여 블랭크를 준비한다. 일련의 시료 희석액을 준비한다. 각 용액 100 μL를 별도의 튜브(마이크로 원심분리 튜브 사용)에 넣고, 각 튜브에 쿠마시 블루 시약 1.0 mL를 첨가한다. 분광 광도계를 켜고 파장을 595 nm로 조정한 다음, 1.5 mL 큐벳을 사용하거나 모바일 스마트폰 카메라(RGBradford 방법)를 사용하여 분광 광도계를 블랭크 처리한다. 2분 동안 기다린 후, 각 표준 용액 및 시료의 흡광도를 595 nm에서 측정한다. 표준 용액의 흡광도를 농도에 따라 그래프로 나타낸다. 소멸 계수를 계산하고 미지 시료의 농도를 계산한다.[9]
4. 2. 미지 시료 농도 측정
미지 시료의 농도를 측정하기 위해서는 먼저 표준곡선을 그려야 한다. 이때 보통 소 혈청 알부민(BSA)을 이용한다.[9] 표준 곡선은 단백질의 농도를 x축에, 흡광도를 y축으로 설정하여 그린다. 이 표준곡선은 미지의 단백질의 농도를 구할 때 사용한다.[9]자료를 선형 회귀 분석법(Linear regression)으로 데이터를 이용하여 표준 곡선을 그린다. 이때 R2 값이 1에 가까워야 이상적이다. 표준 곡선의 방정식에 측정된 흡광도를 y값에 대입하여 단백질의 농도(x값)을 도출해낸다.
0.15 M NaCl로 희석된 일련의 표준 용액을 0 (공백 = 단백질 없음), 250, 500, 750 및 1500 μg/mL의 최종 농도로 준비한다. 또한 측정할 미지의 시료를 연속 희석하여 준비한다. 각 용액 100 μL를 별도의 시험관(또는 분광 광도계 튜브)에 넣는다. 각 튜브에 쿠마시 블루 용액 5.0 mL를 넣고 볼텍스 또는 반전으로 혼합한다. 단백질이 없는 튜브(공백)를 사용하여 분광 광도계를 595 nm 파장으로 조정한다. 5분 동안 기다린 후, 각 표준 용액과 각 시료를 595 nm 파장에서 측정한다. 표준 용액의 흡광도를 농도에 따라 그래프로 나타낸다. 소멸 계수를 계산하고 미지 시료의 농도를 계산한다.
혹은, 단백질 표준 용액을 1, 5, 7.5 및 10 μg/mL 농도로 준비한다. NaCl 용액만 사용하여 블랭크를 준비한다. 각 용액 100 μL를 별도의 튜브(마이크로 원심분리 튜브 사용)에 넣고, 각 튜브에 쿠마시 블루 시약 1.0 mL를 첨가한다. 2분 동안 기다린 후, 각 표준 용액 및 시료의 흡광도를 595 nm에서 측정하고, 표준 용액의 흡광도를 농도에 따라 그래프로 나타낸다. 소멸 계수를 계산하고 미지 시료의 농도를 계산한다. 분광 광도계를 켜고 파장을 595 nm로 조정한 다음, 1.5 mL 큐벳을 사용하거나 모바일 스마트폰 카메라(RGBradford 방법)를 사용하여 분광 광도계를 블랭크 처리한다.[9]
5. 결과 해석 및 활용
소 혈청 알부민(BSA)을 이용하여 표준 곡선을 그린다. 표준 곡선은 단백질 농도를 x축에, 흡광도를 y축으로 설정하여 그리며, 미지 단백질의 농도를 구하는 데 사용된다.[1]
표준 곡선을 그리기 위해서는 우선 선형 회귀 분석법으로 데이터를 분석하여 표준 곡선을 그린다. 이때 R2 값이 1에 가까워야 이상적이다. R2이 1보다 훨씬 작으면 실험을 다시 수행하는 것을 고려해야 한다.[24] 정확한 표준 곡선을 만들기 위해 BSA의 좁은 농도 범위(2-10 ug/mL)만 사용된다.[23]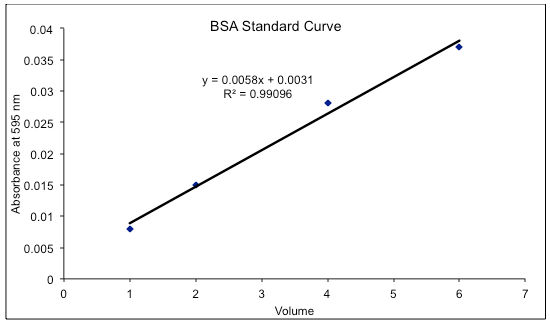
표준 곡선의 방정식에 측정된 흡광도를 y값에 대입하여 단백질의 농도(x값)를 도출해낸다. 그래프 1에서 x는 농도이고 y는 흡광도이므로, 방정식을 재정렬하여 x를 풀고 측정된 미지 시료의 흡광도를 입력해야 한다.[25] 미지 시료의 흡광도 값이 표준 범위 밖에 있을 가능성이 있으며, 주어진 방정식은 한계 밖의 값에는 적용될 수 없으므로 이러한 값은 계산에 포함해서는 안 된다.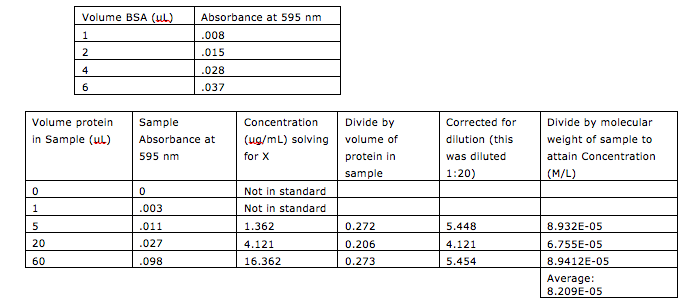
데이터에 맞는 농도를 얻으려면 미지 시료의 희석, 농도 및 단위를 정규화해야 한다(표 1). 농도를 정규화하기 위해 농도를 단백질의 부피로 나누고, 희석량을 곱해야 한다.
대규모로 진행하는 경우, 비어-람베르트 법칙을 사용하여 소멸 계수를 계산해야 한다. 여기서 A는 측정된 흡광도, ε는 표준 곡선의 기울기, L은 큐벳의 길이, C는 결정하려는 농도이다.[26]
6. 추가적인 방법
대체 단백질 분석법에는 다음이 포함된다.
- 자외선-가시광선 분광법
- 뷰렛 단백질 분석법
- 로우리 단백질 분석법
- BCA 단백질 분석법
- 아미도 블랙 단백질 분석법
- 콜로이드 금 단백질 분석법
7. 다른 단백질 정량법
자외선-가시광선 분광법, 뷰렛 단백질 분석법, 로우리 단백질 분석법, BCA 단백질 분석법, 아미도 블랙 단백질 분석법, 콜로이드 금 단백질 분석법 등이 브래드퍼드 단백질 정량법의 대체 단백질 분석법으로 사용될 수 있다.
참조
[1]
학술지
A Rapid and Sensitive Method for the Quantification of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding
http://hoffman.cm.ut[...]
1976
[2]
웹사이트
Quick Start TM Bradford Protein Assay
http://www.bio-rad.c[...]
[3]
서적
Fundamental Laboratory Approaches for Biochemistry and Biotechnology
Wiley
2008
[4]
학술지
A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding
1976-05
[5]
웹사이트
Protein determination by the Bradford method
http://www.ruf.rice.[...]
[6]
간행물
The Bradford Method For Protein Quantitation
http://link.springer[...]
Humana Press
2022-06-27
[7]
서적
Fundamental laboratory approaches for biochemistry and biotechnology
John Wiley
2010
[8]
서적
Fundamental Laboratory Approaches for Biochemistry and Biotechnology
John Wiley & Sons, Inc.
[9]
학술지
RGBradford: Accurate measurement of protein concentration using a smartphone camera and the blue to green intensity ratio
https://linkinghub.e[...]
2022-10
[10]
학술지
Colorimetric protein assay techniques
https://iubmb.online[...]
1999-04
[11]
서적
Fundamental Laboratory Approaches for Biochemistry and Biotechnology.
John Wiley & Sons Inc.
[12]
학술지
Comparison of five methods for determination of total plasma protein concentration
2007-08-01
[13]
웹사이트
Protein Assay Technical Handbook
http://wolfson.huji.[...]
[14]
웹사이트
4.5. Determination of protein concentration
http://elte.prompt.h[...]
2016-05-19
[15]
학술지
Protein quantification in the presence of poly(ethylene glycol) and dextran using the Bradford method
2009-08-03
[16]
서적
Fundamental Laboratory Approaches for Biochemistry and Biotechnology
Wiley
[17]
서적
Fundamental Approaches to Biochemistry and Biotechnology
Fitzgerald Science Press, Bethesda, MD.
[18]
서적
Fundamental Laboratory Approaches for Biochemistry and Biotechnology
Wiley
2009
[19]
학술지
An improved bradford protein assay for collagen proteins
https://dx.doi.org/1[...]
1993-10-29
[20]
학술지
Optimization of the cydex blue assay: A one-step colorimetric protein assay using cyclodextrins and compatible with detergents and reducers.
[21]
학술지
Linearization of the Bradford Protein Assay Increases Its Sensitivity: Theoretical and Experimental Studies
1996-05-01
[22]
서적
Protein Protocols Handbook, the
[23]
웹사이트
Linearization of the Bradford Protein Assay Increases Its Sensitivity: Theoretical and Experimental Studies
http://www.tau.ac.il[...]
1995-11-20
[24]
서적
Mathematical Modeling with Excel
Jones & Bartlett Learning
[25]
서적
Calculations for molecular biology and biotechnology: a guide to mathematics in the laboratory
https://archive.org/[...]
Academic Press
[26]
서적
Environmental chemistry: fundamentals
https://archive.org/[...]
[27]
서적
Fundamental Laboratory Approaches for Biochemistry and Biotechnology
Wiley
2008
[28]
웹사이트
4.5. Determination of protein concentration
http://elte.prompt.h[...]
2016-05-19
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
