산화 수은(II)
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
산화 수은(II)는 화학식 HgO를 갖는 수은의 산화물이다. 1774년 조지프 프리스틀리에 의해 발견되었으며, 역사적으로 적색침전물로 불렸다. 350°C에서 수은을 가열하거나 질산수은(II)를 열분해하여 생성되며, 몽트로이타이트와 진사와 유사한 구조를 갖는다. 산화 수은(II)는 수은 생산, 수은 전지 음극 재료로 사용되며, 독성이 강하여 에어로졸 흡입, 피부 흡수, 섭취를 통해 체내에 흡수될 수 있다.
더 읽어볼만한 페이지
- 수은(II) 화합물 - 주색
주색은 본래 진사의 색을 의미했으나 현재는 은주색을 가리키는 경우가 많으며, 다양한 문화권에서 중요한 상징적 의미를 지니는 붉은색 계열의 색깔이다. - 수은(II) 화합물 - 염화 수은(II)
염화 수은(II)는 수은 화합물로, 아세틸렌을 비닐 클로라이드로 변환하는 촉매 등으로 사용되었으나, 독성으로 인해 현재는 사용이 제한적이며, 섭취 시 심각한 내부 손상을 유발하는 매우 유독한 물질이다. - 무기 화합물 - 염화 암모늄
염화 암모늄은 분자량 53.50의 흰색 결정성 고체 화합물로, 물에 잘 녹고 가열 시 암모니아와 염화 수소 기체로 분해되며, 비료, 전지 전해액, 융제, 의약품, 식품 첨가물 등 다양한 용도로 사용된다. - 무기 화합물 - 수산화 알루미늄
수산화 알루미늄은 깁사이트, 바이어라이트, 노르스트란다이트, 도일라이트의 네 가지 다형체가 있는 알루미늄의 수산화물로, 양쪽성 물질이며 바이어 공법으로 생산되어 알루미늄 화합물 원료, 고분자 난연 충전재, 제산제, 백신 보조제 등으로 사용된다. - 산화물 - 산화 아연
산화 아연(ZnO)은 흰색 분말 형태의 양쪽성 산화물로, 고무, 안료, 의약품, 세라믹, 전자 장치 등 다양한 산업 분야에 사용되며 높은 굴절률, 열전도율, 항균성 및 자외선 차단 능력을 지닌 물질이다. - 산화물 - 이산화 규소
이산화규소(SiO₂)는 규소 원자와 산소 원자가 사면체 구조로 결합된 3차원 네트워크 고체 화합물로, 결정질과 비결정질의 다양한 형태로 존재하며, 지구 지각에서 풍부하게 발견되고 산업적으로 널리 사용되지만, 미세 결정질 형태는 건강 문제를 일으킬 수 있다.
| 산화 수은(II) - [화학 물질]에 관한 문서 | |
|---|---|
| 기본 정보 | |
 | |
 | |
| IUPAC 이름 | 산화 수은(II) |
| 다른 이름 | 산화 제이수은 몬트로이드 광물 적색 수은 |
| 화학식 | HgO |
| 몰 질량 | 216.59 g/mol |
| 겉모습 | 노란색 또는 붉은색 고체 |
| 냄새 | 무취 |
| 밀도 | 11.14 g/cm³ |
| 용해도 | 0.0053 g/100 mL (25 °C), 0.0395 g/100 mL (100 °C) |
| 다른 용매 용해도 | 에탄올, 다이에틸 에터, 아세톤, 암모니아에 불용성 |
| 녹는점 | 500 °C (분해) |
| 밴드 갭 | 2.2 eV |
| 굴절률 | 2.5 (550 nm) |
| 자기 감수율 | −44.0·10⁻⁶ cm³/mol |
| 구조 | |
| 배위 | 사방정계 |
| 열화학 | |
| 생성 엔탈피 | −90 kJ/mol |
| 엔트로피 | 70 J·mol⁻¹·K⁻¹ |
| 열용량 | 44.06 J mol⁻¹K⁻¹ (적색) |
| 위험성 | |
| 주요 위험 | 극히 유독함, 환경 오염 물질 |
| 외부 물질안전보건자료 | ICSC 0981 |
| GHS 그림 문자 | |
| GHS 신호어 | 위험 |
| GHS 참고 | Laboratory Chemical Safety Summary (LCSS): Mercuric oxide |
| NFPA 704 | 4 (건강) 0 (인화성) 1 (반응성) |
| NFPA 704 참고 | Safety Data Sheet: Mercury(II) oxide |
| 인화점 | 불연성 |
| LD50 | 18 mg/kg (경구, 쥐) |
| 관련 화합물 | |
| 다른 음이온 | 황화 수은(II) 셀렌화 수은(II) 텔루르화 수은(II) |
| 다른 양이온 | 산화 아연 산화 카드뮴 |
| 다른 화합물 | 산화 수은(I) |
| 식별 | |
| CAS 등록번호 | 21908-53-2 |
| UNII | IY191986AO |
| UN 번호 | 1641 |
| RTECS 번호 | OW8750000 |
| PubChem CID | 30856 |
| KEGG | C18670 |
| 표준 InChI | 1S/Hg.O |
| 표준 InChIKey | UKWHYYKOEPRTIC-UHFFFAOYSA-N |
| SMILES | [Hg]=O |
| ChemSpider ID | 28626 |
| 일본 정보 | |
| IUPAC 이름 | 산화 수은(II) |
| 다른 이름 | 산화 수은 적강홍, 황강홍 |
| 밀도 | 11.14 g/cm³ |
| 용해도 | 불용 |
| 녹는점 | 500 ℃ (분해) |
| 생성 엔탈피 | −90.83 kJ mol⁻¹ (적색) −90.46 kJ mol⁻¹ (황색) −89.5 kJ mol⁻¹ (육방정계) |
| 엔트로피 | 70.29 J mol⁻¹K⁻¹(적색) 71.1 J mol⁻¹K⁻¹(황색) 73.6 J mol⁻¹K⁻¹ (육방정계) |
| 열용량 | 44.06 J mol⁻¹K⁻¹(적색) |
| 외부 MSDS | ICSC 0981 |
| EU 색인 번호 | 080-002-00-6 |
| EU 분류 | 맹독 (T+) 환경 위험성 (N) |
| R 문구 | |
| S 문구 | |
| 인화점 | 불연성 |
| 다른 음이온 | 황화 수은(II) 셀렌화 수은(II) 텔루르화 수은(II) |
| 다른 양이온 | 산화 아연 산화 카드뮴 |
2. 역사
조지프 프리스틀리가 1774년에 산화 수은(II)를 발견하였다. 11세기 아랍-스페인 연금술사 마슬라마 알마지리티(Maslama al-Majriti)가 저서 ''룻바트 알하킴(Rutbat al-hakim)''에서 산화수은(II) 제조 실험을 처음으로 기술하였다.[6] 역사적으로는 적색침전물(대조적으로 백색침전물은 염화수은아미드(mercuric amidochloride)임)이라고 불렸다.
조지프 프리스틀리(Joseph Priestley)는 1774년 산화수은(II)을 가열하면 산소가 방출된다는 사실을 발견했지만, 그 기체를 산소로 확인하지는 못했다(오히려 프리스틀리는 당시 연구하고 있던 패러다임에 따라 그 기체를 "탈플로지스톤 공기"라고 불렀다).[7]
3. 합성 및 반응
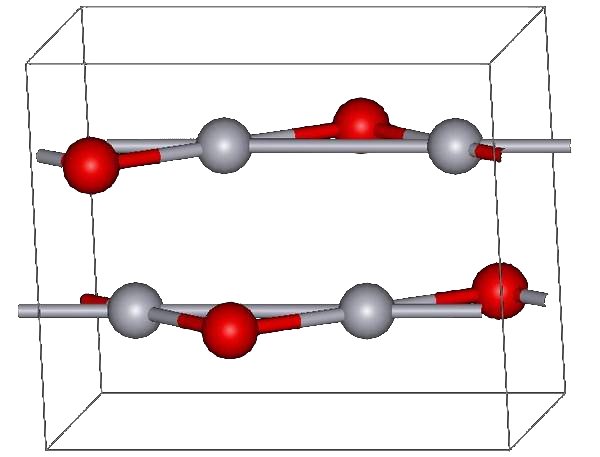
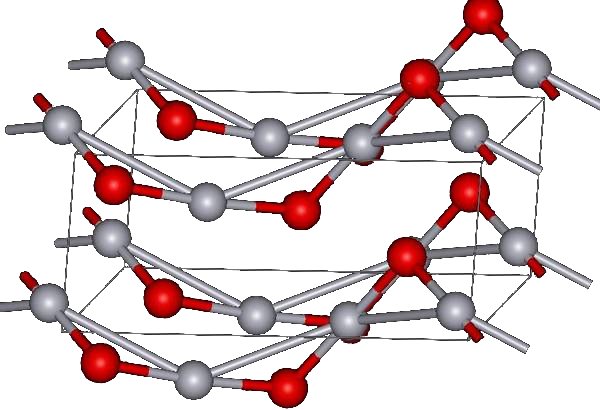
HgO는 적색과 황색의 두 가지 형태로 존재한다. 적색 HgO는 약 350℃에서 산소 중의 Hg를 가열하거나, Hg(NO3)2를 열분해하여 생성할 수 있다.[8] 황색 HgO는 수용액 속의 Hg2+를 알칼리로 침전시켜 얻을 수 있다.[3] 두 형태의 색깔 차이는 입자 크기에 의한 것이며, 모두 약 108°의 Hg-O-Hg 각도를 가진 지그재그 사슬로 연결된 거의 선형의 O-Hg-O 단위로 구성된 동일한 구조를 갖는다.[3]
HgO는 산과 반응하여 수은염을 생성한다. 산소 중에서 수은을 350℃로 가열하면 HgO가 생성되지만, 더 가열하면 400℃에서 흑변하고 500℃에서 수은과 산소로 분해된다.[14] 빛을 쬐어도 분해된다.
질산 수은(II)를 열분해하거나, 수은을 양극 산화시키거나, 수은(II)염 수용액에 염기 또는 탄산염을 넣으면 HgO를 얻을 수 있다. 질산 수은(II)의 열분해나 수은의 직접 산화에서는 적색 HgO가 생성되는 반면, Hg2+ 수용액에 OH-를 가하면 황색 HgO가 침전한다.
HgO는 물에 잘 녹지 않지만(5.2×10-3 g/100g; 25℃), 약한 염기이기 때문에 산성에서는 용해된다. HgO의 용해도곱은 다음과 같다.
:
HgO는 산화제이기도 하여 SO2를 SO3로, 인을 수용액에서 인산으로 산화시킨다.
과거에는 살균제, 방부제, 결막염 치료에 사용되었지만, 현재는 많은 국가에서 법률로 사용이 규제되고 있다.
3. 1. 네슬러 시약과의 반응
산화 수은(II)은 할로겐화 알칼리 금속인 요오드화 칼륨 수용액에 녹아 테트라요오드수은(II)산 칼륨 등으로 복분해되어 염기성을 나타낸다.[14]
:
이 테트라요오드수은(II)산 칼륨의 묽은 용액에 과잉의 염기를 가하여 평형을 되돌리면 육방정계의 등황색 산화 수은(II)의 상전이가 얻어진다.[15]
4. 구조
대기압에서 산화 수은(II)은 두 가지 결정형을 가진다. 하나는 몽트로이다이트(사방정계)이고, 다른 하나는 황화물 광물인 진사(육방정계)와 유사하다. 두 형태 모두 Hg-O 사슬을 특징으로 한다.[10] 10 GPa 이상의 압력에서는 두 구조 모두 정방정계 형태로 변환된다.[1]
5. 용도
산화 수은(II)은 비교적 쉽게 분해되기 때문에 수은 생산에 사용되기도 한다. 분해될 때 산소 기체가 발생한다.
또한 수은 전지의 음극 재료로도 사용된다.[11]
6. 독성 및 규제

산화 수은(II)는 에어로졸 흡입, 피부 흡수, 섭취를 통해 체내에 흡수될 수 있는 고독성 물질이다. 눈, 피부, 호흡기에 자극을 주며 신장에 영향을 미쳐 신장 장애를 일으킬 수 있다. 특히 수생 생물을 통해 인간에게 중요한 먹이 사슬에서 생물축적이 일어난다. EU에서는 살충제로 사용이 금지되어 있다.[12]
20°C에서의 증발은 무시할 만하다.
6. 1. 분해
산화 수은(II)은 비교적 쉽게 분해되어 수은 생산에 사용되기도 한다. 분해될 때 산소 기체가 발생한다.수은을 산소 중에서 350℃로 가열하면 생성되지만, 더 가열하면 400℃에서 흑변하고 500℃에서 수은과 산소로 분해된다.[14] 빛을 쪼여도 분해된다.
6. 2. 반응성
산화 수은(II)는 빛에 노출되거나 500°C 이상으로 가열하면 분해된다. 가열하면 고독성 수은 증기와 산소가 발생하여 화재 위험이 증가한다. 산화 수은(II)는 환원제, 염소, 과산화 수소, 마그네슘(가열 시), 이황화이염소, 삼황화 수소와 격렬하게 반응한다. 황이나 인과 같은 금속 및 원소와는 충격에 민감한 화합물을 형성한다.[13]산소 중에서 수은을 350°C로 가열하면 생성되지만, 더 가열하면 400°C에서 흑변하고 500°C에서 수은과 산소로 분해된다.[14] 빛을 쪼여도 분해된다.
산화 수은(II)는 할로겐화 알칼리 금속의 예로 요오드화 칼륨 수용액에 녹아 테트라요오드수은(II)산칼륨 등으로 복분해하여 염기성을 나타낸다.
:
이 테트라요오드수은(II)산칼륨의 묽은 용액에 과잉의 염기를 가하여 평형을 되돌리면 육방정계의 등황색 산화수은(II)의 상전이가 얻어진다.[15]
산화 수은(II)는 산화제이기도 하여 SO2를 SO3로 산화시키거나, 인을 수용액에서 인산으로 산화시킨다.
참조
[1]
서적
Semiconductors · II-VI and I-VII Compounds; Semimagnetic Compounds
Springer-Verlag
[2]
서적
Chemical Principles 6th Ed.
Houghton Mifflin Company
[3]
웹사이트
Laboratory Chemical Safety Summary (LCSS): Mercuric oxide
https://pubchem.ncbi[...]
National Center for Biotechnology Information
2022-04-14
[4]
웹사이트
Safety Data Sheet: Mercury(II) oxide
https://www.fishersc[...]
Thermo Fisher Scientific
2021-12-25
[5]
웹사이트
Mercuric oxide [ISO]
https://chem.nlm.nih[...]
United States National Library of Medicine
2022-04-14
[6]
서적
Inorganic chemistry
https://books.google[...]
Рипол Классик
1931
[7]
서적
History of Industrial Gases
https://books.google[...]
Springer
[8]
리다이렉트
[9]
웹사이트
Characteristic Reactions of Mercury Ions (Hg²⁺ and Hg₂²⁺)
https://chem.librete[...]
2024-07-23
[10]
학술지
The Structure of Hexagonal Mercury(II)oxide
http://actachemscand[...]
2010-11-17
[11]
서적
Chemistry: The Molecular Science
https://archive.org/[...]
Thomson Brooks/Cole
[12]
웹사이트
Banned and Non-Authorised Pesticides in the United Kingdom
http://www.pesticide[...]
2009-12-01
[13]
웹사이트
Mercury (II) oxide
http://www.inchem.or[...]
International Occupational Safety and Health Information Centre
2009-06-06
[14]
문서
조세프 프리스틀리의 산소 관련 연구에 사용됨
[15]
문서
배열은 지그재그형이지만 나선형 비틀림이 발생하여 평면 배열이 아님
[16]
서적
Semiconductors · II-VI and I-VII Compounds; Semimagnetic Compounds
Springer-Verlag
[17]
서적
Chemical Principles 6th Ed.
https://archive.org/[...]
Houghton Mifflin Company
[18]
웹인용
ChemIDplus - 21908-53-2 - UKWHYYKOEPRTIC-UHFFFAOYSA-N - Mercuric oxide [ISO] - Similar structures search, synonyms, formulas, resource links, and other chemical information.
http://chem.sis.nlm.[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com