유전자 제거
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
유전자 제거는 특정 유전자의 기능을 제거하거나 억제하는 기술로, 다양한 방법으로 수행된다. 초기에는 세균에서 연구가 시작되었으며, 현재는 돌연변이, 상동 재조합, 부위 특정 핵산가수분해효소, 유전자 침묵, 유전자 녹인 등의 기술이 활용된다. 유전자 제거는 특정 유전자나 DNA 영역의 기능을 연구하고, 질병 모델 개발, 신약 개발 등 다양한 분야에 활용된다.
더 읽어볼만한 페이지
- 유전자 변형 생물 - 황금쌀
황금쌀은 비타민 A 전구체인 베타카로틴을 생산하도록 유전적으로 조작된 쌀 품종으로, 록펠러 재단의 연구로 개발되어 현장 시험을 거쳤으나 안전성 및 윤리적 문제로 논쟁이 있으며, 일부 국가에서 상업적 재배가 중단되기도 했다. - 유전자 변형 생물 - 바이오안전성정보센터
바이오안전성정보센터(BCH)는 유전자변형생물체(LMO) 안전 관리를 위한 국제 정보 교환 플랫폼으로, LMO 관련 정보 제공, 개발도상국 지원, 국제 의무 이행, 다국어 지원, 데이터베이스 연동 등의 기능을 수행한다. - 분자생물학 기술 - 중합효소 연쇄 반응
DNA 중합 효소를 사용하여 DNA 특정 부위를 복제 및 증폭하는 중합효소 연쇄 반응(PCR)은 유전체 연구, 분자생물학, 법의학, 의학 진단 등 다양한 분야에서 활용되는 기술로, 캐리 멀리스에 의해 고안되어 발전해왔다. - 분자생물학 기술 - 플라스미드
플라스미드는 염색체와 독립적으로 존재하며 자율적으로 증식하는 주로 원형 DNA 형태의 유전 물질로, 유전자 공학에서 유전자 운반체로 사용되며 세균 내에서 항생제 내성 유전자 등을 포함하여 숙주 세포 생존에 기여하고 생명공학 연구 및 유전자 치료에 활용된다. - 분자유전학 - RNA 간섭
RNA 간섭은 이중가닥 RNA에 의해 유전자 발현이 억제되는 과정으로, 다이서 효소에 의해 생성된 작은 간섭 RNA가 RNA 유도 침묵 복합체와 결합하여 표적 mRNA를 분해하거나 번역을 억제하며, 바이러스 방어, 발생 조절, 유전체 안정성 유지 등 다양한 기능과 응용 분야를 가진다. - 분자유전학 - 염색체
염색체는 유전자를 포함하는 DNA 가닥으로, 진핵생물에서는 단백질과 결합해 염색질을 형성하고 세포 분열 시 응축된 막대 모양을 나타내며, 원핵생물은 진핵생물보다 단순한 구조를 가지고 종에 따라 수와 구조가 다양하며, 이상이 생기면 유전 질환을 유발할 수 있어 유전 연구에 중요한 역할을 한다.
| 유전자 제거 | |
|---|---|
| 개요 | |
| 정의 | 유전자 제거 (gene knockout)는 생물이 특정 유전자를 불활성화시키는 유전적 기술이다. |
| 목적 | 유전자 또는 유전 제품의 기능을 연구 질병 모델 생성 유전자 치료 |
| 방법 | 유전자 표적화 무작위 돌연변이 유발 CRISPR와 같은 유전자 편집 기술 |
| 응용 분야 | 기초 연구 약물 개발 생명 공학 |
| 유전자 표적화 | |
| 원리 | 표적 유전자와 상동성을 갖는 DNA 조각을 세포에 도입하여 표적 유전자를 파괴하거나 변경한다. |
| 과정 | 표적 유전자와 상동성을 갖는 DNA 조각 설계 DNA 조각을 세포에 도입 상동 재조합을 통해 표적 유전자 파괴 또는 변경 유전자 제거 성공 여부 확인 |
| 활용 | 특정 유전자의 기능을 연구하거나 질병 모델을 생성하는 데 사용된다. |
| 무작위 돌연변이 유발 | |
| 원리 | 화학 물질이나 방사선과 같은 돌연변이 유발 물질을 사용하여 세포의 DNA에 무작위적인 돌연변이를 유발한다. |
| 과정 | 세포를 돌연변이 유발 물질에 노출 DNA 손상 복구 과정에서 오류 발생 무작위적인 돌연변이 발생 유전자 제거 표현형을 나타내는 세포 선택 |
| 활용 | 새로운 유전자를 발견하거나 특정 생물학적 과정에 관여하는 유전자를 식별하는 데 사용된다. |
| CRISPR와 같은 유전자 편집 기술 | |
| 원리 | CRISPR 시스템을 이용하여 표적 유전자를 정확하게 절단하고, 세포의 DNA 복구 메커니즘을 이용하여 유전자를 불활성화시킨다. |
| 과정 | 표적 유전자를 인식하는 가이드 RNA 설계 CRISPR-Cas9 복합체를 세포에 도입 Cas9 효소가 가이드 RNA에 의해 지정된 위치에서 DNA 절단 세포의 DNA 복구 메커니즘을 통해 유전자 불활성화 |
| 활용 | 유전자 제거 효율이 높고, 다양한 세포 및 생물체에 적용 가능하다. |
| 응용 | |
| 기초 연구 | 특정 유전자의 기능, 유전자 네트워크, 세포 신호 전달 경로 등을 연구하는 데 사용된다. |
| 약물 개발 | 질병 모델 동물을 만들어 약물 효능을 평가하고, 새로운 약물 표적을 발굴하는 데 사용된다. |
| 생명 공학 | 유전자 제거 기술을 이용하여 농작물의 생산성을 높이거나, 새로운 산업용 미생물을 개발하는 데 사용된다. |
| 장점 및 단점 | |
| 장점 | 특정 유전자의 기능을 정확하게 연구 가능 질병 모델 동물 제작 용이 다양한 생명 공학 분야에 응용 가능 |
| 단점 | 유전자 제거 과정이 복잡하고 시간이 오래 걸릴 수 있음 의도하지 않은 부작용 발생 가능성 존재 일부 생물체에서는 유전자 제거가 어려울 수 있음 |
| 윤리적 고려 사항 | |
| 유전자 제거 기술의 잠재적 위험성 | 인간 유전자 치료에 적용 시 윤리적 문제 발생 가능성 유전자 변형 생물체의 환경 방출 시 생태계 교란 가능성 |
| 유전자 제거 기술의 책임감 있는 사용 | 엄격한 규제 및 감독 필요 사회적 합의를 바탕으로 윤리적 가이드라인 마련 필요 |
2. 방법
유전자 녹아웃은 특정 유전자의 기능을 제거하거나 억제하는 다양한 기술을 통해 실행된다.
초기에는 자연적으로 발생하는 돌연변이를 DNA 시퀀싱 등으로 확인하여 유전자 제거 또는 불활성화를 확인했다.[1]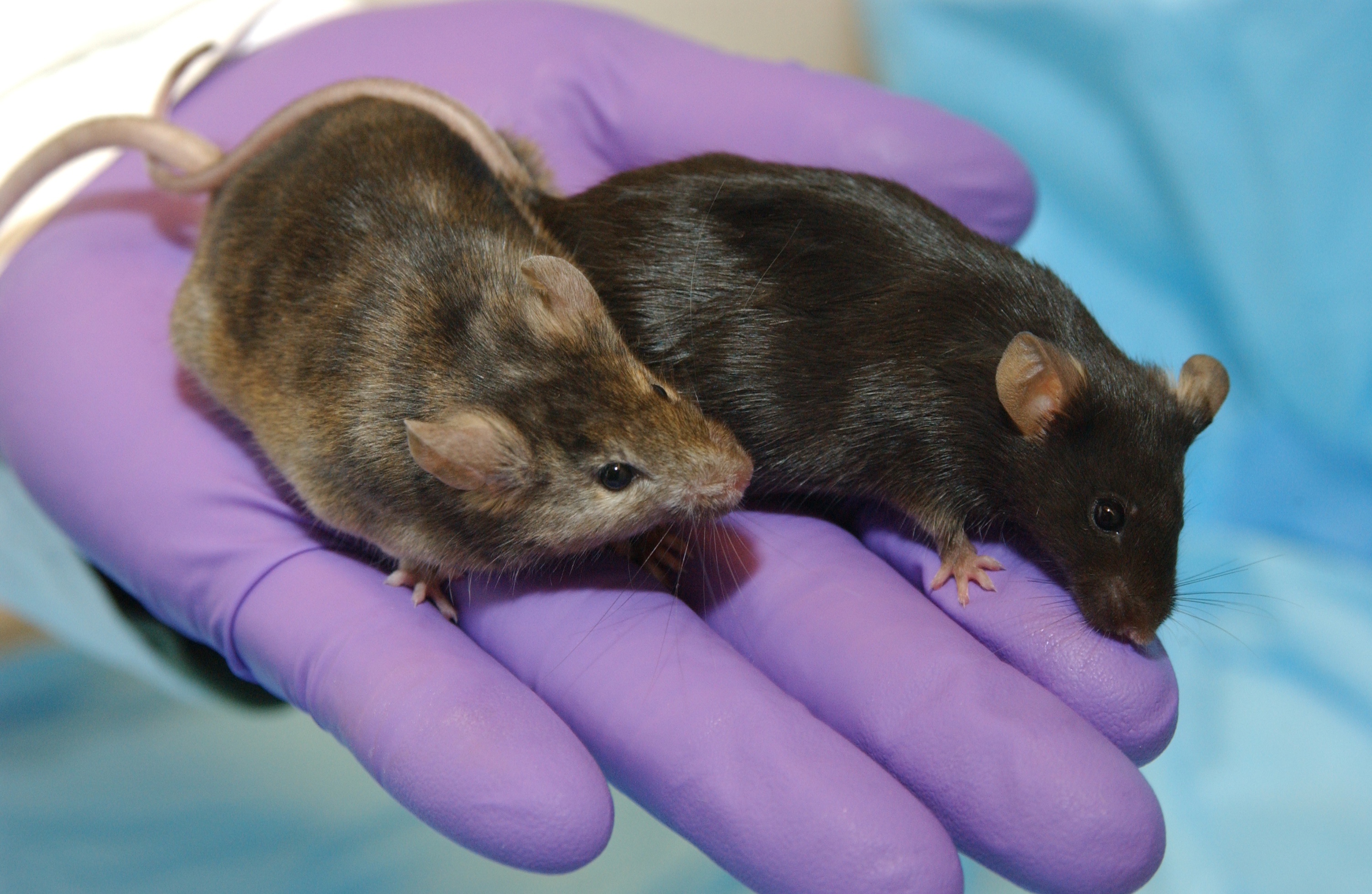
상동 재조합은 유전자 제거를 일으키는 전통적인 방법이었다. 이 방법은 원하는 돌연변이를 포함하는 DNA 구조물을 만들고, 이를 미세 주입이나 전기천공을 통해 세포에 전달한다. 세포는 자체 수리 메커니즘을 통해 이 구조물을 DNA에 재조합시키고, 그 결과 유전자는 비기능 단백질로 번역된다. 하지만 이 방법은 효율이 낮아, 약물 선별 마커를 이용해 재조합된 세포를 선별하는 방법을 주로 사용한다.[2]
이배체 생물에서는 대부분 두 개의 대립 유전자가 존재하며, 여러 유전자가 동일한 기능을 하는 경우도 있다. 따라서 모든 표적 유전자를 녹아웃하기 위해 추가적인 형질전환 및 선별 과정이 필요할 수 있으며, 동형 접합체 녹아웃 동물을 생산하기 위해서는 선별 교배가 필요할 수도 있다.
현재는 DNA 시퀀스를 목표로 이중 가닥 손상을 일으키는 정교한 방법들이 사용된다. 세포는 이 손상을 복구하려 하고, 이 과정에서 비상동 말단 결합(NHEJ)이 일어나 염기쌍 삽입이나 결실을 유발하여 프레임 시프트 돌연변이를 일으킨다.[7] 이 돌연변이는 유전자를 비기능적으로 만들어 유전자 녹아웃을 생성한다. 이 방법은 상동 재조합보다 효율적이다.[7]
유전자 침묵은 RNA 간섭(RNAi)을 이용하여 특정 유전자의 메신저 RNA를 비활성화시켜 유전자 발현을 막는 방법이다.
유전자 녹인은 유전자 녹아웃과 유사하지만, 유전자를 제거하는 대신 다른 유전자를 도입하는 기술이다.
2. 1. 돌연변이
초기에는 자연 발생적인 돌연변이를 DNA 시퀀싱 등으로 확인하고, 유전자 손실 또는 불활성화를 규명하는 방식으로 진행되었다. 1989년 해밀턴 등은 대장균에서 유전자를 삭제하기 위해 두 번의 연속적인 재조합을 사용하는 실험을 발표했다.[2] 이 연구는 세균에서 기능성 유전자를 제거하거나 대체하는 가능성을 확립했다. 그 이후 이 방법은 다른 생물체, 특히 생쥐와 같은 연구 동물에 적용되었다. 유전자 제거 생쥐는 질병과 관련이 있을 수 있는 인간 상응 유전자를 연구하는 데 일반적으로 사용된다. 유전자 제거 생쥐를 사용한 연구의 예로는 중국 한족 인구에서 Xirp 단백질의 급성 원인 불명의 야간 돌연사 증후군(SUNDS) 및 부루가다 증후군에서의 역할에 대한 조사가 있다.[3]2. 2. 상동 재조합 (Homologous Recombination)
상동 재조합은 유전자 제거를 일으키는 전통적인 방법이다. 이 방법을 사용하려면 먼저 원하는 돌연변이 결과물을 포함하는 DNA 구조물을 만들어야 한다. 녹아웃을 목적으로 하는 경우, 이 구조물에는 일반적으로 녹아웃 유전자의 위치에 약제 내성 마커가 포함되며, 목표 유전자 배열에 최소 2kb 크기의 상동성(homology)을 가진다. 이 구조물은 미세 주입이나 전기천공을 통해 줄기 세포에 전달된다.[6]이후 세포 자체의 수리 메커니즘에 의존하여 DNA 구조물을 기존 DNA에 재조합한다. 그 결과 유전자 배열이 바뀌고, 대부분의 경우 유전자는 비기능 단백질로 번역된다. 하지만 이 방법은 효율이 낮아, 상동 재조합은 DNA 통합(DNA integration)에서 10−2에서 10−3 비율 밖에 차지하지 않는다.[2][7] 따라서, 구조물 안에 약물 선별 마커(drug selection marker)를 이용하여 재조합 이벤트가 일어난 세포를 선별하는 방법을 주로 사용한다.
유전자가 결손된 (줄기) 세포는, 쥐의 경우 초기 배아에 삽입하여 생체에서 사용될 수 있다. 만약 이러한 키메라 마우스가 생식 세포계에 이 유전자 변화를 가지고 있으면, 후손에게도 이어진다.[2]
이배체에서 대부분 두 유전자 자리를 포함하는데, 한 가지 기능을 하는데 여러 유전자가 연관되는 경우, 추가적인 형질전환이나 선별 과정이 목표 유전자를 녹아웃할 때까지 필요할 수 있다. 동형 접합체 녹아웃 동물을 생산하기 위해서는 선별 교배가 필요할 수도 있다.
마리오 카페키, 마틴 J. 에반스, 올리버 스미시스는 마우스 줄기 세포에서 상동 재조합에 대한 획기적인 연구를 수행했으며, 그들의 연구 결과로 2007년 노벨 생리학·의학상을 공동 수상했다.[5]
2. 3. 부위 특정 핵산가수분해효소 (Nuclease)
부위 특정 핵산가수분해효소는 특정 DNA 시퀀스를 정확하게 표적하여 이중 가닥 절단을 유도한다. 세포는 이 절단을 복구하려고 시도하는데, 이 과정에서 종종 비상동 말단 결합(NHEJ)이 일어난다. NHEJ는 두 절단된 말단을 직접 연결하는 과정이지만, 완벽하지 않아 염기쌍의 삽입이나 결실을 유발하여 프레임 시프트 돌연변이를 일으킬 수 있다.[7] 이러한 돌연변이는 해당 유전자를 기능하지 못하게 만들어, 결과적으로 유전자 녹아웃을 생성한다. 이 방법은 상동 재조합보다 효율적이어서, 양쪽 대립 유전자가 모두 녹아웃된 개체를 만드는 데 더 쉽다.[7]- '''아연 집게 (Zinc-Fingers)'''에 대한 자세한 내용은 하위 문서를 참고.
- '''탈렌 (TALENS)'''에 대한 자세한 내용은 하위 문서를 참고.
- '''크리스퍼 (CRISPR)'''에 대한 자세한 내용은 하위 문서를 참고.
2. 3. 1. 아연 집게 (Zinc-Fingers)
아연 집게 핵산분해효소(Zinc-finger nucleases)는 DNA 결합 부위를 가지는데, 이 부위는 DNA 시퀀스를 정교하게 표적할 수 있다.[7] 각각의 아연 집게는 원하는 DNA 시퀀스의 코돈을 인식할 수 있어서, 특정 시퀀스에 모듈처럼 조합되어 결합할 수 있다.[9] 이 결합 부위는 DNA에서 이중 가닥 절단(double stranded break(DSB))을 일으킬 수 있는 제한 엔도뉴클레아제와 관련된다.[7] 이 손상은 복구 과정에서 유전자의 기능을 파괴하는 돌연변이를 일으킬 수 있다.2. 3. 2. 탈렌 (TALENS)
전사 활성자 유사 효과기 뉴클레아제(TALENs)는 DNA 결합 도메인과 DNA를 절단할 수 있는 핵산분해효소(뉴클레아제)를 포함한다.[8] DNA 결합 영역은 각각 원하는 표적 DNA 서열의 단일 염기쌍을 인식하는 아미노산 반복체로 구성된다.[9] 이 절단이 유전자 코딩 영역을 표적으로 하고, 비상동 말단 결합(NHEJ) 매개 복구가 삽입 및 삭제를 도입하는 경우, 프레임 시프트 돌연변이가 자주 발생하여 유전자의 기능을 방해한다.[8]
2. 3. 3. 크리스퍼 (CRISPR)
크리스퍼(CRISPR, Clustered Regularly Interspaced Short Palindromic Repeats, 규칙적으로 간격을 둔 짧은 팔린드롬 반복 서열)는 유전체(게놈)의 정확한 편집을 가능하게 하는 유전자 편집 기술이다. CRISPR의 한 가지 응용 분야는 유전자 제거이며, 이는 유기체에서 특정 유전자를 비활성화하거나 "제거"하는 것을 포함한다.CRISPR를 사용한 유전자 제거 과정은 세 가지 주요 단계를 포함한다.
# 유전체의 특정 위치를 표적으로 하는 가이드 RNA(gRNA)를 설계한다.
# gRNA와 Cas9 효소(분자 가위 역할을 함)를 표적 세포에 전달한다.
# 세포가 DNA의 절단을 복구하도록 한다.
세포가 절단을 복구할 때, 절단된 끝을 다시 연결하여 비기능성 유전자를 만들거나, 유전자 기능을 방해하는 돌연변이를 도입할 수 있다.
이 기술은 박테리아, 효모, 식물, 동물 등 다양한 유기체에서 사용될 수 있으며, 과학자들은 유전자 부재의 영향을 관찰하여 특정 유전자의 기능을 연구할 수 있다. CRISPR 기반 유전자 제거는 질병의 유전적 기초를 이해하고 새로운 치료법을 개발하기 위한 강력한 도구이다.
모든 유전자 편집 기술과 마찬가지로 CRISPR 기반 유전자 제거는 유기체에 의도하지 않은 또는 해로운 영향을 미칠 수 있으므로 주의해서 사용해야 한다.[9][10] 결합된 Cas9는 DNA에 이중 가닥 절단을 일으킨다.[9] 아연 핑거 및 TALEN과 동일한 원리에 따라, 이러한 이중 가닥 절단을 복구하려는 시도는 종종 비기능성 유전자를 생성하는 프레임 시프트 돌연변이를 초래한다.[9] 비침습적 CRISPR-Cas9 기술은 뇌 혈관 장벽을 통과하여 유전자 변형을 가능하게 하는 최초의 성공적인 전달로, 생쥐의 우울증 및 불안과 관련된 유전자를 성공적으로 제거했다.[11]
2. 4. 유전자 침묵 (Gene Silencing)
RNA 간섭(RNAi)은 유전자 침묵이라고도 하며, 특정 유전자에 대한 메신저 RNA를 소형 간섭 RNA (siRNA) 또는 짧은 헤어핀 RNA (shRNA)를 사용하여 비활성화하여 유전자가 발현되는 것을 효과적으로 막는 방법이다. 종양 유전자(Bcl-2 및 p53 등), 신경 질환, 유전 질환 및 바이러스 감염과 관련된 유전자들이 RNA 간섭 (RNAi)을 활용한 유전자 침묵의 대상이다.[4]2. 5. 유전자 녹인 (Knockin)
유전자 녹인은 유전자 제거와 유사하지만, 유전자를 제거(무효화)하는 것이 아니라, 다른 유전자를 도입하는 것이다.3. 유형
유전자 녹아웃은 유전자 제거 방식에 따라 여러 유형으로 나뉜다. 일반적인 유전자 녹아웃은 표적 유전자 중간 부분을 비기능성 서열로 대체하여 상동 재조합을 유도, 유전자 기능을 손상시키는 방식이다. 이배체 생물의 경우, 대부분의 유전자에 두 개의 대립 유전자가 존재하며, 동일한 작용에 대해 복수의 유전자가 관여하기도 한다. 따라서 모든 표적 유전자를 녹아웃하기 위해 유전자 삽입 및 선별 작업을 반복하며, 동형 접합체를 만들기 위해 선택적 교배가 필요할 수 있다.
조건부 녹아웃 외에도, 유전자 녹인과 같이 다른 유전자를 도입하는 유사한 기술도 존재한다.
3. 1. 조건부 녹아웃 (Conditional Knockout)
조건부 녹아웃은 특정 조직이나 특정 시기에 유전자 제거가 일어나도록 조절하는 방법이다. 이는 유전자 주변에 loxP 부위라고 하는 짧은 서열을 삽입하여 이루어진다. 이 서열은 생식 계열에 도입되며, Cre-재조합효소라는 바이러스 효소를 가진 다른 생식 계열과 교배될 수 있다. Cre-재조합효소는 loxP 서열을 인식하고 재조합하여 해당 부위에 위치한 유전자를 제거한다.[12] [13]이러한 조건부 유전자 제거는 특정 조직 또는 세포 유형에서 유전자의 기능을 연구하거나, 영(null) 돌연변이가 배아 사망을 유발하는 경우에 유용하다. 다른 재조합 효소도 조건부 유전자 제거 실험에 사용될 수 있다.[14]
4. 활용

유전자 제거는 특정 유전자 또는 DNA 영역의 기능을 연구하고, 약물 개발의 선별 도구로 활용된다. 특히, 맥주효모균(''Saccharomyces cerevisiae'')의 전체 유전자 제거 라이브러리를 활용해 약물의 작용 기전을 이해하기도 한다.[15]
4. 1. 유전자 기능 연구
유전자 녹아웃은 주로 유전자 제거된 생물체를 야생형과 비교하여 특정 유전자 또는 DNA 영역의 기능을 연구하는 데 사용된다. 이러한 유전자 녹아웃 실험은 야생형 동물과 비슷한 유전 배경을 가진 녹아웃 동물을 비교함으로써 이루어진다.[15]
4. 2. 질병 모델 개발
인간 질병과 관련된 유전자를 제거한 동물 모델을 제작하여 질병의 원인과 치료법을 연구한다. 전통적으로 상동 재조합은 유전자 제거를 일으키는 중요한 방법이었다. 이 방법을 통해 유전자 배열이 바뀌게 되고, 대부분의 경우 번역이 완료되면 유전자는 비기능 단백질로 번역된다. 이러한 유전자 녹아웃은 야생형 동물과 비슷한 유전적 배경을 가진 녹아웃 동물과의 비교를 통해 특정 유전자나 DNA 지역의 기능을 이해하는 데 사용된다.유전자 제거는 세균에서 흔히 수행된다. 1989년 해밀턴 등이 ''대장균''에서 이 기술을 처음 발표했다.[2] 그 이후 이 방법은 다른 생물체, 특히 생쥐와 같은 연구 동물에 적용되었다. 유전자 제거 생쥐는 질병과 관련이 있을 수 있는 인간 유전자를 연구하는 데 일반적으로 사용된다. 예를 들어, 중국 한족 인구에서 Xirp 단백질이 급성 원인 불명의 야간 돌연사 증후군(SUNDS) 및 부루가다 증후군에 미치는 역할에 대한 연구에 유전자 녹아웃 쥐가 사용되었다.[3]
4. 3. 신약 개발
유전자 제거된 세포주나 동물 모델은 특정 질병과 관련된 유전자를 제거하여 신약 후보 물질의 효능을 평가하고 작용 기전을 연구하는 데 사용된다. 예를 들어, 맥주효모균(''사카로미세스 세레비지에'')의 전체 녹아웃 라이브러리는 약물 작용 기전을 이해하는 데 활용되고 있다.[15] 유전자 녹아웃은 야생형 동물과 비슷한 유전적 배경을 가진 녹아웃 동물과의 비교를 통해 특정 유전자나 DNA 영역의 기능을 이해하는 실험에서 주로 사용된다.참조
[1]
서적
An Introduction to Genetic Analysis
https://www.ncbi.nlm[...]
W. H. Freeman
[2]
논문
New method for generating deletions and gene replacements in ''Escherichia coli''
1989-09
[3]
논문
Critical Roles of Xirp Proteins in Cardiac Conduction and Their Rare Variants Identified in Sudden Unexplained Nocturnal Death Syndrome and Brugada Syndrome in Chinese Han Population
2018-01
[4]
논문
RNAi as a gene therapy approach
http://www.tandfonli[...]
2003-07
[5]
웹사이트
The Nobel Prize in Physiology or Medicine 2007
http://nobelprize.or[...]
The Nobel Foundation
2008-12-15
[6]
논문
Overview: Generation of Gene Knockout Mice
Wiley-Blackwell
2009-09-01
[7]
논문
Targeted gene knockout in mammalian cells by using engineered zinc-finger nucleases
2008-04-15
[8]
논문
TALENs: a widely applicable technology for targeted genome editing
2013-01
[9]
논문
ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering
[10]
논문
Efficient Gene Knockout in Goats Using CRISPR/Cas9 System
2014-09-04
[11]
웹사이트
First-of-its-kind noninvasive CRISPR method knocks out anxiety gene
https://newatlas.com[...]
2023-06-21
[12]
논문
Conditional gene knockout using cre recombinase
2001-03-01
[13]
논문
Methods in Nutrition Science: Cre/loxP System for Generating Tissue-specific Knockout Mouse Models
https://academic.oup[...]
2004-06
[14]
논문
Strategies for site-specific recombination with high efficiency and precise spatiotemporal resolution
2021-01
[15]
웹사이트
YeastDeletionWebPages
http://www-sequence.[...]
2017-02-21
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
