전기생리학
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
전기생리학은 생물학적 조직 내의 이온 흐름과 관련된 생리학의 한 분야로, 특히 이러한 흐름을 측정하는 전기적 기록 기술을 다룬다. 18세기 루이지 갈바니의 동물 전기 연구를 시작으로, 19세기에는 신경 활동의 전기적 특성이 규명되었으며, 20세기에는 전기 자극법과 측정 기술이 발전했다. 실험 방법으로는 전극을 사용하여 전압 또는 전류를 제어하고 측정하며, 전압 고정법, 전류 고정법, 패치 클램프 등의 기술이 사용된다. 최근에는 광유전학, 전산 모사 등 새로운 방법들이 개발되었으며, 임상적으로는 심장, 뇌, 신경 등의 전기적 활동을 측정하는 데 활용된다. 전기생체도(electrography)는 전기생리학적 기록을 통칭하며, 심전도(ECG), 뇌파검사(EEG), 근전도검사(EMG) 등이 포함된다.
더 읽어볼만한 페이지
- 신경영상 - 전자 스핀 공명
전자 스핀 공명(ESR) 또는 전자상자성공명(EPR)은 짝짓지 않은 전자를 검출하는 분광학적 기법으로, 외부 자기장과 마이크로파를 이용하여 시료 내 짝짓지 않은 전자의 스핀이 특정 에너지의 마이크로파를 공명 흡수하는 현상을 통해 짝짓지 않은 전자의 존재와 환경에 대한 정보를 얻어 다양한 분야에서 활용되며, 측정된 스펙트럼 파라미터를 분석하여 시료의 전자 구조 및 분자 환경에 대한 정보를 제공한다. - 신경영상 - 단일 광자 방출 컴퓨터 단층 촬영
단일 광자 방출 컴퓨터 단층 촬영(SPECT)은 감마 카메라로 2차원 영상을 획득하고 재구성하여 3차원 영상을 얻는 핵의학 영상 기법으로, 감마선을 직접 방출하는 방사성 추적자를 사용하여 종양, 감염, 갑상선 영상 등 다양한 임상 분야에서 활용되며, 특히 심근 관류 영상이나 뇌 기능 영상에서 허혈성 심장 질환 진단 또는 치매 원인 병리 진단에 사용된다. - 전기생리학 - 바이오피드백
바이오피드백은 정밀 기기로 생리적 활동을 측정하여 사용자에게 피드백을 제공, 사고, 감정, 행동 변화를 유도하여 생리적 변화를 지원하며, 치료 및 성적 향상에 활용되는 과정이다. - 전기생리학 - 근전도 검사
근전도 검사는 근육과 신경의 기능 이상을 진단하기 위해 근육의 전기적 활동을 측정하는 검사로, 신경근 질환 진단, 운동 연구, 보툴리눔 독소 주입 보조 등 다양한 분야에서 활용되며 인터페이스 제어 기술로도 연구된다. - 신경생리학 - 신경가소성
신경가소성은 뇌의 구조와 기능이 경험, 학습, 손상에 따라 변화하는 능력이며, 시냅스 가소성, 구조적 가소성으로 나뉘어 뇌졸중, 학습 장애 등의 치료와 재활, 명상, 예술 활동 등 다양한 분야에 응용된다. - 신경생리학 - 신경근 접합부
신경근 접합부는 운동 뉴런과 골격근 세포 사이의 시냅스로, 아세틸콜린을 매개로 신경 신호를 근육 수축으로 전환하며, 콜린에스터라제에 의해 신호가 종료되는 과정이 다양한 요인에 의해 영향을 받고 여러 질병과 관련되어 연구되고 있다.
| 전기생리학 |
|---|
2. 역사
18세기 전자기학의 여명기에 생체 조직(근육)이 전기 자극에 반응한다는 사실이 알려졌다.[2] 앨런 로이드 호지킨(Alan Lloyd Hodgkin)과 앤드루 필딩 헉슬리(Andrew Fielding Huxley)는 1963년 뉴런에서 활동 전위 생성 기전을 규명하여 노벨 생리학·의학상을 수상했다. 이들의 실험에는 대서양 오징어(''Loligo pealei'')의 거대 축삭을 이용한 세포 내 기록이 포함되었으며, 이는 "전압 고정" 기술의 초기 적용 사례 중 하나였다.
오늘날 세포 내 기록에는 주로 유리 미세 피펫이 사용되며, 팁 직경이 1마이크로미터 미만이고 저항은 수 메가옴이다. 미세 피펫은 세포 내액과 유사한 이온 조성의 용액으로 채워진다. 피펫 내 염화은 와이어는 전해질을 증폭기 및 신호 처리 회로에 전기적으로 연결한다. 측정 전압은 세포 주변 세포 외액과 접촉하는 염화은 코팅 은선인 기준 전극의 전압과 비교된다. 전극 팁이 작을수록 전기 저항이 높아지므로, 전극은 크기와 저항 사이의 절충안으로 결정된다.
건강한 뇌 절편을 유지하는 것은 성공적인 전기생리학적 기록에 필수적이다. Compresstome vibratome과 같은 도구를 사용하여 뇌 절편을 준비하면 정확하고 신뢰할 수 있는 기록을 위한 최적의 조건을 보장할 수 있다. 그러나 최고 수준의 조직 처리에도 불구하고, 절편 준비는 뇌의 주요 면역 세포인 미세아교세포의 빠르고 강력한 표현형 변화를 유도하므로, 이 모델을 사용할 때에는 이를 고려해야 한다.
2. 1. 18세기: 갈바니의 동물 전기
1780년 물리학자이자 해부학자인 루이지 갈바니는 개구리 다리에 전기 자극을 가하는 실험 중, 우연히 외부에서 전류를 가하지 않아도 전기 자극을 가했을 때와 같은 현상이 일어나는 것을 발견했다(갈바니 전기 참조).[2] 이는 후에 알레산드로 볼타가 지적한 바와 같이, 화학 전지(갈바니 전지)가 우연히 성립되었기 때문이었지만, 갈바니는 생물체 내에 전류 발생 요인이 있으며, 그것에 의해 근육 등 생체가 움직인다고 생각하고, 이를 "동물 전기(animal electricity)"라고 명명했다(일련의 추론은 최종적으로 1791년에 서적으로 정리되어 발표되었다).[2] 이러한 착상이 오늘날 전기생리학의 효시로 여겨진다.[2]2. 2. 19세기: 신경 활동의 전기적 특성 규명
루이지 갈바니는 1780년에 개구리 다리에 전기 자극을 가하는 실험 중, 외부에서 전류를 가하지 않아도 전기 자극을 가했을 때와 같은 현상이 일어나는 것을 우연히 발견했다. 알레산드로 볼타는 이것이 화학 전지(갈바니 전지)가 우연히 성립되었기 때문이라고 지적했지만, 갈바니는 생물체 내에 전류 발생 요인이 있다고 생각하고, 이를 "동물 전기(animal electricity)"라고 명명했다. 이러한 착상이 오늘날 전기생리학의 효시로 여겨진다.[2]19세기에는 전기를 이용한 생리학 연구가 활발해졌고, 에밀 뒤 부아-레몽이나 헤르만 폰 헬름홀츠를 중심으로 신경 활동이 전기적 활동이라는 것이 확립되었다. 근전도와 심전도 연구는 19세기 말부터 이루어졌으며, 심전도 측정은 이후 연구된 뇌파와 함께 현재는 임상 검사로도 빼놓을 수 없는 기술이 되었다.[2]
2. 3. 20세기: 전기 자극법과 측정 기술의 발전
19세기에는 전기를 이용한 생리학 연구가 활발해졌고, 에밀 뒤 부아레몽이나 헤르만 폰 헬름홀츠를 중심으로 신경 활동이 전기적 활동이라는 것이 확립되었다. 조직의 전기적 활동을 관찰하는 방법으로는 근전도와 심전도 연구가 19세기 말부터 이루어졌으며, 심전도 측정은 이후 연구된 뇌파와 함께 현재는 임상 검사로도 필수적인 기술이 되었다. 20세기 중반에는 뇌·신경계 연구에 전기 자극법이 사용되었다. 또한 조직·세포의 전기적 활동을 측정하기 위한 방법이 발전하여, 전기적 활동으로서의 신경 활동의 상세한 내용이 밝혀졌다.일본에서는 전 도호쿠 대학 총장 모토카와 히로이치가 이 분야의 연구자로서 선구적인 존재이며, 저서로 『전기생리학』(이와나미 전서)이 있다.
2. 4. 21세기: 광유전학과 계산 전기생리학
엄밀히 말해 실험적 측정에 해당하지는 않지만, 단백질과 생체막의 전도 특성을 ''전산 모사''로 검토하는 방법이 개발되었다. 이는 주로 분자 역학 시뮬레이션으로, 지질 이중층과 같은 모델 시스템에 외부 전압을 가하는 방식이다. 이러한 설정을 사용한 연구를 통해 막의 전기천공[27] 및 채널을 통한 이온 이동과 같은 동적 현상을 연구할 수 있었다.[28]이러한 방법의 장점은 원자 수준의 시뮬레이션이 제공하는 본질적으로 높은 해상도와 데이터 밀도로 인해 활성 전도 메커니즘에 대한 높은 수준의 세부 정보를 얻을 수 있다는 것이다. 모델의 타당성에 대한 불확실성과 시스템 자체의 거시적 특성을 재현하는 것으로 간주될 수 있을 만큼 충분히 크고 충분한 시간 규모에 걸쳐 시스템을 모델링하는 데 드는 계산 비용으로 인해 상당한 단점이 있다. 원자 수준 시뮬레이션은 마이크로초 영역에 근접하거나 이를 넘어서는 시간 규모에 접근할 수 있지만, 이는 패치 클램핑과 같은 실험적 방법의 해상도보다도 수십 배 낮다.
막전위의 광학적 측정법을 통해 막전위의 '''계측'''은 광학적으로 가능해졌다. 전기생리학에서 중요한 또 다른 측면은 막전위의 '''조작'''이다.
광유전학을 이용하면, 광감수성 단백질을 통해 '''빛으로 막전위를 조작'''하는 것이 가능해진다.
3. 실험 방법
광학 전기생리학 기법은 기존 기법의 한계를 극복하기 위해 개발되었다. 기존 기법은 조직 내 한 지점에서만 전기적 활동을 관찰할 수 있었지만, 광학 기법은 전압 감응 염료나 형광 단백질을 이용하여 전기적 활동의 1차원 또는 2차원 분포를 관찰하고 기록할 수 있게 해준다.
'''세포 내 기록'''은 세포막 전압 및/또는 전류를 측정하는 것이다. 1963년 앨런 로이드 호지킨과 앤드루 필딩 헉슬리는 오징어 거대 축삭을 이용한 세포 내 기록 실험으로 뉴런의 활동 전위 생성 기전을 밝혀 노벨 생리학·의학상을 수상했다.
'''패치 클램프''' 기법은 에르빈 네어와 베르트 자크만이 개발한 기술로, 세포막의 작은 부분(패치)을 통해 흐르는 이온 전류를 측정한다. 세포 부착 모드, 전세포 기록, 천공 패치 기록 등 다양한 방법이 있다.
'''전산 모사'''는 단백질과 생체막의 전도 특성을 컴퓨터 시뮬레이션으로 연구하는 방법이다. 분자 역학 시뮬레이션을 통해 막의 전기천공 및 채널을 통한 이온 이동과 같은 동적 현상을 연구할 수 있다.[27][28]
전기생리학적 실험 방법은 전극을 조직 표면, 조직 내, 세포 표면, 세포 내 등에 고정하여 전압 또는 전류를 제어하고 측정한다. 사용되는 전극 종류에는 고전적인 고체 전극, 인쇄 회로 기판, 유리 피펫 등이 있다.
측정 방법에는 전압 고정법과 전류 고정법이 있다.
- '''전압 고정법''': 막 전위를 일정하게 유지하고 이온 채널의 활동을 조사한다.

- '''전류 고정법''': 신경 전달 물질의 작용으로 이온류가 발생했을 때 세포의 반응을 조사한다.

마이크로미터 단위의 작은 전극을 사용하면 단일 세포의 전기 활동을 기록할 수 있다. 최근에는 세포 활동에 영향을 덜 주는 미세한 유리 피펫을 사용하는 경우가 많다. 선단 직경이 1마이크로미터 이하이고 전기 저항이 수 메가옴인 이러한 전극을 통해 분자 수준의 측정이 가능하다.
최근에는 막전위의 광학적 측정법(막전위 이미징)이 개발되어 신경 세포 집단의 활동을 동시 기록하는 것이 가능해졌다. 또한, 광유전학을 이용하면 빛으로 막전위를 조작할 수 있다.
기타 방법으로는 평면 패치 클램프, 생체 전기 인식 분석법(BERA), 막 엔지니어링을 통한 분자 식별(MIME) 등이 있다.
3. 1. 전극의 종류
전극은 형태와 크기에 따라 다양한 종류가 있으며, 실험 목적에 맞게 사용된다. 고전적인 고체 전극 외에도 인쇄 회로 기판이나 유리 피펫에 완충액을 채운 형태 등이 사용된다.세포 내 이온 구성을 최소한으로 변화시키면서 세포막 내부의 전위를 기록하기 위해서는 뾰족 전극을 사용한다. 이 미세 피펫은 패치 클램프에 사용되는 것과 유사하지만, 구멍이 훨씬 작아 세포 내 유체와 피펫 내 전해질 사이의 이온 교환이 거의 일어나지 않는다.[8]
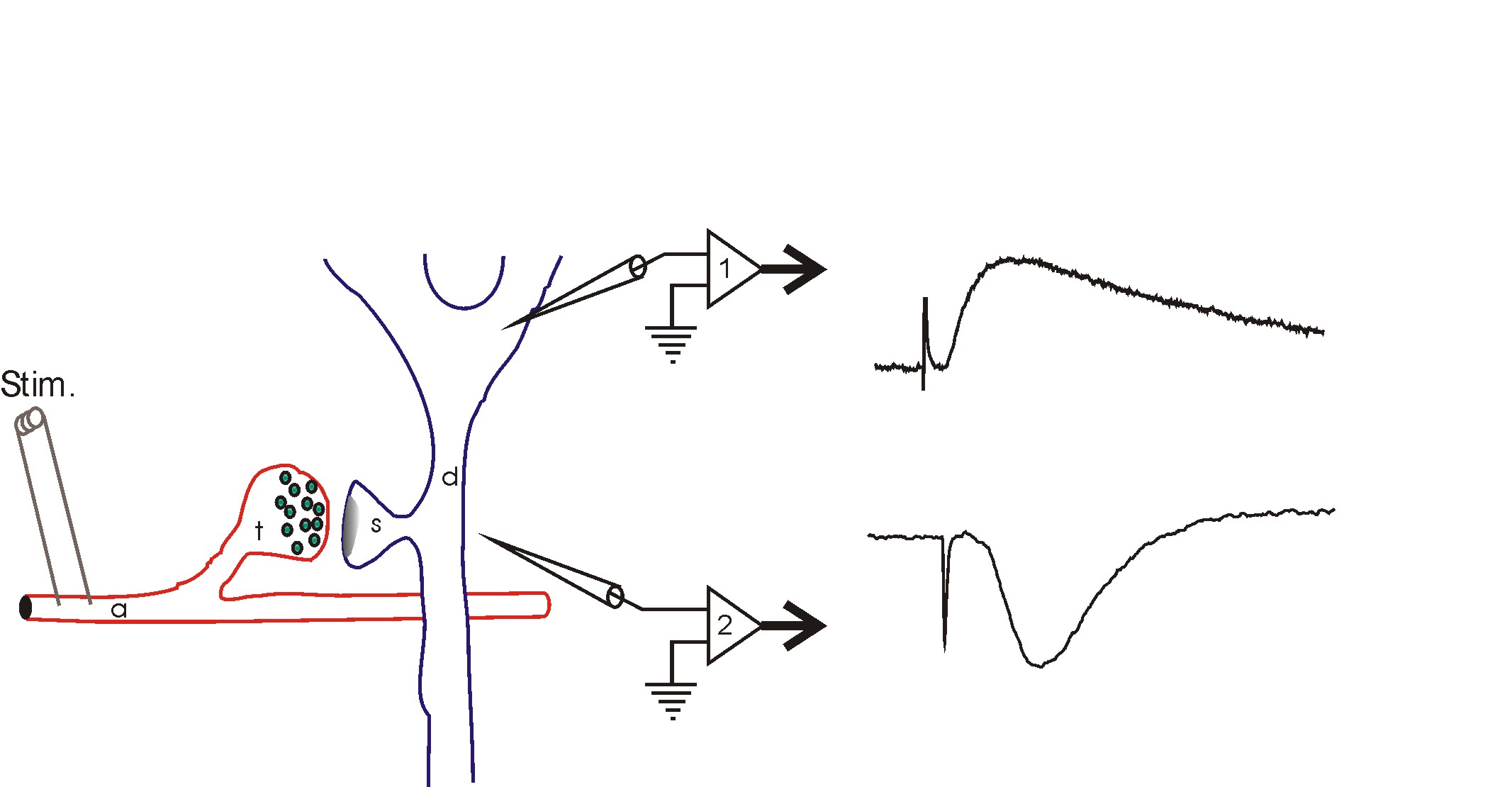
살아있는 동물의 뇌에 삽입된 전극은 전극 팁 주변의 뉴런에 의해 생성된 전기적 활동을 감지한다. 팁 크기가 약 1 마이크로미터인 미세 전극은 일반적으로 최대 하나의 뉴런 활동을 감지하며, 이를 "단일 단위" 기록이라고 한다. 데이비드 허블과 토르스텐 위젤은 이러한 방식으로 고양이의 1차 시각 피질에서 단일 뉴런의 활동을 기록하여, 이 영역의 뉴런이 시각 자극의 매우 구체적인 특징에 반응한다는 것을 보였다.[9] 이들은 이 공로로 1981년 노벨 생리학·의학상을 수상했다.[10]
전극 팁이 약간 더 크면, 여러 뉴런에서 생성된 활동을 기록할 수 있는데, 이를 "멀티 유닛 기록"이라고 한다. 전극 팁이 더 크면, 개별 뉴런의 활동을 구별할 수는 없지만, 장 전위를 기록할 수 있다.
마이크로미터 단위의 작은 전극을 사용하면 단일 세포의 전기 활동을 기록할 수 있으며, 최근에는 세포 활동에 영향을 덜 주는 미세한 유리 피펫을 사용하는 경우가 많다. 선단 직경이 1마이크로미터 이하이고 전기 저항이 수 메가옴인 이러한 전극을 통해 분자 수준의 측정이 가능하다.
세포 내에 가느다란 바늘 모양의 전극을 삽입하여 막 안팎의 전위차 또는 전류를 측정할 수 있다. 앨런 로이드 호지킨과 앤드루 필딩 헉슬리는 오징어의 거대 축삭에 전압 고정법을 적용하여 뉴런의 활동 전위 메커니즘을 연구했으며, 1963년 노벨상을 수상했다.
에르빈 네어와 베르트 작만은 패치 클램프 기법을 개발하여 세포막의 작은 부분(패치)의 전기적 활동을 기록할 수 있게 했다. 이들은 1991년 노벨상을 수상했다. 패치 클램프 기법에는 다음과 같은 세 가지 종류가 있다.
- 세포 흡착: 피펫 안쪽의 완충액을 가볍게 흡인하여 세포를 흡착시켜 패치에 있는 이온 채널의 성질을 조사한다.
- 패치 파괴: 강하게 흡인하여 패치를 파괴하고 완충액을 세포 내와 연결하여 세포 내 기록을 한다.
- 패치 분리: 패치를 세포에서 떼어내 회수하여 막에 있는 이온 채널의 성질을 조사한다.
이 외에도, 세포 내 이온 조성을 가능한 한 바꾸지 않고 기록하기 위해 구멍 크기를 더욱 작게 하여 이온의 출입이 거의 없도록 한 미세 피펫을 사용하기도 한다.
3. 2. 측정 방법
전기생리학적 측정 방법은 생물학적 조직 내 이온의 흐름, 즉 이온 전류를 측정하고 기록하는 기술이다. 이러한 흐름을 측정하기 위해 다양한 종류의 전극이 사용된다.- 단순한 고체 도체 (예: 원판, 바늘)
- 인쇄 회로 기판 또는 유연한 폴리머의 추적선
- 염화칼륨 용액과 같은 전해질로 채워진 속이 빈 튜브 (예: 유리 피펫)
측정 대상에는 다음이 포함된다.
- 살아있는 유기체
- 절제된 조직 (급성 또는 배양)
- 절제된 조직에서 분리된 세포 (급성 또는 배양)
- 인공적으로 성장한 세포 또는 조직
전극의 크기에 따라 측정의 분해능이 달라진다.
- 마이크로미터 단위의 작은 전극: 단일 세포의 세포 내 전기적 활동을 직접 관찰하거나, 활동 전위를 간접적으로 관찰(단위 활동 기록)할 수 있다.
- 더 큰 전극: 여러 세포의 순 활동(국소장 전위)을 측정하거나, 수백만 개 세포 집단의 동기 활동을 감지하는 데 사용된다.
전기생리학의 고전적 기술에는 다음이 포함된다.
- 단일 채널 기록
- 전류법
- 광학 전기생리학 기법: 전압 감응 염료나 형광 단백질을 이용하여 전기적 활동의 공간적 분포를 관찰한다.
주요 측정 방법
- '''전압 고정 (Voltage Clamp)''': 세포의 막 전위를 특정 값으로 고정하여, 그 전압에서 막을 통과하는 이온 전류를 측정한다. 전압 개폐 이온 통로의 특성을 연구하는 데 유용하다.
- '''전류 고정 (Current Clamp)''': 세포에 전류를 주입하여 막 전위 변화를 기록한다. 신경전달물질과 같이 막 이온 채널을 통해 작용하는 물질에 대한 세포의 반응을 연구하는 데 사용된다.
- '''패치 클램프 (Patch Clamp)''': 에르빈 네어와 베르트 자크만이 개발한 기술로, 세포막의 작은 부분(패치)을 통해 흐르는 이온 전류를 측정한다.
- '''세포 부착 모드''': 막 패치에 존재하는 이온 채널의 활성을 연구한다.
- '''전세포 기록''': 세포 내 유체와 기록 전극 내부 용액이 섞여 세포 내 유체의 일부가 희석될 수 있다.
- '''천공 패치 기록''': 이오노포어를 사용하여 막 패치에 작은 구멍을 만들어 이온만 통과시킨다.
- '''단일 단위 기록''': 살아있는 동물의 뇌에 삽입된 미세 전극을 사용하여 단일 뉴런의 활동을 기록한다. 데이비드 허블과 토르스텐 위젤은 이 방법을 사용하여 고양이의 1차 시각 피질 뉴런이 시각 자극의 특정 특징에 반응한다는 것을 발견했다.[9][10]
- '''다중 단위 기록''': 여러 뉴런에서 생성된 활동을 기록한다.
- '''세포 외 전장 전위 기록''': 많은 세포의 집단 활동에 의해 생성되는 국소 전류 싱크 또는 소스를 측정한다. 동시 활성화되는 뉴런의 시냅스 전달에 의해 생성되는 경우가 많다.
- '''전류법''': 탄소 전극을 사용하여 생물학적 용액의 산화된 구성 요소의 화학적 조성 변화를 기록한다. 노르에피네프린, 도파민, 세로토닌과 같은 모노아민 신경 전달 물질의 측정이 가능하다.
- '''평면 패치 클램프''': 바이오칩의 미세 구조화된 구멍에 세포 현탁액을 피펫팅하여 단일 세포를 위치시키고 밀착 연결(기가실)을 형성하는 고처리량 전기 생리학 방법이다.[12]
뾰족 전극을 사용하면 세포 내 이온 구성을 최소한으로 변화시키면서 세포막 내부의 전위를 기록할 수 있다. 전극의 끝은 루시퍼 옐로우와 같은 염료로 채워져 기록된 세포의 형태를 확인할 수 있게 한다.[8]
3. 3. 기타 방법
평면 패치 클램프는 고처리량 전기 생리학을 위해 개발된 새로운 방법이다.[12] 부착된 세포에 피펫을 위치시키는 대신, 세포 현탁액을 미세 구조화된 구멍이 있는 바이오칩에 피펫한다. 그런 다음 흡입을 통해 단일 세포를 구멍에 위치시키고 밀착 연결(기가실)이 형성된다. 평면 기하학은 기존 실험에 비해 다양한 이점을 제공한다.- 마이크로 유체 공학의 통합이 가능하여 이온 채널 스크리닝을 위한 자동 화합물 적용이 가능하다.
- 이 시스템은 광학 또는 주사 탐침 현미경 기술에 접근할 수 있다.
- 세포 내 측면의 관류를 수행할 수 있다.
이 전기생리학적 접근법을 사용하면, 채널 또는 수송체(transporter)를 포함하는 단백질 리포솜, 막 소포 또는 막 조각들이 기능화된 전극 위에 칠해진 지질 단일층에 흡착된다. 이 전극은 유리 지지대, 크롬 층, 금 층, 그리고 옥타데실 메르캅탄 단일층으로 구성된다. 칠해진 막이 전극에 의해 지지되기 때문에, 이를 고체 지지 막(solid-supported membrane)이라고 부른다. 일반적으로 생물학적 지질 막을 파괴하는 기계적 교란은 SSM의 수명에 영향을 미치지 않는다. 정전 용량성 전극(SSM과 흡수된 소포로 구성)은 기계적으로 매우 안정적이어서 표면에서 용액을 빠르게 교환할 수 있다. 이러한 특성은 소포와 전극 간의 용량성 결합을 통해 측정되는, 관심 있는 단백질의 전기 발생 활성을 조사하기 위해 기질/리간드 농도 급증을 빠르게 적용할 수 있게 해준다.[13]
생체 전기 인식 분석법(BERA)은 젤 매트릭스에 고정된 세포의 막 전위 변화를 측정하여 다양한 화학 및 생물학적 분자를 결정하는 새로운 방법이다. 전극-세포 인터페이스의 안정성 증가 외에도 고정화는 세포의 생존력과 생리학적 기능을 유지한다. BERA는 세포막 전위를 변화시켜 고정화된 전체 세포와 상호 작용할 수 있는 분석물을 분석하기 위해 주로 바이오센서 응용 분야에 사용된다. 이러한 방식으로 양성 샘플이 센서에 추가되면 전기 전위의 특징적인 "시그니처와 같은" 변화가 발생한다. BERA는 최근에 시작된 범유럽 FOODSCAN 프로젝트의 핵심 기술로, 유럽의 살충제 및 식품 위험 평가에 관한 것이다.[14]
BERA는 다음을 특정하고, 신속(1-2분), 재현 가능하며, 비용 효율적인 방식으로 탐지하는 데 사용되었다.
- 인간 바이러스 (B형 간염 및 C형 바이러스, 헤르페스 바이러스)[15]
- 수의학적 질병 병원체 (구제역 바이러스, 프리온, 블루텅 바이러스)
- 식물 바이러스 (담배 및 오이 바이러스)[16]
이 방법은 또한 살충제[17][18][19] 및 식품 내 마이코톡신[20]과 같은 환경 독소, 코르크 및 와인 내 2,4,6-트리클로로아니솔[21][22]의 검출, 임상 샘플에서 매우 낮은 농도의 슈퍼옥사이드 음이온을 측정하는 데 사용되었다.[23][24]
BERA 센서는 소모성 생물학적 인식 요소와 내장된 인공 지능을 갖춘 전자 판독 장치,[25] 두 부분으로 구성된다.
최근의 발전은 막 엔지니어링을 통한 분자 식별(MIME)이라는 기술의 개발이다. 이 기술은 수천 개의 인공 수용체를 세포막에 삽입하여 거의 모든 관심 분자에 대해 정의된 특이성을 가진 세포를 구축할 수 있게 해준다.[26]
실험 방법으로는, 전극을 조직 표면, 조직 내(세포 외), 세포 표면, 또는 세포 내 등에 고정하여 전압 또는 전류를 제어하고 측정한다. 전극의 종류에는 고전적인 고체 전극 외에도, 인쇄 회로 기판, 그리고 유리 피펫 등의 관에 완충액을 채운 것이 있으며, 목적에 맞는 형태와 크기의 전극이 이용된다.
측정 방법에는 전압을 고정하고 전류를 기록하는 전압 고정법과, 일정한 전류를 흘려 전압을 기록하는 전류 고정법이 있다. 전압 고정법은 일정한 막 전위에서의 이온 채널의 활동을 조사하는 데 적합하다. 전류 고정법은 신경 전달 물질의 작용으로 이온류가 발생했을 때 세포의 반응을 조사하는 데 적합하다. 전압 고정법은 전기 신호를 증폭기로 증폭하여 측정하지만, 전류 고정법은 증폭기를 사용하지 않고 직접 측정하는 경우가 많다.
마이크로미터 단위의 작은 전극을 사용하면, 단일 세포의 전기 활동을 기록할 수 있다. 현재는 세포의 활동에 영향을 덜 주는 미세한 유리 피펫을 사용하는 경우가 많다. 이것은 선단 직경이 1마이크로미터 이하, 전기 저항이 수 메가옴인 것이다. 이를 통해 분자 수준의 측정 또한 가능하다. 완충액과 전극을 넣은 미세한 피펫의 끝을 세포막에 밀착시키면 피펫 안팎의 액체가 절연되어 밀착된 안쪽 부분(패치)의 전기 활동을 기록할 수 있다. 이 방법을 패치 클램프라고 한다. 이 방법은 에르빈 네어와 베르트 작만 (1991년 노벨상 수상)에 의해 개발되었다.
실험 방법에는 크게 3가지 종류가 있다.
1. 피펫 안쪽의 완충액을 가볍게 흡인하여 세포를 흡착시킨다. 이것으로 피펫 끝으로 둘러싸인 패치에 있는 이온 채널의 성질을 조사할 수 있다.
2. 더욱 강하게 흡인하면 패치가 파괴되어 완충액은 세포 내와 연결되고, 기존의 고체 전극과 마찬가지로 세포 내 기록이 가능하다. 단점으로는 세포질이 완충액과 섞여 묽어진다는 점이 있다. 이것을 개선하기 위해 고안된 것이 천공 패치법으로, 이온만 통과시키는 물질(이오노포어)을 패치 부분의 막에 흡수시켜 이온만 자유롭게 통과하도록 하는 방법이다. 이것으로, 단백질 등은 밖으로 나오지 않지만 전기적으로는 연결된다.
3. 패치를 세포에서 떼어내 회수하여 조사할 수도 있다. 이것은 막에 있는 이온 채널의 성질을 조사하는 뛰어난 방법이다. 이것에는 피펫 끝을 세포에 밀착시킨 단계에서 패치를 잘라내는 방법(세포 내측이 피펫 바깥쪽에 위치)과, 일단 패치를 파괴한 다음 그 주변의 막을 끌어내는 방법(세포 내측이 피펫 안쪽에 위치)이 있다.
이상 외에도, 세포 내 이온 조성을 가능한 한 바꾸지 않고 기록하기 위해 패치 클램프와 같은 피펫이지만, 구멍 크기를 더욱 작게 하여 이온의 출입이 거의 없도록 한 것을 사용하는 방법이 있다. 막전위의 광학적 측정법을 통해 막전위의 계측은 광학적으로 가능해졌다. 전기생리학에서 중요한 또 다른 측면은 막전위의 조작이다. 광유전학을 이용하면, 광감수성 단백질을 통해 빛으로 막전위를 조작하는 것이 가능해진다.
4. 임상 전기생리학
임상 전기생리학은 전기생리학적 원리와 기술을 인간의 건강에 어떻게 적용할 수 있는지를 연구하는 분야이다. 예를 들어, 임상 심장 전기생리학은 심장 리듬과 활동을 제어하는 전기적 특성을 연구한다. 심장 전기생리학은 부정맥(불규칙한 심장 박동)과 같은 질환을 관찰하고 치료하는 데 사용될 수 있다. 예를 들어, 의사는 심장 근육의 전기적 활동을 기록하기 위해 전극이 포함된 카테터를 심장에 삽입할 수 있다.
임상 전기생리학의 또 다른 예는 임상 신경생리학이다. 이 의학 전문 분야에서 의사는 뇌, 척수, 그리고 신경의 전기적 특성을 측정한다. 뒤센 드 불로뉴(1806–1875)와 나다니엘 A. 부흐발트(1924–2006)와 같은 과학자들은 신경생리학 분야를 크게 발전시켜 임상적 응용을 가능하게 한 것으로 여겨진다.
5. 전기생체도(Electrography)
전기생리학적 기록은 일반적으로 전기생체도(electrography)라고 불리며(''electro-'' + ''-graphy'', "전기적 기록") 생성된 기록은 전기생체도(electrogram)이다. 그러나 "전기생체도(electrography)"라는 단어는 키를리안 사진술, 전기사진술을 포함하는 다른 의미를 가지기도 한다. 특정 유형의 전기생리학적 기록은 일반적으로 ''electro-'' + [신체 부위 결합 형태] + ''-graphy'' (약어 ExG)의 패턴으로 구성된 특정 이름으로 불린다. "electrogram"이라는 단어는 심장 내 전기생체도의 특정 의미를 가지는 경우가 많으며, 이는 심전도와 유사하지만 비침습적 리드(피부)가 아닌 일부 침습적 리드(심장 내부)가 사용된다는 차이가 있다. 임상적 진단 목적으로 전기생리학적 기록은 전기진단 검사 범주에 포함된다. 다양한 "ExG" 모드는 다음과 같다.
| 모달리티 | 약어 | 신체 부위 | 임상 사용 빈도 |
|---|---|---|---|
| 심전도 | ECG 또는 EKG | 심장 (구체적으로 심근), 피부 전극 사용 (비침습적) | 1—매우 흔함 |
| 심방 전기생체도 | EAG | 심방 심근 | 3—흔하지 않음 |
| 심실 전기생체도 | EVG | 심실 심근 | 3—흔하지 않음 |
| 심장 내 전기생체도 | EGM | 심장 (구체적으로 심근), 심장 내 전극 사용 (침습적) | 2—다소 흔함 |
| 뇌파검사 | EEG | 뇌 (일반적으로 대뇌피질), 두개외 전극 사용 | 2—다소 흔함 |
| 뇌피질전기생체도 | ECoG 또는 iEEG | 뇌 (구체적으로 대뇌피질), 두개 내 전극 사용 | 2—다소 흔함 |
| 근전도검사 | EMG | 신체 전체의 근육 (일반적으로 골격근, 때로는 평활근) | 1—매우 흔함 |
| 안구전도검사 | EOG | 눈—전체 안구 | 2—다소 흔함 |
| 망막전위도검사 | ERG | 눈—구체적으로 망막 | 2—다소 흔함 |
| 전자안진검사 | ENG | 눈—각막망막 전위 이용 | 2—다소 흔함 |
| 후각전기생체도 | EOG | 포유류의 후각 상피 | 3—흔하지 않음 |
| 촉각전기생체도 | EAG | 절지동물의 더듬이의 후각 수용체 | 4—임상적으로 적용 불가 |
| 전기와우도검사 | ECOG 또는 ECochG | 달팽이관 | 2—다소 흔함 |
| 위전도검사 | EGG | 위 평활근 | 2—다소 흔함 |
| 위장관전도검사 | EGEG | 위 및 장 평활근 | 2—다소 흔함 |
| 성문전도검사 | EGG | 성문 | 3—흔하지 않음 |
| 구개전도검사 | EPG | 구개의 혀 접촉 | 3—흔하지 않음 |
| 동맥 전기생체도 | EAG | 동맥 혈류는 피부를 통해 감지되는 스트리밍 전위로 측정[3] | 3—흔하지 않음 |
| 눈꺼풀 전기생체도 | EBG | 눈꺼풀 근육 | 3—흔하지 않음 |
| 피부전기반응 | EDG | 피부 | 3—흔하지 않음 |
| 췌장 전기생체도 | EPG | 췌장 | 3—흔하지 않음 |
| 자궁 전기생체도 | EHG | 자궁 | 3—흔하지 않음 |
| 신경전도검사 | ENeG 또는 ENoG | 신경 | 3—흔하지 않음 |
| 폐활량측정 | EPG | 폐 (가슴 움직임) | 3—흔하지 않음 |
| 척수 전기생체도 | ESG | 척수 | 3—흔하지 않음 |
| 서골 코 전기생체도 | EVG | 서골 코 기관 | 3—흔하지 않음 |
참조
[1]
논문
Electrophysiology in the age of light
[2]
웹사이트
https://www.bmseed.c[...]
[3]
특허
US
[4]
Youtube
Movie featuring Alan Hodgkin recording action potentials from a squid axon
https://www.youtube.[...]
[5]
논문
Healthy Brain-pituitary Slices for Electrophysiological Investigations of Pituitary Cells in Teleost Fish
2018
[6]
논문
Microglia contribute to neuronal synchrony despite endogenous ATP-related phenotypic transformation in acute mouse brain slices
2024
[7]
웹사이트
The Nobel Prize in Physiology or Medicine 1991
http://nobelprize.or[...]
2018-05-05
[8]
서적
Using microelectrodes
http://plymsea.ac.uk[...]
[9]
논문
Receptive fields, binocular interaction and functional architecture in the cat's visual cortex
http://www.jphysiol.[...]
1962-01-01
[10]
웹사이트
The Nobel Prize in Physiology or Medicine 1981
http://nobelprize.or[...]
2018-05-05
[11]
논문
Obtaining Acute Brain Slices
2018
[12]
웹사이트
Automated patch clamp
http://www.nanion.de[...]
2010-01-17
[13]
논문
SSM-based electrophysiology
[14]
문서
Bioelectric recognition assay (BERA)
[15]
문서
Development of a Novel, Ultra-rapid Biosensor for the Qualitative Detection of Hepatitis B Virus-associated Antigens and Anti-HBV, Based on "Membrane-engineered" Fibroblast Cells with Virus-Specific Antibodies and Antigens
[16]
문서
Engineering of the membrane of fibroblast cells with virus-specific antibodies: a novel biosensor tool for virus detection
[17]
문서
Development and Validation of a Cellular Biosensor Detecting Pesticide Residues in Tomatoes
[18]
문서
Assessment of organophosphate and carbamate pesticide residues in cigarette tobacco with a novel cell biosensor
[19]
문서
Screening of Total Organophosphate Pesticides in Agricultural Products with a Cellular Biosensor
[20]
문서
High throughput cellular biosensor for the ultra-sensitive, ultra-rapid detection of aflatoxin M1
[21]
문서
Development of a cellular biosensor for the detection of 2, 4, 6- trichloroanisole (TCA)
[22]
문서
Extraction-less, rapid assay for the direct detection of 2,4,6-trichloroanisole (TCA) in cork samples
[23]
문서
Application of "membrane-engineering" to bioelectric recognition cell sensors for the detection of picomole concentrations of superoxide radical: a novel biosensor principle
[24]
문서
Superoxide determination using membrane-engineered cells: An example of a novel concept for the construction of cell sensors with customized target recognition properties
[25]
문서
Pesticide Residue Screening Using a Novel Artificial Neural Network Combined with a Bioelectric Cellular Biosensor
[26]
문서
Visualization of the membrane-engineering concept: evidence for the specific orientation of electroinserted antibodies and selective binding of target analytes
[27]
논문
Ion Leakage through Transient Water Pores in Protein-Free Lipid Membranes Driven by Transmembrane Ionic Charge Imbalance
[28]
논문
Computational Electrophysiology: The Molecular Dynamics of Ion Channel Permeation and Selectivity in Atomistic Detail
[29]
웹사이트
Minimum Information about a Neuroscience Investigation (MINI) Electrophysiology
http://precedings.na[...]
2008
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com