질산 은
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
질산 은은 은을 질산에 녹여 제조하는 무색의 결정성 고체이다. 알베르투스 마그누스는 질산이 은을 녹여 금과 은을 분리할 수 있다는 것을 기록했다. 구리와 반응하여 은 금속 결정과 질산 구리 용액을 형성하며, 가열하면 분해되어 은, 산소, 이산화 질소를 생성한다. 은 화합물 전구체, 유기 합성, 생물학, 의료, 선거 잉크, 스테인드글라스 제작 등 다양한 용도로 사용된다. 질산 은은 산화제이므로 유기 화합물과 격리하여 보관해야 하며, 피부에 얼룩을 남기고 고농도에 노출되면 화상을 입을 수 있다.
더 읽어볼만한 페이지
- 은 화합물 - 아불화 은
아불화 은은 아이오딘화 카드뮴과 결정 구조는 같지만 이온 위치가 반대이며, 은 원자 간 최단 거리는 299.6 pm이다. - 은 화합물 - 산화 은(I)
산화 은(I)은 사면체 산소에 의해 연결된 선형 2배위 은 중심을 갖는 구조의 화합물로, 질산 은과 알칼리 수산화물의 반응으로 생성되며 전도성 페이스트 충전재, 유기 화학의 온화한 산화제, 산화 은 전지의 양극 재료 등 다양한 용도로 사용된다. - 질산염 - 질산 나트륨
질산 나트륨은 화학식 NaNO3의 무기 화합물로, 비료, 산화제, 폭약 성분 등으로 사용되며, 조해성이 있고 물에 잘 녹으며, 식품 첨가물로 사용될 경우 발암성 물질 생성과 관련될 수 있다. - 질산염 - 질산 암모늄
질산 암모늄은 질산과 암모니아의 반응으로 만들어지는 염으로, 질소 비료와 폭약의 재료로 사용되며, 물에 용해될 때 흡열 반응을 일으키는 특성이 있지만 가열되거나 특정 조건에서는 폭발할 수 있어 안전 관리가 중요하다. - 염색 염료 - H&E 염색
H&E 염색은 헤마톡실린과 에오신을 사용하여 조직의 핵은 파란색 또는 보라색으로, 세포질은 분홍색 또는 붉은색으로 염색하는 조직학적 염색법이다. - 염색 염료 - 질-닐슨 염색
질-닐슨 염색은 결핵균 등 항산성 세균 검출을 위해 개발된 염색 방법으로, 석탄산 푹신으로 1차 염색 후 산성 알코올로 탈색하고 대비 염색하여 항산성 세균을 붉은색으로, 비항산성 세균을 다른 색으로 염색한다.
| 질산 은 - [화학 물질]에 관한 문서 | |
|---|---|
| 일반 정보 | |
 | |
 | |
 | |
| IUPAC명 | 질산 은 |
| 다른 이름 | 질산 은(1+) 라피스 인페르날리스 아르젠투스 질산염 |
| 계통명 | 질산 은(I) |
| 식별 정보 | |
| 화학 물질 식별 번호 (ChemSpider ID) | 22878 |
| 유럽 화학 물질 은행 (ChEMBL) | 177367 |
| 펍켐 (PubChem) CID | 24470 |
| UNII | 95IT3W8JZE |
| 인치아이 (InChI) | 1/Ag.NO3/c;2-1(3)4/q+1;-1 |
| 인치아이 키 (InChIKey) | SQGYOTSLMSWVJD-UHFFFAOYAW |
| 표준 인치아이 (StdInChI) | 1S/Ag.NO3/c;2-1(3)4/q+1;-1 |
| 표준 인치아이 키 (StdInChIKey) | SQGYOTSLMSWVJD-UHFFFAOYSA-N |
| CAS 등록 번호 | 7761-88-8 |
| 화학 물질 실체 데이터베이스 (ChEBI) | 32130 |
| 미국 국립 직업 안전 보건 연구소 (RTECS) 번호 | VW4725000 |
| 유엔 번호 (UN Number) | 1493 |
| 유럽 공동체 (EC) 번호 | 231-853-9 |
| 화학적 특성 | |
| 원소 구성 | Ag=1 | N=1 | O=3 |
| 겉모습 | 무색 고체 |
| 냄새 | 무취 |
| 밀도 | 4.35 g/cm3 (24 °C) |
| 녹는점 | 209.7 °C |
| 끓는점 | 440 °C (분해) |
| 용해도 (물) | 122 g/100 mL (0 °C) 170 g/100 mL (10 °C) 256 g/100 mL (25 °C) 373 g/100 mL (40 °C) 912 g/100 mL (100 °C) |
| 다른 용매에 대한 용해도 | 아세톤, 암모니아, 에테르, 글리세롤에 용해됨 |
| 용해도 (아세트산) | 0.776 g/kg (30 °C) 1.244 g/kg (40 °C) 5.503 g/kg (93 °C) |
| 용해도 (아세톤) | 0.35 g/100 g (14 °C) 0.44 g/100 g (18 °C) |
| 용해도 (벤젠) | 0.22 g/kg (35 °C) 0.44 g/kg (40.5 °C) |
| 용해도 (에탄올) | 3.1 g/100 g (19 °C) |
| 용해도 (에틸 아세테이트) | 2.7 g/100 g (20 °C) |
| 굴절률 | 1.744 |
| 점성도 | 3.77 cP (244 °C) |
| 로그P | 0.19 |
| 자기 감수율 | −45.7·10−6 cm3/mol |
| 구조 정보 | |
| 결정 구조 | 사방정계, oP56 |
| 공간군 | P212121, No. 19 |
| 점군 | 222 |
| 격자 상수 a | 6.992(2) Å |
| 격자 상수 b | 7.335(2) Å |
| 격자 상수 c | 10.125(2) Å |
| 격자 상수 α | 90 |
| 열화학 정보 | |
| 표준 생성 엔탈피 | −124.4 kJ/mol |
| 표준 생성 자유 에너지 | −33.4 kJ/mol |
| 엔트로피 | 140.9 J/mol·K |
| 열용량 | 93.1 J/mol·K |
| 약리학 정보 | |
| ATC 코드 | D08AL01 |
| 위험성 정보 | |
| GHS 신호어 | 위험 |
| 미국 화재 예방 협회 (NFPA) | 건강: 3 화재: 0 반응성: 2 기타: OX |
| 주요 위험 | 에탄올과 폭발적으로 반응함. 유독함. 부식성. |
| 최소 치사량 (LDLo) | 800 mg/kg (토끼, 경구) 20 mg/kg (개, 경구) |
| 관련 화합물 | |
| 관련 화합물 | 황산 은(I) |
2. 합성 및 구조
질산 은은 은을 질산에 녹여 제조하며, 사용되는 질산의 농도에 따라 반응식과 생성물이 달라진다. 자세한 반응식은 하위 항목인 '합성'에 나와있다. 질산 은의 구조는 X선 결정학 연구를 통해 밝혀졌으며, 자세한 내용은 하위 항목인 '구조'에 나와있다.
2. 1. 합성
알베르투스 마그누스는 13세기에 질산이 은을 녹여 금과 은을 분리할 수 있음을 기록했다.[8] 질산 은은 실제로 은을 질산에 녹인 후 용액을 증발시켜 제조할 수 있다. 반응의 화학 양론은 사용된 질산의 농도에 따라 달라진다.:3 Ag + 4 HNO3 (냉각 및 희석) → 3 AgNO3 + 2 H2O + NO
:Ag + 2 HNO3 (가열 및 농축) → AgNO3 + H2O + NO2
순수한 은을 소량의 순수한 질산에 용해시키고 증발, 건조시켜 질산 은을 얻는다. 이 과정에서 이산화 질소 등이 발생한다.[31]
:Ag + 2HNO3 → AgNO3 + NO2 + H2O
공업적으로도 이 방법으로 제조한다. 위 반응식은 농질산과의 반응이며, 묽은 질산과의 경우에는 다음과 같다.
:3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
2. 2. 구조
질산 은의 구조는 여러 번 X선 결정학에 의해 연구되었다. 일반적인 온도와 압력에서 안정적인 사방정계 형태에서 은 원자는 3.227 Å의 Ag---Ag 접촉을 갖는 쌍을 형성한다. 각 Ag+ 중심은 단 및 이좌 배위 질산 리간드의 6개의 산소 중심에 결합되어 있다. Ag-O 거리는 2.384 ~ 2.702 Å이다.[7]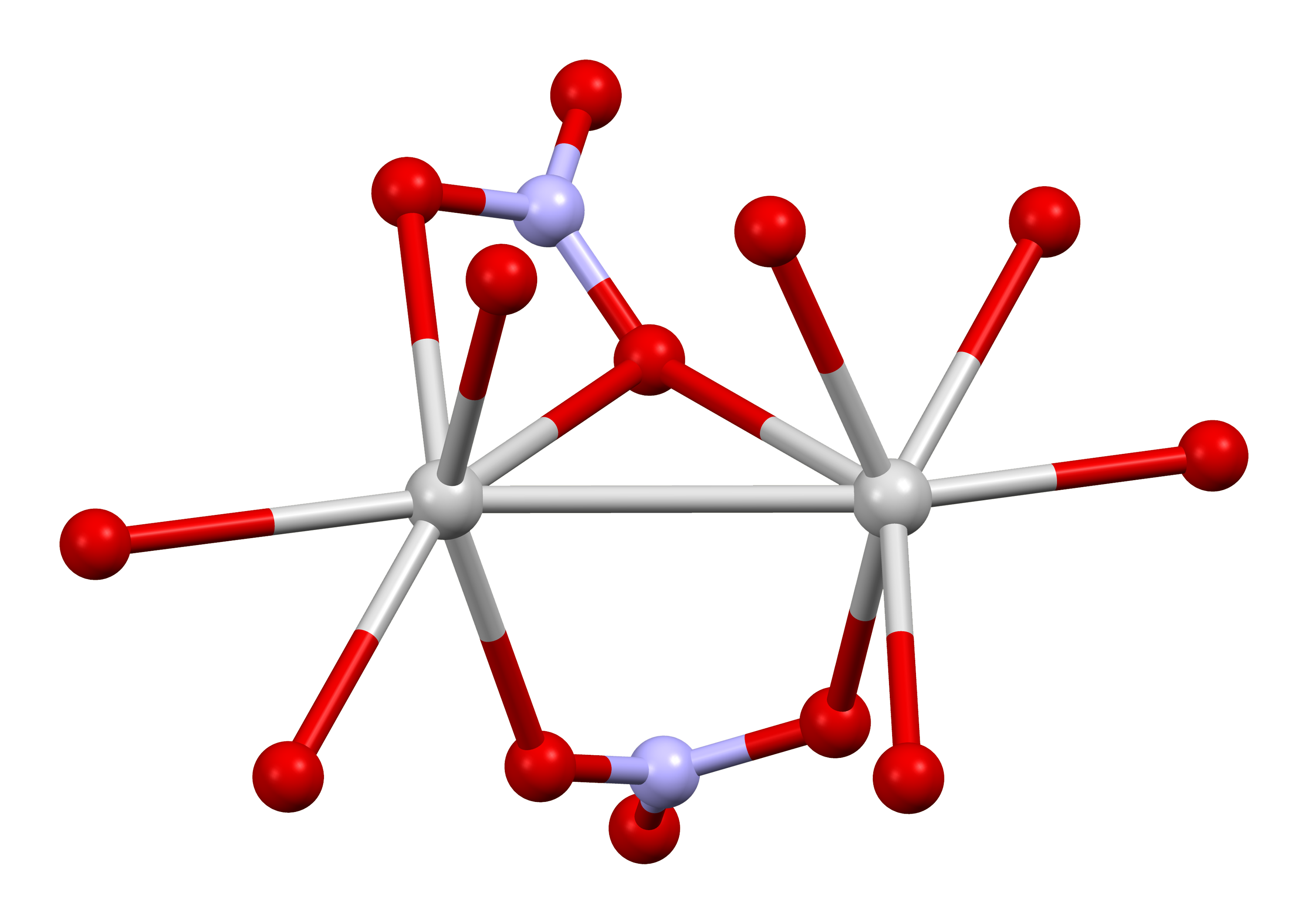
3. 반응
질산 은은 강전해질이며 물에는 잘 녹지만, 벤젠과 같은 비극성 용매에는 잘 녹지 않는다. 메탄올이나 아세톤에는 약간 녹는다.[32] 수용액은 거의 중성을 띤다. 피부에 묻으면 환원되어 은 미립자가 침착, 검게 변색되며 한동안 지워지지 않는다. 또한 산화 작용으로 부식성을 갖는다.
질산 은은 무색 결정성 고체이며, 유기물 등 불순물이 섞인 경우 햇빛 아래에서 유기물에 접촉하면 환원되어 검게 변한다. 고순도 질산 은은 빛에 비교적 안정적이다. 은거울 반응 시약, 도금, 염화물 이온 검출, 살균제, 사진 감광제, 분석 시약, 전기 통신 기기, 거울·보온병 등의 은 도금, 의약품 원료 등 다양한 용도로 사용된다. 빛에 의해 화학 반응을 일으키므로 갈색 병에 보관한다.
질산 은(I)은 액체 암모니아나 암모니아수와 반응하여 뇌은(Ag3N과 AgNH2의 혼합물)이라는 검은색 결정을 생성하기도 한다. 뇌은은 매우 민감한 화합물로, 수용액에서도 약간의 마찰이나 열에 폭발할 수 있다. 나트륨 이온이 있으면 뇌은 생성이 촉진되므로, 뇌은을 잘못 만든 경우 질산 은(I)과 암모니아 혼합 폐액이나 은거울 반응 후 폐액은 식염수(염화 나트륨 수용액)나 염산으로 분해 후 처리해야 한다.
3. 1. 구리와의 반응
질산 은 용액에 구리 막대를 담가 몇 시간 동안 방치하면, 질산 은은 구리와 반응하여 머리카락 모양의 은 금속 결정과 푸른색 질산 구리 용액을 형성한다.[9]: 2 AgNO3 + Cu → Cu(NO3)2 + 2 Ag
3. 2. 열분해
질산 은은 가열하면 분해된다.[9]: 2 AgNO3(l) → 2 Ag(s) + O2(g) + 2 NO2(g)
정성적으로 분해는 녹는점 이하에서는 무시할 수 있지만, 약 250°C에서 상당해지고 440°C에서 완전히 분해된다.[9]
대부분의 금속 질산염은 열적으로 해당 산화물로 분해되지만, 산화 은은 질산 은보다 낮은 온도에서 분해되므로 질산 은의 분해는 원소 은을 생성한다.
3. 3. 할로겐화물과의 반응
질산 은은 할로겐화물 공급원과 빠르게 반응하여 불용성 할로겐화 은을 생성하는데, 브로민화 이온(Br-)을 사용하면 크림색 침전물, 염화 이온(Cl-)을 사용하면 흰색 침전물, 아이오딘화 이온(I-)을 사용하면 노란색 침전물을 생성한다.[11] 이 반응은 무기 화학에서 할로겐화물을 추출하는 데 일반적으로 사용된다.:Ag+(aq) + X-(aq) → AgX(s)
여기서 X- = Cl-, Br-, 또는 I-이다.
이 반응은 분석 화학에서 염화물, 브롬화물, 또는 요오드화물 이온의 존재를 확인하는 데 사용된다. 시료는 일반적으로 간섭 이온(예: 탄산염 이온과 황화물 이온)을 제거하기 위해 묽은 질산으로 산성화한다. 이 단계는 황화 은 또는 탄산 은 침전물이 할로겐화 은 침전물과 혼동되는 것을 방지한다. 침전물의 색상은 할로겐화물에 따라 다르다: 흰색 (염화 은), 옅은 노란색/크림색 (브롬화 은), 노란색 (요오드화 은). AgBr과 특히 AgI는 노출된 시료에서 회색을 띠는 것으로 보아 금속으로 광화학적으로 분해된다.[11]
같은 반응이 보일러 급수가 해수로 오염되었는지 여부를 결정하기 위해 증기선에 사용되었다. 이는 과거에 건조했던 화물의 습기가 습한 공기의 결로인지 아니면 선체를 통해 새어 들어온 해수인지 확인하는 데 여전히 사용된다.[11]
4. 용도
질산 은은 은 화합물 전구체, 유기 합성, 생물학, 의학 등 다양한 분야에서 널리 사용된다.
질산 은은 무색의 결정성 고체이며, 은거울 반응의 시약이나 도금에 사용된다. 염화물과 반응하여 흰색 염화은(I) 침전을 생성하므로, 염화물 이온 검출에도 이용된다. 살균제, 사진 감광제, 분석 시약, 전기 통신 기기, 거울, 보온병 등의 은 도금, 의약품 원료로도 쓰인다. 고순도 질산 은은 빛에 비교적 안정적이지만, 불순물, 특히 유기물이 있으면 햇빛 아래에서 환원되어 검은색을 띤다. 빛에 의해 화학 반응을 일으키므로 갈색 병에 보존한다.[32]
액체 암모니아 또는 암모니아수와 반응하여 뇌은을 생성하기도 하는데, 이는 매우 민감한 화합물로 약간의 마찰이나 열에도 폭발한다. 나트륨 이온 존재 하에 뇌은 생성이 촉진되므로, 질산 은과 암모니아 혼합 폐액은 식염수나 염산으로 분해 후 처리해야 한다.
질산 은은 사진, 거울, 보온병 재료로 사용되며, 가공을 통해 기폭제로도 사용된다. 1971년 오사카부의 한 보온병 제조 회사에서 100kg의 질산 은이 도난당하는 사건이 발생했는데, 오사카부 경찰은 과격파가 폭탄 투쟁에 사용할 가능성을 고려하여 수사 본부를 설치하기도 하였다.[33]
의료용으로는 1~2% 수용액을 신생아 안질환 예방을 위해 점안하기도 한다.
4. 1. 은 화합물 전구체
질산 은은 다른 은 화합물을 만드는 데 널리 사용되는 출발 물질이다. 은 플루오로붕산염 및 은 과염소산염과 달리 물을 흡수하지 않는 비흡습성을 가지며, 빛에 비교적 안정적이고 물을 포함한 다양한 용매에 잘 녹는다. 질산염은 다른 리간드로 쉽게 교체할 수 있어 활용도가 높다.[10]할로겐 이온 용액으로 처리하면 AgX (X = Cl, Br, I) 침전물이 생성된다. 사진 필름을 만들 때 질산 은을 할로겐화 나트륨 또는 칼륨 용액으로 처리하여 불용성 할로겐화 은을 생성하고, 이를 사진 젤라틴에 섞어 삼아세테이트 또는 폴리에스터 필름에 도포한다. 이와 유사하게, 질산 은은 침전 반응을 통해 풀민산염, 아자이드, 아세틸라이드와 같은 은 기반 폭발물을 만드는 데 사용된다.[10]
질산 은을 수산화물로 처리하면 짙은 회색의 산화 은이 생성된다.[10]
:2 AgNO3 + 2 NaOH → Ag2O + 2 NaNO3 + H2O
4. 2. 유기 합성
질산 은은 탈보호 및 산화와 같은 여러 가지 방법으로 유기 합성에 사용된다. Ag+는 알켄과 가역적으로 결합하며, 질산 은은 선택적 흡착을 통해 알켄 혼합물을 분리하는 데 사용되어 왔다. 생성된 부착체는 암모니아로 분해하여 자유 알켄을 방출할 수 있다.[12] 질산 은은 물에는 매우 잘 녹지만, 아세토니트릴(111.8 g/100 g, 25 °C)을 제외한 대부분의 유기 용매에는 잘 녹지 않는다.[13]4. 3. 생물학
조직학에서 질산 은은 은 염색에 사용되어 망상 섬유, 단백질 및 핵산을 확인하는 데 사용된다. 이러한 이유로 젤 전기영동 겔에서 단백질을 확인하는 데에도 사용된다. 주사 전자 현미경에서 염색제로 사용할 수 있다.[14]절화 줄기를 질산 은 용액에 담그면 에틸렌 생성을 막을 수 있다. 이것은 꽃의 노화를 늦춘다.[15]
4. 4. 의료
은 염은 방부제 성질을 가지고 있다. 1881년 크레데는 어머니로부터의 임질 감염으로 실명될 수 있는 신생아의 임질 감염을 예방하기 위해 출생 시 신생아의 눈에 묽은 질산 은 용액을 사용하는 방법을 도입했다. (현재는 현대적인 항생제가 대신 사용된다).[19][20][21]막대 모양으로 성형된 융합된 질산 은은 전통적으로 "월경성 부식제"라고 불렸다. 이는 장루 주변의 육아 조직을 제거하기 위한 소작제로 사용된다. 제임스 애보트 경은 1827년 인도에서 한 영국인 외과의사가 미친 개의 물림으로 인한 팔의 상처에 질산 은을 주입하여 상처를 소작하고 광견병 발병을 예방했다고 일지에 기록했다.[22]
질산 은은 코의 얕은 혈관을 소작하여 코피를 예방하는 데 사용된다. 치과의사는 때때로 질산 은을 주입한 면봉을 사용하여 구강 궤양을 치료한다. 일부 족병 전문의는 질산 은을 사용하여 손발톱 바닥에 위치한 세포를 제거한다.
캐나다 의사 C. A. 더글러스 링로즈는 질산 은이 난관을 막고 부식시킬 수 있다고 믿고 불임 시술에 질산 은을 사용하는 연구를 했다.[23] 이 기술은 효과가 없었다.[24]
질산 은의 은 이온은 대장균을 불활성화시키는 능력이 있다. 불활성화 실험에서 평가된 질산 은의 농도는 Ag+로 1리터당 10–200 마이크로그램 범위이다.
은의 항균 활성은 현대적인 항생제가 발견되기 전에 많은 적용 사례를 보였으며, 이후 거의 사용되지 않게 되었다. 은착증과의 연관성은 소비자들을 조심스럽게 만들었고, 대안이 주어졌을 때 은을 외면하게 만들었다.
매일 반복적으로 질산 은을 사용하면 피부 사마귀를 적절히 파괴할 수 있지만, 때때로 색소 침착된 흉터가 생길 수 있다. 70명의 환자를 대상으로 한 위약 대조 연구에서 9일 동안 질산 은을 투여한 결과, 치료 후 한 달 뒤 모든 사마귀가 제거된 경우는 43%, 사마귀가 개선된 경우는 26%였으며, 위약군의 경우 각각 11%와 14%였다.[25]
의료용으로, 1~2% 수용액을 신생아에게 안질환 예방을 위해 점안하기도 한다.
4. 5. 기타
질산 은은 피부에 닿으면 오래 지속되는 얼룩을 생성하여 잉크의 성분으로 사용된다. 선거 잉크는 선거에서 투표한 사람의 손가락에 질산 은을 사용하여 표시함으로써 중복 투표를 방지한다.[16][17]질산 은은 스테인드글라스 제작에도 사용된다. 14세기부터 1,000년 이상 동안 예술가들은 질산 은으로 만든 "은 스테인"(노란색 스테인)을 사용하여 투명한 유리에 노란색 효과를 냈다. 이 스테인은 옅은 레몬색에서 짙은 오렌지색 또는 금색까지 다양한 색상을 생성했다. 은 스테인은 유리 페인트와 함께 사용되었으며, 페인트와 반대편 유리에 적용되었다. 또한 창문의 유리 조각 수를 줄여 모자이크 효과를 내는 데에도 사용되었다.
질산은은 사진, 거울, 보온병의 재료로 사용되어 왔다. 또한, 가공을 통해 기폭제로 사용되기도 한다.[33]
5. 안전성
산화제인 질산 은은 유기 화합물과 멀리 떨어진 곳에 보관해야 하며, 에탄올과 격렬하게 반응한다.[26] 극히 낮은 농도로 임질 예방과 코피를 멈추게 하는 데 널리 사용되지만, 여전히 매우 독성이 강하고 부식성이 있다.[27] 짧은 노출은 피부에 보라색, 갈색 또는 검은색 얼룩 외에는 즉각적인 부작용을 일으키지 않지만, 고농도에 지속적으로 노출되면 화상을 포함한 부작용이 나타난다. 장기간 노출은 눈 손상을 유발할 수 있다. 질산 은은 피부와 눈에 자극을 주는 것으로 알려져 있으며, 잠재적인 발암 물질에 대한 연구가 충분히 이루어지지 않았다.[28]
1g 이상의 은이 체내에 축적되면 은중독증이라는 질환이 발생할 수 있는데, 이는 피부와 내부 장기가 청회색으로 변하는 영구적인 미용 질환이다. 미국 환경 보호국은 1990년까지 수중에 있는 은에 대한 최대 오염 물질 제한을 두었지만, 착색에도 불구하고 은중독증이 영향을 받은 장기의 기능에 영향을 미치지 않는다는 결론을 내렸다.[29] 은중독증은 질산 은보다는 콜로이드성 은 용액의 섭취와 더 관련이 있지만, 어떤 종류의 은 이온 용액을 섭취하기 전에는 주의해야 한다.
손에 묻으면 환원되어 은의 미립자가 침착되어 검게 물들어 한동안 지워지지 않는다. 또한 산화 작용에 의한 부식성을 갖는다.
참조
[1]
문서
CRC90
[2]
서적
Solubilities of Inorganic and Organic Compounds
https://archive.org/[...]
D. Van Nostrand Company
[3]
웹사이트
silver nitrate
http://chemister.ru/[...]
2014-07-20
[4]
웹사이트
2014-07-20
[5]
문서
Silver (metal dust and soluble compounds, as Ag)
[6]
웹사이트
Definition of Lunar Caustic
http://dictionary.di[...]
[7]
학술저널
Structure du nitrate d'argent à pression et température ordinaires. Exemple de cristal parfait
[8]
서적
History of analytical chemistry
https://books.google[...]
Taylor & Francis
[9]
학술저널
High Temperature Properties and Decomposition of Inorganic Salts Part 3, Nitrates and Nitrites
[10]
웹사이트
3-Thiophenecarboxylic (Thenoic) Acid
[11]
웹사이트
Silver nitrate method
http://www.tis-gdv.d[...]
Gesamtverband der Deutschen Versicherungswirtschaf
2015-06-22
[12]
웹사이트
trans-Cyclooctene
[13]
웹사이트
silver nitrate
http://chemister.ru/[...]
2019-04-04
[14]
학술저널
The use of silver nitrate as a stain for scanning electron microscopy of arterial intima and paraffin sections of kidney
[15]
웹사이트
Silver Nitrate (072503) Fact Sheet
https://www3.epa.gov[...]
2024-10-29
[16]
뉴스
The ink with a 'secret formula' that powers the world's biggest democratic exercise {{!}} India {{!}} The Guardian
https://www.theguard[...]
2024-04-17
[17]
뉴스
The ink with a 'secret formula' that powers the world's biggest democratic exercise
https://www.theguard[...]
2024-04-17
[18]
웹사이트
Khan Academy
https://www.khanacad[...]
2024-10-29
[19]
학술저널
Dr Carl Credé (1819–1892) and the prevention of ophthalmia neonatorum
[20]
학술저널
Die Verhürtung der Augenentzündung der Neugeborenen
[21]
학술저널
Is Credés prophylaxis for ophthalmia neonatorum still valid?
https://www.scielosp[...]
[22]
문서
British Library, India Office Records, European Manuscripts, MSS EUR F171/33/3, page 109.
[23]
학술저널
Office tubal sterilization
[24]
문서
Cryderman v. Ringrose (1978), 89 D.L.R. (3d) 32 (Alta S.C.) and Zimmer et al. v. Ringrose (1981) 4 W.W.R. 75 (Alta C.A.).
[25]
학술저널
Guidelines for the management of cutaneous warts
http://www.huidziekt[...]
[26]
학술저널
Silver nitrate + ethanol = explosion
https://pubs.acs.org[...]
1986-11
[27]
웹사이트
Safety data for silver nitrate (MSDS)
http://msds.chem.ox.[...]
Oxford University Chemistry department
2008-03-25
[28]
웹사이트
New Jersey Right-To-Know-Act Hazardous Substance Fact Sheet - Silver Nitrate
http://nj.gov/health[...]
[29]
문서
"Silver Compounds." Encyclopedia of Chemical Technology. Vol. 22. Fourth Ed. Excec. Ed. Jaqueline I. Kroschwitz. New York: John Wiley and Sons, 1997.
[30]
문서
Wagman, D. D.; Evans, W. H.; Parker, V. B.; Schumm, R. H.; Halow, I.; Bailey, S. M.; Churney, K. L.; Nuttal, R. I.; Churney, K. L.; Nuttal, R. I. (1982). “The NBS tables of chemical thermodynamics properties”. ''J. Phys. Chem.'' Ref. Data 11 Suppl. 2.
[31]
문서
日本化学会編 『新実験化学講座 無機化合物の合成II』 丸善、1977年
[32]
문서
『化学大辞典』 共立出版、1993年
[33]
뉴스
「硝酸銀100キロ盗まれる 過激派の爆弾作戦か」『中國新聞』昭和46年10月14日 15面
[34]
문서
CRC90
[35]
서적
Solubilities of Inorganic and Organic Compounds
https://archive.org/[...]
D. Van Nostrand Company
[36]
웹인용
silver nitrate
http://chemister.ru/[...]
2014-07-20
[37]
저널
Structure du nitrate d'argent à pression et température ordinaires. Example de cristal parfait
[38]
Sigma-Aldrich
2014-07-20
[39]
IDLH
Silver (metal dust and soluble compounds, as Ag)
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com