헤마글루티닌
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
헤마글루티닌(HA)은 바이러스 표면에 존재하는 당단백질로, 바이러스의 감염 과정에 중요한 역할을 한다. 인플루엔자 바이러스, 홍역 바이러스 등 다양한 바이러스에서 발견되며, 바이러스 종류에 따라 다른 종류의 헤마글루티닌이 존재한다. 헤마글루티닌은 숙주 세포 표면의 시알산에 결합하여 바이러스의 세포 침투를 돕고, 바이러스 막과 숙주 세포 막의 융합을 통해 유전 물질을 세포 내로 전달하는 기능을 한다. 또한, 혈구응집 억제 시험, 혈액형 검사 등 혈청학적 분석에 활용되며, 다양한 질병 진단에 기여한다.
더 읽어볼만한 페이지
- 면역 검사 - C-반응성 단백질
C-반응성 단백질(CRP)은 간에서 생성되는 단백질로, 염증 반응의 지표로 사용되며, 세균 감염, 조직 손상, 자가면역 질환 등에서 혈중 농도가 증가하여 면역 반응에 기여한다. - 면역 검사 - 면역조직화학
면역조직화학(IHC)은 항체를 사용하여 조직 절편 내 특정 단백질의 존재와 분포를 시각화하는 기법으로, 항원-항체 복합체를 검출하여 단백질의 발현 위치와 정도를 파악하며 다양한 분야에서 활용된다. - 혈액학 - 색전증
색전증은 혈관을 막는 색전이 혈류를 따라 이동하여 발생하는 질환으로, 혈전, 지방, 종양 등 다양한 원인에 의해 발생하며, 동맥 또는 정맥에서 혈류 차단으로 인한 장기 부전을 유발한다. - 혈액학 - 지혈
지혈은 혈관 수축, 혈소판 마개 형성, 혈액 응고 과정을 통해 출혈을 막는 신체의 고유한 반응이며, 다양한 방법으로 이루어지고 응급 처치에 사용되며, 관련 질환과 약물, 유전적 요인이 지혈에 영향을 미친다.
| 헤마글루티닌 | |
|---|---|
| 일반 정보 | |
 | |
| 다른 이름 | HA, 적혈구 응집소 |
| 발견 | 조지 케블 허스트 |
| 생화학적 특성 | |
| 기능 | 세포 부착 막 융합 |
| 위치 | 바이러스 외피 당단백질 |
| 관련 질병 | 인플루엔자 |
| 관련 바이러스 | 인플루엔자 바이러스 |
| 상세 정보 | |
| 구조 | 헤마글루티닌은 바이러스 표면에 존재하는 당단백질임. 약 500개의 아미노산으로 구성됨. |
| 기능적 역할 | 숙주 세포 표면의 시알산에 결합하여 바이러스가 세포에 부착하도록 도움. 바이러스가 세포 내로 진입할 수 있도록 세포막 융합을 촉진. |
| 역할 | 헤마글루티닌은 인플루엔자 바이러스의 주요 표면 항원이며, 바이러스가 숙주 세포에 부착하고 침투하는 데 필수적인 역할 수행. 인플루엔자 바이러스의 아형을 결정하는 데 사용됨 (예: H1N1, H3N2). 항체의 주요 표적이 됨. |
| 추가 정보 | |
| 유래 | 그리스어 "haima" (피)와 "gluten" (접착제)의 조합 |
2. 종류
헤마글루티닌은 바이러스와 식물에서 발견된다. 바이러스 헤마글루티닌의 종류는 하위 섹션에 상세히 설명되어 있으며, 식물 헤마글루티닌의 PH-E 형태도 존재한다.
2. 1. 바이러스 헤마글루티닌
인플루엔자 바이러스 표면에 존재하는 당단백질인 인플루엔자 헤마글루티닌은 감염성을 담당한다.[13] 인플루엔자 균주는 생성하는 특정 헤마글루티닌 변이체와 뉴라미니다제 변이체에 따라 명명된다. 이러한 헤마글루티닌은 항원 변이 및 항원 부동을 통해 빠르게 진화하여 새로운 아형을 생성하며, 이는 인간 계절성 인플루엔자 발생의 원인이 된다.[14]홍역 바이러스가 생성하는 홍역 헤마글루티닌은[15] 6개의 구조 단백질을 인코딩하며, 헤마글루티닌과 융합 단백질은 부착 및 진입에 관여하는 표면 당단백질이다.[16]
사람 파라인플루엔자 바이러스에 의해 생성되는 파라인플루엔자 헤마글루티닌-뉴라미니다제는 사람과 동물의 질병과 밀접한 관련이 있다.[17]
유행성 이하선염 바이러스 (MuV)가 생성하는 볼거리 헤마글루티닌-뉴라미니다제도 헤마글루티닌의 일종이다.[18]
헤마글루티닌(HA)은 적어도 16종류가 존재하며, H1부터 H16까지 나뉜다. 인플루엔자 바이러스 아형명(예: H5N1)의 H는 HA 종류를, N은 뉴라미니다아제 종류를 나타낸다. H16은 최근 스웨덴과 노르웨이의 재갈매기에서, H17은 과테말라 박쥐에서 발견되었다.[28][29] H1, H2, H3는 사람 인플루엔자 바이러스에 존재한다.
H5N1(조류인플루엔자)은 드물게 사람에게 감염될 수 있는데, 환자에게서 발견된 H5는 아미노산 배열 변이로 수용체 특성이 변화하여 사람에게도 감염될 수 있게 되었다.[30][31] 이 H5N1 바이러스 HA 항원 변이는 프로테아제에 의한 활성형 전환을 용이하게 하여 높은 병원성의 원인이 된다.
3. 구조
헤마글루티닌(HA)은 호모트라이머 구조를 가진 막 당단백질이다. 원통 모양이며 길이는 약 135 Å이다.[19]
HA를 구성하는 동일한 3개의 단량체는 중심부에 α-나선을 가지고 있으며, 머리 부분에 시알산 결합 부위가 있다. HA의 단량체는 먼저 전구체가 합성된 후 당화되어 HA1과 HA2 두 개의 서브 유닛으로 나뉜다.[20] 각 HA 단량체는 막에 붙어있는 긴 나선 사슬로 구성되어 있다.[21]
3. 1. 하위 도메인
헤마글루티닌은 바이러스 막 표면에서 돌출된 작은 단백질로, 길이는 135Å(옹스트롬)이며, 지름은 30Å에서 50Å 사이이다.[19] 각 스파이크는 세 개의 동일한 단량체 서브유닛으로 구성되어 있으며, 이 단백질은 호모트라이머이다. 이러한 단량체는 두 개의 당단백질 HA1과 HA2로 형성되며, 막에서 먼 HA1과 더 작은 막에 근접한 HA2를 포함하여 두 개의 이황화물 폴리펩타이드로 연결되어 있다. X선 결정학, NMR 분광법, 극저온 전자 현미경을 사용하여 단백질의 구조를 밝혔으며, 구조의 대부분은 α-나선형이다.[20] 헤마글루티닌은 호모트라이머 코어 구조 외에도 4개의 하위 도메인을 가지고 있다. 즉 막에서 먼 수용체 결합 R 서브도메인, 수용체를 파괴하는 에스테라아제 역할을 하는 흔적 도메인 E, 융합 도메인 F, 막 앵커 서브도메인 M이다. 막 앵커 서브도메인은 헤마글루티닌을 외피 도메인에 연결하는 탄성 단백질 사슬을 형성한다.[21]4. 기능 및 메커니즘 (인플루엔자 헤마글루티닌)
인플루엔자 바이러스의 헤마글루티닌(HA)은 바이러스가 숙주 세포에 침투하고 감염을 일으키는 데 핵심적인 역할을 한다. HA는 크게 두 가지 기능을 수행하는데, 표적 세포 표면의 시알산에 결합하여 바이러스가 세포에서 떨어지지 않게 하고, 엔도솜 형태로 세포 내로 유입된 후에는 엔도솜 내부가 산성화되면서 HA의 구조가 변형된다.
pH가 6.0까지 저하되면 강한 소수성 부위인 '융합 펩티드'가 노출되어 엔도솜 막에 삽입, 고정된다. HA 분자의 나머지 부분은 낮은 pH에서 안정적인 구조로 바뀌며 융합 펩티드를 끌어당겨 바이러스 막과 엔도솜 막을 융합시킨다. 결과적으로 바이러스의 RNA가 세포질로 방출되어 증식을 시작한다.[3][5][22]
4. 1. 기능
HA에는 두 가지 중요한 기능이 있다.- 목표 동물 세포 표면에 있는 시알산을 인식하고 결합하여 세포에 감염시킨다.
- 숙주 세포의 엔도솜 막과 바이러스 막을 융합시켜 바이러스의 게놈을 세포 내로 삽입한다.
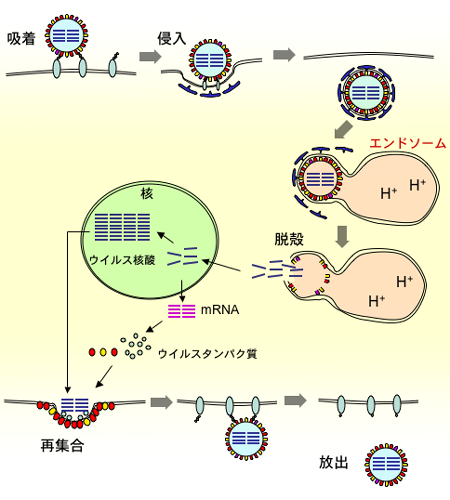
4. 2. 단계별 메커니즘
인플루엔자 A형과 B형 바이러스의 바이러스 캡시드에서 헤마글루티닌은 처음에 비활성화 상태이다. 숙주 단백질에 의해 절단될 때만, 동종 삼합체의 각 단량체 폴리펩타이드는 이황화 결합으로 연결된 HA1과 HA2 소단위체로 구성된 이량체로 변환된다.[22] HA1 소단위체는 숙주 호흡기 세포 표면에 존재하는 시알산 잔기에 결합하여 바이러스 캡시드를 숙주 세포에 도킹하는 역할을 한다. 이 결합은 엔도사이토시스를 유발한다.[5] 그러면 엔도솜 구획의 pH가 양성자 유입으로 감소하고, 이는 HA2 소단위체가 "바깥쪽으로 뒤집히도록" 하는 HA의 입체 구조 변화를 일으킨다. HA2 소단위체는 막 융합을 담당하며, 엔도솜 막에 결합하여 바이러스 캡시드 막과 엔도솜 막을 함께 단단히 당겨 결국 바이러스 게놈이 숙주 세포질로 들어갈 수 있는 구멍을 형성한다.[3] 여기서 바이러스는 숙주 기계를 사용하여 증식할 수 있다.HA에는 두 가지 중요한 기능이 있다.
- 목표 동물 세포 표면에 있는 시알산을 인식하고 결합하여 세포에 감염시킨다.
- 숙주 세포의 엔도솜 막과 바이러스 막을 융합시켜 바이러스의 게놈을 세포 내로 삽입한다.
HA는 표적 세포 표면의 시알산에 결합하여 바이러스가 세포 표면에서 떨어지지 않게 한다. 바이러스는 그대로 세포막에 싸여 엔도솜 형태로 세포 내로 유입된다.
다음으로 세포는 엔도솜 내부를 산화시키고, 바이러스를 리소좀으로 보내 소화하려 한다. 그러나 엔도솜의 pH가 6.0까지 저하되면 HA의 구조는 불안정해지고, 접혀진 펩티드 구조가 부분적으로 전개된다. 그러면 단백질에 가려져 있던 강소수성 부위가 개방된다.
이 '''융합 펩티드'''(fusion peptide)를 마치 갈고리처럼 엔도솜 막에 삽입하여 고정한다. 게다가 HA 분자의 나머지 부분은 새로운 구조(더 낮은 pH에서도 안정적인 구조)로 접혀지고, 융합 펩티드를 끌어당긴다. 그러면 바이러스 자신도 엔도솜 막으로 끌려가 막과 융합한다.
그 후, 바이러스의 RNA는 세포질에 삽입되어 증식을 시작한다.
5. 혈청학적 응용
헤마글루티닌의 적혈구 응집 성질은 혈구응집 억제 시험, ABO식 혈액형 결정, 쿰스 검사 등 다양한 혈청학적 검사에 활용된다.[23][24][25][26]
5. 1. 혈구응집 억제 시험
혈구응집 억제 시험은 알려진 표면 항원을 가진 적혈구를 사용하여 항체를 선별하거나, 알려진 항체 패널을 사용하여 바이러스나 박테리아와 같은 적혈구 표면 항원을 식별하는 데 사용되는 혈청학적 분석법이다.[23] 1942년 조지 K. 허스트가 처음 개발했다.[23] 이 방법은 바이러스 샘플을 혈청 희석액과 혼합하여 항체가 바이러스에 결합하도록 한 후, 적혈구를 혼합물에 첨가한다.[23] 항체에 결합된 바이러스는 적혈구와 연결될 수 없으므로 혈구 응집이 억제된다. 이것은 양성 결과를 의미한다.[23] 반대로, 혈구 응집이 발생하면 시험 결과는 음성이 된다.[23]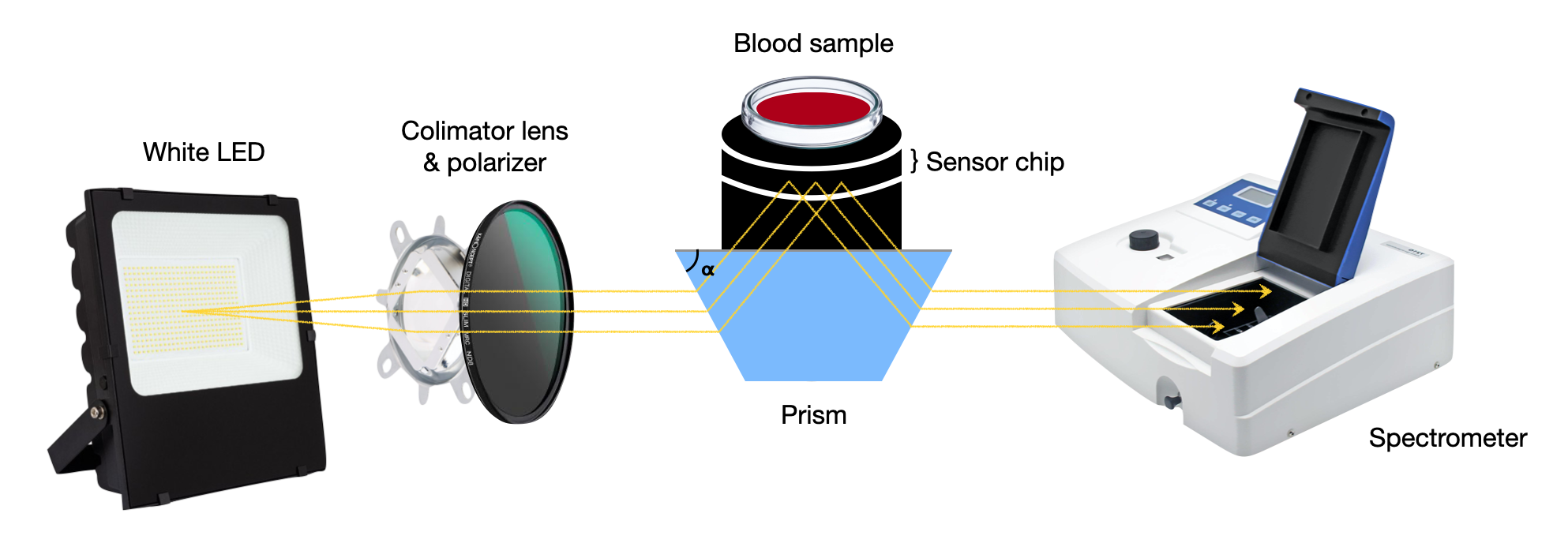
5. 2. 혈구 응집 혈액형 검출
도파관 모드 센서를 사용하여 혈액의 반사 스펙트럼(비응집)과 항체 시약과 혼합된 혈액의 반사 스펙트럼(응집)을 측정한다.[24] 그 결과, 샘플 간 반사율에 약간의 차이가 관찰된다. 항체를 첨가하면 도파관 모드 센서를 사용하여 혈액형 및 Rh(D) 혈액형 검사를 결정할 수 있다. 이 기술은 육안으로는 거의 감지할 수 없는 약한 응집을 감지할 수 있다.5. 3. ABO식 혈액형 결정
A 또는 B 혈액형 표면 항원에 특이적으로 결합하는 항-A 및 항-B 항체를 사용하면, 소량의 혈액 샘플을 검사하여 개인의 ABO식 혈액형을 결정할 수 있다. 이는 Rh(D) 항원(Rh 혈액형)을 식별하지 않는다.[24]5. 4. 병상 카드법
병상 카드법은 개인의 혈액형을 결정하기 위해 시각적 응집에 의존하는 방법이다. 이 카드는 표면에 혈액형 항체 시약이 고정되어 있다. 카드에 있는 각 혈액형 영역에 개인의 혈액 한 방울을 떨어뜨린다. 플록 형성(시각적 응집) 유무는 ABO식 혈액형 및 Rh(D) 상태를 결정하는 빠르고 편리한 방법을 제공한다. 이 기술은 사람의 눈에 의존하기 때문에 도파관 모드 센서 기반 혈액형 검사보다 신뢰성이 떨어진다.[24]5. 5. 쿰스 검사
자가면역 용혈성 빈혈을 검사하기 위해 쿰스 검사가 진단 면역혈액학에서 사용되며, 이때 적혈구의 응집이 이용된다.[25]5. 6. 코데 기술
코데 기술은 세포 표면에 외인성 항원을 노출시켜 항체-항원 반응을 기존의 혈구응집 검사로 감지할 수 있도록 한다.[26]참조
[1]
서적
Orthomyxoviruses
http://www.ncbi.nlm.[...]
University of Texas Medical Branch at Galveston
2024-01-30
[2]
웹사이트
Paramyxoviridae - an overview {{!}} ScienceDirect Topics
https://www.scienced[...]
2024-01-30
[3]
논문
Receptor Binding and Membrane Fusion in Virus Entry: The Influenza Hemagglutinin
http://dx.doi.org/10[...]
2000-06
[4]
논문
"[Structure and function of the hemagglutinin of influenza viruses]"
https://pubmed.ncbi.[...]
1997-10
[5]
간행물
Influenza Virus Entry
http://dx.doi.org/10[...]
Springer US
2024-11-17
[6]
논문
A Site of Vulnerability on the Influenza Virus Hemagglutinin Head Domain Trimer Interface
2019
[7]
웹사이트
Influenza Hemagglutinin and Neuraminidase: Yin–Yang Proteins Coevolving to Thwart Immunity
https://pmc.ncbi.nlm[...]
2019-04-16
[8]
웹사이트
PDB101: Molecule of the Month: Hemagglutinin
https://pdb101.rcsb.[...]
2024-12-11
[9]
논문
Hemagglutinin residues of recent human A(H3N2) influenza viruses that contribute to the inability to agglutinate chicken erythrocytes
2001-10-10
[10]
뉴스
George Keble Hirst, 84, Is Dead; A Pioneer in Molecular Virology
https://www.nytimes.[...]
2024-05-14
[11]
논문
Etymologia: Hemagglutinin and Neuraminidase
2018-10
[12]
서적
Lehninger's Principles of Biochemistry
WH Freeman
[13]
웹사이트
Types of Influenza Viruses
https://www.cdc.gov/[...]
2022-10-18
[14]
논문
Ecology and evolution of avian influenza viruses
http://dx.doi.org/10[...]
2024-08
[15]
논문
Measles Virus Hemagglutinin: Structural Insights into Cell Entry and Measles Vaccine
2011-12-16
[16]
논문
Use of Vaxfectin Adjuvant with DNA Vaccine Encoding the Measles Virus Hemagglutinin and Fusion Proteins Protects Juvenile and Infant Rhesus Macaques against Measles Virus
2014-08-21
[17]
논문
Quantitative Comparison of Human Parainfluenza Virus Hemagglutinin-Neuraminidase Receptor Binding and Receptor Cleavage
2013-08
[18]
서적
Lectin Purification and Analysis
2020
[19]
논문
Hemagglutinin Structure and Activities
http://perspectivesi[...]
2021-10-01
[20]
논문
Hemagglutinin Structure and Activities
http://perspectivesi[...]
2021-10-01
[21]
논문
Hemagglutinin membrane anchor
2018-10-02
[22]
논문
Structure and Receptor Binding of the Hemagglutinin from a Human H6N1 Influenza Virus
http://dx.doi.org/10[...]
2015-03
[23]
서적
Viruses
[24]
논문
Hemagglutination detection for blood typing based on waveguide-mode sensors
2015-03
[25]
간행물
Coombs Test
http://www.ncbi.nlm.[...]
StatPearls Publishing
2022-12-16
[26]
논문
Modified Hemagglutination Tests for COVID-19 Serology in Resource-Poor Settings: Ready for Prime-Time?
2022-03-08
[27]
문서
Lehninger's Principles of Biochemistry
WH Freeman
2005
[28]
문서
Characterization of a novel influenza A virus hemagglutinin subtype (H16) obtained from black-headed gulls
2005
[29]
문서
A distinct lineage of influenza A virus from bats.
http://www.pnas.org/[...]
2012
[30]
문서
Sialobiology of Influenza: Molecular Mechanism of Host Range Variation of Influenza Viruses
https://doi.org/10.1[...]
2005
[31]
문서
Evolution of the receptor binding phenotype of influenza A (H5) viruses
http://www.ncbi.nlm.[...]
2006
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com