혈관내피전구세포
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
혈관내피전구세포(EPC)는 혈관 형성에 관여하는 세포로, 1990년대에 성인 말초혈액에서도 분리가 가능하다는 연구가 발표되면서 연구가 시작되었다. EPC는 배양 방법에 따라 다양한 종류로 분류되며, 종양 성장, 심혈관 질환, 상처 치유, 자궁내막증 등 다양한 질병과 관련된 기능을 수행한다. 만능 줄기세포를 이용하여 EPC를 분화시키려는 연구도 진행되고 있으며, 암, 심혈관 질환 등의 치료에 기여할 수 있을 것으로 기대된다.
더 읽어볼만한 페이지
| 혈관내피전구세포 | |
|---|---|
| 개요 | |
| 영어 명칭 | Endothelial progenitor cell |
| 한국어 명칭 | 혈관내피전구세포 |
| 상세 정보 | |
| 정의 | 골수에서 유래하여 혈액을 통해 순환하며, 혈관 손상 부위로 이동하여 새로운 혈관을 형성하는 세포 |
| 역할 | 혈관 형성 (혈관 발생) 혈관 신생 (혈관 신생) 혈관 복구 |
| 관련 질병 | 허혈성 망막병증 |
| 특징 | 배양 시 내피 세포로 분화 가능 특정 표면 마커 발현 (예: CD34, CD133, VEGFR2) |
| 연구 동향 | |
| 연구 분야 | 혈관 질환 치료 조직 공학 재생 의학 |
| 주요 연구 | 혈관내피전구세포를 이용한 허혈성 망막병증 치료 연구 |
| 추가 설명 | 내피 줄기 세포(Endothelial stem cell)와는 구별됨 |
2. 혈관내피전구세포의 발견과 역사
혈관내피전구세포(Endothelial Progenitor Cell, EPC)는 본래 배아 발달 과정에서 새로운 혈관을 만드는 혈관형성에 관여하는 세포로 알려져 있었다. 그러나 1990년대, 일본의 아사하라(Asahara) 연구팀이 성인의 말초 혈액에서도 혈관내피전구세포 표면에 특징적으로 나타나는 표지자인 CD34 또는 VEGFR-2(KDR)를 이용하여 이 세포를 분리할 수 있으며, 분리된 세포가 허혈성 질환 동물 모델에서 혈관 형성에 기여한다는 사실을 보고하면서[28] 본격적인 연구가 시작되는 중요한 계기가 되었다.
발생학적으로 혈관내피는 조혈계와 밀접하게 연관되어 있는데, 이는 성체 내에서도 새로운 혈관을 생성할 수 있는 혈관모세포 또는 혈관아세포와 유사한 세포가 존재할 것이라는 믿음과 탐색으로 이어졌다.[2] 이러한 세포의 존재 가능성은 20세기 중반부터 제기되었지만, 1990년대 아사하라 연구팀의 발견을 통해 그 존재가 실험적으로 확인되었다.[3]
이후 혈관내피전구세포의 정확한 정의와 기능에 대한 논의가 활발해졌다.[4] 특히 골수에서 유래한 세포가 손상된 혈관 부위로 이동하여 직접 새로운 혈관 세포로 분화하는지, 아니면 주변 세포를 돕는 파라크린 방식으로 혈관 생성을 촉진하는지에 대한 연구가 진행되었다.[5][6][7] 이러한 연구 과정을 통해, 배양 방법이나 기능적 특성에 따라 다양한 특성을 가진 혈관내피전구세포 집단들이 구분되고 이해되기 시작했다.[2][8][9][10]
2. 1. 초기 발견과 논란
혈관내피전구세포(EPC)는 본래 배아 발달 과정에서 혈관 형성에 관여하는 세포로 알려져 있었다. 그러나 1990년대, 일본의 아사하라(Asahara) 연구팀은 혈관내피전구세포 표면에 특징적으로 나타나는 표지자인 CD34 또는 VEGFR-2(KDR)를 이용하여 성인의 말초 혈액에서도 이 세포를 분리할 수 있다고 보고했다. 또한, 이렇게 분리된 세포를 허혈성 질환 동물 모델에 주입했을 때 혈관 형성에 직접 기여한다는 사실을 밝혀냈다.[28] 이 발견은 혈관내피전구세포 연구가 활발해지는 중요한 계기가 되었다.혈관내피는 발생학적으로 조혈계와 밀접한 관련이 있다. 이러한 연관성은 혈관 발생 내피의 존재와 더불어, 성체에서도 새로운 혈관을 만들 수 있는 혈관모세포 또는 혈관아세포와 유사한 세포가 있을 것이라는 믿음과 탐색으로 이어졌다.[2] 혈관내피전구세포의 존재 가능성은 20세기 중반부터 제기되었지만, 아사하라 연구팀이 1990년대에 처음으로 추정되는 EPC를 발견하고 보고하면서 그 존재가 실험적으로 확인되었다.[3]
그러나 이후 '진정한' 혈관내피전구세포가 무엇인지에 대한 정의를 둘러싼 논란이 시작되었다.[4] 초기 연구들은 골수에서 유래한 세포가 손상된 혈관 부위로 이동하여 혈관 신생 과정을 촉진한다고 보았다. 하지만 다른 연구들은 이 세포들이 직접적으로 기능적인 내피 세포가 되는 것이 아니라, 주변 내피 세포의 기능을 돕는 파라크린 방식으로 작용한다고 주장했다.[5][6] 일부 연구자들은 이러한 골수 유래 세포가 진정한 EPC라고 반박했지만,[7] 많은 연구자들은 이 세포들이 새로운 혈관 성장을 촉진하는 조혈 골수성 세포로서의 역할을 더 강조해야 한다고 보았다. 이에 따라 배양 방식에 따라 이 세포들을 콜로니 형성 단위-힐 세포(CFU-Hill) 또는 순환 혈관 신생 세포(CAC)라고 부르기 시작했다.[2][2]
초기에 배양된 추정 EPC 집단에 대한 분자 유전학적 분석 결과, 이 세포들은 실제로는 단핵구와 유사한 유전자 발현 패턴을 보이는 것으로 나타났다. 이는 후기에 배양되는 세포나 혈관내피 콜로니 형성 세포(ECFC)와는 다른, 별개의 전구 세포 집단이 존재함을 시사한다.[8] 또한, 초기에 배양된 세포들은 아세틸화 저밀도 지단백질(Dil-Ac-LDL)과 먹물을 잘 흡수하고 eNOS 발현이 낮은 등 다른 단핵구의 기능적 특징들을 유지하고 있었다. 이들 초기 배양 세포, 즉 CFU-Hill 또는 CAC는 단핵구에서는 발현되지만 내피 세포에서는 발현되지 않는 지질다당류 수용체인 CD14를 발현하는 것으로도 밝혀졌다.[9]
이와는 별개로, 혈관내피 콜로니 형성 세포(ECFC)는 분화하여 혈관 복구를 촉진할 수 있는 잠재력을 가진 또 다른 세포 집단으로 여겨진다. ECFC는 현재 성체 내 조직에 존재하며 일부 혈관 발생 능력을 유지하는 전구 세포로 이해되고 있다.[10]
2. 2. 다양한 혈관내피전구세포의 분류
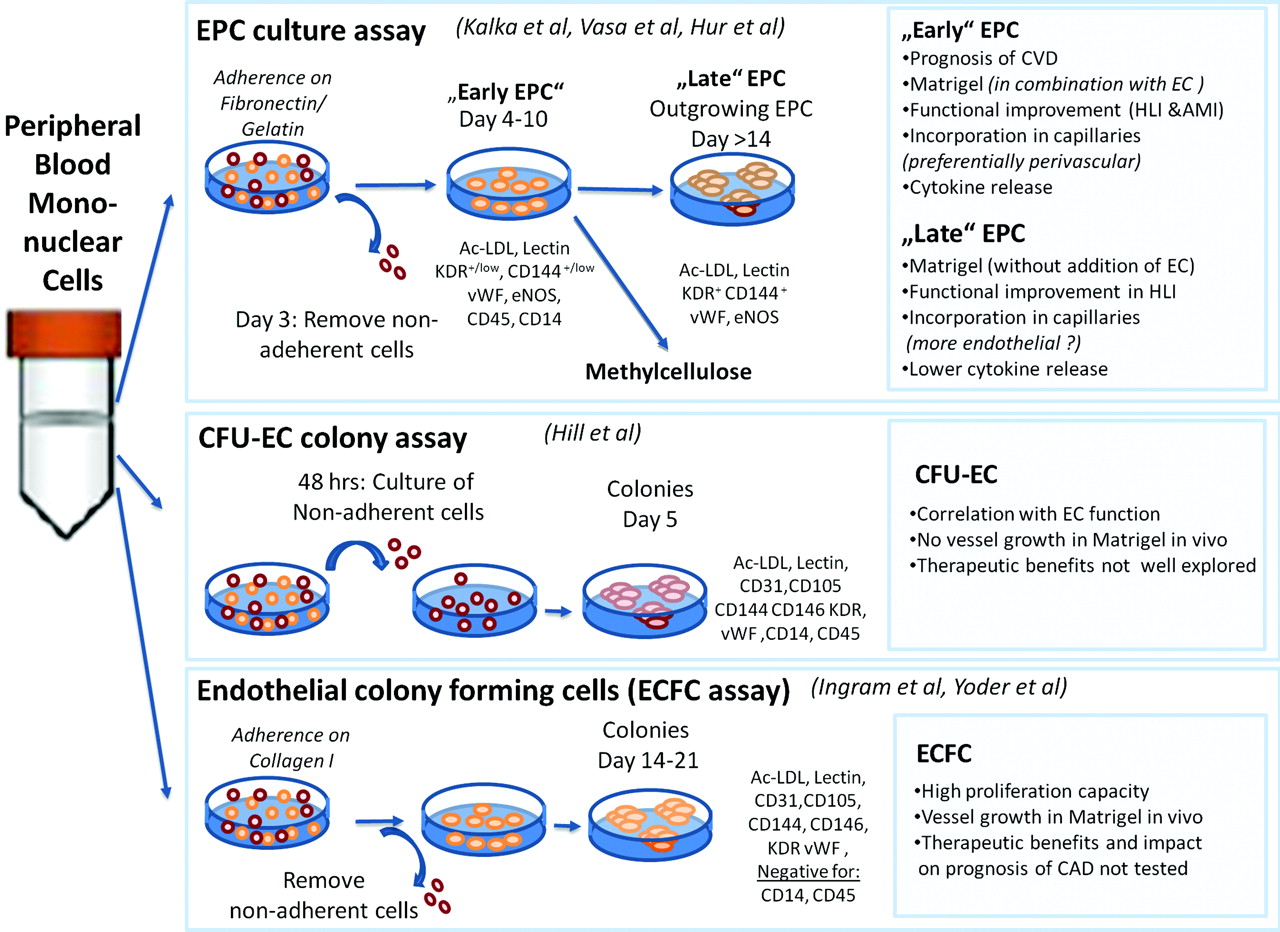
혈관내피전구세포(EPC)는 배양 방법, 나타나는 특징, 기능에 따라 다르게 분류되고 명명된다.[29][30] 분리 방법 및 세포 기능에 따라 크게 세 가지 주요 집단으로 나눌 수 있다: 순환 혈관 생성 세포(Circulating Angiogenic Cells, CACs), 집락 형성 단위-힐(Colony Forming Unit-Hill, CFU-Hill), 내피 집락 형성 세포(Endothelial Colony-Forming Cell, ECFC).[2][11]
순환 혈관 생성 세포 (Circulating Angiogenic Cells, CACs)성인의 말초혈액에서 분리한 단핵세포(hPBMNCs)를 피브로넥틴(fibronectin)이 코팅된 배양접시에서 특정 성장인자들(VEGF, FGF2, IGF-I, EGF 등)이 포함된 배양액으로 배양했을 때 나타나는 세포이다.[31] 배양 4일 후, 부착되지 않은 세포는 제거하고 부착된 세포만 계속 배양한다. 이 세포들은 혈관내피전구세포의 특징인 아세틸화 저밀도 지질단백질(acetylated low-density lipoprotein, ac-LDL)을 흡수하고, 울렉스 유로파에우스 아글루티닌-I 렉틴(Ulex europaeus agglgutinin-I lectin, UEA-I)과 결합하는 능력을 보인다. CACs는 혈관 형성이 필요한 부위로 이동하는 경향이 있지만, 직접 혈관을 형성하기보다는 주변 혈관내피세포의 혈관 형성을 촉진하는 파라크린(paracrine) 효과를 주로 나타낸다. 이는 세포 자체에서 분비하는 다양한 사이토카인이나 성장인자들을 통해 이루어진다.[32]
집락 형성 단위-힐 (Colony Forming Unit-Hill, CFU-Hill)CACs와 유사하게 부착된 세포만을 배양하는 방식으로 얻어진다. 약 4-9일 후 방추사(spindle) 형태의 세포들이 나타나며, 이들은 혈관내피전구세포 또는 혈관내피세포에서 발현하는 표면 항체를 발현하고 혈관내피전구세포의 특징을 가진다. 세포의 기능은 CACs와 유사하다.[33] Asahara 등이 처음 분리한 방식으로, 말초 혈액 단핵 세포를 섬유 결합 단백질(fibronectin) 코팅 배지에 배양하고 부착 세포만 분리하여 얻는 초기 성장 산물이다.[12][13]
내피 집락 형성 세포 (Endothelial Colony-Forming Cell, ECFC)혈관내피 콜로니 형성 세포(ECFC)는 1형 콜라겐이 코팅된 배양접시에서 hPBMNCs 또는 자궁 탯줄 혈액 단핵 세포(UCB-MNCs)를 배양했을 때 나타나는 세포이다. 부착된 세포를 약 5-22일간 배양하면 조약돌(cobblestone) 형태의 콜로니가 형성된다. ECFC는 앞서 설명한 CACs나 CFU-Hill과는 달리 증식 능력이 뛰어나며, 허혈성 질환 모델에 주입했을 때 자체 분비 인자를 통해 혈관 형성을 촉진하거나 직접 혈관내피세포로 분화하여 혈관을 형성할 수 있다.[34] ECFC는 CFU-Hill 세포보다 훨씬 더 오랫동안 배양해야 분리할 수 있는 늦게 자라는 세포 유형이다. 이 세포는 표현형이 내피 세포와 유사하며, 시험관 내(in vitro) 및 생체 내(in vivo)에서 혈관 유사 구조를 생성하는 것으로 확인되었다. 현재 ECFC는 일부 혈관 발생 능력을 유지하는 성체 내 조직 상주 전구 세포로 여겨진다.[10]
EPC 정의에 대한 논란최근 진정한 혈관내피전구세포의 정의에 대한 논란이 있었다.[4] 골수 유래 세포가 손상된 혈관으로 이동하여 혈관 신생을 촉진하는 것으로 보이지만, 이 세포들이 직접 기능적 내피 세포가 되기보다는 주변 내피 세포를 지원하는 파라크린 방식으로 작용한다는 연구 결과도 있다.[5][6] 일부에서는 이들을 진정한 EPC라고 주장했지만,[7] 많은 연구자들은 이들의 역할을 강조하기 위해 배양 방법에 따라 CFU-Hill 또는 CAC라고 부르기 시작했다.[2] 초기 배양된 추정 EPC(CFU-Hill/CAC)는 분자 유전학적 분석 결과 단핵구와 유사한 발현 패턴을 보이며, 이는 후기 배양 세포인 ECFC와는 다른 전구 세포 집단임을 시사한다.[8] 또한, 초기 배양 세포는 높은 Dil-Ac-LDL 및 먹물 섭취 능력, 낮은 eNOS 발현 등 다른 단핵구 기능을 유지하며, 단핵구에서 발현되지만 내피 세포에서는 발현되지 않는 지질다당류 수용체인 CD14를 발현하는 것으로 나타났다.[9]
세포 행동 비교세 가지 주요 성체 혈관내피전구세포 집단의 행동은 다음과 같이 비교할 수 있다.[2][11]
| 행동 | 집락 형성 단위 - 힐 (CFU-Hill) | 순환 혈관 생성 세포 (CAC) | 내피 집락 형성 세포 (ECFC) |
|---|---|---|---|
| 클론 증식 상태 | - | - | + |
| 재배양 능력 | - | - | + |
| 시험관 내 튜브 형성 | +/- | +/- | + |
| 생체 내 신생 혈관 형성 | - | - | + |
| 생체 내 허혈 부위로의 호밍 | + | + | + |
| 혈관 신생의 부가적 지원 | + | + | + |
표현형 마커EPC는 식별에 사용되는 다양한 표현형 마커를 가지고 있다. 하지만 다른 내피 세포나 조혈 세포와 공유되지 않는 EPC 고유의 마커는 아직 발견되지 않았으며, 이는 EPC 연구 분야의 역사적 논쟁에 기여했다. 현재 알려진 마커 발현 양상은 다음과 같다.[2][2]
| 마커 | 집락 형성 단위 - 힐 (CFU-Hill) | 순환 혈관 생성 세포 (CAC) | 내피 집락 형성 세포 (ECFC) |
|---|---|---|---|
| CD34 발현 | +/- | +/- | +/- |
| CD133 발현 | + | + | - |
| CD45 발현 | +/- | +/- | - |
| CD146 발현 | +/- | +/- | + |
| VE-cadherin 발현 | +/- | +/- | ++ |
| CD115 발현 | + | + | - |
| CD31 (PECAM) 발현 | + | + | + |
| CD14 발현 | + | + | - |
| CD105 발현 | + | + | + |
| CD117 (c-kit) 발현 | + | + | +/- |
| VEGFR1 발현 | + | + | + |
| VEGFR2 (KDR/Flk1) 발현 | + | + | ++ |
| TIE-2 발현 | + | + | + |
| CXCR4 발현 | + | + | +/- |
| von Willebrand factor 발현 | +/- | +/- | + |
| ALDH | 밝음 | 밝음 | 밝음 |
| acLDL 섭취 | + | + | + |
3. 혈관내피전구세포의 배양 방법과 특징
혈관내피전구세포(Endothelial Progenitor Cell, EPC)는 어떤 방식으로 배양하는지에 따라 나타나는 특징과 기능, 그리고 부르는 이름도 달라진다.[29][30] 이는 EPC의 정체성에 대한 학계의 오랜 논쟁과 관련이 깊다.
혈관 내피는 발생 과정에서 조혈계와 밀접한 관계를 맺고 있다. 이러한 사실은 성체 내에도 혈관 발생 내피처럼 새로운 혈관을 만들 수 있는 혈관모세포나 혈관아세포와 유사한 세포, 즉 EPC가 존재할 것이라는 기대를 낳았다.[2] EPC의 존재 가능성은 20세기 중반부터 제기되었으나, 1990년대 아사하라 등이 처음으로 추정 EPC를 분리, 배양하여 보고하면서 본격적인 연구가 시작되었다.[3]
하지만 이후 '진정한' EPC가 무엇인지에 대한 논란이 계속되었다.[4] 초기에 발견된 골수 유래 세포들이 손상된 혈관 부위로 이동하여 혈관 생성을 돕는다는 점은 확인되었지만, 이 세포들이 직접 혈관 세포로 분화하여 혈관 구조의 일부가 되는지, 아니면 주변 세포에 영향을 미치는 파라크린 방식으로 도움을 주는지에 대해 의견이 갈렸다.[5][6] 일부 연구자들은 이 초기 세포들이 진정한 EPC라고 주장했지만,[7] 많은 연구자들은 이 세포들이 혈관 생성 환경을 조성하는 조혈계 골수성 세포의 역할에 더 가깝다고 보았다. 이러한 관점에서 배양 초기에 나타나는 세포들을 배양 방법에 따라 콜로니 형성 단위-힐 세포(CFU-Hill) 또는 순환 혈관 신생 세포(Circulating Angiogenic Cell, CAC) 등으로 구분하여 부르기 시작했다.[2]
실제로 초기 배양된 세포 집단(CFU-Hill, CAC 등)을 분자 유전학적으로 분석한 결과, 이들은 단핵구와 유사한 유전자 발현 패턴을 보였다. 또한, 아세틸화 저밀도 지질단백질(ac-LDL)이나 먹물을 잘 흡수하고 eNOS 발현이 낮은 등 단핵구의 특징을 유지하며, 단핵구 표지자인 CD14도 발현하는 것으로 나타났다.[8][9] 이는 배양 후기에 나타나며 다른 특징을 보이는 혈관내피 콜로니 형성 세포(Endothelial Colony-Forming Cell, ECFC)라는 별개의 전구 세포 집단이 존재함을 시사한다.[8]
ECFC는 후기 배양에서 나타나는 세포 집단으로, 직접 혈관 세포로 분화하여 혈관 복구에 기여할 수 있는 잠재력을 가진 것으로 여겨진다. 현재 ECFC는 성체 조직 내에 존재하며 혈관 발생 능력을 일부 유지하는 전구 세포로 이해되고 있다.[10] 따라서 EPC 연구에서는 배양 초기 단계에서 나타나는 세포(CFU-Hill, CAC)와 후기 단계에서 나타나는 ECFC를 구분하여 이해하는 것이 중요하다.
3. 1. Circulating angiogenic cells (CACs)
혈관내피전구세포는 배양 방법에 따라 나타나는 특징, 기능, 명칭이 다르다.[29][30]
Circulating angiogenic cells (CACs)는 성인의 말초혈액에서 분리한 단핵세포(hPBMNCs)를 이용하여 얻을 수 있다. 이 단핵세포를 혈관내피 성장인자(VEGF), 섬유아세포 성장인자 2(FGF2), 인슐린 유사 성장인자-I(IGF-I), 상피세포 성장인자(EGF) 등 여러 성장인자가 포함된 배양액에서 피브로넥틴이 코팅된 배양 접시에 배양하면 CACs가 나타난다.[31] 배양 4일 후, 부착되지 않은 세포는 제거하고 부착된 세포만을 계속 배양한다. 이렇게 얻어진 세포는 혈관내피전구세포의 특징인 아세틸화 저밀도 지질단백질(acetylated low-density lipoprotein, ac-LDL)을 흡수하고 Ulex europaeus agglgutinin-I lectin (UEA-I)과 결합하는 능력을 보인다.
분리된 CACs는 혈관 형성이 필요한 부위로 이동하는 경향이 있다. 그러나 이 세포들은 직접 혈관을 형성하기보다는, 자체적으로 분비하는 다양한 사이토카인이나 성장인자들의 paracrine 효과를 통해 주변 혈관내피세포의 혈관 형성을 촉진하는 역할을 주로 수행한다.[32]
유사한 방법으로 말초 혈액 단핵 세포 분획을 보충된 내피 성장 배지에서 배양하고, 부착되지 않은 세포를 제거한 뒤 남은 세포를 분리할 수도 있다. 이 세포들은 일부 내피 세포의 특성을 나타내지만, 콜로니를 형성하지는 않는다.[2][2]
3. 2. Colony forming unit-Hill (CFU-Hill)
혈관내피전구세포는 배양 방법에 따라 나타나는 특징, 기능, 명명법이 다르다.[29][30]
Colony forming unit-Hill (CFU-Hill)은 Asahara 등이 처음 분리한 방식으로 얻어지는 초기 성장 산물이다. 이 방법은 섬유 결합 단백질으로 코팅된 배지에 말초 혈액 단핵 세포를 도말하여 부착시킨 후, 부착하지 않은 세포는 제거하고 부착한 세포만 배양하는 방식이다. 이렇게 형성된 개별 콜로니를 분리하여 얻는다.[12][13]
CFU-Hill은 circulating angiogenic cells (CACs)와 마찬가지로 부착한 세포만 배양하는데, 약 4-9일 후에 방추사(spindle) 형태를 가진 세포들이 나타난다. 이 세포들은 혈관내피전구세포 또는 혈관내피세포에서 발현하는 표면 항체를 발현하고 혈관내피전구세포의 특징을 가지고 있으며, 세포의 기능은 circulating angiogenic cells (CACs)와 유사하다.[33]
3. 3. Endothelial colony-forming cell (ECFC)
혈관내피전구세포는 배양 방법에 따라 나타나는 특징, 기능, 그리고 명명법이 다르다.[29][30]
Endothelial colony-forming cell (ECFC), 또는 혈관내피 집락 형성 세포는 1형 콜라겐이 코팅된 배양 접시에서 사람 말초 혈액 단핵 세포(hPBMNCs) 또는 탯줄 혈액 단핵 세포(UCB-MNCs)를 배양했을 때 얻어지는 혈관내피전구세포의 한 종류이다. 배지에 세포를 도포하고 부착되지 않은 세포를 제거한 후, 약 5일에서 22일 또는 수 주 동안 배양하면 특징적인 조약돌(cobblestone) 모양의 집락(colony)이 형성된다.[34]
ECFC는 다른 방식으로 배양된 혈관내피전구세포(예: CFU-Hill 세포)보다 훨씬 늦게 자라는 특징이 있지만, 증식 능력이 뛰어나다. 이 세포는 표현형이 혈관내피세포와 유사하며, 체외(in vitro) 및 체내(in vivo) 환경 모두에서 혈관과 유사한 구조를 형성하는 능력이 확인되었다.[34]
허혈성 질환 모델에 ECFC를 주입하면, 이 세포는 두 가지 주요 기전을 통해 혈관 형성을 촉진한다. 첫째, ECFC 자체에서 분비되는 여러 인자들이 주변 세포에 작용하여 혈관 생성을 유도한다. 둘째, ECFC가 직접 혈관내피세포로 분화하여 새로운 혈관 구조의 일부가 된다.[34]
4. 혈관내피전구세포의 호밍(Homing)
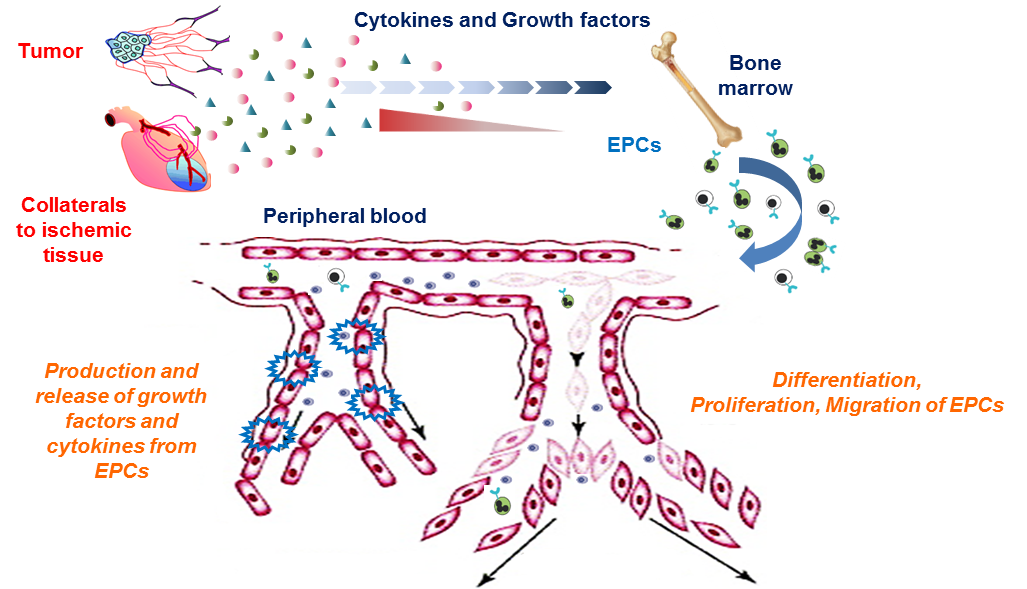
혈관내피전구세포는 암이나 허혈성 부위처럼 혈관형성이 필요한 곳으로 이동하는데, 이러한 현상을 혈관내피전구세포의 호밍(homing)이라고 부른다. 다양한 종류의 사이토카인이나 성장인자들이 호밍 과정을 유도하는 것으로 알려져 있다. 목적지에 도착한 혈관내피전구세포는 스스로 인자들을 분비하여 주변 세포에 영향을 미치는 파라크라인(paracrine) 효과를 나타내거나, 직접 혈관내피세포로 분화하여 혈관 형성을 촉진한다.[35]
5. 전분화능 줄기세포를 이용한 혈관내피전구세포 분화
만능성 줄기세포는 다양한 종류의 세포로 분화할 수 있는 특징을 가지고 있어, 최근 이러한 줄기세포를 이용하여 혈관내피전구세포로 분화시키려는 연구가 활발히 이루어지고 있다. 혈관내피전구세포로의 분화를 유도하는 과정은 일반적으로 다음과 같다.
먼저, 미분화 상태의 줄기세포를 배상체(embryoid body)를 형성하게 하거나 2차원(2D) 배양 방식을 통해 배양한다. 이 단계에서 Activin-Aeng, BMP-4eng 또는 VEGFeng, bFGFeng와 같은 여러 성장인자를 첨가하여 세포가 중배엽(mesoderm lineage) 계통으로 발달하도록 유도한다.
다음으로, 중배엽 계통으로 유도된 세포에 추가적인 처리를 통해 혈관내피전구세포로의 분화를 완성한다. 이 단계에서는 VEGFeng, bFGFeng 또는 SCFeng와 같은 성장인자들이나 IL-6eng 등 특정 사이토카인을 첨가하여 최종적인 혈관내피전구세포로 분화시킨다.
이렇게 분화된 혈관내피전구세포는 허혈성 질환을 가진 실험용 쥐 모델에 주입했을 때 혈관 형성을 유도하는 효과를 보이는 것으로 확인되었다.[36][37]
6. 혈관내피전구세포의 기능과 역할
혈관내피전구세포(EPC)는 골수 등에서 유래하여 혈관 형성에 기여하는 세포로, 다양한 생리적 및 병리적 과정에서 중요한 역할을 수행한다. 특히 종양의 성장과 전이, 심혈관 질환의 발생 및 회복 과정, 상처 치유, 그리고 자궁내막증과 같은 질환의 발병 기전에 관여하는 것으로 알려져 있다. 이러한 기능들은 혈관내피전구세포를 다양한 질병의 진단 및 치료 표적으로서 주목하게 만들고 있다.
6. 1. 종양 성장
혈관내피전구세포(EPC)는 종양 성장에 중요한 역할을 하며, 전이와 혈관 신생에 매우 중요한 것으로 여겨진다.[17][18][19] CFU-Hill 골수 유래 추정 EPC에 대한 많은 연구가 진행되었다. 골수 내 혈관내피전구세포를 제거하면 종양 성장과 혈관 발달이 현저히 감소하는데, 이는 혈관내피전구세포가 새로운 치료 표적이 될 수 있음을 시사한다.[20] DNA 결합 억제제 1(ID1)은 이러한 세포의 마커로 사용되어 왔으며,[21] 이를 통해 골수에서 혈액, 종양 기질에 이르기까지, 심지어 종양 혈관 구조에 통합된 EPC를 추적할 수 있다.최근에는 마이크로RNA(miRNA)가 EPC 생물학 및 종양 혈관 신생을 조절한다는 사실이 밝혀졌다. 특히 miRNA miR-10b 및 miR-196b를 표적으로 삼으면, 종양으로 혈관 신생을 촉진하는 EPC의 동원이 감소하여 혈관 신생 매개 종양 성장에 심각한 결함이 발생하는 것으로 나타났다. 이러한 발견은 EPC에서 이들 miRNA를 표적으로 하는 것이 종양 혈관 신생을 억제하는 새로운 전략으로 이어질 수 있음을 보여준다.[22]
연구에 따르면, 내피 콜로니 형성 세포(ECFC) 및 인간 제대 정맥 내피 세포(HUVEC)는 면역 결핍 마우스에 이식되었을 때 다른 CD34+ 조혈 세포보다 더 큰 종양 이동 및 신혈관생성 능력을 보인다. 이는 내피 전구 세포가 핵심적인 역할을 수행함을 시사하며, 두 세포 유형 모두 약물 요법의 표적으로서 중요함을 더욱 뒷받침한다.[23]
6. 2. 심혈관 질환
환자의 혈류에서 높은 수치의 혈관내피전구세포가 검출될 경우, 더 나은 예후를 보이며 재발성 심장 발작을 덜 경험하는 경향이 있다는 보고가 있다.[24] 그러나 초기 연구에서는 혈중 혈관내피전구세포 수치와 이러한 결과 사이의 통계적 상관 관계는 뚜렷하지 않았다. 혈관내피전구세포는 심근 경색 발생 후 동원되어, 심장 발작 동안 손상된 혈관 내벽을 복구하는 역할을 하는 것으로 알려져 있다.소규모 임상 시험들을 통해 혈관내피전구세포가 다양한 심혈관 질환(CVD)의 잠재적 치료법이 될 수 있다는 가능성이 제시되고 있다. 예를 들어, "급성 심근 경색에서 전구 세포 이식 및 재생 증진"(TOPCARE-AMI) 연구는 1년간 진행되었으며, 급성 심근 경색(MI) 환자 20명을 대상으로 체외에서 증식시킨 골수 유래 혈관내피전구세포와 말초 혈액에서 얻은 배양된 혈관내피전구세포를 주입하는 치료의 효과를 평가했다. 연구 결과, 치료 4개월 후 심실 박출 계수, 심장 형태, 관상 동맥 혈류 예비력 및 심근 생존력에서 유의미한 개선이 확인되었다.
또 다른 유사 연구에서는 심각한 말초 동맥 질환으로 인한 다리 허혈 환자를 대상으로 혈관내피전구세포의 치료 효과를 조사했다. 이 연구에서는 혈관내피전구세포가 풍부한 혈액 샘플을 25명의 환자의 비복근(장딴지 근육)에 주사했다. 24주 후, 측부 혈관(곁순환 혈관) 수가 증가하고 혈류 관류(혈액 공급) 회복이 개선되는 결과가 관찰되었다. 또한, 환자들은 안정 시 통증이 줄어들고 통증 없이 걸을 수 있는 거리도 늘어난 것으로 나타났다.[25]
6. 3. 상처 치유
상처 치유 과정에서 혈관내피전구세포(EPC)가 어떤 역할을 하는지는 아직 불분명하다. 혈액 공급이 부족한 조직(허혈성 조직)에 혈관이 새로 생길 때, 기존의 작은 혈관(모세혈관)이 단순히 기계적인 힘에 의해 혈관이 없던 곳으로 밀려 들어가는 현상이 관찰되기도 한다. 이는 EPC가 새로운 혈관을 만드는 주요 방식이라고 알려진 출아 혈관 신생과는 다른 과정이다.[26]실제로 새로 만들어진 혈관 구조에서 골수에서 온 내피세포를 찾기 어렵다는 연구 결과도 있다. 이는 태어난 이후의 혈관 생성(postnatal vasculogenesis) 과정에서 EPC가 직접 혈관을 구성하는 물질적인 기여는 적을 수 있음을 시사한다. 따라서 혈관이 새로 생겨나는 과정은 EPC보다는 물리적인 힘에 의해 주로 이루어질 가능성이 제기된다.[26]
6. 4. 자궁내막증
자궁내막증에서 이소성 자궁내막 조직의 미세 혈관 내피의 최대 37%가 혈관내피전구세포에서 유래하는 것으로 보인다.[27]참조
[1]
논문
Outgrowth endothelial cells: characterization and their potential for reversing ischemic retinopathy
https://www.research[...]
[2]
논문
Endothelial progenitors
[3]
논문
Isolation of putative progenitor endothelial cells for angiogenesis
[4]
논문
Endothelial progenitor cell: ongoing controversy for defining these cells and their role in neoangiogenesis in the murine system
[5]
논문
Bone marrow-derived circulating endothelial precursors do not contribute to vascular endothelium and are not needed for tumor growth
[6]
논문
Reply to Kerbel et al.: EPCs are again claimed to be essential in yet other models despite the irreproducibility of the original experiments introducing them
[7]
논문
Endothelial progenitor cells are cellular hubs essential for neoangiogenesis of certain aggressive adenocarcinomas and metastatic transition but not adenomas
[8]
논문
Molecular analysis of endothelial progenitor cell (EPC) subtypes reveals two distinct cell populations with different identities
[9]
논문
Adult endothelial progenitor cells from human peripheral blood maintain monocyte/macrophage function throughout in vitro culture
[10]
논문
Identification of a novel hierarchy of endothelial progenitor cells using human peripheral and umbilical cord blood
[11]
논문
Regulation of EPCs: The Gateway to Blood Vessel Formation
[12]
논문
Working hypothesis to redefine endothelial progenitor cells
[13]
논문
Circulating and tissue resident endothelial progenitor cells
[14]
논문
Endothelial progenitor cells, angioblasts, and angiogenesis – old terms reconsidered from a current perspective
[15]
논문
Endothelial progenitor cells: identity defined?
[16]
논문
Mesoangioblasts – vascular progenitors for extravascular mesodermal tissues
[17]
논문
Endothelial Progenitor Cells Control the Angiogenic Switch in Mouse Lung Metastasis
[18]
논문
Bone marrow-derived endothelial progenitor cells are a major determinant of nascent tumor neovascularization
[19]
서적
Molecular Phenotypes of Endothelial Cells in Malignant Tumors
https://doi.org/10.1[...]
Springer International Publishing
2022-07-13
[20]
논문
Using the Transcription Factor Inhibitor of DNA Binding 1 to Selectively Target Endothelial Progenitor Cells Offers Novel Strategies to Inhibit Tumor Angiogenesis and Growth
[21]
논문
Impaired recruitment of bone-marrow-derived endothelial and hematopoietic precursor cells blocks tumor angiogenesis and growth
[22]
논문
MicroRNAs regulate tumor angiogenesis modulated by endothelial progenitor cells.
[23]
논문
Recruitment of human cord blood-derived endothelial colony-forming cells to sites of tumor angiogenesis
[24]
논문
Circulating Endothelial Progenitor Cells and Cardiovascular Outcomes
[25]
논문
Endothelial progenitor cells in cardiovascular disorders
[26]
논문
Biomechanical regulation of blood vessel growth during tissue vascularization
[27]
논문
Vasculogenesis: A new piece of the endometriosis puzzle
[28]
논문
Isolation of putative progenitor endothelial cells for angiogenesis
[29]
논문
[30]
논문
Circulating and tissue resident endothelial progenitor cells
[31]
논문
Transplantation of ex vivo expanded endothelial progenitor cells for therapeutic neovascularization
[32]
논문
Circulating endothelial progenitor cells, vascular function, and cardiovascular risk
[33]
논문
Identification of a novel hierarchy of endothelial progenitor cells using human peripheral and umbilical cord blood
[34]
논문
Role of formyl peptide receptor 2 in homing of endothelial progenitor cells and therapeutic angiogenesis
2014-09-011
[35]
논문
Cell Trafficking of Endothelial progenitor Cells in Tumor Progression
[36]
논문
Efficient differentiation of human pluripotent stem cells into functional CD34 + progenitor cells by combined modulation of the MEK/ERK and BMP4 signaling pathways
2010
[37]
논문
Conversion of human fibroblasts to angioblast-like progenitor cells
2013
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com