지질다당류
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
지질다당류(LPS)는 그람 음성 세균의 세포 외막을 구성하는 주요 성분으로, 세균의 구조적 완전성에 기여하고 숙주 면역 반응을 유도하는 강력한 면역 활성 물질이다. LPS는 O 항원, 코어 올리고당, 리피드 A로 구성되며, 특히 리피드 A가 생물학적 활성을 나타낸다. LPS는 세균의 생존과 병원성 측면에서 중요한 역할을 하며, 숙주 내에서 면역 세포를 활성화시켜 염증성 사이토카인 분비를 촉진한다.
LPS는 숙주 면역 반응에 다양한 영향을 미치며, TLR4 등 수용체와 결합하여 면역 반응을 유도하고, 내독소혈증, 자가면역 질환, 비만, 우울증 등의 병태생리에 관여한다. LPS는 내독소혈증 치료, 자가면역 질환 치료, 백신 보조제 등 의약품 개발에도 활용되며, 연구 및 생명공학 분야에서 오염 물질로 작용하기도 한다. LPS 검사는 세균 감염 진단에 중요하며, EAA(Endotoxin Activity Assay)와 같은 다양한 검사 방법이 사용된다.
더 읽어볼만한 페이지
- 세균 독소 - 스트렙토라이신
스트렙토라이신은 세균 독소로서, 세포막 투과성을 높여 세포를 손상시키며, 특히 스트렙토라이신 O는 콜레스테롤과 결합해 세포막에 구멍을 만들어 세포자멸사를 유도하고 A군 연쇄상구균 감염 진단에 활용되는 항-스트렙토라이신 O 항체 생성 지표가 되며, 스트렙토라이신 S는 연조직 손상, 독성 유발, 신호 분자 역할로 세균의 피부 장벽 통과를 돕는다. - 세균 독소 - 보툴리눔 독소
보툴리눔 독소는 클로스트리디움 보툴리눔균이 생성하는 신경독소로, 아세틸콜린 방출 억제를 통해 근육을 마비시키는 작용을 하며, 치료 및 미용 목적으로 사용되는 맹독성 물질이다. - 당지질 - 갈락토세레브로사이드
갈락토세레브로사이드는 스핑고지질의 일종으로, 세포막의 구성 성분이며 글루코스와 관련이 있다. - 당지질 - 세레브로사이드
세레브로사이드는 세라마이드에 당이 결합된 스핑고지질로, 당 종류에 따라 분류되며 뇌와 신경 조직 수초 형성에 중요하고, 세포 신호 전달에 관여하며, 리소좀에서 분해되는데 관련 효소 결핍은 특정 질병을 유발할 수 있으며, 질량분석법과 크로마토그래피로 분석된다.
| 지질다당류 |
|---|
2. 발견
리처드 파이퍼(Richard Friedrich Johannes Pfeiffer)는 지질다당류(LPS)의 독성 활동을 처음 발견하고 Endotoxin|엔도톡신영어(내독소)라고 명명했다.[95] 그는 세균이 주변 환경으로 분비하는 외독소와 달리, 내독소는 세균 세포벽이 파괴된 후에 방출된다고 생각했다.[6] 그러나 후속 연구에 따르면 LPS는 세균 외막이 파괴되지 않아도 세균 외막 소포(OMV) 형태로 분비될 수 있으며, 이 소포에는 다른 독성 인자도 포함될 수 있다.[7][8]
LPS는 그람 음성 세균 외막의 주요 구성 성분으로, 세균의 구조적 완전성에 크게 기여하고 특정 종류의 화학적 공격으로부터 막을 보호한다.[8] LPS는 세포막의 음전하를 증가시키고 전체 막 구조를 안정화시키는 데 도움을 준다.[8] 이는 LPS를 코딩하는 유전자가 돌연변이되거나 제거될 경우 죽는 많은 그람 음성 세균에게 매우 중요하다.[9]
LPS는 친수성인 O 항원(또는 O 다당류), 코어 올리고당, 소수성 도메인인 리피드 A의 세 부분으로 구성된 양쪽성 분자이다.
3. 세균 내 기능
LPS는 표면 부착, 박테리오파지 감수성, 아메바와 같은 포식자와의 상호 작용을 포함하여 세균 생태학의 비병원성 측면과도 관련되어 있다.[10] 또한 세균 단백질 분해 효소의 일종인 옴프틴의 기능을 위해서도 필요하다.[10]
thumb(지질 이중막)의 세포 외측 지질 부분(왼쪽 그림 위쪽)에 존재한다]]
LPS는 리피드 A라고 불리는 지질에, 다분자의 당으로 구성된 당쇄가 결합된 구조를 가진다. 당쇄 부분은 코어 다당류(또는 코어 올리고당)라고 불리는 부분과 O 측쇄 다당류(O 항원)라고 불리는 부분으로 구성된다. 그람 음성 세균 세포벽의 가장 바깥쪽 부분에는 외막이라고 불리는 지질 이중막이 존재하며, LPS는 리피드 A 부분이 이 지질 이중막의 외층을 형성하는 분자로서 지질층에 들어가고, 당쇄 부분이 세포 외로 돌출된 형태로 그람 음성 세균의 세포 표면에 존재한다.
O 측쇄 다당류는 3~5 종류 정도의 6탄당(헥소스)이나 5탄당(펜토스)으로 구성된 기본 구조가 4~40회 반복된 구조를 갖는다. 임균이나 수막염균 등 균종에 따라 특히 짧은 O 측쇄를 가지며, 이 경우에는 리포다당류(LPS) 대신 리포올리고사카라이드(LOS)라고 부르는 경우가 있다. O 측쇄 다당류의 구조는 같은 종류의 세균 중에서도 균주마다 다르며, 균체 표면의 친수성 및 항원성에 크게 관여한다. O 항원은 세균의 표면 항원의 본체이며, 균주의 분류 및 감별에 이용된다. 예를 들어 대장균에서는 약 170 종류의 서로 다른 형태의 O 항원이 알려져 있으며, O 항원의 차이로 어떤 병원성을 가진 균주인지(O157 등)를 판별할 수 있다. 또한, O 측쇄는 파지에 대한 수용체가 되며, 해당 세균에 어떤 파지가 감염될 수 있는지를 결정하는 인자로서, 파지형 결정에도 관여한다.
코어 다당류는 5탄당, 6탄당 외에 세균에 특유한 7탄당(헵토스)이나 8탄당(특히 2-케토데옥시옥톤산) 등으로 구성된 당쇄이다. O 측쇄와는 달리 그 구조는 균종에 따라 거의 일정하다. 코어 다당류는 소수성이 높은 당류로 구성되어 있으며, 친수성이 높은 O 측쇄 부분이 짧은 경우에는 세균 표면은 소수성이 된다. 세균 표면의 친수성이 높은 경우, 종종 한천 배지 상의 콜로니는 표면이 매끄럽고 광택을 띠는 것(S형)이 되고, 소수성이 높은 경우에는 표면이 거친 것(R형)이 되는 것으로 알려져 있으며, O 측쇄 및 코어로 구성된 다당류의 구성은 콜로니 성상에도 영향을 미친다.
4. 구성
thumb(지질 이중막)의 세포 외측 지질 부분(왼쪽 그림 위쪽)에 존재한다]]
LPS는 리피드 A라고 불리는 지질에, 다분자의 당으로 구성된 당쇄가 결합된 구조를 가진다(오른쪽 그림 참조). 당쇄 부분은 코어 다당류(또는 코어 올리고당)와 O 측쇄 다당류(O 항원)로 구성된다. 그람 음성 세균 세포벽의 가장 바깥쪽 부분에는 외막이라고 불리는 지질 이중막이 존재하며, LPS는 리피드 A 부분이 이 지질 이중막의 외층을 형성하는 분자로서 지질층에 들어가고, 당쇄 부분이 세포 외로 돌출된 형태로 그람 음성 세균의 세포 표면에 존재한다.
코어 다당류는 5탄당, 6탄당 외에 세균에 특유한 7탄당(헵토스)이나 8탄당(특히 2-케토데옥시옥톤산, KDO) 등으로 구성된 당쇄이다. O 측쇄와는 달리 그 구조는 균종에 따라 거의 일정하다. 코어 다당류는 소수성이 높은 당류로 구성되어 있으며, 친수성이 높은 O 측쇄 부분이 짧은 경우에는 세균 표면은 소수성이 된다. 세균 표면의 친수성이 높은 경우, 종종 한천 배지 상의 콜로니는 표면이 매끄럽고 광택을 띠는 S형(Smooth)이 되고, 소수성이 높은 경우에는 표면이 거친 R형(Rough)이 되는 것으로 알려져 있다. O 측쇄 및 코어로 구성된 다당류의 구성은 콜로니 성상에도 영향을 미친다.
임균이나 수막염균 등 일부 균종은 특히 짧은 O 측쇄를 가지는데, 이 경우 LPS 대신 리포올리고사카라이드(리포올리고당, LOS)라고 부른다.
4. 1. O-항원
O 항원(또는 O 다당류)은 코어 올리고당에 부착된 반복적인 글리칸 중합체로, 지질다당류(LPS) 분자의 가장 바깥쪽 영역을 구성한다. O 사슬의 구조와 조성은 균주마다 매우 다양하여 부모 세균 균주의 혈청학적 특이성을 결정한다.[11] 서로 다른 ''대장균''(Escherichia coli) 균주에 의해 160가지가 넘는 서로 다른 O 항원 구조가 생성된다.[12]
O 사슬의 유무에 따라 LPS는 "매끄러운형" 또는 "거친형"으로 분류된다. 전체 길이의 O-사슬을 가지면 LPS는 매끄러운형이 되고, O-사슬이 없거나 줄어들면 LPS는 거친형이 된다.[13] 거친 LPS를 가진 세균은 일반적으로 소수성 항생제에 대해 세포막 투과성이 더 높은데, 이는 거친 LPS가 더 소수성이기 때문이다.[14] O 항원은 세균 세포의 가장 바깥 표면에 노출되어 있어 숙주 항체의 인식 대상이 된다.
4. 2. 코어 올리고당
코어 도메인은 항상 지질 A에 직접 부착되는 올리고사카라이드 성분을 포함하며, 일반적으로 헵토스와 3-데옥시-D-만노-옥트-2-로손산 (KDO, 케토-데옥시옥툴로손산이라고도 함)과 같은 당을 포함한다.[15] 코어 올리고사카라이드는 구조와 조성에서 덜 가변적이며, 특정 코어 구조는 세균의 대규모 그룹에 공통적으로 존재한다.[11] 많은 세균의 LPS 코어는 또한 인산, 아미노산 및 에탄올아민 치환체와 같은 비탄수화물 성분을 포함한다.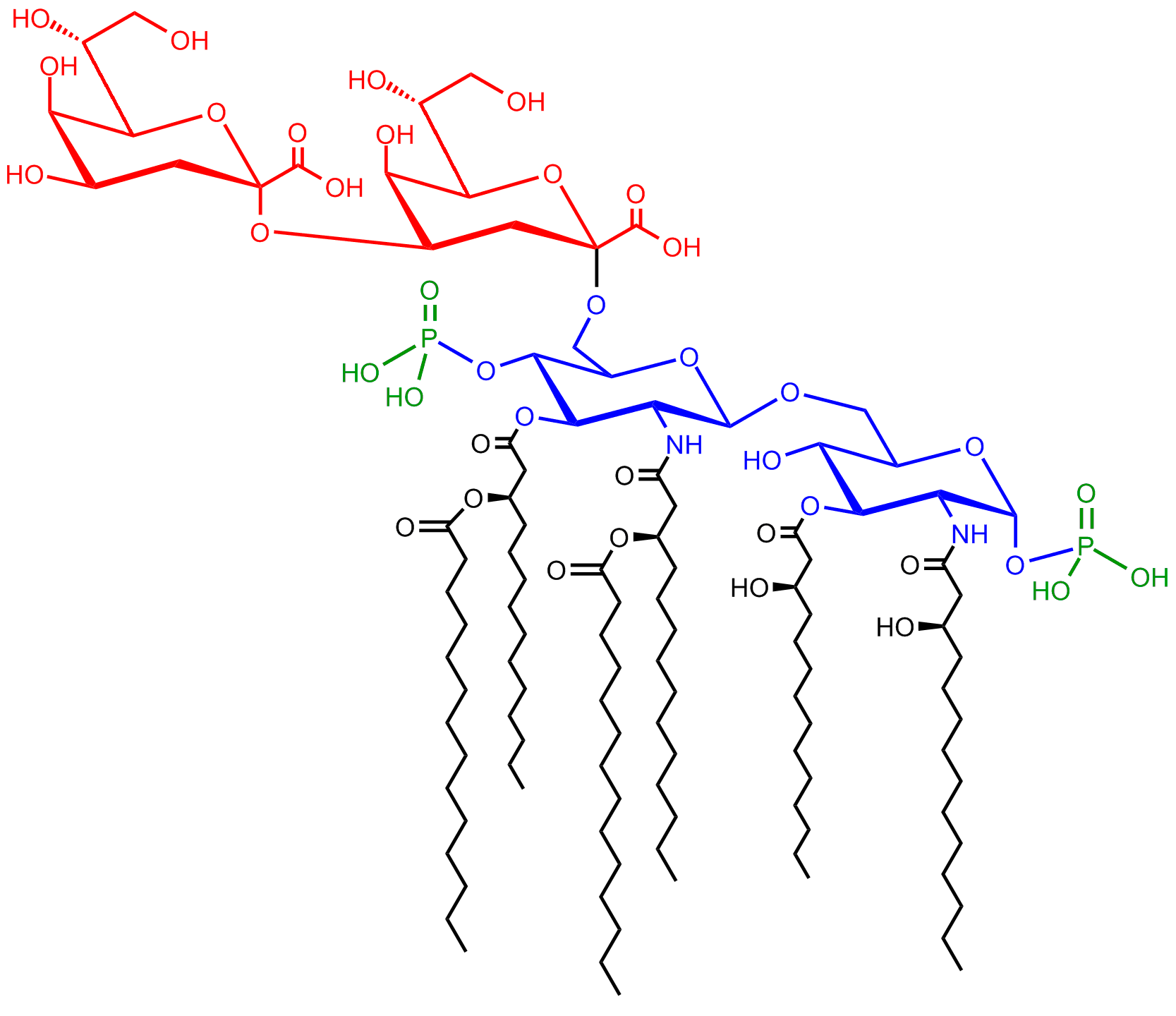
4. 3. 리피드 A
리피드 A는 통상적으로 여러 개의 지방산으로 장식된 인산화된 글루코사민 이당류이다. 이러한 소수성 지방산 사슬은 LPS를 박테리아 막에 고정시키며, 나머지 LPS는 세포 표면에서 튀어나온다. 리피드 A 도메인은 가장 생물학적으로 활성이 높으며, 그람 음성 세균의 독성 대부분을 담당한다. 세균 세포가 용해되어 면역 체계에 의해 파괴되면, 지질 A를 포함하는 막 조각이 혈액 순환으로 방출되어 발열, 설사 및 치명적인 내독성 패혈성 쇼크(패혈성 쇼크의 한 형태)를 유발할 수 있다. 지질 A 부분은 LPS의 매우 보존된 구성 요소이다.[16] 그러나 지질 A 구조는 세균 종에 따라 다르다. 지질 A 구조는 전반적인 숙주 면역 활성화의 정도와 성격을 광범위하게 정의한다.[17]
LPS의 지질 부분에 해당하는 리피드 A는 인산기가 결합된 글루코사민 2분자가 글리코시드 결합한 것에 대해 지방산 사슬이 복수 결합된 화학 구조를 갖는다. LPS의 생리 활성 발현에 있어서 가장 중요한 역할을 하는 것으로 생각되는 것은 리피드 A 부위이며, 리피드 A 단독으로도 생리 작용을 나타낼 수 있다.[79] 리피드 A의 구조에 포함된 지방산 사슬은 세균 종에 따라 다르다.
4. 4. 리포올리고당 (LOS)
LPS의 "거친 형태"는 O-다당류가 없어 분자량이 더 낮다. 그 자리에 짧은 올리고당이 있는데, 이 형태를 리포올리고당(LOS)이라고 하며, 이는 나이세리아, 헤모필루스 등 일부 그람 음성 세균의 외막에서 발견되는 글리콜리피드이다.[18][19] LOS는 그람 음성 세포 외피 외막의 무결성과 기능을 유지하는 데 중요한 역할을 한다. LOS는 면역자극제 및 면역 조절제 역할을 할 수 있기 때문에 특정 세균 감염의 발병 기전에 중요한 역할을 한다.[18] 또한, LOS 분자는 일부 세균 균주가 분자 모방과 항원 변이를 나타낼 수 있게 하여 숙주 면역 방어를 회피하는 데 도움을 주고, 따라서 이러한 세균 균주의 독성에 기여한다. 수막구균(Neisseria meningitidis)의 경우, 분자의 지질 A 부분은 대칭적인 구조를 가지며 내부 코어는 3-데옥시-D-만노-2-옥툴로손산 (KDO)과 헵토스 (Hep) 잔기로 구성된다. 외부 코어 올리고당 사슬은 세균 균주에 따라 다르게 나타난다.[18][19]
5. 생합성 및 수송
LPS(지질다당류) 생성 과정은 지질 A-Kdo2 분자로 시작하며, 이 분자는 세균 세포의 내막 표면에서 먼저 만들어진다. 그 후, MsbA 단백질의 도움으로 내막에서 외막 사이 공간(주변세포질 공간)으로 이동하기 전에 내막에서 이 분자에 당이 추가된다. LPS의 다른 부분인 O-항원은 내막의 특수 효소 복합체에서 만들어진다. O-항원은 세 가지 다른 시스템(Wzy 의존, ABC 수송체 사용, 합성효소 의존 과정)을 통해 외막으로 이동한다.[27]
최종적으로 LPS는 리포다당류 수송(Lpt) 단백질로 구성된 막 횡단 다리에 의해 외막으로 수송된다.[26][28] 이 수송체는 잠재적인 항생제 표적이다.[29][30]
6. 숙주에 대한 생물학적 영향
LPS는 단핵구, 수지상 세포, 대식세포 및 B 세포 등 많은 세포 유형에서 CD14/TLR4/MD2 수용체 복합체에 결합하여 전-염증성 사이토카인, 산화 질소 및 에이코사노이드의 분비를 촉진한다.[32] 브루스 보이틀러는 TLR4가 LPS 수용체임을 입증한 연구로 2011년 노벨 생리의학상을 공동 수상했다.[33][34]
세포 스트레스 반응의 일부로서, 슈퍼옥사이드는 TLR을 발현하는 다양한 세포 유형에서 LPS에 의해 유도되는 주요 활성 산소 중 하나이다.[35] LPS는 또한 외인성 발열원 (열을 유발하는 물질)이다.[3]
LPS는 많은 전사 인자의 활성화에 관여하는 역할 때문에 수년간 실험 연구가 진행되어 왔다. LPS는 또한 패혈성 쇼크에 관여하는 여러 유형의 매개체를 생성한다. 포유류 중 인간은 다른 영장류나 쥐보다 LPS에 훨씬 더 민감하다. 1μg/kg의 용량은 인간에게 쇼크를 유발하지만, 쥐는 최대 천 배 높은 용량을 견딜 수 있다.[37] 이는 두 종 간의 자연 항체 순환 수준의 차이와 관련이 있을 수 있다.[38][39]
LPS는 조혈모 세포(HSC)가 TLR4에 결합하여 직접 감지할 수 있으며, 전신 감염에 반응하여 증식하게 한다. 이러한 반응은 HSC 내에서 TLR4-TRIF-ROS-p38 신호를 활성화하며, 지속적인 TLR4 활성화를 통해 증식성 스트레스를 유발하여 경쟁적 재형성 능력을 손상시킬 수 있다.[42]
뇌수막염균과 같은 병원성 그람 음성 세균에 의한 감염은 수막구균증, 워터하우스-프리데릭센 증후군 및 수막염을 포함한 뇌수막구균 질환을 유발할 수 있는데, 이때 내독소는 이러한 질환들의 임상적 발현에 크게 기여한다.
O 항원(바깥쪽 탄수화물)은 지질다당류(LPS) 분자 중 가장 가변적인 부분으로, 항원에 대한 특이성을 부여한다. 반면에 지질 A는 가장 보존적인 부분이다. 그러나 지질 A의 조성은 속(genus) 내에서, 또는 속 간에 차이가 있을 수 있다(예: 아실 사슬의 수와 특징).[43]
최근 TLR4 매개 경로 외에도, 일시 수용체 전위 이온 채널 계열의 특정 구성원들이 LPS를 인식하는 것으로 나타났다.[50] LPS 매개 TRPA1 활성화가 마우스[51]와 초파리속[52]에서 나타났다. 더 높은 농도에서 LPS는 TRPV1, TRPM3과 어느 정도 TRPM8과 같은 감각 TRP 채널 계열의 다른 구성원들도 활성화시킨다.[53] LPS는 상피 세포에서 TRPV4에 의해 인식된다. LPS에 의한 TRPV4 활성화는 살균 효과와 함께 산화 질소 생성을 유도하는 데 필요하고 충분했다.[54]
LPS는 세포 수용체에 결합하여 염증을 유발한다. 혈액 내 과도한 LPS(내독소혈증)는 내독소성 쇼크를 유발할 수 있는데,[4] 이는 전신 염증 반응 증후군(SIRS)에서 시작하여 다기관 부전 증후군(MODS)으로 이어질 수 있다.[55] 초기 증상으로는 빠른 심박수, 빠른 호흡, 체온 변화, 혈액 응고 문제가 있으며, 이는 혈관 확장 및 혈액량 감소로 이어져 세포 기능 장애를 유발한다.[55]
LPS는 자가면역 질환, 알레르기와 관련이 있으며, 높은 수준의 LPS는 대사 증후군으로 이어져 당뇨병, 심장 질환, 간 문제 등의 위험을 증가시킬 수 있다.[55] 또한 워터하우스-프리데릭센 증후군, 수막구균혈증, 수막염과 같은 심각한 세균 감염 증상에도 기여한다.[55]
LPS의 건강 영향은 강력한 활성제이자 면역 체계 조절제로서의 능력, 특히 염증 유도 능력에 기인한다. LPS는 직접적인 세포 독성을 가지며 매우 강력한 면역 자극을 유발한다. 숙주 면역 세포가 LPS를 인식하면 보체가 강력하게 활성화된다. 보체 활성화와 증가하는 항염증 반응은 면역 세포 기능 장애, 면역 억제, 광범위한 응고 장애, 심각한 조직 손상으로 이어질 수 있으며, 다중 장기 부전 및 사망으로 진행될 수 있다.
LPS는 TLR4를 통해 그 작용을 발현한다. TLR 패밀리는 염증성 사이토카인의 발현에 관여하며, 선천 면역에서 중요한 역할을 한다. TLR4에 의한 LPS의 인식 기작은 먼저 LPS 결합 단백질 (LBP)에 의해 LPS가 포착되어, CD14 분자로 수송됨으로써 시작된다. LPS-CD14 복합체는 TLR4에 결합하며, 이 인지에는 MD-2 분자가 필수적이다.
LPS는 신호 전달 경로를 통해 다양한 염증성 사이토카인의 분비를 촉진한다. 사이토카인의 생성은 세균 제거를 위한 생체 방어 반응이지만 과잉될 경우 독성이 발현되어 쇼크 상태(내독소 쇼크)에 빠진다. LPS는 항원 제시 세포인 수지상 세포 및 대식세포를 활성화시켜 미분화된 T 세포(나이브 T 세포)를 1형 헬퍼 T 세포(Th1 세포)로 분화시키는 작용을 한다. 이러한 작용 때문에 LPS는 생물학 분야의 기초 연구에서 ''in vivo'' 및 ''in vitro'' 모두에서 염증성 자극으로 널리 사용된다. 이 외에도 LPS는 발열, 다발성 장기 부전, 빈맥 등의 작용을 한다.
자연계에서 LPS는 장내 세균에서 유래하는 것 외에 식용 식물 및 한약에도 부착되어 있다. 경구 및 경피 LPS의 자연 섭취는 독성이 없으며, 오히려 면역계 성숙 및 조절에 기여한다는 보고도 있다. 예를 들어, 유아기 LPS 자연 섭취는 알레르기 체질을 막고,[83] 생체 내 항균 물질을 유도하여 항생제 내성균 번식을 예방하며,[84] 마우스 실험에서 LPS를 인플루엔자 설하 백신에 첨가하여 IgG뿐만 아니라 IgA 항체 생성을 높여 예방 효과가 높고,[85] 피부에서 LPS 신호 전달은 피부 상처 치유 및 알레르기 억제에 필수적이다.[86][87] 또한, 염증을 억제적으로 제어하는 조절 T 세포(Treg 세포)는 LPS 자극을 받으면 호중구의 염증 유도를 억제하며,[88] 외부 접점에 존재하는 장관 대식세포 및 피부 랑게르한스 세포는 LPS로 자극해도 염증성 사이토카인을 유도하지 않는다.[89][90] 따라서 LPS는 생리 작용으로서 생체 항상성 유지에 작용하는 측면이 있다.
6. 1. 면역 반응
LPS는 단핵구, 수지상 세포, 대식세포 및 B 세포 등 많은 세포 유형에서 CD14/TLR4/MD2 수용체 복합체에 결합하여 전-염증성 사이토카인, 산화 질소 및 에이코사노이드의 분비를 촉진한다.[32] 브루스 보이틀러는 TLR4가 LPS 수용체임을 입증한 연구로 2011년 노벨 생리의학상을 공동 수상했다.[33][34]세포 스트레스 반응의 일부로서, 슈퍼옥사이드는 TLR을 발현하는 다양한 세포 유형에서 LPS에 의해 유도되는 주요 활성 산소 중 하나이다.[35] LPS는 또한 외인성 발열원 (열을 유발하는 물질)이다.[3]
LPS는 많은 전사 인자의 활성화에 관여하는 역할 때문에 수년간 실험 연구가 진행되어 왔다. LPS는 또한 패혈성 쇼크에 관여하는 여러 유형의 매개체를 생성한다. 포유류 중 인간은 다른 영장류보다 LPS에 훨씬 더 민감하며,[36] 다른 동물(예: 쥐)보다도 민감하다. 1μg/kg의 용량은 인간에게 쇼크를 유발하지만, 쥐는 최대 천 배 높은 용량을 견딜 수 있다.[37] 이는 두 종 간의 자연 항체 순환 수준의 차이와 관련이 있을 수 있다.[38][39]
LPS는 조혈모 세포(HSC)가 TLR4에 결합하여 직접 감지할 수 있으며, 전신 감염에 반응하여 증식하게 한다. 이러한 반응은 HSC 내에서 TLR4-TRIF-ROS-p38 신호를 활성화하며, 지속적인 TLR4 활성화를 통해 증식성 스트레스를 유발하여 경쟁적 재형성 능력을 손상시킬 수 있다.[42]
Said 등은 LPS가 PD-1 수준을 상향 조절하여 CD4 T 세포의 확장과 기능을 IL-10 의존적으로 억제하여, 단핵구에서 PD-1이 PD-L1에 결합한 후 단핵구에서 IL-10이 생성되게 한다는 것을 보여주었다.[40]
내독소는 뇌수막염균과 같은 병원성 그람 음성 세균에 의한 감염, 즉 수막구균증, 워터하우스-프리데릭센 증후군 및 수막염을 포함한 뇌수막구균 질환의 극적인 임상적 발현에 크게 기여한다.
여러 박테리아 균주의 LPS 일부가 인간 숙주 세포 표면 분자와 화학적으로 유사한 것으로 나타났다. 일부 박테리아가 특정 유형의 숙주 세포의 표면 분자와 화학적으로 동일하거나 유사한 분자를 표면에 제시하는 능력을 분자 모방이라고 한다.[41] 이러한 인간 세포 표면 '모방'의 존재는 면역 체계로부터의 '위장' 역할을 하는 것 외에도, 특정 사람 백혈구 항원(HLA) 유전자형을 가진 숙주를 감염시킬 때 면역 관용을 무효화하는 데 역할을 할 수 있다.[18]
6. 2. 면역 반응의 다양성
O 항원(바깥쪽 탄수화물)은 지질다당류(LPS) 분자 중 가장 가변적인 부분으로, 항원에 대한 특이성을 부여한다. 반면에 지질 A는 가장 보존적인 부분이다. 그러나 지질 A의 조성은 속(genus) 내에서, 또는 속 간에 차이가 있을 수 있다(예: 아실 사슬의 수와 특징). 이러한 차이는 LPS에 길항적 특성을 부여할 수 있다.[43]원뿔형 지질 A (예: ''대장균(Escherichia coli)''에서 유래)는 좀 더 작동을 잘한다. 덜 원뿔형인 지질 A를 가진 ''Porphyromonas gingivalis''와 같은 균은 다른 신호(TLR4 대신 TLR2)를 활성화할 수 있다. 완전히 원통형인 지질 A를 가진 ''Rhodobacter sphaeroides''와 같은 균은 TLR에 길항적이라는 추측이 있다.[44][45]
일부 세균은 위상 변이를 통해 숙주의 면역 반응을 회피할 수 있다. ''임균(Neisseria gonorrhoeae)''은 감염 중에 하나 이상의 LOS 유형을 합성하여 LOS 분자의 항원성을 바꿀 수 있다.[48] ''임균(Neisseria gonorrhoeae)'', ''수막염균(Neisseria meningitidis)'', ''인플루엔자균(Haemophilus influenzae)''[18]은 ''생체 외''에서 시알산으로 LOS를 추가 수정하여 보체 매개 살해에 대한 저항성을 증가시키거나,[48] 보체 활성화를 조절하거나,[18] 살균 항체의 효과를 피할 수 있다.[18] 시알산화는 면역 세포에 의한 호중구 부착 및 탐식을 방해하고 산화 폭발을 감소시킨다.[18] 소의 병원체인 ''Haemophilus somnus'' 또한 LOS 위상 변이를 통해[49] 소 숙주 면역 방어를 회피한다.
이러한 관찰 결과, LOS와 같은 세균 표면 분자의 변이는 병원체가 체액성 면역(항체 및 보체 매개) 및 세포 매개 면역(예: 호중구에 의한 살해) 숙주 면역 방어를 모두 회피하는 데 도움을 줄 수 있다.
6. 3. LPS 인식의 비표준 경로
최근 TLR4 매개 경로 외에도, 일시 수용체 전위 이온 채널 계열의 특정 구성원들이 LPS를 인식하는 것으로 나타났다.[50] LPS 매개 TRPA1 활성화가 마우스[51]와 ''초파리속''에서 나타났다.[52] 더 높은 농도에서 LPS는 TRPV1, TRPM3과 어느 정도 TRPM8과 같은 감각 TRP 채널 계열의 다른 구성원들도 활성화시킨다.[53]LPS는 상피 세포에서 TRPV4에 의해 인식된다. LPS에 의한 TRPV4 활성화는 살균 효과와 함께 산화 질소 생성을 유도하는 데 필요하고 충분했다.[54]
6. 4. 병태생리학
LPS는 세포 수용체에 결합하여 염증을 유발한다. 혈액 내 과도한 LPS(내독소혈증)는 내독소성 쇼크를 유발할 수 있는데,[4] 이는 전신 염증 반응 증후군(SIRS)에서 시작하여 다기관 부전 증후군(MODS)으로 이어질 수 있다.[55] 초기 증상으로는 빠른 심박수, 빠른 호흡, 체온 변화, 혈액 응고 문제가 있으며, 이는 혈관 확장 및 혈액량 감소로 이어져 세포 기능 장애를 유발한다.[55]LPS는 자가면역 질환, 알레르기와 관련이 있으며, 높은 수준의 LPS는 대사 증후군으로 이어져 당뇨병, 심장 질환, 간 문제 등의 위험을 증가시킬 수 있다.[55] 또한 워터하우스-프리데릭센 증후군, 수막구균혈증, 수막염과 같은 심각한 세균 감염 증상에도 기여한다.[55] 특정 세균은 LPS를 적응시켜 호흡기 및 소화기 계통에서 장기간 지속되는 감염을 유발할 수 있다.[55]
최근 연구에 따르면 LPS는 세포막 지질을 교란하여 콜레스테롤 및 대사에 영향을 미쳐 고콜레스테롤혈증, 이상 혈중 지질 수치 및 비알코올성 지방간 질환을 유발할 수 있다. 어떤 경우에는 LPS가 독소 제거를 방해하여 신경학적 문제와 관련될 수 있다.[55]
LPS의 건강 영향은 강력한 활성제이자 면역 체계 조절제로서의 능력, 특히 염증 유도 능력에 기인한다. LPS는 직접적인 세포 독성을 가지며 매우 강력한 면역 자극을 유발한다. 숙주 면역 세포가 LPS를 인식하면 보체가 강력하게 활성화된다. 보체 활성화와 증가하는 항염증 반응은 면역 세포 기능 장애, 면역 억제, 광범위한 응고 장애, 심각한 조직 손상으로 이어질 수 있으며, 다중 장기 부전 및 사망으로 진행될 수 있다.
LPS는 TLR4를 통해 그 작용을 발현한다. TLR 패밀리는 염증성 사이토카인의 발현에 관여하며, 선천 면역에서 중요한 역할을 한다. TLR4에 의한 LPS의 인식 기작은 먼저 LPS 결합 단백질 (LBP)에 의해 LPS가 포착되어, CD14 분자로 수송됨으로써 시작된다. LPS-CD14 복합체는 TLR4에 결합하며, 이 인지에는 MD-2 분자가 필수적이다.
LPS는 신호 전달 경로를 통해 다양한 염증성 사이토카인의 분비를 촉진한다. 사이토카인의 생성은 세균 제거를 위한 생체 방어 반응이지만 과잉될 경우 독성이 발현되어 쇼크 상태(내독소 쇼크)에 빠진다. LPS는 항원 제시 세포인 수지상 세포 및 대식세포를 활성화시켜 미분화된 T 세포(나이브 T 세포)를 1형 헬퍼 T 세포(Th1 세포)로 분화시키는 작용을 한다. 이러한 작용 때문에 LPS는 생물학 분야의 기초 연구에서 ''in vivo'' 및 ''in vitro'' 모두에서 염증성 자극으로 널리 사용된다. 이 외에도 LPS는 발열, 다발성 장기 부전, 빈맥 등의 작용을 한다.
자연계에서 LPS는 장내 세균에서 유래하는 것 외에 식용 식물 및 한약에도 부착되어 있다. 경구 및 경피 LPS의 자연 섭취는 독성이 없으며, 오히려 면역계 성숙 및 조절에 기여한다는 보고도 있다. 예를 들어, 유아기 LPS 자연 섭취는 알레르기 체질을 막고,[83] 생체 내 항균 물질을 유도하여 항생제 내성균 번식을 예방하며,[84] 마우스 실험에서 LPS를 인플루엔자 설하 백신에 첨가하여 IgG뿐만 아니라 IgA 항체 생성을 높여 예방 효과가 높고,[85] 피부에서 LPS 신호 전달은 피부 상처 치유 및 알레르기 억제에 필수적이다.[86][87] 또한, 염증을 억제적으로 제어하는 조절 T 세포(Treg 세포)는 LPS 자극을 받으면 호중구의 염증 유도를 억제하며,[88] 외부 접점에 존재하는 장관 대식세포 및 피부 랑게르한스 세포는 LPS로 자극해도 염증성 사이토카인을 유도하지 않는다.[89][90] 따라서 LPS는 생리 작용으로서 생체 항상성 유지에 작용하는 측면이 있다.
6. 5. 내독소혈증
혈액 내 지질다당류(LPS) 존재는 내독소혈증이라 불리며, 높은 농도는 패혈성 쇼크[57], 더 구체적으로 내독소성 패혈성 쇼크[4]로 이어질 수 있다. 반면, 혈류 내 LPS 농도가 낮으면 대사성 내독소혈증이라고 한다.[58] 내독소혈증은 비만, 식단[59], 심혈관 질환[59], 당뇨병[58]과 관련이 있으며, 숙주 유전학 또한 영향을 미칠 수 있다.[60]특히 숙주-병원체 인터페이스에서 유래하는 장관 내독소혈증은 소장 세균 과증식 증후군과 증가된 장 투과성을 기반으로 발생할 가능성이 있는 알코올성 간염 발달에 중요한 요인으로 여겨진다.[61][62]
지질 A는 염증 매개체의 생성을 동반하여 포유류 면역 체계를 제어할 수 없이 활성화시켜 내독성 패혈성 쇼크를 유발할 수 있다.[19][4] 이 염증 반응은 주로 면역 체계 세포 활성을 담당하는 Toll-like 수용체 4에 의해 매개된다.[19] 이러한 염증 매개체에 의해 유발된 혈관의 내피 층 손상은 모세혈관 누출 증후군, 혈관 확장, 심장 기능 감소로 이어져 쇼크를 더욱 악화시킬 수 있다.[63]
LPS는 또한 보체의 강력한 활성제이다.[63] 제어되지 않은 보체 활성화는 파종성 혈관 내 응고(DIC) 또는 신장 및 폐를 포함한 다양한 장기에 손상을 입히는 비정형 용혈성 요독 증후군(aHUS)으로 이어지는 파괴적인 내피 손상을 유발할 수 있다.[64] 피부는 종종 점상 출혈, 자반병 및 반상 출혈 형태로 응고 인자의 고갈과 함께 혈관 손상의 영향을 나타낼 수 있다. 사지 또한 영향을 받을 수 있으며, 때로는 괴저가 발생하여 절단이 필요할 수 있다.[63] 부신 기능 상실은 부신 기능 부전을 유발할 수 있으며, 부신 내 출혈은 워터하우스-프리데릭센 증후군을 유발하며, 이 둘 모두 생명을 위협할 수 있다.
또한, 임질 리포올리고당(LOS)이 인간 나팔관에 손상을 줄 수 있다고 보고되었다.[48]
6. 6. 내독소혈증 치료
토라에이미신은 체외 내독소 제거 치료법으로 널리 사용된다. 이는 폴리스티렌 유래 카트리지 내부에 폴리믹신 B(PMX-B) 분자가 공유 결합된 메쉬 섬유가 들어 있는 형태이다. 폴리믹신은 바실루스 폴리믹사에서 유래한 환상 양이온성 폴리펩타이드 항생제로, 그람 음성 세균에 대한 효과적인 항균 활성을 가지고 있지만 신독성 및 신경독성 부작용으로 인해 정맥 내 임상 사용이 제한되어 왔다.[65] 토라에이미신 카트리지의 체외 사용은 PMX-B가 지질 A에 매우 안정적인 상호 작용으로 결합하여 소수성 잔기를 통해 내독소를 중화시키고, 혈액이 카트리지 내부의 체외 회로를 통과하면서 여과되어 내독소혈증을 되돌리고 독성 전신 효과를 피할 수 있게 한다.[66]6. 7. 자가면역 질환
일부 LPS 분자는 인간 숙주 세포 표면 분자와 화학적으로 유사하여 분자 모방을 일으킨다. 이로 인해 특정 사람 백혈구 항원(HLA) 유전자형을 가진 숙주를 감염시킬 때 면역 관용이 무효화될 수 있다.[41] 예를 들어, ''뇌수막염균'' L2,3,5,7,9의 올리고당 말단 사당류 부분(락토-N-네오테트라오스)은 인간 적혈구의 ABO식 혈액형 글리콜리피드 항원 전구체인 파라글로보사이드와 동일한 사당류이다.[18]6. 8. 비만과의 연관성
역학 연구에 따르면 장내에서 지질다당류를 생성하는 박테리아의 개체 수 증가로 인한 내독소 부하 증가는 특정 비만 관련 환자 그룹과 관련이 있는 것으로 나타났다.[67][68][69] 다른 연구에서는 정제된 ''대장균''(Escherichia coli)에서 추출한 지질다당류를 무균 생쥐 모델에 주사하면 비만과 인슐린 저항성을 유발할 수 있다는 것을 보여주었다.[70] 보다 최근의 연구에서는 인간 환자에서 ''클로아카박터''(Enterobacter cloacae) B29가 비만 및 인슐린 저항성에 잠재적으로 기여하는 역할을 밝혀냈다.[71] 지질다당류와 비만의 연관성에 대한 추정 기전은 지질다당류가 관찰된 비만 및 인슐린 저항성을 설명하는 염증 매개 경로를 유도한다는 것이다.[70] 지질다당류 관련 비만 효과와 관련된 박테리아 속에는 ''대장균''(Escherichia)과 ''클로아카박터''(Enterobacter)가 있다.6. 9. 우울증
LPS가 우울증에 관여할 수 있다는 실험적, 관찰적 증거가 있다. 쥐에게 LPS를 투여하면 우울 증상이 나타날 수 있으며, 우울증 환자 중 일부는 LPS 수치가 상승하는 것으로 보인다. 염증은 때때로 우울증 발달에 역할을 할 수 있으며, LPS는 염증을 유발한다.[72]6. 10. 세포 노화
LPS에 의해 유도된 염증은 세포 노화를 유발할 수 있으며, 이는 폐 상피 세포 및 미세 아교 세포에서 입증되었다(후자는 신경 퇴행으로 이어진다).[73]7. LPS 해독
아실옥시아실 가수분해효소(AOAH)는 지질 A에서 두 개의 이차 아실 사슬을 제거하여 테트라아실 LPS를 생성함으로써 LPS를 비활성화하는 효소이다. 호중구, 대식세포, 수지상 세포에서 생성된다.[20] 마우스 실험에서 AOAH가 결핍된 경우, 비특이적 항체의 역가가 높아지고 간 비대증 및 내독소 내성이 오래 지속되는 것이 확인되었다. 이는 LPS 비활성화가 동물의 항상성 회복에 중요함을 보여준다.[20]
장 알칼리 인산분해효소는 LPS의 지질 A 부분을 탈인산화하여 세균으로부터 장 염증과 누수 장을 예방한다.[22][23][24] ''살모넬라 티피무리움''(Salmonella tryphimurium) 및 ''클로스트리디오이데스 디피실레''(Clostridioides difficile) 감염의 심각성을 줄여 정상적인 장내 미생물군을 회복시킬 수 있다.[21]
8. 검사
LPS 검사는 감염을 신속하게 관리하고 치료하는 데 중요하다. 현재 LPS 검사 방법은 민감하지만, 서로 다른 LPS 그룹을 구별하는 데 어려움이 있다. 일반적인 검출 방법은 지질 A를 식별하며, 생체 내, 생체 외, 변형된 면역, 생물학적, 화학적 검사 등이 있다.[55]
LPS는 우리 세포의 면역 반응을 유발하는 주요 요인이므로 급성 감염의 초기 신호 역할을 한다. 따라서 LPS 검사는 다른 많은 혈청학적 검사보다 더 특이하고 의미가 있다.[55]
LPS는 양친매성(물을 끌어당기는 성질과 물을 밀어내는 성질을 모두 가짐)을 가지고 있어 민감하고 사용하기 쉬운 검사를 개발하기 어렵게 만든다.[55]
8. 1. Endotoxin Activity Assay (EAA™)
EAA는 전혈 시료의 내독소 활성을 측정하는 체외 화학 발광 면역 진단 검사이다. 이 검사는 그람 음성 세균 LPS의 Lipid A 부분과 특이적으로 반응한다.[56]9. 생명공학 및 연구에서의 오염 물질
리포다당류(LPS)는 세균에서 추출한 플라스미드 DNA나 세균에서 발현된 단백질에서 흔히 발견되는 오염 물질이다. 따라서 실험의 오염을 막고, 산업 발효를 통해 만들어진 제품의 독성을 예방하기 위해 DNA나 단백질에서 LPS를 *제거해야* 한다.[74]
오발부민은 내독소에 자주 오염된다. 오발부민은 동물 모델에서 널리 연구되는 단백질 중 하나이며, 기도 과민 반응(AHR)의 모델 알레르겐으로도 잘 알려져 있다. 그러나 LPS에 오염된 오발부민은 단백질 항원이 동물 생리에 미치는 영향을 제대로 반영하지 못해 연구 결과를 왜곡할 수 있다.[75]
제약 생산 과정에서는 소량의 내독소라도 인체에 질병을 유발할 수 있기 때문에, 의약품 용기에서 내독소를 완전히 제거해야 한다. 이를 위해 비발열 처리 오븐이 사용되며, LPS를 완전히 분해하려면 300°C 이상의 고온이 필요하다.[76]
내독소 검출을 위한 표준 검사법으로는 말굽게(''Limulus polyphemus'')의 혈액을 이용하는 림불루스 아메바 혈구 용해물(LAL) 검사법이 있다.[77] LAL 검사는 매우 낮은 농도의 LPS도 검출할 수 있는데, 이는 효소 반응 연쇄를 통해 신호가 증폭되기 때문이다. 그러나 말굽게 개체 수 감소와 LAL 검사를 방해하는 요인들 때문에, LAL 검사의 대안으로 Factor C를 사용하는 ELISA 검사와 같은 재조합 단백질 기반 검사법 개발이 진행되고 있다.[78]
10. 의약 응용
LPS 억제제인 폴리믹신 B는 화이자에서 판매되는 폴리믹신 B 정제나 테라마이신 연고 등의 함유 성분으로 의약품에 응용되고 있다.[79]
한편, 살모넬라균 유래 LPS의 리피드 A를 탈인산화하여 인산기를 하나 남긴 모노포스포릴리피드 A (MPL)[91]는 자궁경부암 백신(서바릭스)의 보조제로 사용되고 있다.[92]
참조
[1]
논문
Bacterial endotoxin: molecular relationships of structure to activity and function
1994-02
[2]
논문
Structural and functional analysis of a cloned delta endotoxin of Bacillus thuringiensis berliner 1715
1986-12
[3]
논문
Mechanisms of fever production and lysis: lessons from experimental LPS fever
2014-10
[4]
논문
The role of endotoxin in septic shock
2023-10
[5]
논문
Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012
2013-02
[6]
서적
Textbook of Microbiology & Immunology
https://books.google[...]
Elsevier
2009-01-01
[7]
논문
Biological functions and biogenesis of secreted bacterial outer membrane vesicles
[8]
논문
Outer Membrane Vesicles of Gram-Negative Bacteria: An Outlook on Biogenesis
[9]
논문
On the essentiality of lipopolysaccharide to Gram-negative bacteria
2013-12
[10]
논문
The omptin family of enterobacterial surface proteases/adhesins: from housekeeping in Escherichia coli to systemic spread of Yersinia pestis
2004-07
[11]
논문
Bacterial endotoxins: biological properties and mechanisms of action.
1993
[12]
논문
Lipopolysaccharide endotoxins
[13]
논문
Smooth and rough lipopolysaccharide phenotypes of Brucella induce different intracellular trafficking and cytokine/chemokine release in human monocytes
2003-12
[14]
논문
Diffusion of macrolide antibiotics through the outer membrane of Moraxella catarrhalis
1999-12
[15]
논문
Chemistry and metabolism of 3-deoxy-D-mannooctulosonic acid. I. Stereochemical determination
1968-04
[16]
논문
Endotoxin of Neisseria meningitidis composed only of intact lipid A: inactivation of the meningococcal 3-deoxy-D-manno-octulosonic acid transferase
2002-05
[17]
논문
Mass Spectrometry-based Structural Analysis and Systems Immunoproteomics Strategies for Deciphering the Host Response to Endotoxin
2018-08
[18]
논문
Molecular mimicry of host structures by bacterial lipopolysaccharides and its contribution to disease
1996-12
[19]
논문
Structural characterization of bacterial lipopolysaccharides with mass spectrometry and on- and off-line separation techniques
[20]
서적
Chapter 2 Kill the Bacteria…and Also Their Messengers?
2009
[21]
논문
The Role of Intestinal Alkaline Phosphatase in Inflammatory Disorders of Gastrointestinal Tract
2017
[22]
논문
Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents inflammation in zebrafish in response to the gut microbiota
2007-12
[23]
논문
Intestinal alkaline phosphatase prevents antibiotic-induced susceptibility to enteric pathogens
2014-04
[24]
논문
Intestinal alkaline phosphatase: novel functions and protective effects
2014-02
[25]
논문
Lipopolysaccharide: Biosynthetic pathway and structure modification
2010-04
[26]
논문
Transport of lipopolysaccharide across the cell envelope: the long road of discovery
2009-09
[27]
논문
Targeting LPS biosynthesis and transport in gram-negative bacteria in the era of multi-drug resistance
2023-03
[28]
논문
Lipopolysaccharide is transported to the cell surface by a membrane-to-membrane protein bridge
2018-02
[29]
논문
A new antibiotic traps lipopolysaccharide in its intermembrane transporter
2024-01
[30]
논문
A novel antibiotic class targeting the lipopolysaccharide transporter
2024-01
[31]
논문
Lipopolysaccharide: an endotoxin or an exogenous hormone?
2005
[32]
서적
Basic Immunology
Elsevier
[33]
논문
Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene
1998-12
[34]
웹사이트
The 2011 Nobel Prize in Physiology or Medicine - Press Release
https://www.nobelpri[...]
2018-04-28
[35]
논문
Roles of Toll-Like Receptors in Nitroxidative Stress in Mammals
2019-06
[36]
논문
Sepsis and the evolution of human increased sensitivity to lipopolysaccharide.
2021
[37]
논문
Resilience to bacterial infection: difference between species could be due to proteins in serum
2010-01
[38]
논문
Endotoxin shock in antibody-deficient mice: unraveling the role of natural antibody and complement in the clearance of lipopolysaccharide
1997-07
[39]
논문
A critical role of natural immunoglobulin M in immediate defense against systemic bacterial infection
1998-12
[40]
논문
Programmed death-1-induced interleukin-10 production by monocytes impairs CD4+ T cell activation during HIV infection
2010-04
[41]
논문
Molecular mimicry as an inducing trigger for CNS autoimmune demyelinating disease
2012-01
[42]
논문
Pathogen-Induced TLR4-TRIF Innate Immune Signaling in Hematopoietic Stem Cells Promotes Proliferation but Reduces Competitive Fitness
2017-08
[43]
논문
The equine TLR4/MD-2 complex mediates recognition of lipopolysaccharide from Rhodobacter sphaeroides as an agonist
2007
[44]
논문
Does the shape of lipid A determine the interaction of LPS with Toll-like receptors?
2002-03
[45]
논문
Intrinsic conformation of lipid A is responsible for agonistic and antagonistic activity
2000-05
[46]
서적
Pathogenicity Islands and the Evolution of Pathogenic Microbes
[47]
논문
Variation suggestive of horizontal gene transfer at a lipopolysaccharide (lps) biosynthetic locus in Xanthomonas oryzae pv. oryzae, the bacterial leaf blight pathogen of rice
2004-10
[48]
논문
The structure of lipooligosaccharide produced by Neisseria gonorrhoeae, strain 15253, isolated from a patient with disseminated infection. Evidence for a new glycosylation pathway of the gonococcal lipooligosaccharide
1994-12
[49]
논문
Antigenic diversity of Haemophilus somnus lipooligosaccharide: phase-variable accessibility of the phosphorylcholine epitope
2000-12
[50]
논문
TRP Channels as Sensors of Bacterial Endotoxins
2018-08
[51]
논문
TRPA1 channels mediate acute neurogenic inflammation and pain produced by bacterial endotoxins
2014-01-20
[52]
논문
Gustatory-mediated avoidance of bacterial lipopolysaccharides via TRPA1 activation in Drosophila
2016-06
[53]
논문
Differential effects of lipopolysaccharide on mouse sensory TRP channels
2018-07
[54]
논문
TRPV4 activation triggers protective responses to bacterial lipopolysaccharides in airway epithelial cells
2017-10
[55]
논문
The Role of Lipopolysaccharide-Induced Cell Signalling in Chronic Inflammation
2022
[56]
논문
A rapid assay of endotoxin in whole blood using autologous neutrophil dependent chemiluminescence
1998
[57]
서적
Endotoxemia and Endotoxin Shock
[58]
논문
Metabolic endotoxemia and diabetes mellitus: A systematic review
2017-03
[59]
논문
Endotoxemia, nutrition, and cardiometabolic disorders
2015-04
[60]
논문
Genetic Profile of Endotoxemia Reveals an Association With Thromboembolism and Stroke
2021-11
[61]
논문
Acute alcoholic hepatitis
2006-10
[62]
논문
Increased intestinal permeability to macromolecules and endotoxemia in patients with chronic alcohol abuse in different stages of alcohol-induced liver disease
2000-05
[63]
논문
Epidemic meningitis, meningococcaemia, and Neisseria meningitidis
2007-06
[64]
논문
Subtypes and Mimics of Sepsis.
2022
[65]
논문
Colistin: The Re-Emerging Antibiotic for Multidrug-Resistant Gram-Negative Bacterial Infections.
2006
[66]
논문
Endotoxin in Sepsis: Methods for LPS Detection and the Use of Omics Techniques
2022
[67]
논문
Circulating lipopolysaccharide-binding protein (LBP) as a marker of obesity-related insulin resistance
2012-11
[68]
논문
Association of lipopolysaccharide-binding protein and coronary artery disease in men
2007-07
[69]
논문
Lipopolysaccharide-binding protein plasma levels and liver TNF-alpha gene expression in obese patients: evidence for the potential role of endotoxin in the pathogenesis of non-alcoholic steatohepatitis
2007-10
[70]
논문
Metabolic endotoxemia initiates obesity and insulin resistance
2007-07
[71]
논문
An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice
2013-04
[72]
논문
Comparison of bacterial lipopolysaccharide-induced sickness behavior in rodents and humans: Relevance for symptoms of anxiety and depression
2020-08
[73]
논문
Cellular senescence: Molecular mechanisms and pathogenicity
2018-12
[74]
논문
Bacterial lipopolysaccharide copurifies with plasmid DNA: implications for animal models and human gene therapy
1995-03
[75]
논문
Endotoxin contamination of ovalbumin suppresses murine immunologic responses and development of airway hyper-reactivity
2003-10
[76]
웹사이트
The Detection of Endotoxins Via the LAL Test, the Chromogenic Method
http://www.wakopyros[...]
Wako Chemicals USA, Inc.
2015-03-14
[77]
논문
Biochemical principle of Limulus test for detecting bacterial endotoxins
2007-05
[78]
논문
A new era in pyrogen testing
http://www.horseshoe[...]
2014-01-02
[79]
논문
Synthetic and natural ''Escherichia coli'' free lipid A express identical endotoxic activities
1985
[80]
논문
Human Nod1 confers responsiveness to bacterial lipopolysaccharides
2001
[81]
논문
MD-2, a molecule that confers lipopolysaccharide responsiveness on Toll-like receptor 4
1999
[82]
논문
Modulation of Toll-interleukin 1 receptor mediated signaling
2005
[83]
논문
Environmental exposure to endotoxin and its relation to asthma in school-age children.
2002
[84]
논문
Vancomycin-resistant enterococci exploit antibiotic-induced innate immune deficits.
2008
[85]
논문
A Lipopolysaccharide from Pantoea Agglomerans Is a Promising Adjuvant for Sublingual Vaccines to Induce Systemic and Mucosal Immune Responses in Mice via TLR4 Pathway.
2015
[86]
논문
Exacerbation of allergen-induced eczema in TLR4- and TRIF-deficient mice.
2013
[87]
논문
Toll-like receptor 4 has an essential role in early skin wound healing.
2013
[88]
논문
Lipopolysaccharide-activated CD4+CD25+ T regulatory cells inhibit neutrophil function and promote their apoptosis and death.
2006
[89]
논문
Differential expression and function of Toll-like receptors in Langerhans cells: comparison with splenic dendritic cells.
2004
[90]
논문
Human intestinal macrophages display profound inflammatory anergy despite avid phagocytic and bacteriocidal activity.
2005
[91]
논문
Monophosphoryl Lipid A (MPL) Formulations for the Next Generation of Vaccines.
1999
[92]
논문
Development of an AS04-adjuvanted HPV vaccine with the adjuvant system approach.
2011
[93]
서적
김명호의 생물학 공방 : 그래픽 노블로 떠나는 매혹과 신비의 생물 대탐험
http://worldcat.org/[...]
사이언스북스
2015
[94]
웹인용
KOREAN > 용어상식 > 자료실 > KONETIC
https://www.konetic.[...]
2021-10-24
[95]
서적
Textbook of Microbiology & Immunology
https://books.google[...]
Elsevier
2009-01-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

