흑연 층간 물질
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
흑연 층간 물질은 흑연 층 사이에 다양한 원자나 분자를 삽입하여 만들어지는 화합물이다. 1861년에 처음 합성되었으며, 금속 삽입 시 전기 전도도가 증가하고, 플루오르화물이나 산화물 삽입 시 전기 전도도가 감소하는 특성을 보인다. 알칼리 금속을 삽입한 흑연 층간 물질에서 초전도 현상이 처음 발견되었으며, 특히 칼슘을 삽입한 CaC6은 높은 임계 온도를 나타내며, 전자-포논 상호작용이 초전도 현상에 중요한 역할을 한다. 흑연 층간 물질은 강력한 환원제, 중합 반응 촉매, 칼륨 이온 배터리 음극재 등으로 활용되며, 초전도 현상 연구 및 다양한 응용 분야에서 중요하게 다루어진다.
더 읽어볼만한 페이지
- 무기 탄소 화합물 - 이산화 탄소
이산화탄소(CO₂)는 탄소 원자 하나와 산소 원자 두 개로 이루어진 무색·무취의 기체로, 드라이아이스로 승화하며, 탄산 형성, 연소, 호흡, 광합성 등 다양한 과정에서 발생하고, 산업적으로 널리 사용되지만 지구 온난화의 주요 원인이자 고농도에서 인체에 유독한 물질이다. - 무기 탄소 화합물 - 이황화 탄소
이황화 탄소는 1796년 람파디우스가 합성한 무색 휘발성 액체로, 높은 굴절률과 우수한 용매 특성을 지니지만, 가연성과 독성으로 인해 건강 문제를 유발하여 사용량이 감소하고 법적 규제를 받고 있다. - 초분자화학 - 이온 결합
이온 결합은 금속 양이온과 비금속 음이온 간의 정전기적 인력에 의해 형성되며, 산화 환원 반응을 통해 생성되어 결정 격자 구조를 가지며, 전기 음성도 차이가 클수록 이온성이 강해진다. - 초분자화학 - 수소 결합
수소 결합은 전기음성도가 큰 원자에 결합된 수소 원자와 다른 원자 사이의 인력으로, 분자 간 또는 분자 내에서 형성되는 화학 결합이며, 물의 특이한 성질, DNA 구조, 단백질 접힘 등 다양한 현상에 중요한 역할을 한다. - 재료과학 - 전자 이동도
전자 이동도는 전기장 내에서 전자의 평균 이동 속도를 나타내는 물리량으로, 재료의 불순물 농도와 온도에 의존하며, 다양한 산란 메커니즘과 측정 방법을 통해 연구되고 반도체 소자 성능에 중요한 영향을 미친다. - 재료과학 - 이온 주입
이온 주입은 원하는 원소를 이온화하여 고체 표면에 주입하는 기술로, 반도체 도핑, 금속 표면 처리 등 다양한 분야에 활용되며, 결정학적 손상, 스퍼터링, 안전 문제 등의 문제점을 야기한다.
| 흑연 층간 물질 | |
|---|---|
| 개요 | |
 | |
 | |
| 화학식 | (guest)Cₙ |
| 다른 이름 | 흑연 삽입 화합물 |
| 정의 | |
| 설명 | 흑연 층간 화합물(GIC)은 화학식 (guest)Cₙ을 갖는 화합물로, 흑연과 삽입된 화학종으로 구성되어 있다. |
| 특징 | GIC는 전하-이동 화합물로, 흑연과 게스트 분자 사이에 전하가 이동한다. 이로 인해 흑연의 전기적 특성이 변화되어 때로는 초전도체가 되기도 한다. |
| 예시 | 알칼리 금속 GIC (예: KC₈) 할로겐 GIC (예: CxF) 금속 염화물 GIC (예: FeCl₃-GIC) |
| 유형 | |
| 수용 화합물 (Acceptor compounds) | 흑연과 전자를 제거하는 화학종 (예: 산화제) 사이의 화합물 |
| 공여 화합물 (Donor compounds) | 흑연에 전자를 공여하는 화학종 (예: 환원제) 사이의 화합물 |
| 예시 | 알칼리 금속 (Li, K, Rb, Cs) 알칼리 토금속 (Ca, Sr, Ba, Eu, Yb) 란타넘족 원소 (La, Ce, Pr, Nd, Sm) |
| 기타 | NH₃, N₂H₄ 금속 할로겐화물 (AlCl₃, FeCl₃, GaCl₃, InCl₃, AsF₅, SbCl₅, SbF₅, UCl₅) 옥사이드 (CrO₃, MoO₃, WO₃, V₂O₅) 플루오라이드 (MoF₆, WF₆) 황산, 질산, 과염소산 브롬, 아이오딘 유기산 (아세트산, 트리플루오로아세트산) 유기 분자 (퀴논, 테트라시아노에틸렌) |
| 특성 | |
| 전기 전도도 | GIC는 흑연보다 높은 전기 전도도를 가진다. 구리, 은과 비슷한 수준의 전도도를 보이기도 한다. |
| 초전도성 | 특정 GIC는 낮은 온도에서 초전도성을 나타낸다. 예: CaC₆ (Tc = 11.5 K) |
| 자기적 특성 | GIC의 자기적 특성은 삽입된 화학종에 따라 다양하게 변한다. |
| 구조적 특성 | 삽입에 의해 흑연 층간 거리가 증가한다. |
| 활용 | |
| 촉매 | GIC는 다양한 화학 반응의 촉매로 사용될 수 있다. |
| 에너지 저장 | GIC는 리튬 이온 배터리의 음극 재료로 사용될 수 있다. |
| 전자 장치 | GIC는 고성능 전자 장치에 사용될 수 있다. |
| 안전성 | |
| 주의사항 | GIC는 반응성이 높을 수 있으며, 취급 시 주의가 필요하다. |
2. 역사
흑연 층간 물질은 1861년 P. Schaffautl에 의해 처음 합성되었으나[15], 체계적인 연구는 1930년대에 들어서야 시작되었다. 초기 연구를 통해 다양한 분자나 원자를 흑연 층 사이에 끼워 넣을 수 있으며, 삽입된 물질의 종류에 따라 전기 전도성이 달라진다는 사실이 밝혀졌다. 예를 들어, 금속 원자를 넣으면 자유 전자가 늘어나 평면 방향 전기 전도도가 증가하는 반면, 플루오린화물이나 산화물을 넣으면 전자가 이들 원소 쪽으로 이동하여 전기 전도도가 감소하는 경향을 보였다.
흑연 층간 물질 연구에서 중요한 발견은 1965년 알칼리 금속을 삽입한 물질에서 초전도 현상이 처음으로 관찰된 것이다.[16] 이는 순수한 흑연에서는 나타나지 않는 특성으로 주목받았다. 이후 2005년에는 영국의 연구진들이 이터븀(Yb)이나 칼슘(Ca)을 삽입한 물질에서 상대적으로 높은 온도에서 초전도 현상이 나타남을 발견하면서[19], 이 분야의 연구가 더욱 활발해지는 계기가 되었다.
2. 1. 초전도 현상 발견
1965년에 처음으로 알칼리 금속(칼륨(K), 루비듐(Rb), 세슘(Cs))을 넣은 흑연 층간 물질에서 초전도 현상이 발견되었다. 이 화합물의 화학식은 C8A (A=K, Rb, Cs)였으며, 초전도성 임계 온도는 모두 1,000 이하로 매우 낮았다.[16] 이후 연구자들은 큰 압력을 가해 금속의 농도를 더 높인 물질들(C6K, C8K, C4Na, C2Na)을 합성했으며, 이 중 C2Na는 임계 온도가 5,000으로 당시 가장 높게 나타났다.[17]흑연 층간 물질에서의 초전도 현상이 주목받은 이유는 순수한 흑연 자체에서는 초전도 현상이 전혀 나타나지 않기 때문이다. 또한, 2001년에 발견된 이붕화 마그네슘(MgB2)의 초전도 현상과 유사한 측면이 있어 학계의 관심을 끌었다.[18]
2005년 10월, 영국의 런던 대학교(University College London)와 케임브리지 대학교(University of Cambridge) 등의 공동 연구팀은 이터븀(Yb)과 칼슘(Ca)을 층간 물질로 사용한 흑연 층간 물질에서 각각 6,500과 11,500의 임계 온도에서 초전도 현상이 나타나는 것을 발견하여 네이처 피직스에 발표했다.[19] 특히 칼슘(Ca)을 사용했을 때 상대적으로 높은 임계 온도가 나타나는 원인에 대한 연구가 활발히 진행되었다. 후속 연구들은 칼슘(Ca)의 경우 전자-포논 상호작용(electron-phonon interaction)이 매우 강하게 나타나 임계 온도가 높게 나타나는 것으로 결론짓고 있다.
| 화학식 | 임계 온도 (Tc) | 발견 연도/특징 |
|---|---|---|
| C8K | < 1,000 | 1965년 발견[16] |
| C8Rb | < 1,000 | 1965년 발견[16] |
| C8Cs | < 1,000 | 1965년 발견[16] |
| C2Na | 5,000 | 고압 합성[17] |
| C6Yb | 6,500 | 2005년 발견[19] |
| C6Ca | 11,500 | 2005년 발견[19] |
흑연 층간 화합물은 흑연을 강한 산화제 또는 강한 환원제로 처리하여 제조한다. 이 반응식은 일반적으로 다음과 같이 나타낼 수 있다.
흑연 층간 물질은 흑연의 탄소 원자 층 사이에 다양한 종류의 원자, 이온, 또는 분자가 삽입되어 형성되는 화합물을 의미한다. 어떤 물질이 층 사이에 삽입되느냐에 따라 그 구조와 성질이 크게 달라지며, 삽입되는 물질의 종류에 따라 다음과 같이 분류할 수 있다.
3. 제조 및 구조
C + m X → CXm
이 반응은 가역적이다.
호스트인 흑연과 게스트인 X는 전하 이동을 통해 상호 작용한다. 이러한 원리는 상업적으로 널리 사용되는 리튬 이온 배터리의 기본적인 작동 과정과 유사하다.
흑연 층간 화합물에서는 모든 흑연 층 사이에 게스트 물질이 채워질 필요는 없다. '1단계 화합물'은 흑연 층과 삽입된 게스트 층이 번갈아 나타나는 구조를 가지며, '2단계 화합물'은 게스트 물질이 없는 두 개의 흑연 층 사이에 삽입된 게스트 층이 번갈아 나타나는 구조를 가진다. 실제 화합물의 조성은 다양하게 나타날 수 있으며, 이는 흑연 층간 화합물이 비화학 양론적 화합물의 한 예임을 보여준다. 따라서 화합물을 표기할 때는 단계와 함께 조성을 명시하는 것이 일반적이다. 게스트 이온이 흑연 층 사이로 삽입되면 층 간의 간격이 벌어지게 된다.
4. 종류
각 종류의 흑연 층간 물질은 삽입된 화학종의 특성과 흑연과의 상호작용 방식에 따라 고유한 구조와 물리적, 화학적 성질을 나타낸다.
4. 1. 알칼리 및 알칼리 토금속 유도체

가장 잘 연구된 흑연 층간 화합물 중 하나인 KC8은 흑연 분말 위에 칼륨을 녹여서 만든다. 칼륨이 흑연에 흡수되면 물질의 색깔이 검은색에서 청동색으로 변한다.[3] 이렇게 만들어진 고체는 자연 발화성을 띤다.[9] 이 화합물의 조성은 칼륨 원자 간 거리가 탄소 골격의 육각형 사이 거리의 두 배라고 가정하여 설명할 수 있다. 음이온성 흑연 층과 칼륨 양이온 사이의 결합은 이온 결합이다. 이 물질의 전기 전도성은 일반적인 흑연(α-흑연)보다 높다.[9][4] KC8은 임계 온도(Tc)가 0.14 K인 초전도체이기도 하다.[5] KC8을 가열하면 칼륨 원자가 빠져나가면서 다음과 같은 일련의 분해 생성물이 순차적으로 형성된다:
:3 KC8 → KC24 + 2 K
분해 과정에서 중간체인 KC24(파란색),[3] KC36, KC48을 거쳐 최종적으로 KC60 화합물이 생성된다.
화학량론 MC8 (M은 금속 원소) 형태는 M = 칼륨(K), 루비듐(Rb), 세슘(Cs)일 때 관찰된다. 더 작은 이온인 M = Li+, Sr2+, Ba2+, Eu2+, Yb3+, Ca2+의 경우에는 MC6 형태가 한계 화학량론이다.[5] 칼슘 흑연 CaC6은 350°C에서 10일 동안 액체 리튬-칼슘(Li-Ca) 합금에 고도로 배향된 열분해 흑연을 담가서 얻는다. CaC6의 결정 구조는 R<0xC3><0xAF>m 공간군에 속한다. 칼슘(Ca)이 층간에 삽입되면 흑연 층간 거리는 3.35 Å에서 4.524 Å로 증가하고, 탄소-탄소 거리는 1.42 Å에서 1.444 Å로 증가한다.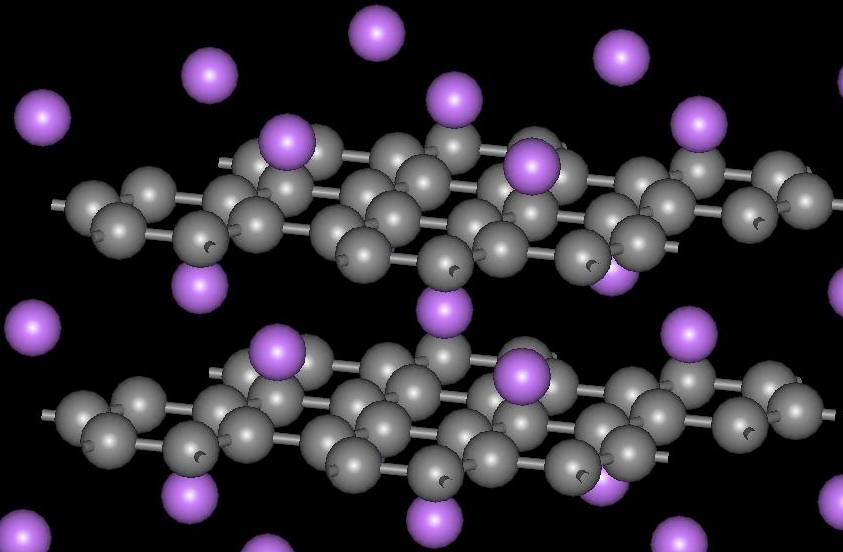
바륨(Ba)과 암모니아(NH3)를 사용하면 양이온이 용매화되어 Ba(NH3)2.5C10.9 (1단계)와 같은 화학량론을 나타낸다. 세슘(Cs), 수소(H), 칼륨(K)을 함께 사용하는 경우에는 CsC8·K2H4/3C8 (1단계) 형태가 된다.
저에너지 전자 현미경을 사용하여 독립적으로 서 있는 그래핀에 알칼리 금속인 K, Cs, Li이 흡착되는 과정과 이중층 그래핀 사이에 층간 삽입되는 현상이 관찰되었다.[6]
다른 알칼리 금속과 달리, 나트륨(Na)은 흑연 층간 삽입이 매우 적게 일어난다. 양자 역학 계산에 따르면 이는 일반적인 현상으로, 알칼리 금속 및 알칼리 토금속 중에서 Na와 마그네슘(Mg)은 주기율표의 같은 족에 있는 다른 원소들에 비해 특정 기질과의 화학적 결합이 일반적으로 가장 약하기 때문이다.[7] 이 현상은 주기율표의 열(column)을 따라 나타나는 이온화 에너지와 이온-기질 결합 경향 사이의 경쟁에서 비롯된다.[7] 그러나 나트륨 이온이 공-층간 삽입(co-intercalation) 과정을 통해 용매 껍질에 둘러싸이면 흑연에 상당한 양의 Na 층간 삽입이 일어날 수 있다. 복합 마그네슘(I) 종 또한 흑연에 층간 삽입된 사례가 있다.[8]
4. 2. 산화 흑연 유도체
흑연 바이설페이트와 흑연 과염소산염은 강산 존재 하에서 흑연을 강한 산화제로 처리하여 제조할 수 있다. 칼륨 및 칼슘 흑연과 달리 이 과정에서는 탄소 층이 산화된다.
화학 반응식 예시는 다음과 같다:
:
흑연 과염소산염의 경우, 탄소 원자의 평면 층은 794pm 간격으로 이온에 의해 분리되어 있다. 흑연 과염소산염의 음극 환원은 의 가열 과정과 유사하게 진행되며, 이 과정에서 가 순차적으로 제거된다.
흑연 바이설페이트와 흑연 과염소산염은 양공 메커니즘을 통해 흑연보다 더 높은 전기 전도도를 나타낸다.[9] 또한, 흑연과 의 반응을 통해 염을 생성할 수도 있다.[9]
4. 3. 금속 할로겐화물 유도체
여러 금속 할로겐화물이 흑연에 삽입된다. 염화물 유도체가 가장 광범위하게 연구되었다. 예시로는 MCl2 (M = Zn, Ni, Cu, Mn), MCl3 (M = Al, Fe, Ga), MCl4 (M = Zr, Pt) 등이 있다.[1] 이 물질은 탄소 시트 사이에 조밀하게 쌓인 금속 할로겐화물 층으로 구성된다. C~8FeCl3 유도체는 스핀 유리 거동을 보인다.[10] 이는 상 전이를 연구하기에 특히 좋은 시스템임이 입증되었다. n단계 자성 흑연 삽입 화합물은 연속적인 자성 층을 분리하는 n개의 흑연 층을 갖는다. 단계 수가 증가함에 따라 연속적인 자성 층 내 스핀 간의 상호 작용이 약해지고 2차원 자기적 거동이 나타날 수 있다.
4. 4. 할로겐 및 산화 흑연 화합물
염소와 브롬은 가역적으로 흑연에 삽입되지만, 요오드는 삽입되지 않는다. 반면, 플루오린은 흑연과 비가역적으로 반응한다. 브롬의 경우, C''n''Br 형태의 다양한 화학 양론이 알려져 있으며, 여기서 ''n''은 8, 12, 14, 16, 20, 28이다.
플루오린화 탄소는 비가역적으로 생성되기 때문에 종종 삽입 화합물로 분류되지 않기도 한다. 화학식은 (CF)''x''이다. 이 물질은 215°C에서 230°C 사이의 온도에서 기체 플루오린과 흑연 탄소를 반응시켜 제조하며, 색상은 회색, 흰색 또는 노란색을 띤다. 탄소와 플루오린 원자 사이의 결합은 공유 결합이다. 테트라플루오린화 탄소(C4F)는 흑연을 플루오린과 플루오르화 수소의 혼합물로 실온에서 처리하여 제조하며, 검푸른 색을 띤다. 플루오린화 탄소는 전도성이 없으며, 일차(비재충전식) 리튬 배터리의 음극 재료로 연구되었다.
산화 흑연은 불안정한 노란색 고체이다.
5. 성질 및 응용
흑연 층간 화합물은 다양한 전자적 및 전기적 특성으로 인해 수년 동안 재료 과학자들의 관심을 받아왔다.
5. 1. 초전도성
1965년 알칼리 금속(칼륨(K), 루비듐(Rb), 세슘(Cs))을 층간 물질로 사용한 흑연 층간 화합물(GIC)에서 처음으로 초전도 현상이 발견되었다. 이 화합물들의 화학식은 C8A(A=K, Rb, Cs)이며, 초전도성 임계 온도(''T''c)는 모두 1,000 이하로 매우 낮았다.[16] 이후 더 높은 압력을 가해 금속 농도를 증가시킨 물질들(C6K, C8K, C4Na, C2Na)이 합성되었고, 특히 C2Na는 임계 온도가 5,000으로 당시로서는 가장 높은 값을 보였다.[17]흑연 층간 물질의 초전도 현상이 주목받는 이유는 순수한 흑연에서는 초전도 현상이 전혀 나타나지 않기 때문이다. 또한 2001년에 발견된 이붕화 마그네슘(MgB2)의 초전도 현상과 유사한 측면이 있어 학계의 관심을 끌었다.[18]
2005년 10월, 영국 런던 대학교(University College London)와 케임브리지 대학교(University of Cambridge) 등의 공동 연구팀은 이터븀(Yb)과 칼슘(Ca)을 층간 물질로 사용한 흑연 층간 화합물에서 각각 임계 온도 6,500(YbC6)과 11,500(CaC6)에서 초전도 현상이 나타나는 것을 발견하여 학술지 ''Nature Physics''에 발표했다.[19] 특히 칼슘(Ca)을 사용한 CaC6의 상대적으로 높은 임계 온도는 많은 후속 연구를 촉발했다.
연구 결과, CaC6의 높은 임계 온도는 칼슘(Ca) 원자와 흑연 층 사이의 강한 전자-포논 상호작용(electron-phonon interaction) 때문인 것으로 밝혀졌다. 초전도 현상은 온도 변화에 따른 전기 저항과 자기 모멘트 측정을 통해 확인할 수 있다. CaC6는 온도가 낮아짐에 따라 전기 저항이 감소하다가, 임계 온도인 11,500에서 갑자기 0.8 μΩ·cm에서 0 μΩ·cm으로 급격하게 떨어진다.[20] 이는 초전도체의 특징적인 현상으로, 일반적인 금속이 절대 영도에 가까워져도 약간의 저항을 가지는 것과 구분된다.
또한 초전도체는 임계 온도 이하에서 외부 자기장을 밀어내어 내부 자기장을 0으로 만드는 마이스너 효과(Meissner effect)를 나타내며 반자성을 띤다. CaC6 역시 11,500 이하에서 자기 모멘트가 음수 값을 가지며 반자성을 보인다.
BCS 이론은 저온 초전도 현상을 성공적으로 설명했지만, 11,500의 비교적 높은 임계 온도를 가진 CaC6를 완전히 설명하기에는 한계가 있다. 대신, BCS 이론을 확장한 강한 전자-포논 상호작용(strong electron-phonon interaction) 이론을 통해 설명할 수 있다. 이 상호작용의 상대적인 크기()는 전자의 에너지 밴드 구조와 포논의 분산 관계에 따라 결정되며, 엘리아쉬 스펙트럴 함수(Eliashberg Spectral Function), 를 통해 계산된다.
:
CaC6의 경우, 칼슘(Ca) 원자의 평면 방향 진동(포논)과 탄소(C) 원자의 수직 방향 진동이 전자와의 상호작용에 크게 기여하여 높은 임계 온도를 나타내는 것으로 여겨진다.
CaC6는 초전도 흑연 층간 화합물 중에서 가장 높은 임계 온도인 ''T''c = 11,500를 나타낸다. 더 나아가 압력을 가하면 임계 온도가 15,100 (8 GPa에서)까지 더욱 증가하는 것이 확인되었다.[5] 이 화합물의 초전도 현상은 페르미 준위보다 약 2 eV 위에 위치하는 '층간 상태(interlayer state)'라고 불리는 전자 상태와 밀접한 관련이 있는 것으로 생각된다. 이 층간 상태에 전자가 채워질 때 비로소 초전도 현상이 나타나는 것으로 보인다.[11] 고품질의 순수한 CaC6 시료를 이용한 각도 분해 광전자 분광법(ARPES) 측정 결과, 초전도 상태에서 π* 밴드에 에너지 갭이 열리는 것이 관측되었으며, 이는 π* 밴드와 층간 상태 밴드 사이의 상호작용이 전체 전자-음향(포논) 결합 강도에 상당히 기여한다는 것을 실험적으로 보여준다.[11]
5. 2. 화학 합성 시약
청동색을 띠는 물질인 KC8은 알려진 가장 강력한 환원제 중 하나이다. 또한 중합 반응의 촉매로, 그리고 아릴 할라이드를 바이페닐로 만드는 커플링 시약으로 사용되어 왔다.[12] 한 연구에서는, 신선하게 제조된 KC8을 1-아이오도도데칸으로 처리하여 클로로포름에 용해되는 변형(긴 사슬 모양의 알킬기가 바깥으로 돌출되어 용해성을 부여하는 마이크로미터 크기의 탄소 판)을 만들었다.[12]또 다른 칼륨 흑연 화합물인 KC24는 중성자 단색화 장치(neutron monochromatoreng)로 사용되었다. 칼륨 흑연의 새로운 필수적인 응용 분야는 칼륨 이온 배터리의 발명으로 도입되었다. 리튬 이온 배터리처럼, 칼륨 이온 배터리는 금속 양극 대신 탄소 기반 음극을 사용해야 한다. 이러한 배터리에서 칼륨 흑연의 안정적인 구조는 중요한 장점이다.
5. 3. 기타 응용
청동색을 띠는 물질인 KC8은 알려진 가장 강력한 환원제 중 하나이다. 또한 중합 반응의 촉매로, 그리고 아릴 할라이드를 바이페닐로 만드는 커플링 반응 시약으로 사용되어 왔다.[12] 한 연구에서는, 신선하게 제조된 KC8을 1-아이오도도데칸으로 처리하여 클로로포름에 용해되는 변형(긴 알킬 사슬이 밖으로 돌출되어 용해성을 제공하는 마이크로미터 규모의 탄소 판상 구조)을 만들었다.[12]또 다른 칼륨 흑연 화합물인 KC24는 중성자 단색화 장치로 사용되었다. 칼륨 흑연의 새로운 필수적인 응용 분야는 칼륨 이온 배터리의 발명으로 도입되었다. 리튬 이온 배터리처럼, 칼륨 이온 배터리는 금속 양극 대신 탄소 기반 음극을 사용해야 한다. 이러한 상황에서 칼륨 흑연의 안정적인 구조는 중요한 이점이다.
참조
[1]
서적
Chemistry of the Elements
Butterworth-Heinemann
[2]
간행물
Nomenclature and terminology of graphite intercalation compounds
http://www.iupac.org[...]
[3]
간행물
Potassium graphites prepared by mixed-reaction technique
[4]
웹사이트
NIST Ionizing Radiation Division 2001 – Major Technical Highlights
https://web.archive.[...]
[5]
간행물
Review: Synthesis and superconducting properties of CaC6
[6]
간행물
Metal Adsorption and Nucleation on Free-Standing Graphene by Low-Energy Electron Point Source Microscopy
American Chemical Society (ACS)
2018-05-07
[7]
간행물
Origin of low sodium capacity in graphite and generally weak substrate binding of Na and Mg among alkali and alkaline earth metals
2016-04-05
[8]
간행물
Graphite Intercalation by Mg Diamine Complexes
American Chemical Society (ACS)
2018-06-25
[9]
서적
Inorganic Chemistry, 3rd Edition
Pearson
[10]
간행물
Observation of spin glass state in FeCl3: intercalated graphite
[11]
간행물
The role of the interlayer state in the electronic structure of superconducting graphite intercalated compounds
[12]
간행물
Functionalization of Potassium Graphite
[13]
문서
Intercalation compounds of graphite
[14]
문서
Nomenclature and terminology of graphite intercalation compounds
http://www.iupac.org[...]
[15]
문서
[16]
문서
Superconductivity in Graphitic Compounds
http://prola.aps.org[...]
[17]
문서
[18]
문서
Superconductivity at 39 K in magnesium diboride
http://www.nature.co[...]
[19]
문서
superconductivity in the intercalated graphite compounds C6Yb and C6Ca
http://www.nature.co[...]
[20]
문서
Specific Heat of the Ca-Intercalated Graphite Superconductor CaC6
http://scitation.aip[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com