갈륨
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
갈륨(Ga)은 은백색의 금속 원소로, 원자 번호 31번이며, 상온에서 고체이지만 녹는점이 낮아 손으로도 녹일 수 있다. 드미트리 멘델레예프는 주기율표를 통해 갈륨의 존재를 예측했으며, 1875년 프랑스 화학자 폴-에밀 르코크 드 부아보드랑에 의해 섬아연석에서 발견되었다. 갈륨은 반도체, 합금, 의료 분야 등 다양한 분야에서 활용되며, 특히 반도체 산업에서 비소갈륨(GaAs)과 질화갈륨(GaN) 형태로 널리 사용된다. 또한, 플루토늄 합금, 저융점 합금, 중성미자 검출, 액체 금속 이온원 등에도 사용되며, 의료 분야에서는 항암 치료 및 진단용 방사성 의약품으로 활용되기도 한다.
더 읽어볼만한 페이지
- 갈륨 - 갈륨 동위 원소
갈륨 동위 원소는 원자 번호 31번 갈륨의 다양한 핵종을 지칭하며 자연 상태에서는 69Ga와 71Ga 두 가지 안정 동위 원소로 존재하고, 갈륨-67, 68은 의료 영상 기술인 갈륨 스캔에 활용되는 방사성 동위 원소도 존재한다. - 전이후 금속 - 인듐
인듐은 은백색의 무른 금속 원소로, 낮은 경도와 뛰어난 전연성을 가지며, LCD 투명 전극, 반도체, 태양전지 등 다양한 산업 분야에서 사용되는 아연 광석의 부산물이다. - 전이후 금속 - 알루미늄
알루미늄은 은백색의 가볍고 가공성이 뛰어난 금속으로, 열 및 전기 전도성이 우수하여 다양한 산업 분야에서 합금 형태로 널리 사용되며, 보크사이트에서 추출되어 재활용 또한 활발히 이루어진다. - 장소 이름이 포함된 화학 원소 - 루테튬
루테튬은 원소 기호 Lu, 원자 번호 71을 갖는 희토류 원소로, 란타넘족 중 밀도, 녹는점, 경도가 가장 높고, 주로 +3의 산화 상태를 가지며, 안정 동위원소와 방사성 동위원소 형태로 존재하고, 제한적인 상업적 용도에도 불구하고 촉매, LED, PET, 연대 측정, 암 치료 등에 사용된다. - 장소 이름이 포함된 화학 원소 - 레늄
레늄은 텅스텐과 탄소 다음으로 녹는점이 높고 끓는점이 가장 높은 은백색 금속 원소이며, 몰리브데넘 광석에서 주로 추출되어 제트 엔진, 촉매, 고옥탄가 휘발유 생산 등에 사용된다.
| 갈륨 | |
|---|---|
| 기본 정보 | |
 | |
| 원소 이름 | 갈륨 |
| 영어 이름 | Gallium |
| 일본어 이름 | ガリウム |
| 로마자 표기 | gallium |
| 원소 기호 | Ga |
| 원자 번호 | 31 |
| 분류 | 전이후 금속 |
| 족 | 13 |
| 주기 | 4 |
| 블록 | p |
| 표준 상태 | 고체 |
| 겉모습 | 은백색 |
| 발견자 | 폴 에밀 르코크 드 부아보드랑 |
| 발견 연도 | 1875년 |
| 명명 유래 | (라틴어: 프랑스), 발견자의 조국 |
| 예측 | 드미트리 멘델레예프 |
| 예측 연도 | 1871년 |
| 물리적 성질 | |
| 원자 질량 | 69.723 |
| 전자 배치 | [Ar] 3d10 4s2 4p1 |
| 껍질당 전자 수 | 2, 8, 18, 3 |
| 밀도 | 5.91 g/cm³ |
| 액체 밀도 | 6.095 g/cm³ |
| 녹는점 | 302.9146 K (29.7646 °C, 85.5763 °F) |
| 끓는점 | 2676 K (2403 °C, 4357 °F) |
| 삼중점 | 정보 없음 |
| 임계점 | 정보 없음 |
| 융해열 | 5.59 kJ/mol |
| 기화열 | 254 kJ/mol |
| 열용량 | 25.86 J/(mol·K) |
| 증기압 | 1310 Pa (1310 K) 1448 Pa (1448 K) 1620 Pa (1620 K) 1838 Pa (1838 K) 2125 Pa (2125 K) 2518 Pa (2518 K) |
| 결정 구조 | 사방정계 |
| 산화 상태 | 3, 2, 1 (양쪽성 산화물) |
| 전기 음성도 | 1.81 |
| 이온화 에너지 | 1차: 578.8 kJ/mol 2차: 1979.3 kJ/mol 3차: 2963 kJ/mol |
| 원자 반지름 | 135 pm |
| 공유 반지름 | 122 ± 3 pm |
| 반데르발스 반지름 | 187 pm |
| 자기 정렬 | 반자성 |
| 전기 저항 | 270 nΩ·m |
| 열전도율 | 40.6 W/(m·K) |
| 열팽창 | 20.5 × 10⁻⁶/K (20 °C) |
| 막대 음속 | 2740 m/s (20 °C) |
| 영률 | 9.8 GPa |
| 푸아송 비 | 0.47 |
| 모스 경도 | 1.5 |
| 브리넬 경도 | 60 |
| 기타 정보 | |
| CAS 등록 번호 | 7440-55-3 |
| 동위 원소 | |
| 안정 동위 원소 | 질량수: 69, 존재비: 60.11 %, 중성자 수: 38 질량수: 71, 존재비: 39.89 %, 중성자 수: 40 |
2. 역사
갈륨은 1875년 프랑스 화학자 폴-에밀 르코크 드 부아보드랑(Paul-Émile Lecoq de Boisbaudran)이 섬아연석 샘플에서 특징적인 스펙트럼(두 개의 보라색 선)을 사용하여 분광법을 통해 발견했다.[38] 그해 후반, 르코크는 수산화칼륨 용액에서 수산화물의 전기분해를 통해 자유 금속을 얻었다.[39]
갈륨의 명명에는 두 가지 설이 있다. 하나는 발견자인 보아보드랑이 이 새로운 원소를 그의 모국 프랑스의 라틴어 명칭인 "갈리아 (Gallia)"를 따서 갈륨으로 명명했다는 설이고, 다른 하나는 보아보드랑의 미들네임인 "Lecoq"와 관련지어 프랑스어로 수탉을 의미하는 "le coq"의 라틴어인 ''gallus''에서 유래했다는 설이다(후자는 1877년 본인에 의해 부정되었다).[109]
1871년 드미트리 멘델레예프는 주기율표를 발표하면서, "에카-알루미늄(eka-alminium)"으로 예측한 원소의 원자량과 비중 등을 예측했다.[110] 처음에 드 부아보드랑은 갈륨의 밀도를 4.7 g/cm3로 결정했는데, 이는 멘델레예프의 예측과 일치하지 않은 유일한 특성이었다. 멘델레예프는 그에게 편지를 써서 밀도를 재측정할 것을 제안했고, 드 부아보드랑은 멘델레예프가 정확하게 예측했던 5.9 g/cm3의 올바른 값을 얻었다.[9]
1875년 발견 이후 반도체 시대까지 갈륨의 주요 용도는 고온 온도 측정과 특이한 안정성 또는 용융 용이성을 가진 금속 합금(일부는 상온에서 액체 상태임)이었다.
2. 1. 멘델레예프의 예측
멘델레예프는 당시 알려진 63개 원소의 주기율을 발견하고 그 연관성을 주기율표로 정리하면서, 빈칸에 들어갈 원자량과 성질을 예측하였다. 그는 이 원소가 주기율표에서 알루미늄 아래에 있다고 하여 에카-알루미늄(eka-aluminum)이라 불렀다. 6년 뒤인 1875년에 에카-알루미늄이 발견되었는데, 이 원소가 갈륨이다.[37]1871년, 러시아 화학자 드미트리 멘델레예프는 주기율표 상의 위치를 바탕으로 갈륨의 존재를 최초로 예측하고, "에카-알루미늄"이라고 명명했다. 그는 또한 에카-알루미늄의 밀도, 녹는점, 산화물 특성, 염화물 결합과 같이 실제 갈륨의 특성과 매우 유사한 몇 가지 특성을 예측했다.[9]
| 특성 | 멘델레예프의 예측 | 실제 특성 |
|---|---|---|
| 원자량 | ~68 | 69.723 |
| 밀도 | 5.9 g/cm3 | 5.904 g/cm3 |
| 녹는점 | 낮음 | 29.767 °C |
| 산화물 화학식 | M2O3 | Ga2O3 |
| 산화물 밀도 | 5.5 g/cm3 | 5.88 g/cm3 |
| 수산화물의 성질 | 양쪽성 | 양쪽성 |
멘델레예프는 에카-알루미늄이 분광기를 통해 발견될 것이며, 금속 에카-알루미늄은 산과 알칼리 모두에 서서히 용해되고 공기와 반응하지 않을 것이라고 추가로 예측했다. 또한 M2O3가 산에 용해되어 MX3 염을 생성하고, 에카-알루미늄 염이 염기성 염을 형성하며, 에카-알루미늄 황산염이 명반을 형성하고, 무수 MCl3가 ZnCl2보다 더 큰 휘발성을 가질 것이라고 예측했다. 이러한 모든 예측은 사실로 밝혀졌다.[9]
1875년에 폴 보아보드랑이 피레네 산맥산 섬아연광을 분광법으로 분석했을 때, 특징적인 두 개의 보라색 광선으로서 발견했다.[111] 멘델레예프가 예측한 밀도의 이론값 5.9는 실측값인 5.94와 매우 일치하는 등, 예측된 많은 물성이 실측값과 매우 일치했다.[112] 이 "에카-알루미늄"의 예측 물성과 "갈륨"의 실측 물성의 근사는 당시 평가받지 못했던 멘델레예프의 주기율표가 주목받게 된 계기가 되었다.[113]
2. 2. 부아보드랑의 발견
드미트리 멘델레예프는 1871년에 주기율표 상의 위치를 바탕으로 갈륨의 존재를 예측하고, "에카-알루미늄"이라고 명명했다. 그는 에카-알루미늄의 밀도, 녹는점, 산화물 특성, 염화물 결합과 같이 실제 갈륨의 특성과 매우 유사한 몇 가지 특성을 예측했다.[37]| 특성 | 멘델레예프의 예측 | 실제 특성 |
|---|---|---|
| 원자량 | ~68 | 69.723 |
| 밀도 | 5.9 g/cm3 | 5.904 g/cm3 |
| 녹는점 | 낮음 | 29.767 °C |
| 산화물 화학식 | M2O3 | Ga2O3 |
| 산화물 밀도 | 5.5 g/cm3 | 5.88 g/cm3 |
| 수산화물의 성질 | 양쪽성 | 양쪽성 |
멘델레예프는 에카-알루미늄이 분광기를 통해 발견될 것이며, 금속 에카-알루미늄은 산과 알칼리 모두에 서서히 용해되고 공기와 반응하지 않을 것이라고 추가로 예측했다. 또한 M2O3가 산에 용해되어 MX3 염을 생성하고, 에카-알루미늄 염이 염기성 염을 형성하며, 에카-알루미늄 황산염이 명반을 형성하고, 무수 MCl3가 ZnCl2보다 더 큰 휘발성을 가질 것이라고 예측했는데, 이러한 모든 예측은 사실로 밝혀졌다.[9]
1875년 프랑스 화학자 폴-에밀 르코크 드 부아보드랑(Paul-Émile Lecoq de Boisbaudran)이 섬아연석 샘플에서 특징적인 스펙트럼(두 개의 보라색 선)을 사용하여 분광법을 통해 갈륨을 발견했다.[38] 그해 후반, 르코크는 수산화칼륨 용액에서 수산화물의 전기분해를 통해 자유 금속을 얻었다.[39]
그는 이 원소를 프랑스의 고향을 뜻하는 라틴어 Galliala에서 따서 "갈리아"(gallia)라고 명명했다. 나중에 19세기 과학자들이 즐겨 사용하던 다국어 말장난으로 자신의 이름을 따서 갈륨을 명명했다는 주장도 제기되었다. Le coq프랑스어는 프랑스어로 '수탉'을 의미하며, 수탉의 라틴어는 gallusla이다. 1877년 논문에서 르코크는 이 추측을 부인했다.[39]
처음에 드 부아보드랑은 갈륨의 밀도를 4.7 g/cm3로 결정했는데, 이는 멘델레예프의 예측과 일치하지 않은 유일한 특성이었다. 멘델레예프는 그에게 편지를 써서 밀도를 재측정할 것을 제안했고, 드 부아보드랑은 멘델레예프가 정확하게 예측했던 5.9 g/cm3의 올바른 값을 얻었다.[9]
2. 3. 반도체 시대와 갈륨
1960년대 비화갈륨이 직접 밴드갭 반도체로 개발되면서 갈륨 응용 분야에서 가장 중요한 단계가 시작되었다.[9] 1960년대 후반, 전자 산업은 발광 다이오드, 태양 전지 및 반도체를 제조하는 데 갈륨을 상업적으로 사용하기 시작했고, 금속 산업에서는 합금의 녹는점을 낮추는 데 사용했다.[40] [41]최초의 청색 질화갈륨 LED는 1971년~1973년에 개발되었지만, 성능이 미약했다.[42] 1990년대 초 나카무라 슈지가 GaN을 인듐 갈륨 질화물과 결합하여 현재 널리 사용되는 백색 LED의 기반이 되는 현대적인 청색 LED를 개발했고, 니치아가 1993년에 이를 상용화했다. 나카무라 슈지는 다른 두 명의 일본 과학자들과 함께 이 업적으로 2014년 노벨 물리학상을 수상했다.[43][44]
전 세계 갈륨 생산량은 1970년대 수십 톤/년에서 2010년경 100톤/년을 넘어서 급격히 증가했으며,[45] 2024년에는 약 450톤/년에 이르렀다.[46]
3. 성질
갈륨은 상온(20°C)에서 고체이지만, 녹는점이 약 29.7646°C로 낮아 사람의 체온으로도 녹일 수 있다. 순수한 갈륨은 은청색을 띠며, 유리처럼 조가비 모양으로 부서진다. 액체에서 고체로 변할 때 부피가 3.10% 증가하므로, 상태 변화 시 파손될 수 있는 용기에 보관할 때는 주의해야 한다. 갈륨은 물, 실리콘, 저마늄, 비스무트, 플루토늄과 같이 액체 상태의 밀도가 더 높은 몇 안 되는 물질 중 하나이다.[9]
갈륨은 대부분의 금속과 합금을 형성하며, 알루미늄, 알루미늄–아연 합금[10] 및 강철[11]과 같은 일부 금속의 균열이나 입계로 쉽게 확산되어 액체 금속 취성을 일으킨다.
갈륨의 녹는점은 지구 중위도의 평균 여름 낮 기온과 거의 같으며, 국제 도량형국(BIPM)이 설정한 1990년 국제 온도 눈금(ITS-90)의 공식 온도 기준점 중 하나이다.[12][13][14] 액체 갈륨은 과냉각되기 쉬워 씨앗 결정을 넣어주면 어는 것을 도울 수 있다. 갈륨은 세슘, 루비듐, 수은과 함께 실온 부근에서 액체인 4가지 비방사성 금속 중 하나이다. 반응성이 높은 루비듐이나 세슘, 독성이 강한 수은과 달리 갈륨은 비교적 안전하여 고온 온도계에 사용될 수 있다. 또한, 금속 중 액체 상태로 존재할 수 있는 온도 범위가 가장 넓고, 고온에서 증기압이 낮다는 특징이 있다.[9] 갈륨의 끓는점은 2676 K로, 녹는점보다 거의 9배 높아, 모든 원소 중 녹는점과 끓는점의 비율이 가장 크다.[9]
액체 갈륨은 유리와 피부는 물론, 석영, 흑연, 산화갈륨(III)[17], PTFE[9]를 제외한 대부분의 물질을 적신다. 따라서 수은보다 독성은 덜하지만, 다루기는 더 어렵다. 유리에 칠한 갈륨은 밝은 거울이 된다.[9]
갈륨은 단순한 결정 구조로 결정화되지 않으며, 일반적인 조건에서 안정한 상태는 단위 세포에 8개의 원자가 있는 사방정계이다. 각 원자는 244 pm 거리에 가장 가까운 이웃 원자 하나를 가지며, 나머지 6개의 이웃 원자는 27, 30, 39 pm 더 멀리 떨어져 쌍으로 묶여 있다.[18] 가장 가까운 두 원자 사이의 결합은 공유 결합이므로, Ga₂ 이합체가 결정의 기본 구성 요소로 간주된다. 이는 이웃 원소인 알루미늄, 인듐에 비해 녹는점이 낮은 이유를 설명한다. 이 구조는 요오드와 유사하며, 갈륨 원자의 4p 전자 상호작용으로 형성될 수 있다. 3d¹⁰ 전자는 바깥쪽 전자를 원자핵으로부터 잘 가리지 못하므로, 갈륨의 첫 번째 이온화 에너지는 알루미늄보다 크다.[9] Ga₂ 이합체는 액체 상태에서는 지속되지 않으며, 액체 갈륨은 복잡한 저배위 구조를 가진다.[20][21]
갈륨의 물리적 특성은 이방성이 매우 강하여, 세 가지 주요 결정축 ''a'', ''b'', ''c''에 따라 다른 값을 가진다. 특히 녹는점 근처에서 온도에 따라 특성이 크게 달라지는데, 예를 들어 열팽창 계수는 용융 시 수백 퍼센트 증가한다.[22]
상온, 상압에서 갈륨은 사방정계(비중 5.9)의 푸른빛을 띤 금속 광택을 가진 금속 결정이다. 끓는점은 2403℃로 매우 높다. 물처럼 액체 상태가 고체보다 부피가 작으며, 고체에서 액체로 변할 때 부피가 약 3.4% 감소한다. 고순도 금속 갈륨은 은색이며, 고체 금속의 단면은 유리와 비슷하다. 금속 갈륨은 매우 물러 모스 경도는 1.5이다. 액체에서 고체로 상전이할 때 부피가 3.2% 증가한다.
갈륨은 고체 상태에서는 반자성이지만, 액체 상태에서는 상자성이며, 40℃에서의 자화율은 χm = 2.4×10−6이다.
갈륨은 다른 금속의 격자로 확산되어 부식시키는데, 예를 들어 알루미늄-아연 합금이나 강철의 입계를 부식시켜 약하게 만든다. 또한, 다른 금속과 쉽게 합금을 형성한다.
갈륨은 상압에서 다양한 조건에 따라 α, β, γ, δ-갈륨의 네 가지 다형과, 고압에서 Ga-II, Ga-III, Ga-IV가 존재한다. α-갈륨은 단위 격자에 8개의 원자를 포함하는 사방정계이며, 가장 가까운 원자 간 거리는 244pm이고, 6개의 인접 원자와는 39pm 떨어져 있다. 이러한 낮은 대칭성은 갈륨의 낮은 융점의 원인으로 여겨진다.[123] 이량체 갈륨은 액체와 기체 상태에서도 검출된다.[124] 과냉각된 액체 갈륨은 결정화되면서 β-갈륨(-16.3℃ 이하, 단사정계), δ-갈륨(-19.4℃ 이하, 삼방정계), γ-갈륨(-35.6℃, 사방정계)을 형성할 수 있다.[125]
갈륨의 결정 다형, 다른 결정축에 대한 성질은 아래 표와 같다.
| 다형 | α-Ga[126] | β-Ga[127] | γ-Ga[128] | δ-Ga[129] | Ga-II[130] | Ga-III[130] | Ga-IV[131] |
|---|---|---|---|---|---|---|---|
| 구조 | 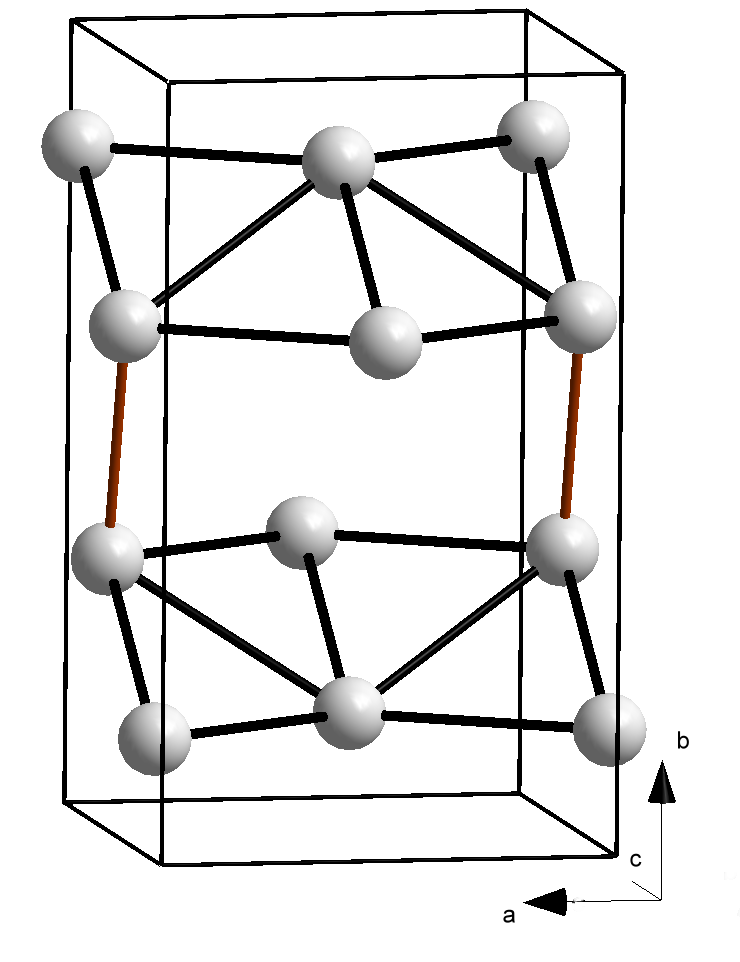 | 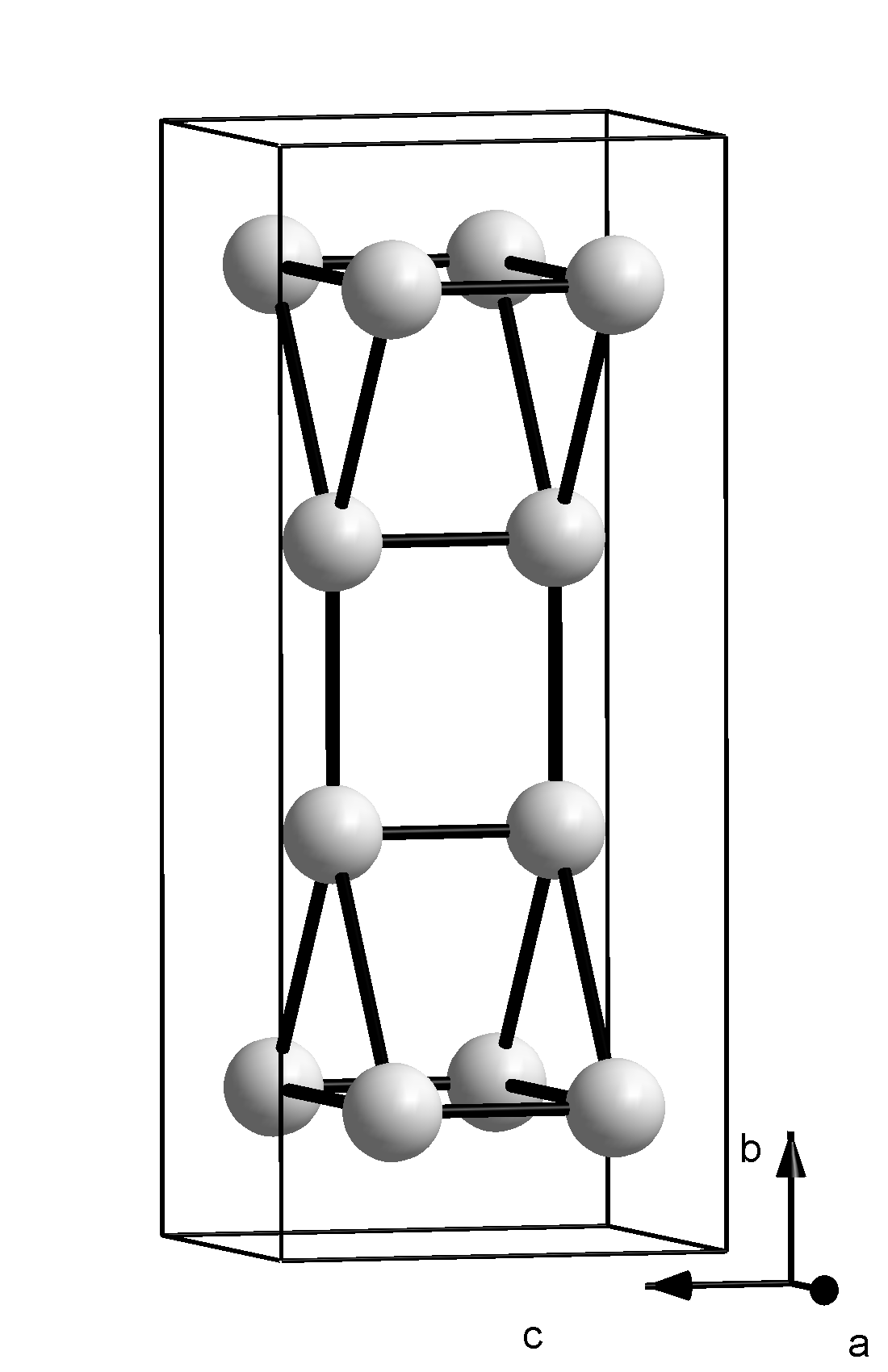 | 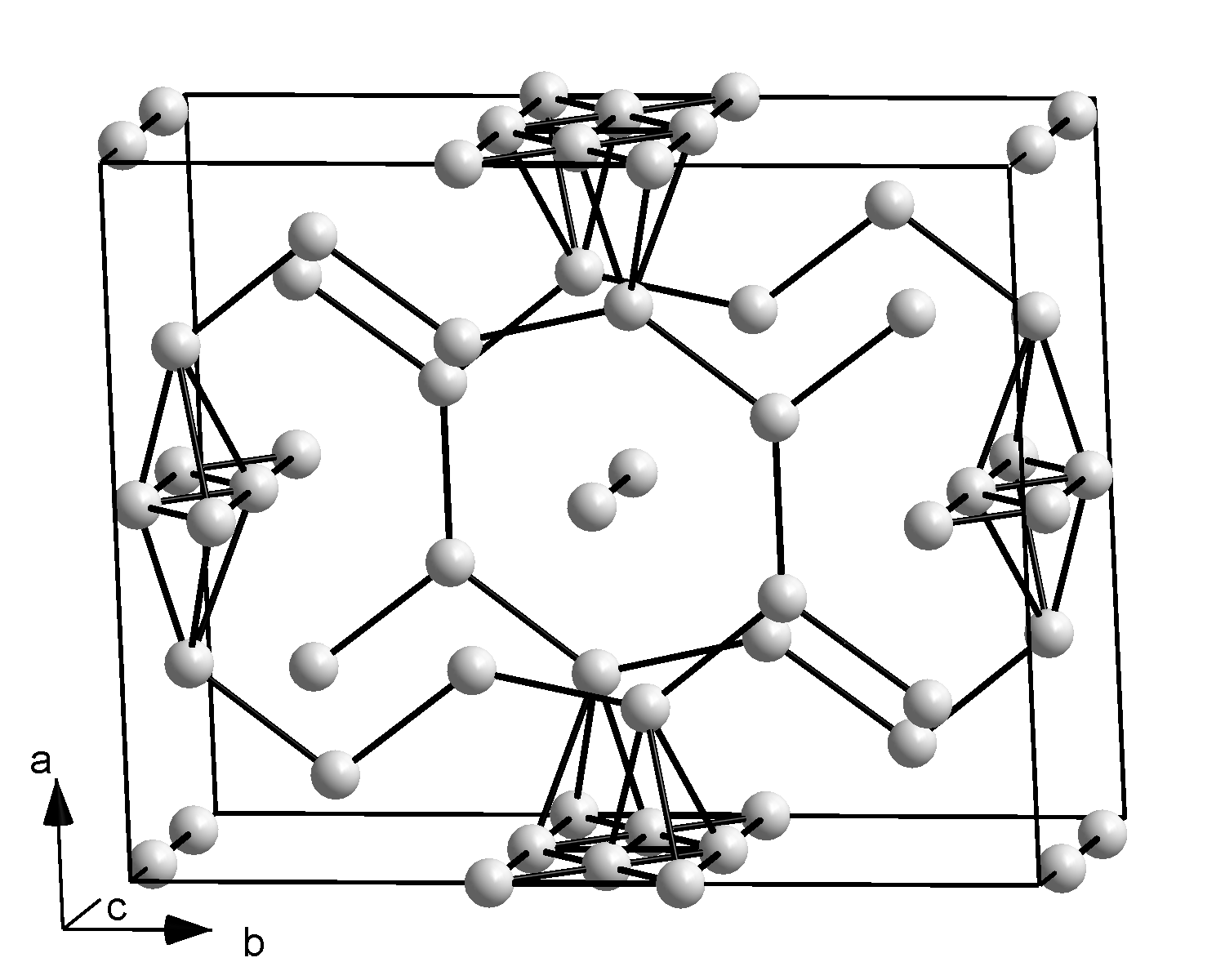 |  | 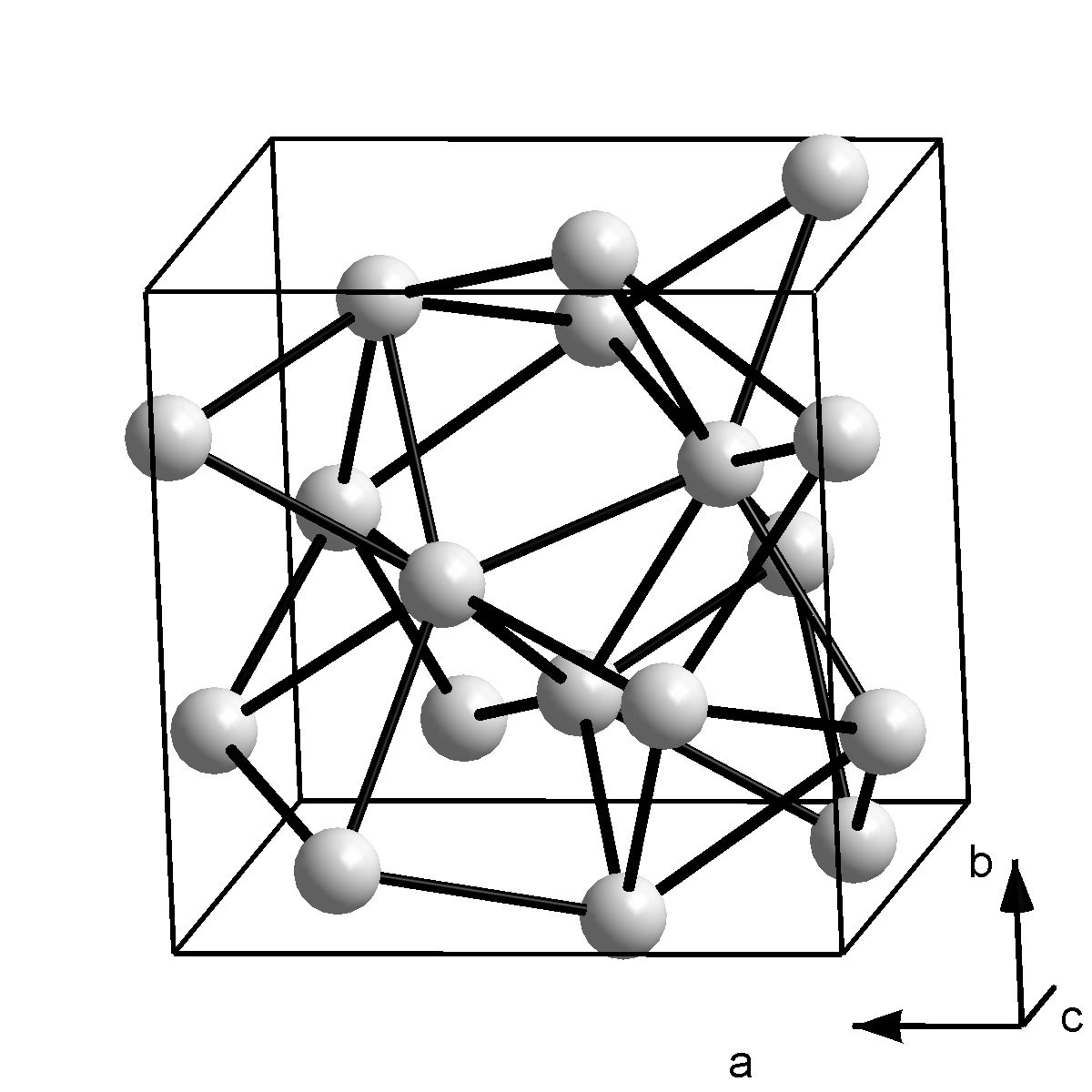 | 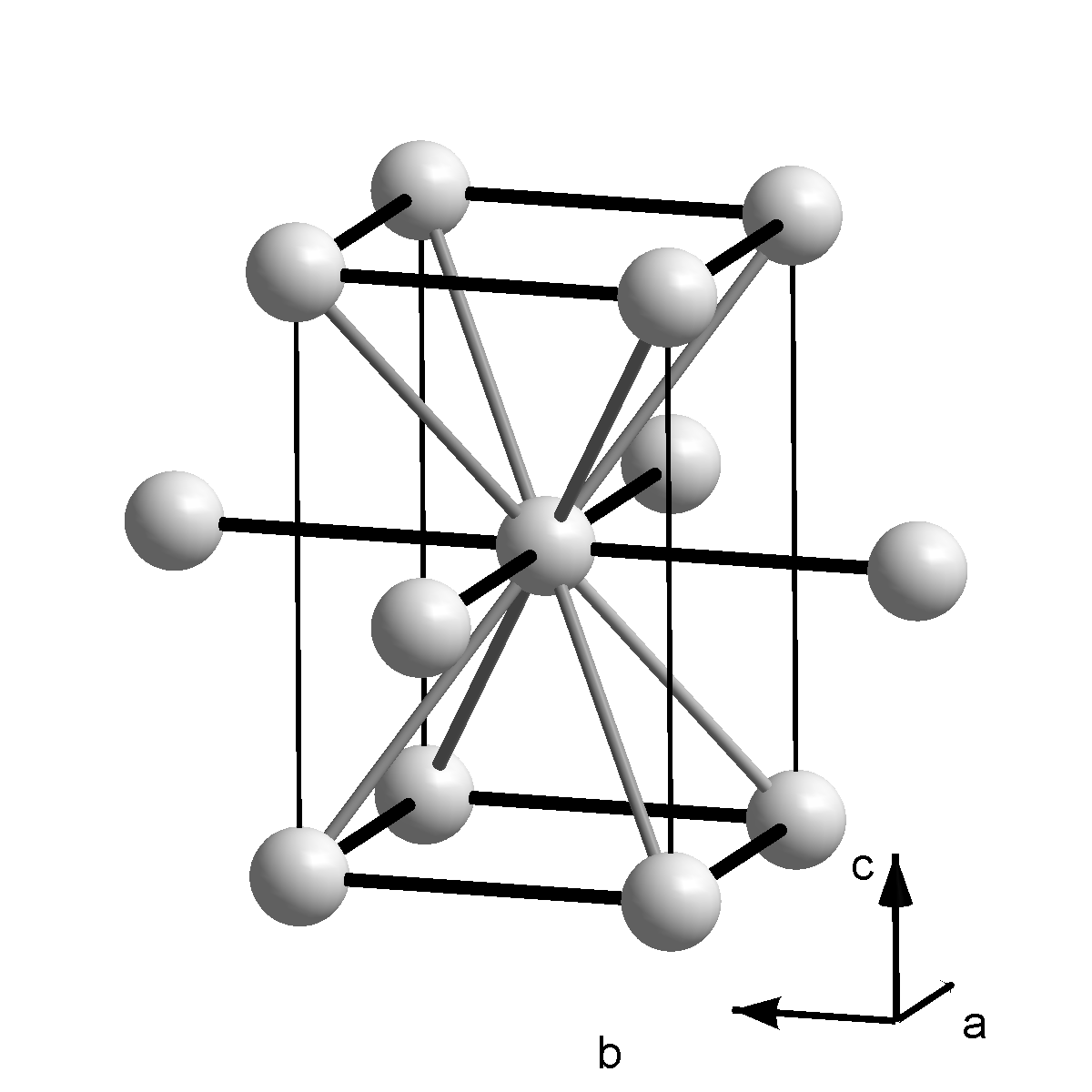 |  |
| 결정계 명칭 | 사방정계 | 단사정계 | 사방정계 | 삼방정계 | 입방정계 | 정방정계 | 입방정계 |
| 배위수 | 1+6 | 8 (2+2+2+2) | 3, 6–9 | 6–10 | 8 | 4+8 | 12 |
| 공간군 | Cmca | C2/c | Cmcm | I3d | I4/mmm | m | |
| 격자 상수 | a = 452.0 pm b = 766.3 pm c = 452.6 pm | a = 276.6 pm b = 805.3 pm c = 333.2 pm β = 92° | a = 1060 pm b = 1356 pm c = 519 pm | a = 907.8 pm c = 1702 pm | a = 459.51 pm | a = 280.13 pm c = 445.2 pm | a = 408 pm |
| 격자당 원자수 | 8 | 8 | 40 | 66 | 12 | 3 | 4 |
| 생성 방법 | 30 kbar 이상의 고압 조건 | 140 kbar 이상의 고압 조건 | 1200 kbar 이상의 고압 조건 |
| 성질 | a | b | c |
|---|---|---|---|
| α (~25 °C, μm/m) | 16 | 11 | 31 |
| ρ (29.7 °C, nΩ·m) | 543 | 174 | 81 |
| ρ (0 °C, nΩ·m) | 480 | 154 | 71.6 |
| ρ (77 K, nΩ·m) | 101 | 30.8 | 14.3 |
| ρ (4.2 K, pΩ·m) | 13.8 | 6.8 | 1.6 |
3. 1. 물리적 성질
갈륨은 상온(20°C)에서는 고체이지만, 녹는점이 약 29.7646°C (302.9146K)로[169][170][171] 사람의 체온에 의해 녹을 수 있다. 매우 순수한 갈륨은 은빛을 띤 파란색 금속이며, 유리처럼 조가비상으로 부서진다. 액체에서 고체로 변할 때 부피가 3.10% 증가하므로, 상태 변화 시 파손될 수 있는 용기에 보관할 때는 주의해야 한다. 갈륨은 물, 실리콘, 저마늄, 비스무트, 플루토늄을 포함한 소수의 다른 물질들과 함께 고밀도 액체 상태를 공유한다.[9]갈륨은 대부분의 금속과 합금을 형성하며, 알루미늄, 알루미늄–아연 합금[10] 및 강철[11]과 같은 일부 금속의 균열이나 입계로 쉽게 확산되어 액체 금속 취성을 일으킨다.
갈륨의 녹는점은 지구 중위도의 평균 여름철 낮 기온과 거의 같다. 이 녹는점은 국제 도량형국(BIPM)이 설정한 1990년 국제 온도 눈금(ITS-90)의 공식적인 온도 기준점 중 하나이다.[12][13][14] 액체 금속은 과냉각되는 경향이 강하며, 종자를 사용하면 결빙을 도울 수 있다. 갈륨은 실온 또는 그 근처에서 액체인 4가지 비방사성 금속(세슘, 루비듐, 수은) 중 하나이다. 갈륨은 고도로 반응성이 높은(루비듐과 세슘처럼) 것도 아니고 고도로 독성이 높은(수은처럼) 것도 아니므로, 금속-유리 고온 온도계에 사용될 수 있다. 또한 금속 중에서 가장 넓은 액체 범위를 가지고 있으며 (수은과 달리) 고온에서 낮은 증기압을 가지고 있다는 점에서도 주목할 만하다. 갈륨의 끓는점은 2676 K로, 절대 눈금에서 녹는점보다 거의 9배 높아 모든 원소 중에서 녹는점과 끓는점의 비율이 가장 크다.[9]
수은과 달리 액체 갈륨 금속은 유리와 피부, 그리고 대부분의 다른 물질(석영, 흑연, 산화갈륨(III)[17] 및 PTFE 제외)[9]을 적시기 때문에, 수은보다 상당히 독성이 낮고 훨씬 적은 예방 조치가 필요하지만 기계적으로 취급하기가 더 어렵다. 유리에 칠한 갈륨은 밝은 거울이 된다.[9]
갈륨은 간단한 결정 구조로 결정화되지 않는다. 일반적인 조건에서 안정적인 상은 종래의 단위 세포에 8개의 원자가 있는 사방정계이다. 단위 세포 내에서 각 원자는 가장 가까운 이웃 하나(244 pm 거리)만 가지고 있다. 나머지 6개의 단위 세포 이웃은 27, 30 및 39 pm 더 멀리 떨어져 있으며, 같은 거리로 쌍으로 그룹화되어 있다.[18]
가장 가까운 두 이웃 사이의 결합은 공유 결합이므로, Ga₂ 이합체는 결정의 기본 구성 요소로 간주된다. 이것은 이웃 원소인 알루미늄과 인듐에 비해 녹는점이 낮은 것을 설명한다. 이 구조는 요오드의 구조와 매우 유사하며, 갈륨 원자의 단일 4p 전자 사이의 상호 작용으로 인해 형성될 수 있다. 3d¹⁰ 전자는 바깥쪽 전자를 원자핵으로부터 잘 차폐하지 않으므로, 갈륨의 첫 번째 이온화 에너지는 알루미늄보다 크다.[9] Ga₂ 이합체는 액체 상태에서는 지속되지 않으며, 액체 갈륨은 복잡한 저배위 구조를 나타낸다.[20][21]
갈륨의 물리적 특성은 매우 이방성적이다. 즉, 세 가지 주요 결정축 ''a'', ''b'', ''c''를 따라 다른 값을 가진다. 갈륨의 특성은 특히 녹는점 근처에서 온도에 따라 크게 달라진다. 예를 들어, 열팽창 계수는 용융 시 수백 퍼센트 증가한다.[22]
상온, 상압에서 갈륨은 사방정계(비중 5.9)의 푸른빛을 띤 금속 광택을 가진 금속 결정이다. 녹는점은 29.8℃로 낮지만, 끓는점은 2403℃로 매우 높다. 물과 마찬가지로 액체 상태가 고체 상태보다 부피가 작은 이상액체이다. 갈륨은 고체에서 액체로 변할 때 부피가 약 3.4% 감소한다. 고순도 금속 갈륨은 광택이 있는 은색이며, 고체 금속의 단면은 유리와 비슷한 조개껍질 모양이다. 금속 갈륨은 매우 무르며, 모스 경도는 1.5이다. 액체에서 고체로 상전이할 때 부피가 3.2% 증가한다.
갈륨은 고체 상태에서는 반자성이지만, 액체 상태에서는 상자성이 되며, 40℃에서의 자화율은 χm = 2.4×10−6이다.
갈륨은 대부분의 다른 금속에 대해 금속 격자에 확산하여 부식시킨다. 예를 들어, 갈륨은 알루미늄-아연 합금이나 강철의 입계에 부식하여 이들을 취화시킨다. 또한, 금속 갈륨은 다른 금속과 쉽게 합금을 형성한다.
갈륨은 다른 금속과 같은 단순한 결정 구조 형태로는 결정화되지 않고, 상압 상태에서 서로 다른 조건 하에 형성되는 네 가지의 알려진 다형인 α, β, γ, δ-갈륨과 고압 상태에서 형성되는 Ga-II, Ga-III, Ga-IV가 존재한다. 일반적인 상태에서 안정적인 상태는 단위격자에 여덟 개의 원자를 포함하는 사방정계인 α-갈륨이 형성한다. α-갈륨에서 가장 가까운 원자 간의 거리는 244pm이고, 여섯 개의 인접 원자와는 39pm 더 떨어져 있다. 이러한 낮은 대칭성의 불안정한 구조는 갈륨의 낮은 융점의 원인으로 여겨진다.[123] 가장 가까운 인접 원자 간의 결합은 공유 결합적인 성질을 가지고 있으며, 따라서 Ga₂ 이량체는 결정의 기본 요소로 간주되고, 공유 결합한 이량체가 각각 금속 결합하는 구조를 취한다. 이 또한 갈륨이 동족 원소인 알루미늄이나 인듐과 비교하여 융점이 현저히 낮은 것을 설명하는 이유로 여겨진다. 이 이량체 갈륨은 액체 상태에서도 안정적이며, 기체 상태에서도 이량체 갈륨을 검출할 수 있다.[124]
과냉각 상태의 액체 갈륨으로부터의 결정화에 의해 다른 결정 형태의 갈륨을 얻을 수 있다. −16.3℃ 이하에서는 단사정계의 β-갈륨, −19.4℃ 이하에서는 삼방정계의 δ-갈륨, −35.6℃에서는 γ-갈륨이 형성된다.[125]
갈륨의 결정 다형에 대한 표는 다음과 같다.
| 다형 | α-Ga[126] | β-Ga[127] | γ-Ga[128] | δ-Ga[129] | Ga-II[130] | Ga-III[130] | Ga-IV[131] |
|---|---|---|---|---|---|---|---|
| 구조 | |||||||
| 결정계 명칭 | 사방정계 | 단사정계 | 사방정계 | 삼방정계 | 입방정계 | 정방정계 | 입방정계 |
| 배위수 | 1+6 | 8 (2+2+2+2) | 3, 6–9 | 6–10 | 8 | 4+8 | 12 |
| 공간군 | Cmca | C2/c | Cmcm | I3d | I4/mmm | m | |
| 격자 상수 | a = 452.0 pm b = 766.3 pm c = 452.6 pm | a = 276.6 pm b = 805.3 pm c = 333.2 pm β = 92° | a = 1060 pm b = 1356 pm c = 519 pm | a = 907.8 pm c = 1702 pm | a = 459.51 pm | a = 280.13 pm c = 445.2 pm | a = 408 pm |
| 격자당 원자수 | 8 | 8 | 40 | 66 | 12 | 3 | 4 |
| 생성 방법 | 30 kbar 이상의 고압 조건 | 140 kbar 이상의 고압 조건 | 1200 kbar 이상의 고압 조건 |
3. 2. 화학적 성질
갈륨 원소는 자연 상태에서는 발견되지 않지만, 제련을 통해 쉽게 얻을 수 있다. 매우 순수한 갈륨은 은빛을 띤 파란색 금속으로, 조가비처럼 유리처럼 부서진다. 갈륨은 액체에서 고체로 변할 때 부피가 3.10% 증가하며, 이는 고체 상태에서 분자 간 결합을 형성하는 물질의 전형적인 현상이다. 갈륨처럼 액체가 고체보다 밀도가 높은 물질은 실리콘, 저마늄, 비스무트, 플루토늄 및 물과 같이 제한된 몇 가지 물질뿐이다.[9] 금속이나 유리 용기 보관은 갈륨의 고화에 의한 용기 파손을 방지하기 위해 피해야 한다.갈륨은 대부분의 금속과 합금을 형성한다. 갈륨은 알루미늄, 알루미늄–아연 합금[10] 및 강철[11]과 같은 일부 금속의 균열이나 입계로 쉽게 확산되어 액체 금속 취성이라고 하는 강도와 연성의 극심한 손실을 야기한다. 또한, 금속 갈륨은 다른 금속과 쉽게 합금을 형성하며, 그 대표적인 예로 자왜재료나 제진재료에 사용되는 철갈륨 합금(FeGa)이 있다.
갈륨의 녹는점은 29.7646°C로 상온보다 약간 높으며, 지구 중위도의 평균 여름철 낮 기온과 거의 같다. 이 녹는점은 국제 도량형국(BIPM)이 설정한 1990년 국제 온도 눈금(ITS-90)의 공식적인 온도 기준점 중 하나이다.[12][13][14] 미국 표준기술연구소(NIST)는 녹는점보다 갈륨의 삼중점 29.7666°C를 선호한다.[15]
갈륨의 녹는점은 사람의 손에서 녹아서 꺼내면 응고될 수 있게 한다. 액체 금속은 과냉각되어 녹는점/어는점 이하로 내려갈 수 있는 경향이 강하다. 갈륨은 과냉각되는 경향이 매우 강하기 때문에, 종자 결정의 첨가에 의한 결정화의 촉진을 하지 않으면 녹는점 이하의 온도에서도 결정화하기 어렵다. Ga 나노입자는 90 K 이하의 액체 상태로 유지될 수 있다.[16] 종자를 사용하면 결빙이 시작되는 것을 도울 수 있다. 갈륨은 실온 또는 그 근처에서 액체인 것으로 알려진 4가지 비방사성 금속(세슘, 루비듐, 수은) 중 하나이다. 네 가지 중에서 갈륨은 고도로 반응성이 높은(루비듐과 세슘처럼) 것도 아니고 고도로 독성이 높은(수은처럼) 것도 아니므로, 금속-유리 고온 온도계에 사용될 수 있다. 또한 금속 중에서 가장 넓은 액체 범위를 가지고 있으며 (수은과 달리) 고온에서 낮은 증기압을 가지고 있다는 점에서도 주목할 만하다. 갈륨의 끓는점인 2676 K는 절대 눈금에서 녹는점보다 거의 9배 높으며, 이는 모든 원소 중에서 녹는점과 끓는점의 비율이 가장 큰 것이다.[9] 수은과 달리 액체 갈륨 금속은 유리와 피부, 그리고 대부분의 다른 물질(석영, 흑연, 산화갈륨(III)[17] 및 PTFE 제외)[9]을 적시기 때문에, 수은보다 상당히 독성이 낮고 훨씬 적은 예방 조치가 필요하지만 기계적으로 취급하기가 더 어렵다. 액체 갈륨은 독성이 강하지 않아 예방 조치의 필요성은 적지만, 수은과 달리 유리나 금속 또는 피부에 대한 젖음성이 강하기 때문에, 기계적으로 취급이 어렵다. 유리에 칠한 갈륨은 밝은 거울이 된다.[9]
갈륨은 고체 상태에서는 반자성이지만, 액체 상태에서는 상자성이 되며, 40 ℃에서의 자화율은 χm = 2.4×10−6이다.
| 성질 | a | b | c |
|---|---|---|---|
| α (~25 °C, μm/m) | 16 | 11 | 31 |
| ρ (29.7 °C, nΩ·m) | 543 | 174 | 81 |
| ρ (0 °C, nΩ·m) | 480 | 154 | 71.6 |
| ρ (77 K, nΩ·m) | 101 | 30.8 | 14.3 |
| ρ (4.2 K, pΩ·m) | 13.8 | 6.8 | 1.6 |
갈륨은 간단한 결정 구조 중 어느 것에도 결정화되지 않는다. 일반적인 조건에서 안정적인 상은 종래의 단위 세포에 8개의 원자가 있는 사방정계이다. 단위 세포 내에서 각 원자는 가장 가까운 이웃 하나(244 pm 거리)만 가지고 있다. 나머지 6개의 단위 세포 이웃은 27, 30 및 39 pm 더 멀리 떨어져 있으며, 같은 거리로 쌍으로 그룹화되어 있다.[18] 온도와 압력의 함수로 많은 안정적이고 준안정적인 상이 발견된다.[19]
가장 가까운 두 이웃 사이의 결합은 공유 결합이므로, Ga₂ 이합체는 결정의 기본 구성 요소로 간주된다. 이것은 이웃 원소인 알루미늄과 인듐에 비해 녹는점이 낮은 것을 설명한다. 이 구조는 요오드의 구조와 매우 유사하며, 갈륨 원자의 단일 4p 전자(원자핵보다 더 멀리 떨어져 있고 4s 전자와 [Ar]3d¹⁰ 코어보다 멀리 떨어져 있음) 사이의 상호 작용으로 인해 형성될 수 있다. 이 현상은 "유사-비활성 기체" [Xe]4f¹⁴5d¹⁰6s² 전자 배열을 가진 수은에서도 반복되며, 실온에서 액체이다.[9] 3d¹⁰ 전자는 바깥쪽 전자를 원자핵으로부터 잘 차폐하지 않으므로, 갈륨의 첫 번째 이온화 에너지는 알루미늄보다 크다.[9] Ga₂ 이합체는 액체 상태에서는 지속되지 않으며, 액체 갈륨은 각 갈륨 원자가 다른 10개의 원자로 둘러싸여 있는 복잡한 저배위 구조를 나타내는데, 이는 대부분의 액체 금속에서 일반적인 11~12개의 이웃과는 다르다.[20][21]
갈륨의 물리적 특성은 매우 이방성적이다. 즉, 세 가지 주요 결정축 ''a'', ''b'', ''c''를 따라 다른 값을 가지며(표 참조), 선형(α) 및 부피 열팽창 계수 사이에 상당한 차이를 만든다. 갈륨의 특성은 특히 녹는점 근처에서 온도에 따라 크게 달라진다. 예를 들어, 열팽창 계수는 용융 시 수백 퍼센트 증가한다.[22]
갈륨은 주로 +3 산화 상태로 존재한다. +1 산화 상태도 일부 화합물에서 발견되지만, 갈륨보다 무거운 동족원소인 인듐과 탈륨에서보다 덜 일반적이다. 예를 들어, 매우 안정적인 GaCl2는 갈륨(I)과 갈륨(III) 모두를 포함하며 GaIGaIIICl4로 나타낼 수 있다. 반대로, 일염화물은 0 °C 이상에서 불안정하며, 원소 갈륨과 갈륨(III) 염화물로 불균일화된다. Ga–Ga 결합을 포함하는 화합물은 GaS(Ga24+(S2−)2로 나타낼 수 있음) 및 디옥산 착물 Ga2Cl4(C4H8O2)2와 같이 진정한 갈륨(II) 화합물이다.[9]
갈륨을 강산에 녹이면 질산갈륨(III)과 같은 갈륨(III)염을 생성한다. 갈륨(III)염의 수용액에는 수화된 갈륨 이온()이 포함되어 있다.[24][134] 수산화갈륨(III)()은 갈륨(III) 수용액에 암모니아를 첨가하여 얻을 수 있으며, 100 °C에서 탈수시키면 산화수산화갈륨 GaO(OH)가 생성된다.[25][135]
알칼리성 수산화물 용액은 갈륨을 용해시켜 음이온을 포함하는 '갈레이트'(gallate) 염을 형성한다(같은 이름의 갈산 염과 혼동해서는 안 된다).[28][24][27] 수산화갈륨(III) 또한 양쪽성 화합물이며, 알칼리에 용해되어 갈륨산염을 만든다.[137] 초기 연구에서는 이 또 다른 가능한 갈레이트 음이온으로 제시되었지만,[26] 후속 연구에서는 발견되지 않았다.[136]
금속 갈륨은 상온에서 산화 피막을 형성하기 때문에 공기와 물에 대해 불활성이다. 하지만 더 높은 온도에서는 공기 중의 산소와 반응하여 산화갈륨(III)()를 생성합니다.[28][133] 이 산화 갈륨(III)은 반도체 소자나 가스 센서 등에 사용된다. 또한, 산화 갈륨(III)을 금속 갈륨과 함께 진공 속에서 500 ℃에서 700 ℃로 가열하면, 암갈색의 산화갈륨(I) Ga₂O가 얻어진다.[139]는 매우 강력한 환원제로, 을 로 환원시킬 수 있다.[25][140] 산화 갈륨(I)은 800 ℃에서 불균등화을 일으켜 금속 갈륨과 산화 갈륨(III)이 된다.[141]
황화갈륨(III)()는 950 °C에서 갈륨과 황화수소()의 반응으로 생성할 수 있으며,[25][142] 3가지 결정 변형이 가능합니다.[29][143] 747 °C에서 를 사용할 수 있다.[30]
:2 + 3 → + 6
알칼리 금속의 탄산염과 의 혼합물에 황화수소를 반응시키면 음이온을 포함하는 ''티오갈레이트''가 생성된다. 강산은 이러한 염을 분해하여 를 방출합니다.[29][145] 티오갈륨산의 수은염 HgGa₂S₄는 형광체로 사용된다.[146]
녹색의 황화 갈륨(I)이나 황화 갈륨(II)과 같은 저황화물도 생성되며, 황화 갈륨(I)은 황화 갈륨(II)을 질소 기류하에서 1000 ℃로 가열함으로써 만들어진다.[147]
다른 이원 화합물로는 셀렌화 갈륨 Ga₂Se₃나 텔루르화 갈륨 Ga₂Te₃가 있으며, 섬아연광형 구조를 취한다. 이러한 화합물은 반도체이지만, 쉽게 가수분해되기 때문에 용도에는 제한이 있다.[143]
갈륨을 1050 ℃에서 암모니아와 반응시키면 청색 발광 다이오드의 재료로 알려진 질화갈륨(GaN)을 형성한다. 갈륨은 인, 비소, 안티몬과도 이원 화합물을 형성한다. 인화갈륨(GaP), 비소갈륨(GaAs), 안티몬화갈륨(GaSb) 등이 있다. 이러한 화합물들은 ZnS과 같은 구조를 가지며, 비화갈륨은 반도체 재료로서 중요하며, 인화갈륨은 발광 다이오드의 재료로 이용되는 등 중요한 반도체 특성을 지닌다.[24][148] GaP, GaAs, GaSb는 갈륨과 원소 인, 비소 또는 안티몬의 직접 반응을 통해 합성될 수 있다.[29][149] 이들은 GaN보다 더 높은 전기전도성을 나타낸다.[29][150] GaP는 저온에서 와 인을 반응시켜서도 합성할 수 있다.[32]
갈륨은 삼원 질화물을 형성한다.[29][149]
: + →
인과 비소를 포함하는 유사한 화합물도 가능합니다: 및 . 이러한 화합물은 묽은 산과 물에 의해 쉽게 가수분해된다.[29][150] 삼원 인화물의 대표적인 화합물로 압전소자로 이용되는 인산갈륨(GaPO4)이 있다.
산화갈륨(III)은 불화제(예: HF 또는 )와 반응하여 )을 형성한다. 삼불화갈륨(III)는 물에는 잘 녹지 않는 이온성 화합물이지만, 불화수소산에는 삼수화물 GaF₃·3H₂O를 형성하여 녹는다. 이것을 건조시키면 수산화불화갈륨의 n수화물 GaF₂OH·nH₂O가 얻어진다. 이 첨가물은 암모니아와 반응하여 을 형성하며, 이는 가열하여 무수 를 생성할 수 있다.[25][152]
염화갈륨(III)는 갈륨 금속과 염소 기체의 반응으로 생성된다.[28][133] 삼불화물과 달리, 염화갈륨(III)는 78 °C의 녹는점을 갖는 이합체 분자 로 존재한다. 삼브롬화갈륨(III) Ga₂Br₆ 및 삼요오드화갈륨(III) Ga₂I₆도 마찬가지이다.[153]
다른 13족 삼할로겐화물과 마찬가지로, 갈륨(III) 할로겐화물은 루이스 산이며, 할로겐화물 수용체로서 알칼리 금속 할로겐화물과 반응하여 음이온(여기서 X는 할로겐임)을 포함하는 염을 형성한다. 또한 알킬 할로겐화물과 반응하여 카르보양이온과 를 형성한다.[25][154]
고온으로 가열하면 갈륨(III) 할로겐화물은 원소 갈륨과 반응하여 해당 갈륨(I) 할로겐화물을 형성한다. 예를 들어, 은 Ga와 반응하여 을 형성한다.
:2 Ga + 3 GaCl (g)
저온에서는 평형이 왼쪽으로 이동하고 GaCl은 원소 갈륨과 로 다시 불균등화된다. 일염화갈륨(I)은 금속 갈륨과 염화수소를 950 ℃에서 반응시켜서도 만들 수 있으며, 그것은 붉은색 고체로 농축할 수 있다.[155]
갈륨(I) 화합물은 루이스 산과 첨가물을 형성함으로써 안정화될 수 있다. 예를 들어:
:GaCl + →
소위 "갈륨(II) 할로겐화물" 은 실제로는 해당 갈륨(III) 할로겐화물과 갈륨(I) 할로겐화물의 첨가물이며, 구조를 갖는다.[28][24][33][133][155][156]
:GaCl + →
3. 3. 동위 원소
갈륨은 질량수 60에서 89까지 30가지의 동위 원소가 알려져 있다. 자연 상태에서 안정적으로 존재하는 동위 원소는 갈륨-69와 갈륨-71 두 가지뿐이다. 갈륨-69가 더 풍부하며, 자연계 갈륨의 약 60.1%를 차지하고, 나머지 39.9%는 갈륨-71이다.[23] 다른 모든 동위 원소는 방사성 동위 원소이며, 이 중 갈륨-67이 가장 반감기가 길다(3.261일).[23]갈륨-69보다 가벼운 동위 원소는 일반적으로 β+ 붕괴(양전자 방출) 또는 전자 포획을 통해 아연의 동위 원소로 붕괴되며, 갈륨-71보다 무거운 동위 원소는 β- 붕괴(전자 방출), 경우에 따라 지연된 중성자 방출을 통해 게르마늄의 동위 원소로 붕괴된다.[23] 갈륨-70은 β- 붕괴와 전자 포획 모두를 통해 붕괴될 수 있다. 갈륨-67은 가벼운 동위 원소 중에서 전자 포획만을 붕괴 모드로 갖는 독특한 동위 원소인데, 이는 그 붕괴 에너지가 양전자 방출을 허용할 만큼 충분하지 않기 때문이다.[23] 갈륨-67과 갈륨-68(반감기 67.7분)은 모두 핵의학에 사용된다.[23]
4. 화합물
갈륨은 주로 +3 산화 상태로 존재한다. +1 산화 상태도 일부 화합물에서 발견되지만, 갈륨보다 무거운 동족원소인 인듐과 탈륨에서보다 덜 일반적이다. 매우 안정적인 GaCl2는 갈륨(I)과 갈륨(III) 모두를 포함하며 GaIGaIIICl4로 나타낼 수 있다. 반대로, 일염화물은 0 °C 이상에서 불안정하며, 원소 갈륨과 갈륨(III) 염화물로 불균일화된다. Ga–Ga 결합을 포함하는 화합물은 GaS(Ga24+(S2−)2로 나타낼 수 있음) 및 디옥산 착물 Ga2Cl4(C4H8O2)2와 같이 진정한 갈륨(II) 화합물이다.[9]
강산은 갈륨을 용해시켜 Ga(NO3)3(질산갈륨(III))과 같은 갈륨(III) 염을 형성한다. 갈륨(III) 염의 수용액에는 수화된 갈륨 이온 [Ga(H2O)6]3+이 포함되어 있다.[24] 수산화갈륨(III) Ga(OH)3은 암모니아를 첨가하여 갈륨(III) 용액에서 침전될 수 있다. 100 °C에서 Ga(OH)3를 탈수시키면 산화수산화갈륨 GaO(OH)가 생성된다.[25]
알칼리성 수산화물 용액은 갈륨을 용해시켜 [Ga(OH)4]- 음이온을 포함하는 '갈레이트'(gallate) 염을 형성한다(같은 이름의 갈산 염과 혼동해서는 안 된다).[28][24][27] 양쪽성인 수산화갈륨도 알칼리에 용해되어 갈레이트 염을 형성한다.[25] 초기 연구에서는 [Ga(OH)6]3-이 또 다른 가능한 갈레이트 음이온으로 제시되었지만,[26] 후속 연구에서는 발견되지 않았다.[27]
갈륨은 비교적 높은 온도에서만 칼코겐과 반응한다. 상온에서 갈륨 금속은 부동태성 보호 산화물 층을 형성하기 때문에 공기와 물과 반응하지 않는다. 그러나 고온에서는 대기 중 산소와 반응하여 산화갈륨(III) Ga2O3를 생성한다.[28] 진공 상태에서 500 °C~700 °C의 온도로 원소 갈륨을 사용하여 Ga2O3를 환원시키면 암갈색의 산화갈륨(I) Ga2O가 생성된다.[25] Ga2O는 매우 강력한 환원제로, H2SO4을 H2S로 환원시킬 수 있다.[25] 800 °C에서 갈륨과 Ga2O3로 다시 불균등화된다.[29]
황화갈륨(III) Ga2S3는 3가지 결정 변형이 가능하며,[29] 950 °C에서 갈륨과 황화수소(H2S)의 반응으로 생성할 수 있다.[25] 또는 747 °C에서 Ga(OH)3를 사용할 수 있다.[30]
:2 Ga(OH)3 + 3 H2S → Ga2S3 + 6 H2O
알칼리 금속 탄산염과 Ga2O3의 혼합물을 H2S와 반응시키면 [Ga2S4]2- 음이온을 포함하는 '티오갈레이트'가 생성된다. 강산은 이러한 염을 분해하여 H2S를 방출한다.[29] 수은염인 HgGa2S4는 형광체로 사용될 수 있다.[31]
갈륨은 또한 황화갈륨(II) 및 녹색의 황화갈륨(I)과 같이 낮은 산화 상태의 황화물을 형성한다. 후자는 전자를 질소 기류 하에서 1000 °C로 가열하여 생성된다.[29]
다른 이원 칼코겐화물인 Ga2Se3 및 Ga2Te3는 섬아연석 구조를 가지고 있다. 모두 반도체이지만 쉽게 가수분해되며 활용도가 제한적이다.[29]
갈륨은 1050 °C에서 암모니아와 반응하여 질화갈륨(GaN)을 형성한다. 갈륨은 인, 비소, 안티몬과도 이원 화합물을 형성하며, 인화갈륨(GaP), 비소갈륨(GaAs), 안티몬갈륨(GaSb) 등이 있다. 이러한 화합물들은 ZnS과 같은 구조를 가지며 중요한 반도체 특성을 지닌다.[24] GaP, GaAs, GaSb는 갈륨과 원소 인, 비소 또는 안티몬의 직접 반응을 통해 합성될 수 있다.[29] 이들은 GaN보다 더 높은 전기 전도도를 나타낸다.[29] GaP는 저온에서 Ga2O와 인을 반응시켜서도 합성할 수 있다.[32]
갈륨은 삼원 질화물을 형성한다. 예를 들면:[29]
:Li3Ga + N2 → Li3GaN2
인과 비소를 포함하는 유사한 화합물도 가능하며, Li3GaP2 및 Li3GaAs2가 있다. 이러한 화합물은 묽은 산과 물에 의해 쉽게 가수분해된다.[29]
갈륨(III) 산화물은 불화제(예: HF 또는 F2)와 반응하여 GaF3)을 형성한다. 이것은 물에 대한 용해도가 매우 낮은 이온성 화합물이다. 하지만 불화수소산에 녹으며, 물과 첨가물 GaF3·3H2O을 형성한다. 이 첨가물을 탈수시키려고 하면 GaF2OH·nH2O가 생성된다. 이 첨가물은 암모니아와 반응하여 GaF3·3NH3을 형성하며, 이는 가열하여 무수 GaF3를 생성할 수 있다.[25]
삼염화갈륨(III)은 금속 갈륨과 염소 기체의 반응으로 생성된다.[28] 삼불화물과 달리, 염화갈륨(III)는 78 °C의 녹는점을 갖는 이합체 분자 Ga2Cl6로 존재한다. 브롬과 요오드와도 동등한 화합물인 Ga2Br6 및 Ga2I6이 형성된다.[25]
다른 13족 삼할로겐화물과 마찬가지로, 갈륨(III) 할로겐화물은 루이스 산이며, 할로겐화물 수용체로서 알칼리 금속 할로겐화물과 반응하여 GaX4- 음이온(여기서 X는 할로겐임)을 포함하는 염을 형성한다. 또한 알킬 할로겐화물과 반응하여 카르보양이온과 GaX4-를 형성한다.[25]
고온으로 가열하면 갈륨(III) 할로겐화물은 원소 갈륨과 반응하여 해당 갈륨(I) 할로겐화물을 형성한다. 예를 들어, GaCl3은 Ga와 반응하여 GaCl을 형성한다.
:2 Ga + GaCl3 3 GaCl (g)
저온에서는 평형이 왼쪽으로 이동하고 GaCl은 원소 갈륨과 GaCl3로 다시 불균등화된다. GaCl은 950 °C에서 Ga와 HCl을 반응시켜서도 생성할 수 있으며, 생성물은 붉은색 고체로 응축될 수 있다.[24]
갈륨(I) 화합물은 루이스 산과 첨가물을 형성함으로써 안정화될 수 있다. 예를 들어:
:GaCl + AlCl3 → Ga+[AlCl4]-
소위 "갈륨(II) 할로겐화물" GaX2는 실제로는 해당 갈륨(III) 할로겐화물과 갈륨(I) 할로겐화물의 첨가물이며, Ga+[GaX4]- 구조를 갖는다.[28][24][33]
:GaCl + GaCl3 → Ga+[GaCl4]-
알루미늄과 마찬가지로, 갈륨 또한 수소화물인 GaH3, 즉 갈란(gallane)을 형성하는데, 이는 −30 °C에서 리튬 갈라네이트(LiGaH4)와 염화갈륨(III)(GaCl3)을 반응시켜 생성할 수 있다.[24]
:3 LiGaH4 + GaCl3 → 3 LiCl + 4 GaH3
디메틸 에테르를 용매로 사용하면, GaH3는 (GaH3)n으로 중합된다. 용매를 사용하지 않으면, 이량체 Ga2H6 (디갈란(digallane))이 기체로 생성된다. 그 구조는 두 갈륨 중심을 연결하는 두 개의 수소 원자를 가지고 있는 디보란과 유사하며,[24] 이는 배위수가 6인 α-수소화알루미늄(AlH3)과는 다르다.[24]
갈란은 −10 °C 이상에서는 불안정하여, 원소 갈륨과 수소로 분해된다.[34]
유기갈륨 화합물은 유기인듐 화합물과 유사한 반응성을 가지며, 유기알루미늄 화합물보다는 반응성이 낮지만 유기탈륨 화합물보다는 반응성이 높다.[9] 알킬갈륨은 단량체이다. 루이스 산성은 Al > Ga > In 순으로 감소하며, 그 결과 유기갈륨 화합물은 유기알루미늄 화합물과 같이 가교된 이량체를 형성하지 않는다. 유기갈륨 화합물은 또한 유기알루미늄 화합물보다 반응성이 낮다. 안정적인 과산화물을 형성한다.[35] 이러한 알킬갈륨은 상온에서 액체이며, 녹는점이 낮고, 매우 이동성이 좋고 가연성이 있다. 트리페닐갈륨은 용액에서 단량체이지만, 약한 분자간 Ga···C 상호작용으로 인해 결정은 사슬 구조를 형성한다.[9]
갈륨 삼염화물은 카르보갈륨화 반응과 같이 유기갈륨 화합물을 형성하기 위한 일반적인 출발 시약이다.[36] 갈륨 삼염화물은 디에틸 에테르에서 리튬 시클로펜타디에니드와 반응하여 삼각 평면 갈륨 시클로펜타디에닐 착물 GaCp3를 형성한다. 갈륨(I)은 아렌 리간드와 같은 헥사메틸벤젠과 착물을 형성한다. 이 리간드는 매우 부피가 크기 때문에 [Ga(η6-C6Me6)]+의 구조는 반 샌드위치 구조이다. 메시틸렌과 같은 부피가 더 작은 리간드는 구부러진 샌드위치 구조에서 중심 갈륨 원자에 두 개의 리간드가 부착될 수 있도록 한다. 벤젠은 더 작은 부피를 가지며 이합체의 형성을 허용한다. 예를 들어 [Ga(η6-C6H6)2] [GaCl4]·3C6H6가 있다.[9]
5. 생산
갈륨은 다른 금속의 광석을 처리하는 과정에서 부산물로만 생산된다. 주요 원료는 알루미늄의 주요 광석인 보크사이트이지만, 소량은 황화 아연 광석(주요 매개 광물은 섬아연석)에서도 추출된다.[55][54]
보크사이트를 베이어 공정을 통해 알루미나로 처리하는 과정에서 갈륨은 수산화나트륨 용액에 축적된다. 이로부터 다양한 방법으로 추출할 수 있는데, 가장 최근 방법은 이온 교환 수지를 사용하는 것이다.[55] 일반적인 원료 농도 50ppm에서 함유된 갈륨의 약 15%만 추출할 수 있다.[55] 나머지는 적색 침전물과 수산화알루미늄 흐름으로 이동한다. 갈륨은 용액에서 이온 교환 수지에서 제거된 후, 전기 분해를 통해 갈륨 금속을 얻는다. 반도체 용도의 경우, 영역 정련 또는 용융물에서 단결정 추출(초크랄스키법)을 통해 더욱 정제된다. 99.9999%의 순도는 일상적으로 달성되며 시판되고 있다.[56]
알루미늄이나 아연 제련 시 부산물로 얻어지는 갈륨은 바이어법으로 알루미나를 생산할 때 얻어지는 갈륨을 포함한 바이어액(알루민산나트륨 용액)에서 Ga₂O₃(산화 갈륨(III))을 침전시킨 후, 수은 음극을 사용하여 전해 환원하여 얻는다. 갈륨 함유 용액에는 다른 금속도 포함되므로, 그것들과 분리하여 정제해야 한다. 반도체로 사용하는 경우에는 존메르트법으로 더욱 순도를 높이거나, 초크랄스키법을 사용하여 단결정을 얻는다.[56]
2017년 세계 저품위 갈륨 생산량은 약 315톤이었으며, 주요 생산국은 중국, 일본, 한국, 러시아, 우크라이나였다.[60] 고순도 갈륨의 생산량은 약 180톤으로 대부분 중국, 일본, 슬로바키아, 영국, 미국에서 생산되었다.[60] 2023년 7월 기준으로 중국은 갈륨 생산량의 80%[61]에서 95%를 차지했다.[62]
6. 용도
갈륨은 다양한 용도로 사용되는 흥미로운 금속이다. 주요 용도는 다음과 같다.
- 반도체: 반도체 응용 분야는 갈륨의 상업적 수요의 98%를 차지한다.[63] 비소 갈륨(GaAs)과 질화 갈륨(GaN)과 같은 화합물은 집적 회로, 광전자 장치 등 다양한 전자기기에 사용된다.
- 합금: 갈륨은 다른 금속과 쉽게 합금을 이루며, 특히 갈린스탄과 같은 저융점 합금은 의료용 온도계, 컴퓨터 칩 냉각, 써멀 그리스 대체제 등으로 사용된다.
- 기타:
- 밝은 거울 제작: 갈륨은 유리나 자기를 적시는 성질을 이용하여 밝은 거울을 만드는 데 사용될 수 있다.
- 액추에이터: 높은 표면 장력과 변형성을 가진 갈륨 기반 액체 금속은 액추에이터 제작에 사용될 수 있다.
- 핵무기 안정화: 핵무기 피트에 사용되는 플루토늄은 갈륨과 합금하여 안정화된다.
- 의약품: 갈륨 염은 의약품 및 방사성의약품으로 사용되거나 개발 중이다.
- 중성미자 검출: 러시아의 SAGE 실험과 이탈리아의 GALLEX 실험에서 중성미자 검출에 사용되었다.
- 이온원: 액체 금속 이온원으로 사용되어 집속 이온 빔을 생성한다.
- 윤활제: 스키와 기타 저마찰 표면 재료의 글라이드 왁스에 첨가제로 사용된다.
- 플렉서블 전자기기: 플렉서블하고 웨어러블한 기기 개발에 적합한 소재로 연구되고 있다.
- 수소 생성: 알루미늄의 보호 산화층을 파괴하여 수소 가스를 생성하는 데 사용될 수 있다.
- 장난: 갈륨 수저를 이용한 장난에 사용될 수 있다.
- 1990년 국제 온도 눈금(ITS-90)의 공식적인 온도 기준점 중 하나이다.[12][13][14]
- 광전지: 태양전지에 사용되는 광전지 화합물의 구성요소이다.
6. 1. 반도체

갈륨은 반도체 산업에서 중요한 역할을 한다. 특히, 비소갈륨(GaAs)과 질화갈륨(GaN)은 전자 부품에 널리 사용된다. 2007년 미국 갈륨 소비량의 약 98%가 이 두 화합물에 사용되었다.[65]
갈륨은 1050 °C에서 암모니아와 반응하여 질화갈륨(GaN)을 형성한다.[24] 질화갈륨은 나카무라 슈지가 개발한 청색 발광 다이오드의 재료로 사용된다. 또한, 갈륨은 인, 비소, 안티몬과 반응하여 인화갈륨(GaP), 비소갈륨(GaAs), 안티몬갈륨(GaSb) 등의 이원 화합물을 만든다. 이 화합물들은 황화아연과 같은 구조를 가지며, 중요한 반도체 특성을 지닌다.[148] 특히 비소갈륨은 반도체 레이저와 같은 곳에 사용되는 III-V족 반도체의 주요 재료로 꼽힌다.
인화갈륨, 비소갈륨, 안티몬갈륨은 갈륨과 해당 원소들을 직접 반응시켜 합성할 수 있으며,[149] 질화갈륨보다 높은 전기전도성을 보인다.[150] 인화갈륨은 산화갈륨(I)과 인을 반응시켜 저온에서 합성할 수도 있다.[151]
갈륨은 삼원 질화물을 형성하기도 한다.[149]
:
압전소자로 사용되는 인산갈륨(GaPO4)과 같이 인이나 비소를 포함하는 유사한 삼원 화합물(Li3GaP2, Li3GaAs2)도 존재하며, 이들은 묽은 산과 물에 쉽게 가수분해된다.[150]
전 세계적으로 갈륨 비소는 연간 갈륨 소비량의 95%를 차지한다.[56] 2016년 시장 규모는 75억달러였으며, 주로 휴대전화(53%), 무선 통신(27%) 등에 사용되었다.[60] 특히 3G 및 4G 스마트폰의 등장으로 갈륨 비소 소비량이 증가했는데, 이들 스마트폰은 구형 모델보다 최대 10배 많은 갈륨 비소를 사용한다.[60]
갈륨 비소와 갈륨 질화물은 광전자 장치에도 널리 사용되며, 2015년과 2016년 시장 규모는 각각 153억달러와 185억달러였다.[60] 알루미늄 갈륨 비소(AlGaAs)는 고출력 적외선 레이저 다이오드에 사용되며, 갈륨 질화물과 인듐 갈륨 질화물은 청색 및 자색 발광 다이오드와 레이저 다이오드에 사용된다. 예를 들어, 갈륨 질화물 405nm 다이오드 레이저는 블루레이 디스크 드라이브의 자색 광원으로 사용된다.[66]
갈륨 질화물은 케이블 텔레비전 전송, 상용 무선 인프라, 전력 전자 장치, 위성 등에도 활용된다. 2016년 GaN 무선 주파수 장치 시장 규모는 4.2억달러로 추산되었다.[60]
다중 접합 태양 전지는 분자선 에피택시 또는 유기 금속 화학 기상 증착법을 사용하여 갈륨 비소, 인듐 갈륨 인화물, 인듐 갈륨 비소 박막으로 제작되며, 위성 전력 공급에 사용된다. 화성 탐사 로버와 여러 위성은 저마늄 기반 삼중 접합 갈륨 비소 셀을 사용한다.[67] 또한 갈륨은 광전지 화합물(예: 구리 인듐 갈륨 셀레늄 황화물)의 구성 요소로, 결정질 실리콘보다 저렴한 대안으로 사용된다.[68]
6. 2. 합금
갈륨은 대부분의 금속과 쉽게 합금을 형성하며, 특히 저융점 합금의 성분으로 사용된다. 갈륨, 인듐, 주석의 공정조성 합금은 상온에서 액체 상태를 유지하는데, 의료용 온도계에 사용된다. 이 합금은 "갈린스탄"(-스탄’은 라틴어로 주석을 뜻하는 stannumla에서 유래)이라는 상품명으로 판매되며, −19 °C (−2.2 °F)의 낮은 녹는점을 갖는다.[69] 이러한 합금 계열은 물 대신 컴퓨터 칩을 냉각하는 데 사용될 수 있다는 제안이 있었으며, 고성능 컴퓨팅에서는 써멀 그리스 대체제로 자주 사용된다.[70][71] 갈륨 합금은 수은 아말감의 대체재로 평가되었지만, 아직 널리 사용되지는 않는다. 주로 갈륨과 인듐을 포함하는 액체 합금은 기체 CO2를 고체 탄소로 침전시키는 것으로 밝혀졌으며, 탄소 포집 및 저장 및 탄소 제거 방법으로 연구되고 있다.[72][73]갈륨은 유리 또는 자기를 적시기 때문에, 갈륨을 이용하여 밝은 거울을 만들 수 있다. 갈륨 합금의 젖음 작용이 바람직하지 않은 경우(갈린스탄 유리 온도계와 같이) 유리는 산화갈륨(III)의 투명한 층으로 보호해야 한다.[74]
높은 표면 장력과 변형성[75] 때문에, 갈륨 기반 액체 금속은 표면 장력을 제어하여 액추에이터를 만드는 데 사용될 수 있다.[76][77][78] 연구자들은 로봇 구동에서 액체 금속 액추에이터를 인공 근육으로 사용할 가능성을 입증했다.[79][80]
핵무기 피트에 사용되는 플루토늄은 δ 상에서 안정화되고 갈륨과 합금하여 가공 가능하게 만들어진다.[81][82]
마이크로파 집적회로와 적색 발광 다이오드, 반도체 레이저 등에 사용되는 비화갈륨과 같은 III-V족 반도체의 주요 재료이다. 질화갈륨은 나카무라 슈지가 개발한 청색 발광 다이오드의 재료이다. 세계 시장 갈륨의 95%는 반도체에 사용되지만, 합금이나 연료 전지 등의 새로운 용도 개발도 계속되고 있다.
녹는점이 낮기 때문에 저융점 합금에도 사용된다. 갈륨 68.5%, 인듐 21.5% 및 주석 10%로 구성된 합금은 갈린스탄이라고 불리며, 독성이 낮고 상온에서 액체(녹는점 -19 ℃)이기 때문에 액체 거울 망원경의 수은 대체재로 연구되고 있으며, 합금에 포함된 인듐의 고속 중성자에 대한 반응 단면적의 높이를 이용하여 핵융합로의 냉각재로도 연구되고 있다.[166] 플루토늄-갈륨 합금은 트리니티 실험에 사용된 핵폭탄 및 나가사키에 투하된 팻맨의 중심핵에 사용되어 플루토늄의 결정 구조를 안정화시키는 데 사용되었다.[167]
6. 3. 기타 용도
갈륨 원소는 자연 상태에서는 발견되지 않지만, 제련을 통해 쉽게 얻을 수 있다. 매우 순수한 갈륨은 은빛을 띤 파란색 금속으로, 유리처럼 부서진다. 갈륨은 액체에서 고체로 변할 때 부피가 3.10% 증가하므로, 상태 변화 시 파손될 수 있는 용기에 보관할 때는 주의해야 한다.[9] 갈륨은 대부분의 금속과 합금을 형성하며, 특히 알루미늄, 알루미늄–아연 합금[10] 및 강철[11]과 같은 금속의 균열이나 입계로 쉽게 확산되어 액체 금속 취성을 야기한다.갈륨의 녹는점은 302,914.60,000,000,003 (29.7646°C)로 실온보다 약간 높으며, 1990년 국제 온도 눈금(ITS-90)의 공식적인 온도 기준점 중 하나이다.[12][13][14] 사람의 손에서 녹은 갈륨은 꺼내면 응고될 수 있다. 액체 금속은 과냉각되어 녹는점/어는점 이하로 내려갈 수 있는 경향이 강하며, Ga 나노입자는 90,000 이하의 액체 상태로 유지될 수 있다.[16] 종자를 사용하면 결빙을 시작할 수 있다. 갈륨은 실온 또는 그 근처에서 액체인 4가지 비방사성 금속(세슘, 루비듐, 수은) 중 하나이며, 금속-유리 고온 온도계에 사용될 수 있다. 또한 금속 중에서 가장 넓은 액체 범위를 가지고 있으며 (수은과 달리) 고온에서 낮은 증기압을 가지고 있다는 점에서도 주목할 만하다.[9]
갈륨은 유리와 피부, 그리고 대부분의 다른 물질을 적시기 때문에, 수은보다 독성은 낮지만 기계적으로 취급하기가 더 어렵다.[9] 유리에 칠한 갈륨은 밝은 거울이 된다.[9] 이러한 이유와 금속 오염 및 동결 팽창 문제 때문에 갈륨 금속 샘플은 일반적으로 다른 용기 안에 폴리에틸렌 포장으로 제공된다.
갈륨은 간단한 결정 구조 중 어느 것에도 결정화되지 않는다. 일반적인 조건에서 안정적인 상은 종래의 단위 세포에 8개의 원자가 있는 사방정계이다. 단위 세포 내에서 각 원자는 가장 가까운 이웃 하나(244 pm 거리)만 가지고 있다. 나머지 6개의 단위 세포 이웃은 27, 30 및 39 pm 더 멀리 떨어져 있으며, 같은 거리로 쌍으로 그룹화되어 있다.[18]
가장 가까운 두 이웃 사이의 결합은 공유 결합이므로, Ga₂ 이합체는 결정의 기본 구성 요소로 간주된다. 이는 이웃 원소인 알루미늄과 인듐에 비해 녹는점이 낮은 것을 설명한다. 3d¹⁰ 전자는 바깥쪽 전자를 원자핵으로부터 잘 차폐하지 않으므로, 갈륨의 첫 번째 이온화 에너지는 알루미늄보다 크다.[9] Ga₂ 이합체는 액체 상태에서는 지속되지 않으며, 액체 갈륨은 각 갈륨 원자가 다른 10개의 원자로 둘러싸여 있는 복잡한 저배위 구조를 나타낸다.[20][21]
갈륨의 물리적 특성은 이방성적이다. 즉, 세 가지 주요 결정축 ''a'', ''b'', ''c''를 따라 다른 값을 가진다. 갈륨의 특성은 특히 녹는점 근처에서 온도에 따라 크게 달라진다. 예를 들어, 열팽창 계수는 용융 시 수백 퍼센트 증가한다.[22]
비화갈륨과 같은 III-V족 반도체의 주요 재료로, 마이크로파 집적회로와 적색 발광 다이오드, 반도체 레이저 등에 사용된다. 나카무라 슈지가 개발한 청색 발광 다이오드의 재료인 질화갈륨이 대표적이다. 세계 시장 갈륨의 95%는 반도체에 사용되지만, 합금이나 연료 전지 등의 새로운 용도 개발도 계속되고 있다.
302,910 (29.76°C) ~ 2,676,000 (2403°C)의 넓은 온도 범위에서 액체이기 때문에 액주 온도계에 사용된다.[165][114] 수은과 달리 저온에서 증기압이 낮은 것도 온도계로 사용하는 데 유리하다.
녹는점이 낮기 때문에 저융점 합금에도 사용된다. 갈륨 68.5%, 인듐 21.5% 및 주석 10%로 구성된 합금은 갈린스탄이라고 불리며, 독성이 낮고 상온에서 액체(녹는점 -19 ℃)이기 때문에 액체 거울 망원경의 수은 대체재로 연구되고 있다. 또한 합금에 포함된 인듐의 고속 중성자에 대한 반응 단면적의 높이를 이용하여 핵융합로의 냉각재로도 연구되고 있다.[166] 플루토늄-갈륨 합금은 트리니티 실험에 사용된 핵폭탄 및 나가사키에 투하된 팻맨의 중심핵에 사용되어 플루토늄의 결정 구조를 안정화시키는 데 사용되었다.[167]
녹는점(302,914.60,000,000,003 (29.7646°C))이 일반적으로 실온보다 높고, 손가락의 마찰열로 쉽게 녹는점까지 온도를 높일 수 있기 때문에, “숟가락 굽히기”나 “숟가락 자르기” 용 숟가락 제작 재료로 사용되는 경우가 있다.
1990년, 국제도량형국이 정한 국제온도눈금(ITS-90)의 정의 고정점 중 하나로 표준기압(101,325 Pa)에서 갈륨의 융점인 302,914.60,000,000,003 (29.7646°C)가 사용되었다.[169][170][171]
인간의 손바닥에 고체 갈륨을 올려놓으면 체온으로 녹고, 녹은 갈륨을 다른 용기 등으로 옮기면 서서히 고체로 돌아오기 때문에, 융점에 관한 교육 자료로 활용할 수 있다. 다만, 액체 갈륨은 젖음성이 강하여 손이나 유리에 묻으면 잘 떨어지지 않으므로 취급에 주의해야 한다.
갈륨은 다음과 같은 다양한 용도로 사용된다.
- 중성미자 검출: 러시아 바크산 중성미자 천문대의 SAGE 실험에서 사용된 갈륨-저마늄 중성미자 망원경에 55~57톤의 액체 갈륨이 사용되었다.[91]
- 이온원: 액체 금속 이온원으로 사용되어 집속 이온 빔을 생성한다. 예를 들어, 집속 갈륨 이온 빔은 세계에서 가장 작은 책인 ''턴업 타운의 티니 테드''를 만드는 데 사용되었다.[93]
- 윤활제: 스키와 기타 저마찰 표면 재료의 글라이드 왁스에 첨가제로 사용된다.[94]
- 플렉서블 전자기기: 갈륨의 특성은 플렉서블하고 웨어러블한 기기를 개발하는 데 적합할 수 있다고 추측된다.[95][96]
- 수소 생성: 갈륨은 알루미늄의 보호 산화층을 파괴하여 물이 AlGa의 알루미늄과 반응하여 수소 가스를 생성할 수 있게 한다.[97]
- 장난: 갈륨 수저를 만들어 차를 제공하면 뜨거운 차에서 녹는 장난에 사용될 수 있다.[98]
7. 생체 내 이용
갈륨은 생물학적으로 자연적인 기능을 가지고 있지 않지만, 갈륨 이온은 철(III)(iron(III))과 유사한 방식으로 체내 과정에 관여한다. 이러한 과정에는 많은 질병 상태의 지표인 염증이 포함되므로, 여러 갈륨 염이 의학에서 의약품 및 방사성의약품으로 사용되거나 개발 중이다.[83] 종양을 가진 동물에 67Ga(III) 시트르산염을 주사했을 때 종양 부위에 국한됨이 발견되면서 갈륨의 항암 특성에 대한 관심이 생겨났다. 임상 시험 결과, 질산갈륨(gallium nitrate)이 비호지킨 림프종과 요로 상피암에 대한 항종양 활성을 가지는 것으로 나타났다. 트리스(8-퀴놀리놀라토)갈륨(III)(KP46) 및 말톨산갈륨(gallium maltolate)과 같은 새로운 세대의 갈륨-리간드 복합체가 등장했다.[83] 질산갈륨(상표명 Ganite)는 뼈로의 종양 전이와 관련된 고칼슘혈증을 치료하기 위한 정맥 주사용 의약품으로 사용되어 왔다. 갈륨은 파골세포 기능을 방해하는 것으로 생각되며, 다른 치료법이 실패했을 때 효과적일 수 있다.[84] 경구용으로 흡수율이 높은 갈륨(III) 이온 형태인 말톨산갈륨은 병리적으로 증식하는 세포, 특히 암세포와 철(III)(Fe3+) 대신 이를 받아들이는 일부 박테리아에 대한 항증식 효과를 나타낸다. 연구자들은 이 화합물을 다양한 암, 감염성 질환 및 염증성 질환의 잠재적 치료제로 임상 및 전임상 시험을 수행하고 있다.[85]
''슈도모나스속''과 같은 박테리아가 철(III) 대신 갈륨 이온을 잘못 흡수하면 이온은 호흡을 방해하고 박테리아는 죽는다. 이는 철은 산화환원 활성을 가지고 있어 호흡 중 전자 전달을 허용하지만 갈륨은 산화환원 비활성이기 때문이다.[86][87]
복합 아민-페놀 Ga(III) 화합물 MR045는 클로로퀸(말라리아 치료에 사용되는 일반적인 약물)에 내성이 있는 기생충에 대해 선택적으로 독성을 나타낸다. Ga(III) 복합체와 클로로퀸 모두 기생충이 혈액을 소화하여 형성되는 폐기물인 헤모조인의 결정화를 억제하여 작용한다.[88][89]
갈륨-67 (Gallium-67)의 염, 예를 들어 구연산갈륨(citrate)과 질산갈륨(nitrate)은 핵의학 영상 기법인 갈륨 스캔에서 방사성의약품으로 사용된다. 67Ga라는 방사성 동위원소가 사용되며, 갈륨의 화합물이나 염의 종류는 중요하지 않다. 신체는 Ga3+를 Fe3+와 거의 같은 방식으로 처리하며, 이온은 염증 부위(예: 감염 부위)와 세포 분열이 빠른 부위에 결합하여(그리고 농축되어) 축적된다. 이를 통해 핵 스캔 기법으로 이러한 부위를 영상화할 수 있다.[106]
갈륨-68은 반감기가 68분인 양전자 방출체로, 현재 DOTATOC(신경내분비 종양 조사에 사용되는 소마토스타틴 유사체)나 신경내분비 전이 및 폐 신경내분비암(특정 유형의 ''미세세포종'' 등)에 사용되는 보다 새로운 유사체인 DOTA-TATE와 같은 의약품에 결합하여 PET-CT에서 진단용 방사성핵종으로 사용된다. 갈륨-68의 의약품으로서의 제조는 화학적이며, 이 방사성핵종은 갈륨-68 발생기에서 저마늄의 합성 방사성 동위원소인 저마늄-68로부터 용출에 의해 추출된다.[90] 갈륨(III) 이온은 생체 내에서 철(III) 이온과 마찬가지로 행동하기 때문에, 철(III) 이온이 관여하는 생체 반응에 상호 작용하여 국재화된다. 이러한 성질을 이용하여 질병 추정 검사인 신티그램에 갈륨염이 사용되고 있다. 또한 갈륨의 생물학적 역할은 알려져 있지 않지만, 대사 촉진을 돕는다는 것이 제시되었다.[168]
8. 해양에서의 갈륨
미량 원소 분석 기술이 발전하면서 과학자들은 대서양과 태평양에서 용존 갈륨의 흔적을 발견할 수 있었다.[99] 최근에는 보퍼트해에서도 용존 갈륨 농도가 나타났다.[99][100] 이러한 결과는 태평양과 대서양 해수가 가진 특성을 반영한다.[100] 태평양의 경우, 일반적인 용존 갈륨 농도는 수심 150m 미만에서 4~6 pmol/kg이다. 반면 대서양 해수는 수심 350m 초과에서 25~28 pmol/kg이다.[100]
갈륨은 주로 대기 중 침강을 통해 해양으로 유입되지만, 해양에서 알루미늄의 분포를 밝히는 데 사용될 수 있다.[101] 갈륨은 알루미늄과 지구화학적으로 유사하지만 반응성이 낮기 때문이다. 갈륨은 알루미늄보다 표층수 체류 시간이 약간 더 길다.[101] 갈륨은 알루미늄과 유사한 용존 프로파일을 가지고 있어 알루미늄의 추적자로 사용될 수 있다.[101] 갈륨은 대기 중 철 유입의 추적자로도 사용될 수 있다.[102] 갈륨은 북서 태평양, 남대서양 및 중앙 대서양에서 철의 추적자로 사용된다.[102] 예를 들어, 북서 태평양의 아극지역에서는 표층수의 갈륨 농도가 낮은데, 이는 먼지 유입량이 적다는 것을 보여주며, 영양염이 풍부하고 클로로필이 부족한 환경적 특성을 설명할 수 있다.[102]
9. 주의 사항
갈륨 금속 자체는 독성이 없다. 그러나 여러 갈륨 화합물은 독성이 있다.
갈륨 할로겐화물 착물은 독성이 있을 수 있다.[105] 수용성 갈륨 염의 Ga3+ 이온은 대량으로 주입될 경우 불용성 수산화물을 형성하는 경향이 있다. 이 수산화물의 침전은 동물에서 신장 독성을 유발했다. 소량의 수용성 갈륨은 잘 견디며 독으로 축적되지 않고 주로 소변을 통해 배설된다. 갈륨의 배설은 두 단계로 진행되는데, 첫 번째 단계는 생물학적 반감기가 1시간이고, 두 번째 단계는 생물학적 반감기가 25시간이다.[106]
흡입된 Ga2O3 입자는 아마도 독성이 있을 것이다.[107]
인간의 손바닥에 고체 갈륨을 올려놓으면 체온으로 녹고, 녹은 갈륨을 다른 용기 등으로 옮기면 서서히 고체로 돌아오기 때문에, 융점에 관한 교육 자료로 활용할 수 있다. 다만, 액체 갈륨은 젖음성이 강하여 손이나 유리에 묻으면 잘 떨어지지 않으므로 취급에 주의해야 한다.
참조
[1]
논문
Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks
https://www.research[...]
[2]
웹사이트
Gallium (CAS Number 7440-55-3) : Strem Product Catalog
https://www.strem.co[...]
2023-12-04
[3]
서적
Selected Values of the Crystallographic Properties of Elements
ASM International
2018
[4]
서적
CRC, Handbook of Chemistry and Physics
Chemical Rubber Company Publishing
[5]
서적
The Periodic Table: Its Story and Its Significance
Oxford University Press
[6]
웹사이트
Gallium – Element information, properties and uses Periodic Table
https://www.rsc.org/[...]
[7]
논문
COST action TD1407: network on technology-critical elements (NOTICE)—from environmental processes to human health threats
2015
[8]
논문
Less-Studied Technology-Critical Elements (Nb, Ta, Ga, In, Ge, Te) in the Marine Environment: Review on Their Concentrations in Water and Organisms
2019
[9]
서적
Chemistry of the Elements
Butterworth-Heinemann
[10]
논문
Grain boundary imaging, gallium diffusion and the fracture behavior of Al–Zn Alloy – An in situ study
2003
[11]
웹사이트
Liquid Metal Embrittlement of ASTM A723 Gun Steel by Indium and Gallium
https://apps.dtic.mi[...]
Defense Technical Information Center
1999-06-01
[12]
논문
The International Temperature Scale of 1990 (ITS-90)
http://www.bipm.org/[...]
1990-01-01
[13]
웹사이트
ITS-90 documents at Bureau International de Poids et Mesures
http://www.bipm.org/[...]
[14]
간행물
Guidelines for Realizing the International Temperature Scale of 1990 (ITS-90)
http://www.cstl.nist[...]
National Institute of Standards and Technology
1990-08-01
[15]
논문
NIST realization of the gallium triple point
http://ws680.nist.go[...]
[16]
논문
Extreme undercooling (down to 90K) of liquid metal nanoparticles
[17]
학회발표
2019 IEEE 32nd International Conference on Micro Electro Mechanical Systems (MEMS)
[18]
논문
Ab initio calculations of structural and electronic properties of gallium solid-state phases
1995-10-01
[19]
보고서
Phase diagrams of the elements
1975-09-11
[20]
논문
Energy dispersive x-ray diffraction and reverse Monte Carlo structural study of liquid gallium under pressure
2012-11-07
[21]
논문
Structural Ordering in Liquid Gallium under Extreme Conditions
2020-04-09
[22]
서적
Handbook of Electron Tube and Vacuum Techniques
https://books.google[...]
Springer
1992
[23]
논문
The NUBASE evaluation of nuclear and decay properties
https://hal.archives[...]
[24]
서적
Inorganic chemistry
Academic Press
2001
[25]
서적
Chemistry of aluminium, gallium, indium, and thallium
Springer
1993
[26]
서적
Electrochemistry—Volume 3: Specialist periodical report
https://books.google[...]
Royal Society of Chemistry
1971
[27]
논문
The Structure of Gallium in Strongly Alkaline, Highly Concentrated Gallate Solutions—a Raman and {{SimpleNuclide|Ga|71}}-NMR Spectroscopic Study
[28]
서적
Concise encyclopedia chemistry
https://archive.org/[...]
Walter de Gruyter
1994
[29]
서적
Advances in inorganic chemistry and radiochemistry
Academic Press
1962
[30]
서적
Semiconductors: data handbook
Birkhäuser
2004
[31]
논문
Mercury gallium sulfide, HgGa₂S₄, a new phosphor
[32]
서적
Inorganic Chemistry
Lotus Press
2006
[33]
서적
Text Book Of Inorganic Chemistry
Discovery Publishing House
2005
[34]
서적
Advances in Inorganic Chemistry
Academic Press
1994
[35]
논문
Reducing Ga-H and Ga-C Bonds in Close Proximity to Oxidizing Peroxo Groups: Conflicting Properties in Single Molecules
2009-10-26
[36]
논문
GaCl₃ in Organic Synthesis
2005
[37]
서적
The Ingredients: A Guided Tour of the Elements
Oxford University Press
2002
[38]
논문
Caractères chimiques et spectroscopiques d'un nouveau métal, le gallium, découvert dans une blende de la mine de Pierrefitte, vallée d'Argelès (Pyrénées)
1875
[39]
논문
The discovery of the elements. XIII. Some elements predicted by Mendeleeff
1932
[40]
뉴스
Gallium
https://images.libra[...]
GPO
1978
[41]
뉴스
An Overview of Gallium
https://www.azom.com[...]
AZoNetwork
2001-12-18
[42]
웹사이트
History of Gallium–Nitride-Based Light-Emitting Diodes for Illumination
https://ieeexplore.i[...]
2024-12-20
[43]
웹사이트
Why It Was Almost Impossible to Make the Blue LED
https://www.getrecal[...]
2024-12-20
[44]
논문
Background story of the invention of efficient blue InGaN light emitting diodes (Nobel Lecture)
https://onlinelibrar[...]
2015
[45]
논문
Assessing Rare Metal Availability Challenges for Solar Energy Technologies
https://www.mdpi.com[...]
2015-09-01
[46]
웹사이트
Gallium: Assessing the long term future extraction, supply, recycling and price of using WORLD7, in relation to future technology visions in the European Union
https://www.research[...]
2024-12-20
[47]
논문
The distribution of gallium, germanium and indium in conventional and non-conventional resources – Implications for global availability
2016
[48]
논문
The abundances of gallium and germanium in terrestrial materials
2007
[49]
웹사이트
Mineral Yearbook 2006: Gallium
https://minerals.usg[...]
United States Geological Survey
2008-11-20
[50]
논문
Determination of gallium in coal and coal fly ash by electrothermal atomic absorption spectrometry using slurry sampling and nickel chemical modification
1992
[51]
웹사이트
Gallium in West Virginia Coals
http://www.wvgs.wvne[...]
West Virginia Geological and Economic Survey
2002-03-02
[52]
논문
Recovery of gallium and vanadium from gasification fly ash
2007
[53]
논문
Elements in Coal Ash and Their Industrial Significance
1953
[54]
논문
Gallium, germanium, indium, and other trace and minor elements in sphalerite as a function of deposit type — A meta-analysis
2016-07
[55]
논문
On the current and future availability of gallium
2016-03
[56]
논문
Gallium: the backbone of the electronics industry
2003
[57]
논문
Assessing the supply potential of high-tech metals – A general method
2015
[58]
논문
Quantifying the relative availability of high-tech by-product metals – The cases of gallium, germanium and indium
2017-06
[59]
서적
Gallium – In: USGS Mineral Commodity Summaries
https://minerals.usg[...]
United States Geological Survey
[60]
웹사이트
Galium
https://minerals.usg[...]
USGS
2018
[61]
웹사이트
What are Gallium and Germanium? China curbs exports of metals critical to chips and other tech
https://www.cnbc.com[...]
2023-07-04
[62]
웹사이트
China verhängt Ausfuhrkontrollen für seltene Metalle
https://www.tagessch[...]
2023-07-04
[63]
논문
Gallium and Gallium Compounds
Wiley-VCH, Weinheim
2012
[64]
웹사이트
Global Gallium consumption distribution by end-use
https://www.statista[...]
2024-12-20
[65]
웹사이트
Mineral Commodity Summary 2006: Gallium
http://minerals.usgs[...]
United States Geological Survey
2008-11-20
[66]
서적
Advances in Semiconductor Lasers
https://books.google[...]
Academic Press
2012-05-02
[67]
논문
The performance of gallium arsenide/germanium solar cells at the Martian surface
2004
[68]
논문
Material and device properties of single-phase Cu(In,Ga)(Se,S)2 alloys prepared by selenization/sulfurization of metallic alloys
2003
[69]
논문
Voltammetric analysis using a self-renewable non-mercury electrode
2005-11
[70]
뉴스
Hot chips chilled with liquid metal
https://www.newscien[...]
2005-05-05
[71]
웹사이트
High Performance Liquid Metal Thermal Interface for Large Volume Production
https://domino.resea[...]
2019-11-20
[72]
웹사이트
Technology solidifies carbon dioxide – ASME
https://www.asme.org[...]
2022-09-05
[73]
웹사이트
New way to turn carbon dioxide into coal could 'rewind the emissions clock'
https://www.science.[...]
2022-09-05
[74]
서적
Liquid-metals handbook
https://books.google[...]
U.S. Govt. Print. Off.
1954
[75]
학술지
Giant and switchable surface activity of liquid metal via surface oxidation
2014-09-30
[76]
학술지
Liquid metal actuator driven by electrochemical manipulation of surface tension
2017-12-18
[77]
학술지
Soft actuators by electrochemical oxidation of liquid metal surfaces
2021
[78]
학술지
Muscle-Inspired Linear Actuators by Electrochemical Oxidation of Liquid Metal Bridges
2022-09
[79]
학술지
Liquid Metal Actuators: A Comparative Analysis of Surface Tension Controlled Actuation
2024-01
[80]
논문
Liquid metal actuators
https://kilthub.cmu.[...]
Carnegie Mellon University
2022
[81]
웹사이트
Section 6.2.2.1
http://nuclearweapon[...]
2008-01-24
[82]
논문
Thermochemical Behavior of Gallium in Weapons-Material-Derived Mixed-Oxide Light Water Reactor (LWR) Fuel
https://zenodo.org/r[...]
2005
[83]
서적
Metallo-Drugs: Development and Action of Anticancer Agents
2018
[84]
웹사이트
gallium nitrate
http://www.cancer.or[...]
2009-07-07
[85]
논문
Chemistry and Pharmacokinetics of Gallium Maltolate, a Compound With High Oral Gallium Bioavailability
2000
[86]
웹사이트
A Trojan-horse strategy selected to fight bacteria
http://www.infoniac.[...]
INFOniac.com
2008-11-20
[87]
웹사이트
Gallium May Have Antibiotic-Like Properties
http://www.medpageto[...]
MedPage Today
2008-11-20
[88]
논문
Probing the chloroquine resistance locus of Plasmodium falciparum with a novel class of multidentate metal(III) coordination complexes
1997
[89]
서적
Medicinal Organometallic Chemistry
2010
[90]
논문
Clinical Applications of Gallium-68
2013-06
[91]
웹사이트
Russian American Gallium Experiment
http://ewi.npl.washi[...]
2001-10-19
[92]
웹사이트
Neutrino Detectors Experiments: GALLEX
http://lapp.in2p3.fr[...]
1999-06-26
[93]
뉴스
Nano lab produces world's smallest book
https://www.sfu.ca/m[...]
Simon Fraser University
2007-04-11
[94]
특허
Use of a synthetic resin composition containing gallium particles in the glide surfacing material of skis and other applications
1995
[95]
논문
Gallium: The liquid metal that could transform soft electronics
https://knowablemaga[...]
2022-05-03
[96]
논문
Gallium Liquid Metal: The Devil's Elixir
2021-07-26
[97]
논문
Aluminum Nanoparticles from a Ga–Al Composite for Water Splitting and Hydrogen Generation
2022-02-25
[98]
서적
The Disappearing Spoon: And Other True Tales of Madness, Love, and the History of the World from the Periodic Table of the Elements
https://archive.org/[...]
Little, Brown and Company
2010
[99]
논문
Dissolved Gallium in the Open Ocean
1988-04
[100]
논문
Dissolved Gallium in the Beaufort Sea of the Western Arctic Ocean: A GEOTRACES cruise in the International Polar Year
2015-12-20
[101]
논문
Dissolved Gallium in the Atlantic Ocean
1998-06-01
[102]
논문
Dissolved Gallium in the northwest Pacific and the south and central Atlantic Oceans: Implications for aeolian Fe input and reconsideration of Profiles
2006-08-01
[103]
웹사이트
Gallium 203319
https://www.sigmaald[...]
Sigma Aldrich
[104]
웹사이트
MSDS – 203319
https://www.sigmaald[...]
Sigma Aldrich
[105]
논문
Gallium poisoning: a rare case report.
2012-02-01
[106]
서적
Handbook on the Toxicology of Metals
Academic Press
2014-08-07
[107]
서적
Encyclopedia of Environmental Health
2011-01-01
[108]
웹사이트
http://www.encyclo.c[...]
[109]
논문
Gallium: the backbone of the electronics industry
2003-01-01
[110]
서적
Viewegs Geschichte der Chemie
Vieweg
1997-01-01
[111]
논문
Caractères chimiques et spectroscopiques d'un nouveau métal, le gallium, découvert dans une blende de la mine de Pierrefitte, vallée d'Argelès (Pyrénées)
http://gallica.bnf.f[...]
2010-11-15
[112]
서적
Discovery of the Elements
Kessinger Publishing
[113]
서적
化学の歴史
ちくま学芸文庫
[114]
간행물
村上 (2004)
[115]
백과사전
Gallium
Thieme Verlag
2006-12
[116]
백과사전
Gallium and Gallium Compounds
Wiley-VCH
[117]
논문
Atomic structure of the α-Ga(001) surface investigated by scanning tunneling microscopy: Direct evidence for the existence of Ga₂ molecules in solid gallium
[118]
서적
CRC Handbook of Chemistry and Physics
CRC (Chemical Rubber Publishing Company)
[119]
논문
Grain boundary imaging, gallium diffusion and the fracture behavior of Al–Zn Alloy – An in situ study
[120]
보고서
Liquid Metal Embrittlement of ASTM A723 Gun Steel by Indium and Gallium
http://stinet.dtic.m[...]
Defense Technical Information Center
1999-06
[121]
웹사이트
広温度範囲で使用できるマイクロ磁歪アクチュエータ
https://www.aml.t.u-[...]
東京大学 工学系研究科 精密工学専攻 先端メカトロニクス研究室
2011-06-06
[122]
서적
千谷 (1959)
[123]
서적
Anorganische Strukturchemie
Vieweg+Teubner Verlag
[124]
서적
Lehrbuch der Anorganischen Chemie
de Gruyter
[125]
서적
Lehrbuch der Anorganischen Chemie
de Gruyter
[126]
논문
A refinement of the crystal structure of gallium
[127]
논문
Structure cristalline du gallium β
[128]
논문
Structure cristalline de Ga γ
[129]
논문
Structure cristalline de Ga δ
[130]
논문
Crystal structure of Ga(II) and Ga(III)
[131]
논문
High-pressure bct-fcc phase transition in Ga
[132]
논문
High-pressure bct-fcc phase transition in Ga
[133]
서적
Concise encyclopedia chemistry
Walter de Gruyter
[134]
서적
Wiberg, Holleman (2001)
[135]
서적
Downs (1993)
[136]
논문
The Structure of Gallium in Strongly Alkaline, Highly Concentrated Gallate Solutions—a Raman and 71Ga-NMR Spectroscopic Study
[137]
서적
Downs (1993)
[138]
서적
Electrochemistry—Volume 3: Specialist periodical report
https://books.google[...]
Royal Society of Chemistry
[139]
서적
Downs (1993)
[140]
서적
Downs (1993)
[141]
서적
Greenwood (1962)
[142]
서적
Downs (1993)
[143]
서적
Greenwood (1962)
[144]
서적
Semiconductors: data handbook
Birkhäuser
[145]
서적
Greenwood (1962)
[146]
논문
Mercury gallium sulfide, HgGa2S4, a new phosphor
[147]
서적
Greenwood (1962)
[148]
서적
Wiberg, Holleman (2001)
[149]
서적
Greenwood (1962)
[150]
서적
Greenwood (1962)
[151]
서적
Inorganic Chemistry
Lotus Press
[152]
간행물
Downs (1993)
[153]
간행물
Downs (1993)
[154]
간행물
Downs (1993)
[155]
간행물
Wiberg, Holleman (2001)
[156]
서적
Text Book Of Inorganic Chemistry
Discovery Publishing House
[157]
간행물
千谷 (1959)
[158]
간행물
Wiberg, Holleman (2001)
[159]
간행물
Wiberg, Holleman (2001)
[160]
서적
Advances in Inorganic Chemistry, Volume 41
Academic Press
[161]
서적
コットン、ウィルキンソン (1987)
[162]
논문
A reaction-transport model of GaAs growth by metalorganic chemical vapor deposition using trimethyl-gallium and tertiary-butyl-arsine
[163]
간행물
大量生産GaN用MOCVD装置の開発
http://www.tn-sanso-[...]
大陽日酸
[164]
서적
コットン、ウィルキンソン (1987)
[165]
서적
コットン、ウィルキンソン (1987)
[166]
논문
Gallium Safety in the Laboratory
http://www.osti.gov/[...]
2010-11-15
[167]
웹사이트
Section 6.2.2.1
http://nuclearweapon[...]
2010-11-16
[168]
웹사이트
Scholar Edition: gallium: Biological information
http://www.webelemen[...]
The University of Sheffield and WebElements Ltd, UK
2010-11-15
[169]
논문
The International Temperature Scale of 1990 (ITS-90)
http://www.bipm.org/[...]
2010-11-15
[170]
웹사이트
ITS-90 documents at Bureau International de Poids et Mesures
http://www.bipm.org/[...]
2010-11-15
[171]
논문
Guidelines for Realizing the International Temperature Scale of 1990 (ITS-90)
http://www.cstl.nist[...]
National Institute of Standards and Technology
1990-08-01
[172]
뉴스
中国のレアメタル戦略 ガリウム・ゲルマニウム規制の狙いは?
https://www3.nhk.or.[...]
2023-08-08
[173]
간행물
ストロンチウム及びガリウムの需要・供給・価格動向等
http://www.jogmec.go[...]
2008-12-21
관련 사건 타임라인
( 최근 20개의 뉴스만 표기 됩니다. )
전략광물 30종 특정국 편중 심화…"안정적 확보 필요"
전세계 전략 광물 30개 특정국 편중...공급 불균형 대비 필요
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

