면역글로불린 A
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
면역글로불린 A(IgA)는 두 가지 동형, IgA1과 IgA2로 존재하며, 혈액, 점막 분비물 등에서 발견된다. IgA는 혈청형과 분비형으로 나뉘며, 분비형 IgA(sIgA)는 J 사슬과 분비성분(SC)을 포함하는 중합체로, 점막 면역에서 중요한 역할을 한다. sIgA는 병원균의 상피세포 결합을 차단하고 면역 배제를 통해 작용하며, 소화관, 기도, 비강 등 점막 면역 방어계(MALT)의 일부를 구성한다. IgA는 형질세포에서 생성되어 점막 상피세포를 가로질러 수송되며, 점막에서 병원균에 대한 장벽을 형성한다. IgA 결핍은 선택적 IgA 결핍증을 유발하며, 임질균, 폐렴구균 등은 IgA를 분해하는 단백질분해효소를 생성한다. IgA는 IgA 신증, 셀리악병, 헤노흐-쇤라인 자반증 등 자가면역 및 면역 매개 질환과 관련이 있다.
더 읽어볼만한 페이지
- 항체 - 중화 항체
중화 항체는 병원체의 세포 침투를 막아 감염성을 억제하는 항체로, 바이러스 외피 단백질이나 세균 독소에 결합하여 작용하며, 수동 면역 치료나 백신 접종에 활용되지만, 일부 바이러스는 중화 항체를 회피하기도 하고, 광범위 중화 항체는 여러 바이러스 변종을 중화하는 능력이 있다. - 항체 - 면역글로불린 M
면역글로불린 M(IgM)은 초기 면역 반응에 관여하는 다량체 구조의 면역글로불린으로, 보체 활성화, 점막 이동, 특정 Fc 수용체 결합 등의 기능을 수행하며 감염성 질환 진단 및 혈액형 부적합 반응에 중요한 역할을 한다. - 당단백질 - 프로테오글리칸
프로테오글리칸은 단백질에 글리코사미노글리칸이라는 다당류가 결합된 복합체로, 동물과 식물에서 구조적 차이를 보이며 동물의 세포외기질에서 세포 간 공간을 채우고 조직의 수분 유지 및 분자 이동을 조절하는 역할을 수행하며, 분해 능력에 문제가 생기면 뮤코다당증 같은 유전 질환을 유발할 수 있다. - 당단백질 - 인터페론
인터페론은 바이러스 감염에 대한 세포 방어에 중요한 단백질로, 1형, 2형, 3형으로 나뉘어 면역 수용체에 따라 항바이러스, 항암 효과, 면역 체계 활성화 등의 다양한 작용을 하며, 유전자 조작을 통해 대량 생산되어 바이러스성 간염, 일부 종양 및 백혈병 치료에 활용된다.
| 면역글로불린 A | |
|---|---|
| 일반 정보 | |
 | |
| 유형 | 면역글로불린 |
| 사슬 유형 | 중쇄: IgA1: α1 IgA2: α2 경쇄: κ λ |
| 분자량 | 단량체: 160 kDa 이량체: 385 kDa |
| 유전자 | IgA1: IGHAI IgA2: IGHA2 |
| 발현 세포 | 형질 세포 |
| 발견 연도 | 1959년 |
| 특성 | |
| 기능 | 점막 면역 |
| 분포 | 혈액 점막 분비물 (눈물, 타액, 땀, 위장액, 호흡기 분비물, 모유) |
| 하위 유형 | |
| IgA1 | 주요 하위 유형 (혈액 내 IgA의 90%) |
| IgA2 | 점막 분비물에서 더 풍부함 |
| 임상적 중요성 | |
| IgA 결핍증 | 가장 흔한 선천성 면역 결핍 질환 |
| 추가 정보 | |
| 상호 작용 | FcαRI IgA 수용체 |
2. 형태
면역글로불린 A(IgA)는 IgA1과 IgA2라는 두 가지 주요 아이소타입으로 존재한다.[9] 이 두 아형은 구조, 체내 분포 등에서 차이를 보이며, 자세한 내용은 하위 문단에서 다룬다. IgA1과 IgA2 모두 심하게 글리코실화된 단백질이다.[9] 또한 IgA는 분비되는 형태 외에도 B 세포 표면에 결합한 막 결합 형태로 존재하여 B 세포 수용체의 일부로 기능할 수도 있다.[13]
2. 1. IgA1과 IgA2
IgA에는 두 가지 동형(isotype|아이소타입영어)인 IgA1과 IgA2가 존재한다. 이 두 아형은 인체 내 분포와 구조에서 차이를 보인다. IgA1과 IgA2를 분비하는 세포의 비율은 림프조직마다 다르다.[47]혈청에서는 IgA1이 전체 IgA의 약 80%를 차지하며 우세하고, 대부분의 림프 조직에서도 IgA1 생성 세포가 더 많다.[10][12] 혈액 내 IgA는 주로 단량체 형태로 존재하며, IgA1과 IgA2의 비율은 대략 10:1이다.[49] 반면, 점막 분비물에서는 IgA2의 비율이 혈청에서보다 높아 전체 분비형 IgA의 약 35%에 달한다.[10][48] 특히 장 관련 림프 조직(GALT)과 같은 분비성 림프 조직에서는 비장이나 말초 림프절 같은 비분비성 림프 기관에 비해 IgA2 생산 비율이 더 높다. 장관 내 형질 세포가 생산하는 IgA는 주로 J 사슬로 연결된 이합체 형태이며, 이때 IgA1과 IgA2의 비율은 약 2:3으로 IgA2가 더 우세하다.[49]
구조적으로 IgA2는 중쇄(H 사슬)와 경쇄(L 사슬)가 이황결합이 아닌 비공유결합으로 연결되어 있다는 특징이 있다.[48] 이러한 구조적 차이로 인해 IgA2는 장내 세균 등이 분비하는 단백질분해효소에 대한 저항성이 IgA1보다 강한 것으로 여겨진다. 반면, IgA1의 중쇄는 확장된 힌지(hinge) 영역을 가지고 있어 다가(multivalent) 항원의 다양한 항원 결정기(epitope) 간격에 더 유연하게 결합할 수 있지만, 특정 세균성 단백질분해효소에는 상대적으로 취약할 수 있다.[14]
IgA1과 IgA2는 모두 심하게 글리코실화된 단백질이며,[9] 초유, 모유, 눈물, 침(타액)과 같은 다양한 외부 분비물에서 공통적으로 발견된다.[48][10] 또한, 두 아형 모두 B 세포 표면에 막 결합 형태로 존재하여 B 세포 수용체(BCR)의 일부로 기능할 수도 있다.[13]
항원의 종류는 생성되는 IgA 아형의 비율에 영향을 줄 수 있다. 일반적으로 세균의 세포벽 성분과 같은 다당류 항원은 단백질 항원에 비해 IgA2의 생성을 더 많이 유도하는 경향이 있다.[47][11]
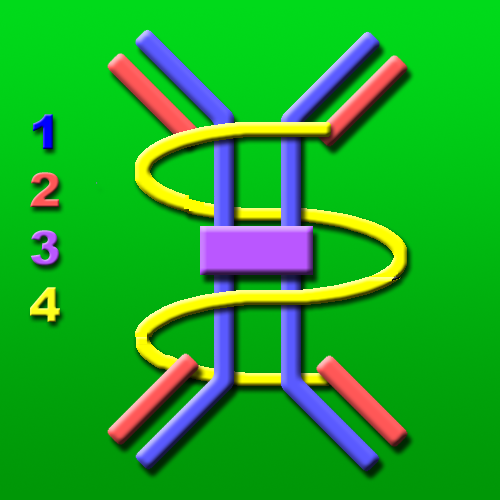
1. 중쇄(H 사슬, 파란색)
2. 경쇄(L 사슬, 주황색)
3. J 사슬(자주색)
4. SC(노란색)
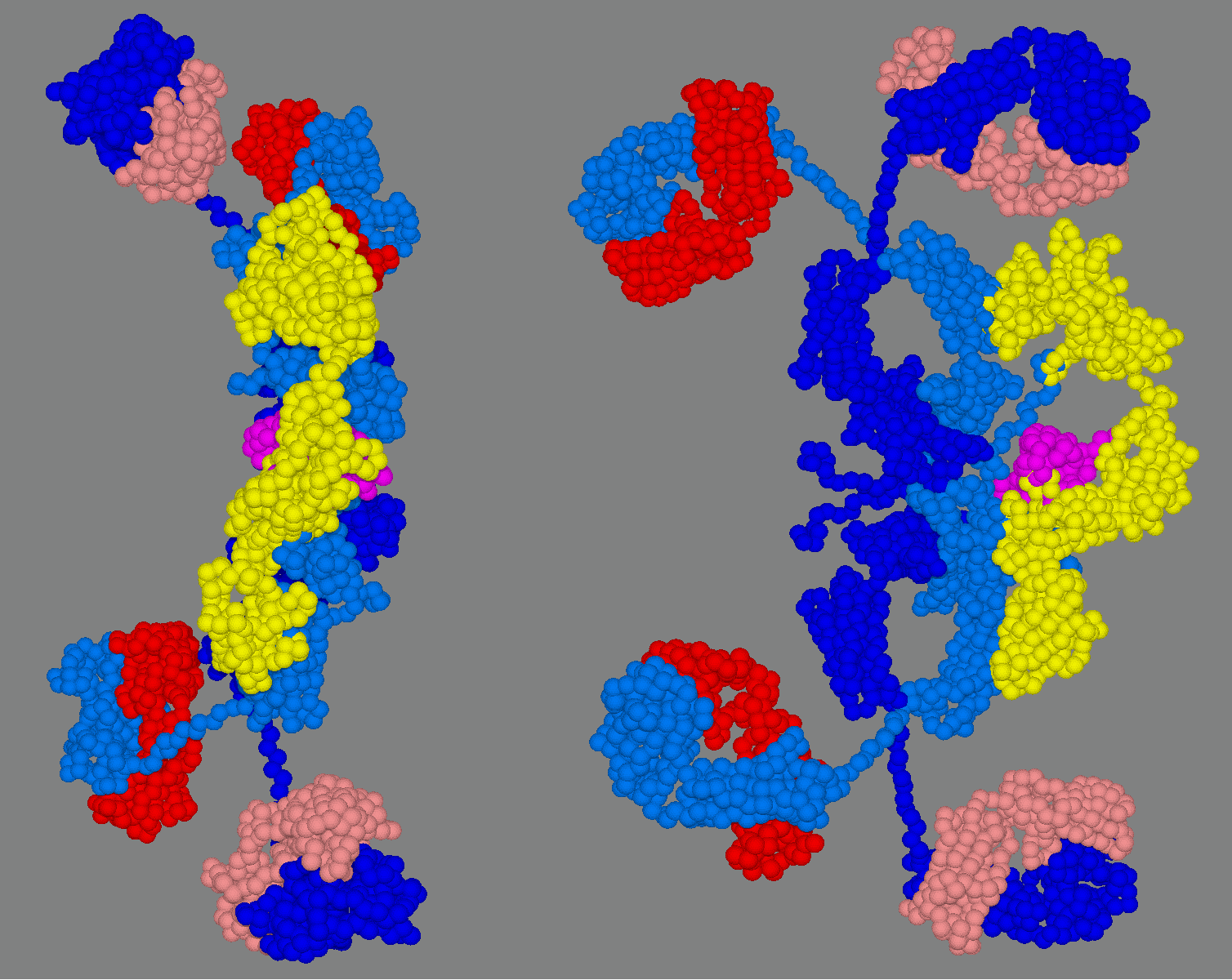
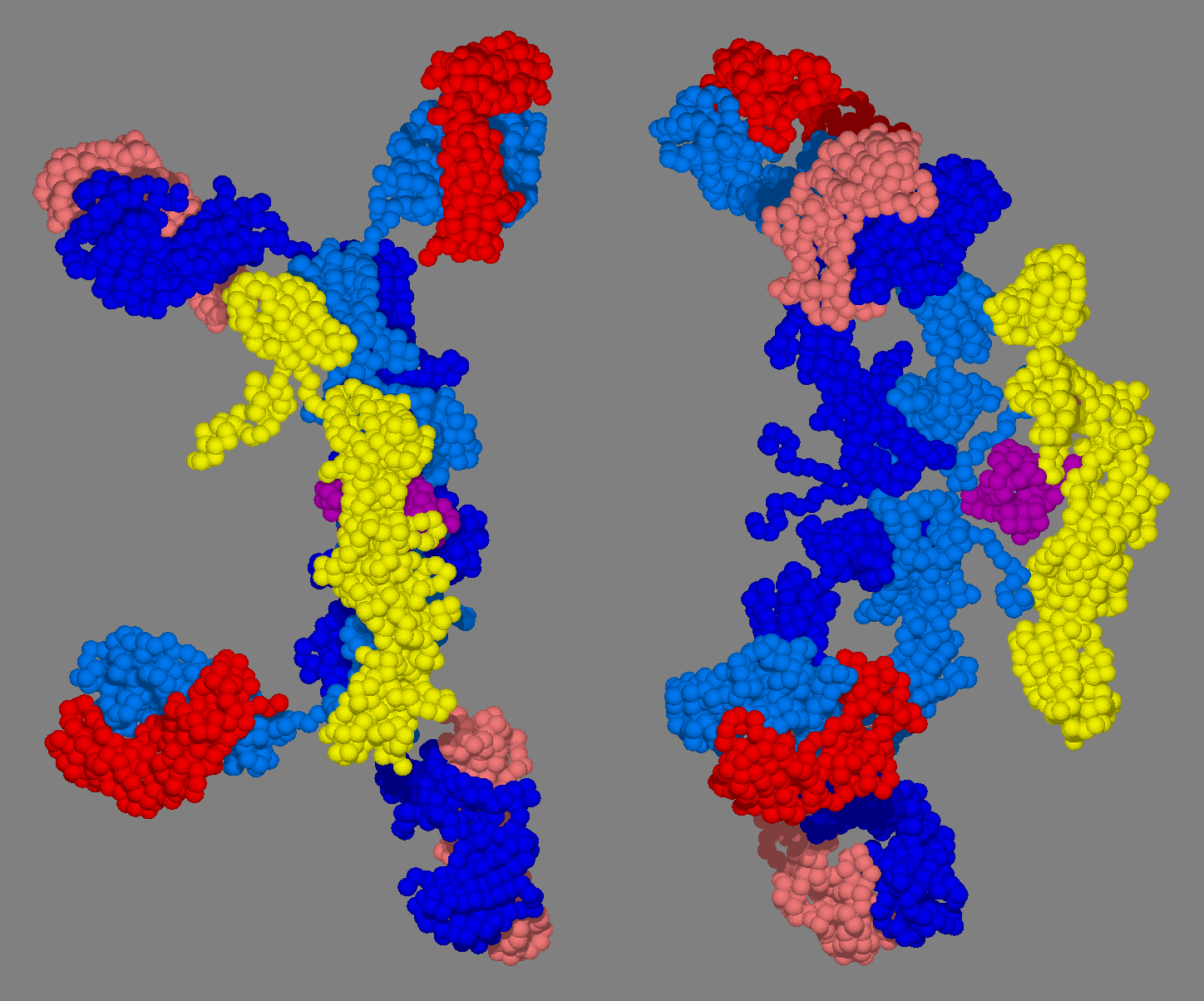
2. 2. 혈청형과 분비형
1. 중쇄(H 사슬, 파란색)2. 경쇄(L 사슬, 주황색)
3. J 사슬(자주색)
4. SC(노란색)]]
IgA는 혈청에 존재하는 형태와 분비되는 형태가 다르다. 혈청에 존재하는 IgA는 주로 단량체 형태이지만, 점막 표면 등으로 분비되는 분비형 IgA(secretory IgA|시크리터리 아이지에이영어, sIgA)는 IgA 단량체 2~4개가 J 사슬 (joining chain|조이닝 체인영어)이라는 추가적인 사슬로 연결된 중합체 형태이며, 총 분자량은 약 385 kDa이다.
J 사슬은 분자량 15 kDa의 폴리펩타이드로, 시스테인 잔기를 많이 포함하고 있으며 다른 면역글로불린과는 구조적으로 다르다. 이 J 사슬은 IgA를 분비하는 형질 세포에서 생산된다.
점막으로 분비되는 중합체 형태의 IgA에는 상피세포에서 생산된 분비성분(secretory component, SC)도 결합되어 있다. 분비성분은 분자량 70 kDa의 폴리펩타이드로, 원래 상피세포의 기저막 쪽에 존재하는 poly-Ig 수용체(130 kDa)의 일부이다. 이 수용체는 형질 세포가 분비한 중합체 IgA와 결합하여 IgA를 상피세포 안으로 들여와 세포를 가로질러 이동시키는 트랜스사이토시스 (transcytosis|트랜스사이토시스영어)를 통해 눈물, 침, 땀, 장액 등 점막 표면으로 운반하는 역할을 한다. 이 과정에서 poly-Ig 수용체의 일부가 잘려나가 IgA에 결합된 채로 남게 되는데, 이것이 분비성분이다. 분비성분은 IgA가 점막 표면의 단백질 분해효소에 의해 분해되는 것을 막아 안정적으로 기능할 수 있도록 보호하는 중요한 역할을 한다.
3. 생리적 기능
면역글로불린 A(IgA)는 인체의 주요 항체 중 하나로, 특히 점막 표면에서의 방어와 혈액 내 면역 조절에 중요한 역할을 수행한다.
점막에서는 주로 이량체 형태인 분비형 IgA(secretory IgA영어, sIgA)가 핵심적인 역할을 한다. 이는 점막 고유층의 형질세포에서 생산되어 중합체 면역글로불린 수용체(pIgR)를 통해 점막 상피세포를 거쳐 외부로 분비된다.[50] 분비된 sIgA는 병원균이나 독소가 점막 상피세포에 부착하는 것을 직접적으로 막고[51], 병원체를 응집시켜 점액과 함께 몸 밖으로 배출시키는 면역 배제(immune exclusion영어) 기능을 수행한다.[51] 중요한 특징 중 하나는 이러한 방어 과정에서 보체 활성화나 옵소닌화를 거의 유도하지 않아[52] 불필요한 염증 반응을 최소화하면서 효과적으로 병원체를 중화한다는 점이다.[51] 또한, 장 내 공생 미생물 군집의 균형을 조절하는 데에도 관여하는 것으로 알려져 있다.[52] 점막 면역 시스템과 sIgA의 구체적인 작용 방식은 #점막 면역에서의 역할 섹션에서 더 자세히 다룬다.
한편, 혈액 내에 존재하는 IgA는 주로 단량체 형태로 존재하며 다른 기능을 수행한다. 혈청 IgA는 호산구, 대식세포 등 다양한 면역 세포 표면에 있는 Fc 수용체인 FcαRI(CD89)와 결합한다.[50][41] 이 결합은 항체의존 세포매개 세포독성(ADCC), 식세포작용, 호흡폭발, 염증 매개 물질 분비 촉진 등 다양한 세포 매개 면역 반응을 유발하여 침입한 병원체에 대응하는 염증 반응을 개시한다.[50][41] 혈청 IgA의 상세한 기능은 #혈청 IgA의 기능 섹션에서 설명한다.
3. 1. 점막 면역에서의 역할
점막은 외부 환경과 끊임없이 접촉하며 병원균이나 외부 항원에 노출되는 주요 경로이다. 따라서 점막 표면에는 이를 방어하기 위한 특수한 국소 면역 기전인 점막 면역 방어계(MALT, Mucosa-associated Lymphoid Tissue영어)가 존재한다.[36] 대표적인 MALT로는 소화관의 장연관 림프조직(GALT),[37] 기도의 기관지연관 림프조직(BALT),[38] 비강의 비강연관 림프조직(NALT)[36] 등이 알려져 있다. 분비형 IgA(sIgA)는 이러한 점막 면역 시스템의 핵심적인 역할을 수행한다.점막 면역은 항원 인식 및 면역 반응 유도가 일어나는 '유도 조직'과 실제 IgA가 분비되어 기능하는 '실효 조직', 그리고 이 둘을 연결하는 '귀소 경로'로 구성된다. 이를 합쳐 '공통 점막 면역 기전'(CMIS[39], Common Mucosal Immune System영어)이라고도 부른다. 유도 조직의 항원 제시 세포는 림프구를 활성화시키고 특정 점막 부위로 이동하도록 유도한다. 활성화된 림프구는 림프절 등에서 분화한 후 실효 조직으로 이동하여 IgA를 생산하는데, 한번 특정 유도 조직에서 활성화된 림프구는 다시 같은 종류의 점막 조직으로 돌아가는 경향(호밍, 귀소 현상)을 보인다.[40]
실효 조직의 점막 고유층에 존재하는 IgA 생산 형질세포는 J 사슬과 결합된 이량체 형태의 IgA를 생산하여 분비한다.[17] 형질세포는 본래 IgM을 생산하는 B 세포에서 분화하는데, 사이토카인인 TGF-β와 인터루킨-4(IL-4)의 자극을 받아 클래스 스위칭을 통해 IgA 생산 능력을 갖추게 된다. 이후 인터루킨-5(IL-5)와 인터루킨-6(IL-6)의 추가 자극으로 최종 분화한다. 이 과정에는 Th2 타입 사이토카인이 중요하게 작용한다. 생산된 이량체 IgA는 점막 상피세포의 바닥쪽 막(기저외측 표면)에 있는 중합체 면역글로불린 수용체(pIgR)에 결합하여 세포내이입을 통해 세포 안으로 흡수된다.[16][17] IgA-수용체 복합체는 세포를 가로질러 이동한 뒤, 수용체의 일부인 분비 성분(SC, Secretory Component영어)과 함께 점막 표면(강 표면)으로 분비되어 최종적으로 분비형 IgA(sIgA)가 된다.[17] 분비 성분은 sIgA가 점막 표면의 단백질 분해효소에 의해 분해되는 것을 막아 안정성을 높이는 역할을 한다.[17]
점막 표면에서 sIgA의 주요 기능은 병원균의 침입을 막는 것이다. sIgA는 병원균 표면의 특정 부위(리간드)에 결합하여 병원균이 상피세포 표면의 수용체에 부착하는 것을 직접적으로 방해한다.[51][19] 여러 sIgA 분자가 하나의 병원체에 결합하면 입체적인 방해를 통해 병원체의 상피 접근을 더욱 효과적으로 차단할 수 있다.[51][19] 또한 sIgA는 면역 배제(immune exclusion영어)라는 과정을 통해 병원체를 제거한다. 이는 sIgA가 여러 병원체나 다중가 항원을 서로 연결하여 큰 응집체를 형성시킨 후, 이를 점액층에 가두어 연동 운동을 통해 몸 밖으로 배출시키는 방식이다.[51][19] sIgA 분자에 포함된 분비 성분의 올리고사카라이드 사슬은 점액층과의 결합을 용이하게 하여 이 과정을 돕는다.[51][19]
중요한 특징 중 하나는 sIgA가 이러한 방어 작용을 수행하면서도 보체를 활성화하거나 옵소닌화를 유도하는 능력은 낮다는 점이다.[52][19] 이는 sIgA가 병원체를 효과적으로 중화하면서도 불필요한 염증 반응을 일으키지 않아 점막 조직의 손상을 최소화한다는 것을 의미한다. 이는 항상 외부 항원에 노출되어 있는 점막 환경에 적합한 면역 전략이라 할 수 있다.
sIgA는 외부 병원균뿐만 아니라 장내 미생물총을 구성하는 공생균에 대한 특이적인 항체도 포함하고 있다. 이 IgA는 장내 미생물 군집의 균형을 조절하고 장 건강을 유지하는 데 기여하는 것으로 생각되며, 특별한 감염 상황이 아닌 이상 혈액에서는 거의 발견되지 않는다.[52] 장내 sIgA 분비는 하루 중 특정 시간대에 증가하는 일주기 리듬을 보이며, 이는 장내 미생물군과의 상호작용을 통해 조절될 수 있다.[18]
특정 항원에 대한 sIgA의 생산은 점막의 M 세포가 항원을 샘플링하여 그 아래의 수지상세포와 T 세포에 제시하는 것으로 시작된다. 이후 GALT, 장간막 림프절, 독립 림프 소포 등에서 B 세포의 활성화와 클래스 스위칭이 일어나 IgA를 생산하는 형질세포로 분화하게 된다.[51][19]
한편, 혈액 내에 존재하는 단량체 형태의 IgA는 점막의 sIgA와는 다른 역할을 한다. 혈청 IgA는 호산구, 대식세포 등 면역 세포 표면의 Fc 수용체인 FcαRI(CD89)에 결합하여 항체의존 세포매개 세포독성(ADCC), 식세포작용, 호흡폭발, 염증 매개 물질 분비 촉진 등 다양한 염증성 면역 반응을 유발할 수 있다.[50][41] 이는 점막에서의 비염증성 방어와는 대조적인 기능이다.
3. 2. 혈청 IgA의 기능
혈액 내 IgA는 면역 효과 세포 표면에 발현되는 Fc 수용체인 FcαRI (또는 CD89)와 상호작용하여 염증 반응을 시작한다.[50][16][41] IgA가 이 수용체(FcαRI)에 결합하면 항체의존 세포매개 세포독성(ADCC), 호산구와 호염기구의 탈과립, 단핵구, 대식세포, 호중구에 의한 식세포작용, 다형핵 백혈구에 의한 호흡폭발, 그리고 염증 매개체의 유리 촉진 등 다양한 면역 반응이 유발된다.[50][16][41]IgM이나 IgG와는 달리, 혈청 IgA는 고전적인 보체 경로를 활성화하지 않는다. 대신 대체 보체 경로와 렉틴 경로를 통해 보체를 활성화할 수 있다.[15] IgA에 대한 Fc 수용체인 FcαR(CD89)의 유전자는 클로닝되었다.[41]
4. 장 내강으로의 이동
점막에 IgA가 풍부한 것은 중합체형 IgA(polymeric IgA|중합체형 IgA영어, pIgA)를 생산하는 형질세포와 중합체 면역글로불린 수용체(pIgR)를 발현하는 점막 상피세포 간의 협력 덕분이다.[16][50]
주로 이합체 형태인 중합체 IgA는 점막 표면 근처 고유판의 형질세포에서 생산된다.[17][53] 생성된 이합체 IgA는 상피세포의 바닥가쪽 표면에 있는 중합체 면역글로불린 수용체(pIgR)에 결합한다.[17][53]
수용체에 결합한 IgA는 세포내이입을 통해 상피세포 안으로 들어가며,[17][53] 수용체-IgA 복합체는 세포 구획을 가로질러 상피세포의 내강 쪽 경계까지 이동한다.[17][53] 이 과정에서 IgA는 점막 상피세포를 통과하여 수송된다.[50]
내강 쪽 표면에 도달하면 수용체는 단백질분해 과정을 거쳐 잘려나가고, 수용체의 일부인 분비성분(SC)만이 이합체 IgA 분자에 부착된 채로 내강으로 방출된다.[17][53] 이렇게 형성된 분비형 IgA(sIgA)는 내강으로 확산되며,[17] 분비성분은 IgA를 단백질 분해효소에 의한 분해로부터 보호하는 역할을 한다.
장에서 분비형 IgA는 상피세포를 덮고 있는 점액층에 결합하여, 잠재적인 항원이 세포에 도달하기 전에 이를 중화하는 장벽을 형성하는 역할을 한다.[17][53] IgA는 염증을 일으키지 않으면서도 병원체가 장 내강에 접근하지 못하게 막는다.[52]
5. 병리학
면역글로불린 A(IgA)의 이상은 다양한 질병과 관련이 있다.
IgA가 부족하거나 없는 상태인 선택적 IgA 결핍증은 임상적으로 심각한 면역결핍 상태이다. 일부 세균은 IgA를 분해하는 단백질가수분해효소를 방출하여 면역 기능을 회피하기도 한다.[54][55][56]
또한 IgA는 여러 자가면역 및 면역 매개 질환과도 연관성이 있다. IgA 신증은 신장에 IgA가 비정상적으로 침착되는 질환이며,[57] 셀리악병 진단에는 특정 IgA 항체가 활용된다.[58][59] 헤노흐-쇤라인 자반(Henoch–Schönleinde)은 IgA와 관련된 전신성 혈관 질환이다.[60]
5. 1. 선택적 IgA 결핍증
IgA를 생성하는 유전적 능력 부족으로 인해 IgA가 감소하거나 없는 상태를 선택적 IgA 결핍증이라고 한다. 이는 임상적으로 유의미한 면역 결핍을 유발할 수 있다.[20]IgA 수치가 낮거나 없는 사람에게서 드물게 항 IgA 항체가 발견되기도 한다. 이런 사람이 IgA를 함유한 혈액 제제를 수혈받으면 심각한 아나필락시스 반응을 일으킬 수 있다. 하지만 아나필락시스 반응이 의심되는 경우라도, 실제로는 IgA 수혈 외 다른 원인으로 급성 전신 반응을 경험하는 경우가 더 많다.[21]
5. 2. 미생물에 의한 IgA 분해
임질을 일으키는 ''임균''(Neisseria gonorrhoeaela),[54][22] ''폐렴구균''(Streptococcus pneumoniaela),[55][23] 그리고 ''인플루엔자균''(Haemophilus influenzaela) b형[56][24]은 모두 IgA를 분해하는 단백질분해효소(프로테아제)를 방출하거나 생성한다. 이 효소는 IgA 항체를 절단하여 비활성화시킨다.또한, 기생충의 일종인 ''블라스트시스''(Blastocystisla)의 일부 아형은 인간의 IgA를 분해하는 시스테인 프로테아제와 아스파르트산 프로테아제 효소를 생성하는 것으로 밝혀졌다.[25]
5. 3. 자가면역 및 면역 매개 질환
IgA 신증은 신장에 IgA가 비정상적으로 쌓여 발생하는 만성 질환이다. IgA가 축적되는 정확한 이유는 아직 명확히 밝혀지지 않았다. 다만, 저당화된 IgA1 분자가 생성되고 이것이 서로 뭉치거나 IgA에 대한 항체(IgG)와 결합하여 면역 복합체를 형성하며, 이 복합체가 신장에 쌓여 보체 연쇄반응을 활성화시켜 염증을 유발한다는 가설이 유력하다.[57][26]셀리악병은 IgA antiendomysial antibody|항근내막 항체영어나 IgA 트랜스글루타미나제 자가항체의 존재를 통해 진단하므로, IgA와 관련된 대표적인 자가면역 질환 중 하나이다.[58][59][27][28][29][30]
헤노흐-쇤라인 자반(HSP) 또는 IgA 혈관염은 IgA와 보체성분 3(C3)이 작은 혈관에 침착되어 발생하는 전신성 혈관염이다. 주로 어린이에게서 발병하며, 피부와 결합조직, 음낭, 관절, 위장관, 신장 등 다양한 기관을 침범할 수 있다. 흔히 상기도 감염 후에 발병하며, 간이 비정상적으로 쌓인 IgA 응집체를 제거하면서 대부분 몇 주 이내에 호전된다.[60][31]
이 외에도 선형 IgA 수포성 피부병과 IgA 천포창은 IgA가 매개하는 면역 수포성 질환의 예시이며, 때로는 일반적인 치료법에 잘 반응하지 않아 치료가 어려울 수 있다.[32]
6. 점막 면역 방어계 (MALT)
점막은 항상 외부의 항원과 미생물에 노출되어 있으며, 이러한 위협으로부터 점막 표면을 보호하기 위한 국소적인 면역 체계가 존재한다. 이를 점막 연관 림프 조직(Mucosa-associated Lymphoid Tissue, MALT)이라고 부르며[36], 분비형 IgA(sIgA)는 MALT를 구성하는 중요한 요소 중 하나이다. 대표적인 MALT로는 소화관에 분포하는 장 연관 림프 조직(Gut-associated Lymphoid Tissue, GALT)[37], 기도에 있는 기관지 연관 림프 조직(Bronchus-associated Lymphoid Tissue, BALT)[38], 그리고 비강 내에 위치한 비강 연관 림프 조직(Nasal-associated Lymphoid Tissue, NALT)[36] 등이 알려져 있다.
점막 면역 체계는 IgA 생산을 유도하는 '유도 조직'과 IgA가 실제로 분비되어 면역 기능을 수행하는 '실효 조직', 그리고 이 두 조직을 연결하는 '귀소 경로'로 구성된다. 이 전체 과정을 합쳐 공통 점막 면역 체계(Common Mucosal Immune System, CMIS)[39]라고도 부른다. 유도 조직에서는 점막 표면에 있는 항원 제시 세포가 특정 항원을 인식하여 림프구를 활성화시키고 이동하도록 유도한다. 활성화된 림프구는 림프절 등에서 분화 과정을 거친 후 혈액을 통해 실효 조직으로 이동하여 IgA를 생산하게 된다. 이때, 한번 특정 유도 조직에서 활성화된 림프구는 다시 원래의 점막 조직으로 돌아가려는 경향을 보이는데, 이를 림프구의 호밍(귀소 현상)이라고 한다[40]。
실효 조직의 점막 고유층에는 IgA를 생산하는 형질 세포가 존재한다. 형질 세포는 림프구의 일종인 B 세포가 분화하여 항체 생산 능력을 갖게 된 세포로, 처음에는 주로 IgM 항체를 만든다. B 세포가 IgA 생산 능력을 갖추려면 특정 사이토카인의 자극이 필요하다. 형질전환 성장인자 베타(TGF-β)와 인터루킨-4(IL-4)의 작용을 받으면 B 세포 내에서 면역글로불린 유전자의 클래스 스위치가 일어나 IgA를 만들도록 유전자가 재조합된다. 이후 인터루킨-5(IL-5)와 인터루킨-6(IL-6)의 추가적인 자극을 받으면 IgA 생산 능력을 가진 형질 세포로 최종 분화한다. 이 과정에서 Th2 타입의 사이토카인이 중요한 역할을 하는 것을 알 수 있다.
형질 세포는 IgA를 생산할 때 'J 사슬'이라는 단백질도 함께 만들어 IgA 두 분자를 연결시킨 이량체(dimer) 형태로 분비한다. 이 중합체형 IgA(polymeric IgA, pIgA)는 점막 상피 세포의 바닥쪽 막(기저외측 표면)에 있는 중합체 면역글로불린 수용체(pIgR)에 결합한다.[16] IgA-pIgR 복합체는 세포내이입 과정을 통해 상피 세포 안으로 들어간 뒤, 세포 내부를 가로질러 관강 쪽 표면으로 이동한다. 최종적으로 pIgR의 일부가 잘려나가면서 IgA와 함께 세포 밖(점막 표면)으로 분비되는데, 이때 IgA에 결합된 pIgR 조각을 분비 성분(Secretory Component, SC)이라고 부른다.[17] 분비 성분은 IgA가 점막 표면의 단백질 분해 효소에 의해 분해되는 것을 막아 안정적으로 기능할 수 있도록 보호하는 역할을 한다. 이렇게 J 사슬과 분비 성분이 결합된 최종 형태의 IgA를 분비형 IgA(sIgA)라고 한다.[17] 장에서는 분비형 IgA가 상피 세포를 덮고 있는 점액층에 결합하여, 병원체가 상피 세포에 도달하기 전에 미리 중화시키는 방어벽 역할을 한다.
분비형 IgA는 주로 병원체 표면의 특정 부위(항원결정인자)에 결합하여 병원체가 상피 세포의 수용체에 부착하는 것을 막는다.[51] 또한, 여러 개의 IgA 분자가 다가 항원이나 병원체에 교차 결합하여 서로 뭉치게 만들고 점액층에 가두어 연동 운동을 통해 제거되도록 하는 면역적 차단(immune exclusion) 역할도 수행한다.[51][19] 분비형 IgA는 옵소닌화(식세포 작용 촉진) 능력이나 보체 경로를 활성화하는 능력은 비교적 낮기 때문에[52], 염증 반응을 크게 유발하지 않으면서 병원체의 침입을 효과적으로 막는 데 특화되어 있다. IgA는 장 내 공생 미생물에 대한 항체도 포함하고 있어, 이들 미생물이 과도하게 증식하거나 다른 부위로 침입하는 것을 막는 역할도 한다.[52]
특정 항원에 대한 분비형 IgA 생산은 M 세포에 의해 시작된다. M 세포는 장 내강의 항원을 샘플링하여 그 아래에 있는 수지상 세포와 T 세포에게 전달한다. 이어서 GALT나 장간막 림프절, 소장의 독립 림프 소포 등에서 B 세포의 활성화와 클래스 스위치가 일어나 특이적인 IgA가 생산된다.[51][19]
한편, 혈액 내에 존재하는 IgA는 주로 단량체 형태이며, 호중구, 호산구, 대식세포 등 면역 세포 표면에 있는 Fc 수용체의 일종인 FcαRI(CD89)와 결합하여 염증 반응을 유발할 수 있다.[50][41] 이 결합은 항체의존 세포매개 세포독성(ADCC), 식세포작용, 호흡폭발 등 다양한 면역 반응을 촉진하여 병원체 제거에 기여한다.[50]
7. 점막 면역 순환 귀소 경로 (CMIS)
점막은 항상 항원과 미생물에 노출되어 있으며, 이들로부터 점막면을 방어하는 국소 면역 기전이 존재한다. 이를 점막 면역 방어계(Mucosa-associated Lymphoid Tissue, MALT)라고 부르며[36], 분비형 IgA가 그 일부를 구성하고 있다. 대표적인 MALT로 소화관 면역 방어계(gut-associated lymphoid tissue, GALT)[37], 기도 면역 방어계(bronchus-associated lymphoid tissue, BALT)[38] 및 비강 면역 방어계(nasal-associated lymphoid tissues, NALT)[36]가 알려져 있다.
점막 면역 기전은 IgA의 생산 유도를 수행하는 유도 조직과 IgA가 분비·기능하는 실효 조직, 그리고 이들을 연결하는 귀소 경로로 구성된다. 이들을 합쳐서 점막 면역 순환 귀소 경로(또는 공통 점막 면역 기전[39], Common Mucosal Immune System, CMIS)라고 부른다. 유도 조직에서 점막면에 존재하는 항원 제시 세포는 림프구를 활성화시키고 이동시키는 작용을 한다. 림프구는 림프절에서 분화된 후에 실효 조직에 도달하여 IgA를 생산한다. 이때, 한 번 유도 조직을 떠난 림프구는 다시 같은 조직으로 돌아오는 경향을 가지며, 이를 림프구의 호밍(귀소 현상)이라고 부른다[40]。
8. IgA 생산 형질 세포로의 분화
IgA는 점막 고유층에 있는 IgA 생산 형질 세포(플라스마 세포)가 만들어 분비한다. 형질 세포는 림프구의 한 종류인 B 세포에서 분화하며, 항체를 만드는 능력을 가진다. 보통은 IgM을 생산한다.
B 세포가 IgA를 생산하려면 사이토카인의 자극이 필요하다. B 세포가 변환 성장 인자-β(TGF-β)와 인터루킨-4의 영향을 받으면, 면역글로불린의 종류를 바꾸는 클래스 스위치가 일어나 IgA 생산 능력을 얻게 된다. 클래스 스위치를 거친 B 세포는 이어서 인터루킨-5와 인터루킨-6의 자극을 받아 IgA를 생산하는 형질 세포로 최종 분화한다. 이 과정을 보면, Th2 세포가 만드는 사이토카인(Th2 사이토카인)이 IgA 생산 형질 세포로의 분화에 중요한 역할을 한다는 것을 알 수 있다.
참조
[1]
논문
Location of secretory component on the Fc edge of dimeric IgA1 reveals insight into the role of secretory IgA1 in mucosal immunity
2009-01
[2]
논문
The nonplanar secretory IgA2 and near planar secretory IgA1 solution structures rationalize their different mucosal immune responses
2009-02
[3]
논문
Intestinal IgA synthesis: regulation of front-line body defences
2003-01
[4]
논문
Let's go mucosal: communication on slippery ground
2004-11
[5]
논문
The functional interactions of commensal bacteria with intestinal secretory IgA
2007-11
[6]
서적
Basic Histology
https://archive.org/[...]
McGraw-Hill
[7]
논문
Mucosal immunity and vaccines
2005-04
[8]
서적
Immunobiology: The Immune System in Health and Disease
https://www.ncbi.nlm[...]
Garland Science
2001
[9]
논문
Glycans in the immune system and The Altered Glycan Theory of Autoimmunity: a critical review
2015-02
[10]
논문
IgA subclasses in various secretions and in serum
1982-10
[11]
논문
Subclass distribution of natural salivary IgA antibodies against pneumococcal capsular polysaccharide of type 14 and pneumococcal surface adhesin A (PsaA) in children
2006-03
[12]
논문
The immune geography of IgA induction and function
2008-01
[13]
논문
Alleles and isoforms of human membrane-bound IgA1
2008-08
[14]
서적
Paul's fundamental immunology
Wolters Kluwer/Lippincott Williams & Wikins
2023
[15]
논문
Complement activation by (auto-) antibodies
https://linkinghub.e[...]
2011-08
[16]
논문
The IgA system: a comparison of structure and function in different species
https://hal.archives[...]
[17]
논문
The polymeric immunoglobulin receptor (secretory component) mediates transport of immune complexes across epithelial cells: a local defense function for IgA
1991-10
[18]
논문
Small Intestinal Microbiota Oscillations, Host Effects and Regulation-A Zoom into Three Key Effector Molecules.
2023-01-16
[19]
논문
Secretory IgA's complex roles in immunity and mucosal homeostasis in the gut
2011-11
[20]
논문
Selective IgA deficiency
2010-01
[21]
논문
IgA anaphylactic transfusion reactions
1995-01
[22]
논문
IgA protease of Neisseria gonorrhoeae: isolation and characterization of the gene and its extracellular product
1984-07
[23]
논문
Production of immunoglobulin A protease by Streptococcus pneumoniae from animals
1990-09
[24]
논문
A Haemophilus influenzae IgA protease-like protein promotes intimate interaction with human epithelial cells
1994-10
[25]
논문
Update on the pathogenic potential and treatment options for Blastocystis sp
[26]
논문
IgA nephropathy
https://www.nature.c[...]
[27]
논문
Immunoglobulin A (IgA) deficiency and alternative celiac disease-associated antibodies in sera submitted to a reference laboratory for endomysial IgA testing
2000-03
[28]
논문
Physiology of IgA and IgA deficiency
2001-09
[29]
논문
Recent advances in celiac disease and refractory celiac disease
2019-06-26
[30]
논문
Comparison of assays for anti-endomysial and anti-transglutaminase antibodies for diagnosis of pediatric celiac disease
2000-02
[31]
논문
Henoch-Schönlein purpura nephritis
http://jasn.asnjourn[...]
1999-12
[32]
논문
Persistence of Autoreactive IgA-Secreting B Cells Despite Multiple Immunosuppressive Medications Including Rituximab
2015-06
[33]
논문
Vancomycin-Induced Linear IgA Bullous Dermatosis
2020-10
[34]
논문
Location of secretory component on the Fc edge of dimeric IgA1 reveals insight into the role of secretory IgA1 in mucosal immunity
2009-01
[35]
논문
The nonplanar secretory IgA2 and near planar secretory IgA1 solution structures rationalize their different mucosal immune responses
2009-02
[36]
논문
粘膜免疫システム―生体防御の最前線
https://www.jstage.j[...]
日本耳鼻咽喉科頭頸部外科学会
[37]
웹사이트
腸管関連リンパ組織(gut-associated lymphoid tissue、GALT)
https://www.nutri.co[...]
ニュートリー株式会社
2024-01-30
[38]
논문
BALT(bronchus-associatedlymphoidtissue)の基礎的,臨床的展望
https://is.jrs.or.jp[...]
日本呼吸器学会
[39]
논문
기술用語解説 粘膜免疫・粘膜ワクチン
https://www.jstage.j[...]
[40]
웹사이트
粘膜免疫循環帰巣経路(common mucosal immune system、CMIS)
https://www.nutri.co[...]
ニュートリー株式会社
2024-01-29
[41]
간행물
Structure and function of human IgA Fc receptors (Fc alpha R).
[42]
저널
Intestinal IgA Synthesis: Regulation of Front-line Body Defenses
[43]
저널
Let's go mucosal: communication on slippery ground
[44]
저널
The functional interactions of commensal bacteria with intestinal secretory IgA
[45]
서적
Basic Histology
https://archive.org/[...]
McGraw-Hill
[46]
저널
Mucosal immunity and vaccines
2005-04
[47]
저널
Subclass distribution of natural salivary IgA antibodies against pneumococcal capsular polysaccharide of type 14 and pneumococcal surface adhesin A (PsaA) in children
2006-03
[48]
저널
IgA subclasses in various secretions and in serum
1982-10
[49]
서적
면역생물학
E PUBLIC
2008-08-25
[50]
저널
The IgA system: a comparison of structure and function in different species
[51]
저널
2011-11
[52]
서적
면역생물학
E PUBLIC
2008-08-25
[53]
저널
The polymeric immunoglobulin receptor (secretory component) mediates transport of immune complexes across epithelial cells: a local defense function for IgA
[54]
저널
IgA protease of Neisseria gonorrhoeae: isolation and characterization of the gene and its extracellular product
1984-07
[55]
저널
Production of immunoglobulin A protease by Streptococcus pneumoniae from animals
1990-09
[56]
저널
A Haemophilus influenzae IgA protease-like protein promotes intimate interaction with human epithelial cells
1994-10
[57]
웹인용
IgA Nephropathy : Pathophysiology
http://emedicine.med[...]
2014-12-01
[58]
저널
Immunoglobulin A (IgA) deficiency and alternative celiac disease-associated antibodies in sera submitted to a reference laboratory for endomysial IgA testing
2000-03
[59]
저널
Physiology of IgA and IgA deficiency
2001-09
[60]
저널
Henoch-Schönlein purpura nephritis
http://jasn.asnjourn[...]
1999-12
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com