아버멕틴
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
아버멕틴은 1978년 일본의 키타사토 연구소에서 분리된 방선균에서 발견된 구충 활성을 가진 화합물이다. 주로 글루탐산-개폐 염소 이온 통로와 GABA 수용체에 작용하여 기생충의 신경 및 근육 세포의 전기적 활동을 차단하여 기생충을 마비시킨다. 아버멕틴은 가축의 기생충 감염 치료, 회선사상충증(강변 실명증) 및 림프사상충증(상피병)과 같은 질병 치료에 사용되며, 일부 상업용 개미 미끼 트랩의 활성 성분으로도 활용된다. 아버멕틴의 생합성은 폴리케타이드 합성효소, 아글리콘 변형 효소, 당 합성 효소, 글리코실화 효소의 작용으로 이루어지며, 과다 복용 시 혼수, 저혈압, 호흡 부전 등의 부작용이 발생할 수 있다.
더 읽어볼만한 페이지
- 폴리케타이드 - 니스타틴
니스타틴은 곰팡이 감염 치료에 사용되는 항진균제로, 곰팡이 세포막에 결합하여 세포 사멸을 유도하며, 피부, 질, 구강, 식도의 칸디다증 치료에 효과적이다. - 폴리케타이드 - 송라산
송라산은 지의류에서 발견되는 우스닌산에 대한 정보를 제공하며, 우스닌산은 항균, 항진균, 자외선 방어, 항산화 작용과 같은 생물학적 역할과 약리학적 특성을 가지지만, 간 손상과 같은 안전성 문제가 제기된 바 있습니다. - 항기생충제 - 이버멕틴
이버멕틴은 선충류 및 외부 기생충으로 인한 인체 질병 치료에 주로 사용되는 약물이지만, 활성 성분에 과민 반응이 있거나 5세 미만, 15kg 미만 어린이는 사용에 주의해야 하며, COVID-19 치료 효과는 입증되지 않아 주요 기관에서 사용을 경고하고 있다. - 항기생충제 - 프라지콴텔
프라지콴텔은 촌충, 흡충과 같은 기생충 감염 치료에 사용되는 구충제로, 기생충 세포막의 칼슘 이온 투과성을 증가시켜 마비를 유발하고 숙주의 면역 반응을 통해 제거되도록 돕는다.
| 아버멕틴 | |
|---|---|
| 약물 정보 | |
 | |
| 분자식 | C48H72O14 (아버멕틴 B1a), C47H70O14 (아버멕틴 B1b) |
| CAS 등록번호 | 65195-55-3 (B1a), 65195-56-4 (B1b) |
2. 역사
1978년, 키타사토 연구소는 일본 시즈오카현 이토시 가와나에서 채취한 토양 샘플에서 방선균을 분리하여 머크 샤프 앤 도움 연구소에 검사를 의뢰했다. 머크 샤프 앤 도움 연구소는 이 방선균을 배양하여 쥐의 ''Nematospiroides dubius''에 대한 구충 활성을 확인했고, 활성 화합물을 ''Streptomyces avermitilis''로 명명했다.[3]
1979년, 북사토 연구소는 시즈오카현 이토시 가와나의 토양에서 방선균을 분리, 배양하여 쥐에 기생하는 ''Nematospiroides dubius영어''에 대한 구충 효과와 낮은 독성을 확인하고, 새로운 화합물로 보고했다.[22]
2002년, 키타사토 대학 키타사토 생명과학 연구소의 타카하시 요코 등은 ''Streptomyces avermitilis''를 ''Streptomyces avermectinius''로 재명명할 것을 제안했다.[4],[23]
2. 1. 발견
1973년, 키타사토 연구소의 오무라 연구팀은 일본 시즈오카현 이토시의 골프장에서 채취한 토양 샘플을 미국 머크 샤프 앤 도움(MSD) 연구실로 보내 분석을 의뢰했다.[38] 몇 년 후, MSD는 샘플에 포함된 ''Streptomyces avermitilis''가 생산하는 아버멕틴이 기생충과 곤충에 대해 저항 효과가 있음을 처음으로 발표했다.[39]1978년, 키타사토 연구소는 일본 시즈오카현 이토시 가와나에서 채취한 토양 샘플에서 방선균을 분리했다. 그해 말, 분리된 방선균은 검사를 위해 머크 샤프 앤 도움 연구소로 보내졌다. 분리된 방선균을 사용하여 다양한 배양액을 발효시켰고, 초기 테스트 결과 발효된 배양액 전체가 쥐의 ''Nematospiroides dubius''에 대해 활성을 나타냈다. 이후 구충 활성이 분리되었고, 이 화합물들을 생산하는 새로운 종은 1978년 머크 연구팀에 의해 ''Streptomyces avermitilis''로 명명되었다.[3]
1979년, 북사토 연구소는 시즈오카현 이토시 가와나의 토양에서 방선균을 분리했다. 이후 방선균은 제약 회사의 연구소로 보내져 배양되었고, 생쥐에 기생하는 ''Nematospiroides dubius|Nematospiroides dubius영어''의 구충 효과가 있으며, 독성이 없다는 것이 확인되었다. 이 구충 효과는 서로 밀접하게 관련된 화합물군이 가져온다는 것이 밝혀졌고, 1979년에 새로운 화합물로 보고되었다.[22]
2002년, 키타사토 대학 키타사토 생명과학 연구소의 타카하시 요코 등은 ''Streptomyces avermitilis''를 ''Streptomyces avermectinius''로 재명명할 것을 제안했다.[4]
2. 2. 개발 및 상용화
1978년, 키타사토 연구소는 일본 시즈오카현이토시 가와나에서 채취한 토양 샘플에서 방선균을 분리했다. 그해 말, 분리된 방선균은 검사를 위해 머크 샤프 앤 도움 연구소로 보내졌다. 분리된 방선균을 사용하여 다양한 배양액을 주의 깊게 관리하며 발효시켰다. 초기 테스트 결과, 발효된 배양액 전체가 주목할 만한 독성 없이 최소 8배 이상의 범위에서 쥐의 ''Nematospiroides dubius''에 대해 구충 활성을 나타냈다. 이후, 구충 활성이 분리되었고 밀접하게 관련된 일련의 화합물로 확인되었다. 이 화합물들은 마침내 특성화되었으며, 이를 생산하는 새로운 종은 1978년 머크 연구팀에 의해 기술되었고, ''Streptomyces avermitilis''로 명명되었다(형용사는 벌레를 죽인다는 의미로 의도되었을 것이다).[3]1979년, 북사토 연구소는 시즈오카현 이토시 가와나의 토양에서 방선균을 분리했다. 이후 방선균은 제약 회사의 연구소로 보내져, 여러 배양액으로 신중한 환경 제어 하에 배양되었고, 생쥐에 기생하는 기생성 선충 ''Nematospiroides dubius|Nematospiroides dubius영어''에 대한 구충 효과가 있으며, 적어도 8배 범위 내의 용량에서 독성이 없다는 것이 확인되었다. 이어서 이 구충 효과는 서로 밀접하게 관련된 화합물군이 가져온다는 것이 밝혀졌다. 그 화합물군은 최종적으로 새로운 화합물로 동정되어 1979년에 보고되었다.[22]
2002년, 기타사토 대학 기타사토 생명과학연구소의 타카하시 요코 등은 ''Streptomyces avermitilis''를 ''Streptomyces avermectinius''로 재명명할 것을 제안했다.[4],[23]
3. 작용 기전
이버멕틴은 기생충의 신경 신호 전달에 관여하는 글루탐산-개폐 염소 채널과 감마-아미노부티르산(GABA) 수용체에 작용하여 기생충을 마비시킨다.[40] 이버멕틴은 기생충의 신경세포에 있는 글루탐산-개폐 염소 채널에 작용하여 세포 내로 염소 이온의 유입을 촉진하고, 신경세포 내 막전위를 과분극시켜 기생충 신경을 마비시킨다. GABA 수용체에도 같은 원리로 작용하여 항기생충 효과를 나타낸다.[41] 밀베마이신과 함께 아버멕틴은 IRAC 그룹 6에 속한다.[10]
아버멕틴은 다른 리간드에 의해 제어되는 염소 이온 채널에도 영향을 줄 수 있다. 예를 들어, 메뚜기 근섬유(비GABA 신경 지배)의 막 컨덕턴스의 비가역적 증가를 유발할 수 있다.[29]
3. 1. 글루탐산-개폐 염소 채널 억제
이버멕틴은 주로 글루탐산의 효과를 증진시켜 원구동물 무척추동물에 특이적인 글루탐산-개폐 염소 이온 통로에서 무척추동물 신경 및 근육 세포의 전기적 활동 전달을 차단한다. 이는 세포 내 염소 이온의 유입을 유발하여 과분극 및 이로 인한 무척추동물 신경근 시스템의 마비를 초래한다. 포유류는 원구동물 특이적 글루탐산-개폐 염소 이온 통로를 가지고 있지 않기 때문에 유사한 용량은 포유류에게는 독성이 없다.[9] 아버멕틴은 무척추동물에 특유한 glutamate-gated chloride channel|글루탐산 작용성 염화물 이온 채널영어에서의 글루탐산 작용을 억제하여 신경 세포 및 근육 세포로의 전기적 신호를 차단한다. 포유류는 글루탐산 작용성 염화물 이온 채널을 가지고 있지 않으므로, 동일한 용량에서는 독성을 나타내지 않는다.[28]3. 2. GABA 수용체 영향
이버멕틴은 기생충의 신경 신호 전달에 관여하는 글루탐산-개폐 염소 채널과 감마-아미노부티르산(GABA) 수용체에 작용하여 기생충의 마비를 일으켜 체내 기생충을 억제한다.[40] 이버멕틴은 기생충의 신경세포에 있는 글루탐산-개폐 염소 채널에 작용하여 세포 내로 염소 이온의 유입을 촉진한다. 신경세포 내의 막전위는 과분극되어 기생충 신경의 마비가 유도된다. GABA 수용체에도 같은 원리로 기생충의 마비를 통해 항기생충 효과를 나타낸다.[41]아버멕틴은 주로 글루탐산의 효과를 증진시켜 원구동물 무척추동물에 특이적인 글루탐산-개폐 염소 이온 통로에서 무척추동물 신경 및 근육 세포의 전기적 활동 전달을 차단한다. 감마-아미노부티르산 수용체에는 미미한 영향을 미친다.[6][7][8] 이는 세포 내 염소 이온의 유입을 유발하여 과분극 및 이로 인한 무척추동물 신경근 시스템의 마비를 초래한다.
아버멕틴은 무척추동물에 특유한 glutamate-gated chloride channel|글루탐산 작용성 염화물 이온 채널영어에서의 글루탐산 작용을 억제하여 신경 세포 및 근육 세포로의 전기적 신호를 차단한다. γ-아미노부티르산(GABA) 수용체에도 약한 효과를 가진다.[25][26][27] 이로 인해 세포 내 염화물 이온의 이동이 방해받아 무척추동물의 신경·근육계에 과분극과 마비를 일으킨다. GABA 수용체에 의해 제어되는 염소 이온 채널 외에도, 아버멕틴은 다른 리간드에 의해 제어되는 염소 이온 채널에도 영향을 미칠 수 있다. 예를 들어, 아버멕틴은 메뚜기 근섬유(비GABA 신경 지배)의 막 컨덕턴스의 비가역적 증가를 유발할 수 있다.[29]
3. 3. 포유류에 대한 안전성
이버멕틴은 사람 세포에 대한 부작용이 적은 것으로 알려져 있다. 이버멕틴이 작용하는 글루탐산-개폐 염소이온 채널은 기생충 세포에만 있고, GABA 수용체는 포유류의 중추신경계에 위치하여 혈관뇌장벽에 의해 이버멕틴의 작용을 받지 않기 때문이다.[42]아버멕틴은 포유류에게 독성이 없는데, 그 이유는 포유류가 원구동물 특이적 글루탐산-개폐 염소 이온 통로를 가지고 있지 않기 때문이다.[9] 포유류는 글루탐산 작용성 염화물 이온 채널을 가지고 있지 않으므로, 동일한 용량에서는 독성을 나타내지 않는다.[28]
4. 아버멕틴이 사용되는 질병
아버멕틴은 경구 투여, 비경구 투여, 국소 도포(수의용 벼룩 방충제 "방울"과 같이)하는 방식으로 투여한다. 아버멕틴은 300μg/kg 이하의 용량(사람, 말, 애완동물 등 여러 종에서 표준으로 보이는 200μg/kg의 이버멕틴)으로 광범위한 선충 및 절지동물 기생충에 대해 활성을 나타낸다.[5] 마크로라이드 또는 폴리엔 항생제와 달리, 아버멕틴은 유의미한 항균 또는 항진균 활성을 보이지 않는다.[24]
4. 1. 회선사상충증 (강변 실명증)
파리매를 통해 전파되는 회선사상충(''Onchocerca volvulus'')에 감염되어 실명이나 종양이 생기는 병이다. 회전사상충증(Onchocerciasis)이나 River blindness로 불리기도 한다. 전 세계 약 3천7백만 명이 회선사상충에 감염되어 있으며, 감염 발생의 99%는 아프리카 대륙 강가에서 일어난다.[45] 세계보건기구(WHO)의 보고서에 따르면 회선사상충의 감염 자체는 사망을 일으키지 않는다.[46] 아직까지 백신이 개발되어 있지 않아 유일한 예방법은 파리매에 물리지 않는 것이다. 사람에게 일단 감염되면 면역 반응이 비교적 약하게 일어나는 피하결절이나 눈에 머무르는 것을 좋아한다. 회선사상충의 유충은 눈의 각막 표면으로 이동하고 각막염을 일으킨다. 만성 감염이 되면 감염 부위에서 염증으로 인해 점점 시야가 뿌옇게 흐려지며 결국 실명으로 이어진다.[47]4. 2. 림프사상충증 (상피병)
세계보건기구(WHO)가 '육체적 장애를 일으키는 가장 흔한 원인' 중 하나로 지목한 병이다.[43] 사상충은 실처럼 긴 선충류로, 숙주에 감염되면 림프절에 기생한다. 다 자란 성체의 경우 수컷은 4cm, 암컷은 6cm-10cm 정도이다. 사상충은 숙주와 우호적인 관계를 유지하므로 기생충이 살아있는 동안은 숙주에 병리효과를 일으키지 않는다. 하지만 사상충이 수명(5-8년)을 다하고 죽은 뒤에는, 사상충의 사체로부터 떨어져 나온 단백질을 면역계가 인식하여 격렬한 면역반응을 일으킨다. 그 결과 림프절과 림프관에 염증이 발생하여 열과 심한 통증을 일으키고 림프 순환에 장애가 생겨 몸이 붓게 된다. 이때 생기는 부종은 손가락으로 누르면 원상태로 돌아가는 부종이지만, 염증과 회복 과정이 반복되면서 섬유질이 두껍게 쌓인다. 이때 생기는 부종은 딱딱한 부종이며, 부종이 생기는 위치는 사상충이 기생하는 부위에 따라 달라진다.[44]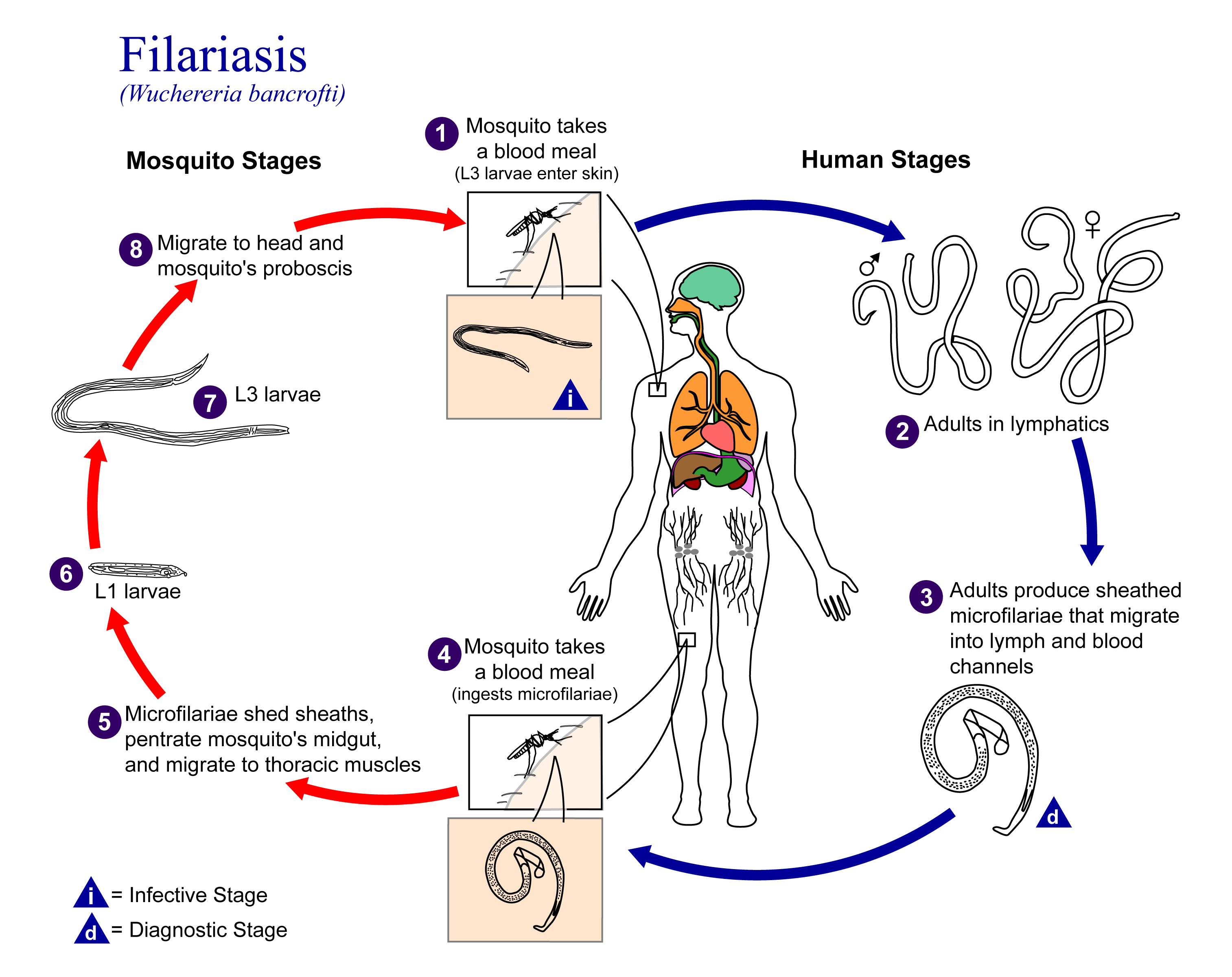
4. 3. 기타 기생충 감염증
최근 널리 사용되는 치료법은 아버멕틴을 경구, 비경구, 국소 또는 국소 도포(수의용 벼룩 방충제 "방울"과 같이)하는 방식이다. 아버멕틴은 300μg/kg 이하의 용량(인간, 말, 애완동물 등 여러 종에서 표준으로 보이는 200μg/kg의 이버멕틴)으로 광범위한 선충 및 절지동물 기생충에 대해 활성을 나타낸다. 매크로라이드 또는 폴리엔 항생제와 달리, 아버멕틴은 유의미한 항균 또는 항진균 활성을 보이지 않는다.[5]일반적으로 아버멕틴은 경구 투여 또는 국소(외용) 투여된다. 벼룩 구제의 경우 감염 부위에 점적 투여된다. 가축의 선충이나 절지동물 감염증에 300µg/kg 이하로 광범위한 유효성을 나타낸다. 이버멕틴은 사람, 말, 애완동물 등 많은 동물 종에 200µg/kg의 투여량으로 사용된다. 마크로라이드계 항생 물질이나 폴리엔계 항진균제와는 달리 항균 작용이나 항진균 작용은 가지지 않는다.[24]
5. 독성 및 부작용
아버멕틴 저항성이 보고되었으며, 이는 사용의 신중함을 시사한다. 가장 명백한 경로인 글루탐산-개폐 염소 이온 통로의 변이로 인해 ''예쁜꼬마선충''에서 저항성이 관찰되었다. 이버멕틴, 피페라진, 디클로르보스의 병용에 대한 연구에서도 독성의 가능성을 보여준다.[11] 아버멕틴은 종양 괴사 인자, 산화 질소, 프로스타글란딘 E2의 LPS 유도 분비를 차단하고, Ca2+의 세포 내 농도를 증가시키는 것으로 보고되었다.[12][32]
부작용은 대부분 일시적이지만, 과량 투여 시 드물게 심각한 혼수, 저혈압, 호흡 부전을 일으켜 사망에 이를 수 있다. 특정 해독 요법은 없지만, 증상을 적절하게 관리하면 일반적으로 예후가 양호하다.[33]
5. 1. 일반적인 부작용
아버멕틴의 부작용은 일반적으로 일시적이다.[13][14] 심각한 부작용은 드물며, 상당한 과다 복용 시에만 발생할 수 있다. 과다 복용 시 혼수, 저혈압, 호흡 부전을 포함한 증상이 나타날 수 있으며, 이는 사망으로 이어질 수 있다. 특별한 치료법은 없지만, 증상 관리를 통해 일반적으로 예후가 좋다.[13][14]5. 2. 심각한 부작용
아버멕틴 저항성이 보고되어 사용에 신중해야 한다.[30] 부작용은 일반적으로 일시적이나, 드물게 심각한 부작용이 나타날 수 있다. 심각한 부작용은 상당한 과다 복용 시에만 발생할 수 있지만, 혼수, 저혈압, 호흡 부전을 포함하며, 이는 사망으로 이어질 수 있다. 특별한 치료법은 없지만, 증상 관리를 통해 일반적으로 예후가 좋다.[13][14]5. 3. 저항성
아버멕틴 저항성이 보고되었으며, 이는 사용의 신중함을 시사한다. 가장 명백한 경로인 글루탐산-개폐 염소 이온 통로의 변이로 인해 ''예쁜꼬마선충''에서 저항성이 관찰되었다. 이버멕틴, 피페라진, 디클로르보스의 병용에 대한 연구에서도 독성의 가능성을 보여준다.[11] 아버멕틴은 종양 괴사 인자, 산화 질소, 프로스타글란딘 E2의 LPS 유도 분비를 차단하고, Ca2+의 세포 내 농도를 증가시키는 것으로 보고되었다.[12] 아버멕틴에 대한 내성이 보고되어 사용량을 줄여야 한다는 점이 시사되었다.[30]6. 아버멕틴 생합성
1978년, 키타사토 연구소는 일본 시즈오카현이토시 가와나에서 채취한 토양 샘플에서 방선균을 분리했다. 같은 해 말, 이 방선균은 검사를 위해 머크 샤프 앤 도움 연구소로 보내졌다. 분리된 방선균을 사용하여 다양한 배양액을 발효시켰고, 초기 테스트 결과 발효된 배양액 전체가 쥐의 ''Nematospiroides dubius''에 대해 활성을 나타냈으며 독성은 없었다. 이후 구충 활성이 분리되었고, 밀접하게 관련된 일련의 화합물로 확인되었다. 이 화합물들은 ''Streptomyces avermitilis''로 명명되었다.[3] 2002년, 키타사토 대학키타사토 생명과학 연구소의 타카하시 요코 등은 ''Streptomyces avermitilis''를 ''Streptomyces avermectinius''로 재명명할 것을 제안했다.[4]
아버멕틴 생합성은 크게 네 단계로 나뉜다.
# 폴리케타이드 합성효소에 의한 아버멕틴 아글리콘 부분 합성
# 아글리콘의 변형
# 당 측쇄의 합성 및 변형
# 아글리콘의 당화
이러한 과정을 통해 구조가 다른 8가지 아버멕틴이 합성된다.
6. 1. 유전자 클러스터
''S. avermitilis''에서 아버멕틴 생합성을 위한 유전자 클러스터의 서열이 밝혀졌다.[15] 아버멕틴 생합성 유전자 클러스터는 아버멕틴 생산의 네 단계를 담당하는 효소를 암호화한다.1. 폴리케타이드 합성효소에 의한 아버멕틴 아글리콘 생산
2. 아글리콘의 변형
3. 변형된 당의 합성
4. 변형된 아버멕틴 아글리콘의 글리코실화
이 유전자 클러스터는 약간의 구조적 차이를 가진 8가지 아버멕틴을 생산할 수 있다.[16]
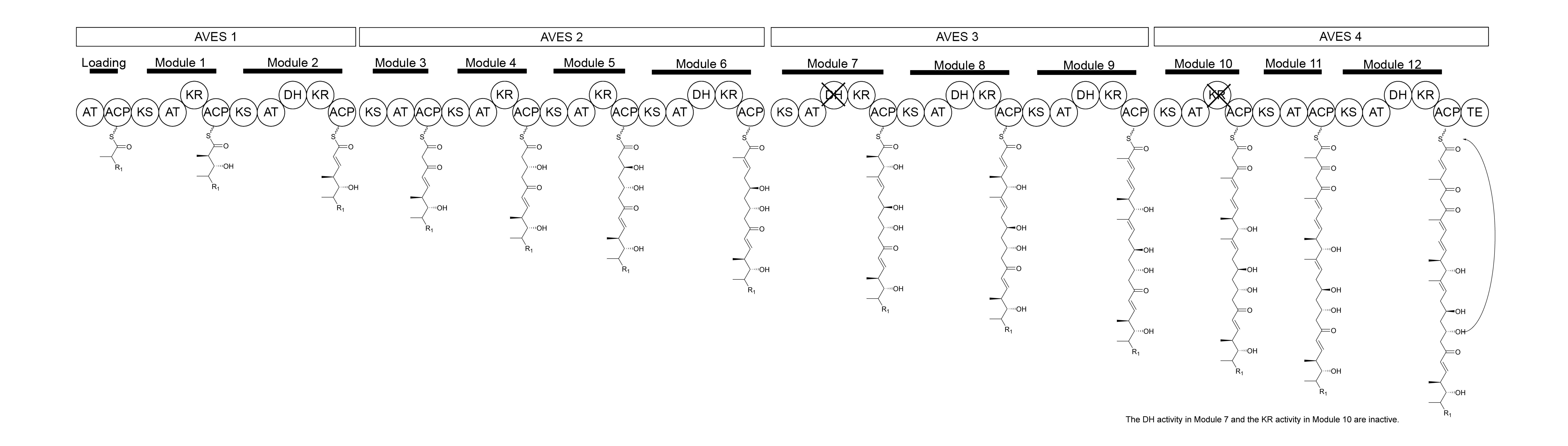
아버멕틴 초기 아글리콘은 네 가지 단백질(AVES 1, AVES 2, AVES 3, AVES 4)의 폴리케타이드 합성효소 활성에 의해 합성된다. 이 효소 복합체의 활성은 I형 폴리케타이드 합성효소와 유사하다.[16] 2-메틸부티릴 CoA 또는 이소부티릴 CoA는 시작 단위로 사용될 수 있으며, 아세테이트 단위 7개와 프로피오네이트 단위 5개로 확장되어 각각 아버멕틴 "a" 계열 또는 "b" 계열을 생성한다.[16] 초기 아글리콘은 분자 내 고리형 에스터 형성에 의해 AVES 4의 티오에스터분해효소 도메인에서 방출된다.[16]
아버멕틴 초기 아글리콘은 아버멕틴 생합성 유전자 클러스터의 다른 효소에 의해 추가로 변형된다. AveE는 시토크롬 P450 모노옥시게나아제 활성을 가지며 C6과 C8 사이의 푸란 고리 형성을 촉진한다.[16] AveF는 NAD(P)H 의존적 케토환원효소 활성을 가지며 C5 케토기를 수산기로 환원시킨다.[16] AveC는 모듈 2에서 탈수소효소 활성에 영향을 미치지만(C22-C23에 영향), 이 작용 기전은 명확하지 않다.[15][16] AveD는 SAM 의존적 C5 O-메틸트랜스퍼라제 활성을 갖는다.[16] AveC 또는 AveD가 아글리콘에 작용하는지에 따라 생성되는 아버멕틴 아글리콘이 아버멕틴, 계열 "A" 또는 "B", 그리고 계열 1 또는 2를 각각 생성할지가 결정된다.
아홉 개의 열린 판독 프레임(orf1 및 aveBI-BVIII)은 글리코실화 및 당 합성과 관련된 것으로 알려진 aveA4의 하류에 위치한다.[16] AveBII-BVIII은 dTDP-L-올레안드로스의 합성에 관여하고, AveBI는 dTDP-당을 이용한 아버멕틴 아글리콘의 글리코실화에 관여한다.[16] orf1의 서열은 그 생성물이 환원효소 활성을 가질 것으로 시사하지만, 이 기능은 아버멕틴 합성에 필요하지 않은 것으로 보인다.[16]
6. 2. 생합성 단계
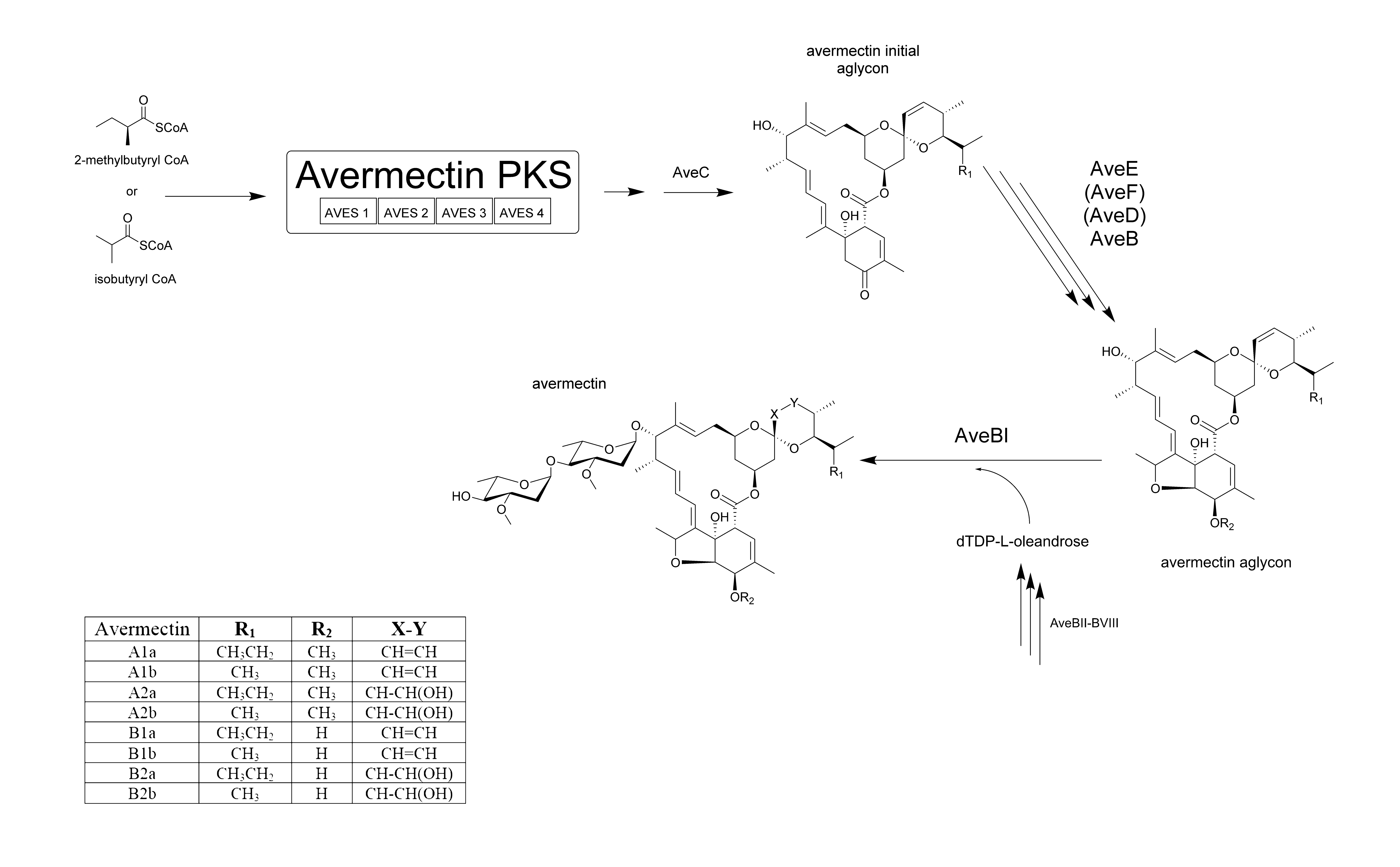
아버멕틴 생합성은 ''S. avermitilis''에서 유래한 유전자 클러스터에 의해 이루어진다.[15] 이 유전자 클러스터는 다음 네 단계를 거쳐 아버멕틴을 생산하는 효소를 암호화한다.[16]
# 폴리케타이드 합성효소에 의한 아버멕틴 아글리콘 생성
# 아글리콘 변형
# 변형된 당 합성
# 변형된 아버멕틴 아글리콘의 글리코실화
이러한 과정을 통해 구조적 차이를 가진 8가지 아버멕틴이 생산된다.[16]
6. 2. 1. 폴리케타이드 합성효소(PKS)에 의한 아글리콘 생성
''S. avermitilis''에서 아버멕틴 생합성을 위한 유전자 클러스터의 서열이 밝혀졌다.[15] 아버멕틴 생합성 유전자 클러스터는 아버멕틴 생산의 네 단계를 담당하는 효소를 암호화하는데, 그 중 첫 번째 단계는 폴리케타이드 합성효소에 의한 아버멕틴 아글리콘 생산이다. 이 유전자 클러스터는 약간의 구조적 차이를 가진 8가지 아버멕틴을 생산할 수 있다.[16]
아버멕틴 초기 아글리콘은 네 가지 단백질(AVES 1, AVES 2, AVES 3, AVES 4)의 폴리케타이드 합성효소 활성에 의해 합성된다. 이 효소 복합체의 활성은 I형 폴리케타이드 합성효소와 유사하다.[16] 2-메틸부티릴 CoA 또는 이소부티릴 CoA는 시작 단위로 사용될 수 있으며, 아세테이트 단위 7개와 프로피오네이트 단위 5개로 확장되어 각각 아버멕틴 "a" 계열 또는 "b" 계열을 생성한다.[16] 초기 아글리콘은 분자 내 고리형 에스터 형성에 의해 AVES 4의 티오에스터분해효소 도메인에서 방출된다.[16]
아버멕틴 초기 아글리콘은 아버멕틴 생합성 유전자 클러스터의 다른 효소에 의해 추가로 변형된다.
6. 2. 2. 아글리콘 변형
아버멕틴 초기 아글리콘은 4가지 단백질(AVES 1, AVES 2, AVES 3, AVES 4)의 폴리케타이드 합성효소 활성에 의해 합성된다. 이 효소 복합체의 활성은 I형 폴리케타이드 합성효소와 유사하다.[16] 2-메틸부티릴 CoA 또는 이소부티릴 CoA는 시작 단위로 사용될 수 있으며, 아세테이트 단위 7개와 프로피오네이트 단위 5개로 확장되어 각각 아버멕틴 "a" 계열 또는 "b" 계열을 생성한다.[16] 초기 아글리콘은 분자 내 고리형 에스터 형성에 의해 AVES 4의 티오에스터분해효소 도메인에서 방출된다.[16]아버멕틴 초기 아글리콘은 아버멕틴 생합성 유전자 클러스터의 다른 효소에 의해 추가로 변형된다. AveE는 시토크롬 P450 모노옥시게나아제 활성을 가지며 C6과 C8 사이의 푸란 고리 형성을 촉진한다.[16] AveF는 NAD(P)H 의존적 케토환원효소 활성을 가지며 C5 케토기를 수산기로 환원시킨다.[16] AveC는 모듈 2에서 탈수소효소 활성에 영향을 미치지만(C22-C23에 영향), 이 작용 기전은 명확하지 않다.[15][16] AveD는 SAM 의존적 C5 O-메틸트랜스퍼라제 활성을 갖는다.[16] AveC 또는 AveD가 아글리콘에 작용하는지에 따라 생성되는 아버멕틴 아글리콘이 아버멕틴, 계열 "A" 또는 "B", 그리고 계열 1 또는 2를 각각 생성할지가 결정된다.
6. 2. 3. 당 합성
''S. avermitilis''에서 아버멕틴 생합성을 위한 유전자 클러스터의 서열이 밝혀졌다.[15] 아버멕틴 생합성 유전자 클러스터는 아버멕틴 생산의 네 단계를 담당하는 효소를 암호화한다.
1. 폴리케타이드 합성효소에 의한 아버멕틴 아글리콘 생산
2. 아글리콘의 변형
3. 변형된 당의 합성
4. 변형된 아버멕틴 아글리콘의 글리코실화
이 유전자 클러스터는 약간의 구조적 차이를 가진 8가지 아버멕틴을 생산할 수 있다.[16]
아버멕틴 초기 아글리콘은 네 가지 단백질(AVES 1, AVES 2, AVES 3, AVES 4)의 폴리케타이드 합성효소 활성에 의해 합성된다. 이 효소 복합체의 활성은 I형 폴리케타이드 합성효소와 유사하다.[16] 2-메틸부티릴 CoA 또는 이소부티릴 CoA는 시작 단위로 사용될 수 있으며, 아세테이트 단위 7개와 프로피오네이트 단위 5개로 확장되어 각각 아버멕틴 "a" 계열 또는 "b" 계열을 생성한다.[16] 초기 아글리콘은 분자 내 고리형 에스터 형성에 의해 AVES 4의 티오에스터분해효소 도메인에서 방출된다.[16]
아버멕틴 초기 아글리콘은 아버멕틴 생합성 유전자 클러스터의 다른 효소에 의해 추가로 변형된다. AveE는 시토크롬 P450 모노옥시게나아제 활성을 가지며 C6과 C8 사이의 푸란 고리 형성을 촉진한다.[16] AveF는 NAD(P)H 의존적 케토환원효소 활성을 가지며 C5 케토기를 히드록실기로 환원시킨다.[16] AveC는 모듈 2에서 탈수소효소 활성에 영향을 미치지만(C22-C23에 영향), 이 작용 기전은 명확하지 않다.[15][16] AveD는 SAM 의존적 C5 O-메틸트랜스퍼라제 활성을 갖는다.[16] AveC 또는 AveD가 아글리콘에 작용하는지에 따라 생성되는 아버멕틴 아글리콘이 아버멕틴, 계열 "A" 또는 "B", 그리고 계열 1 또는 2를 각각 생성할지가 결정된다.[16]
아홉 개의 열린 판독 프레임(orf1 및 aveBI-BVIII)은 글리코실화 및 당 합성과 관련된 것으로 알려진 aveA4의 하류에 위치한다.[16] AveBII-BVIII은 dTDP-L-올레안드로스의 합성에 관여하고, AveBI는 dTDP-당을 이용한 아버멕틴 아글리콘의 글리코실화에 관여한다.[16] orf1의 서열은 그 생성물이 환원효소 활성을 가질 것으로 시사하지만, 이 기능은 아버멕틴 합성에 필요하지 않은 것으로 보인다.[16]
6. 2. 4. 글리코실화
''S. avermitilis''에서 유래한 아버멕틴 생합성 유전자 클러스터의 서열이 밝혀졌다.[15] 아버멕틴 생합성 유전자 클러스터는 아버멕틴 생산의 네 단계를 담당하는 효소를 암호화하는데, 이 중 네 번째 단계는 변형된 아버멕틴 아글리콘의 글리코실화이다. 이 유전자 클러스터는 약간의 구조적 차이를 가진 8가지 아버멕틴을 생산할 수 있다.[16]아홉 개의 열린 판독 프레임(orf1 및 aveBI-BVIII)은 글리코실화 및 당 합성과 관련된 것으로 알려진 aveA4의 하류에 위치한다.[16] AveBII-BVIII은 dTDP-L-올레안드로스의 합성에 관여하고, AveBI는 dTDP-당을 이용한 아버멕틴 아글리콘의 글리코실화에 관여한다.[16] orf1의 서열은 그 생성물이 환원효소 활성을 가질 것으로 시사하지만, 이 기능은 아버멕틴 합성에 필요하지 않은 것으로 보인다.[16]
당쇄의 합성 및 당화에 대해서는 AveA4의 하류에 위치한 9개의 부위 (orf1과 aveBI〜BVIII)가 관여하고 있다.[35] AveBII〜BVIII은 dTDP-L-올레안드로스를 합성하며, AveBI는 아글리콘을 dTDP-당으로 당화하고 있다.[35] 유전자 orf1에서 생성되는 효소는 환원효소 활성을 갖는 것으로 생각되지만, 합성의 어떤 과정에 관여하는지는 확실하지 않다.[35]
7. 기타 용도
아버멕틴은 일부 상업용 개미 미끼 트랩의 활성 성분이다. 아버멕틴에서 제제화된 이버멕틴은 인류에게 광범위하게 사용된다. 약물의 공동 제작자인 오무라 사토시와 앤디 크럼프가 일본 학회에 기고한 논문(이버멕틴: 일본의 “기적의 약” : 인류 사용 관점)에 따르면, 이버멕틴은 전 세계 수십억 명의 삶을 개선했으며, 단순히 항기생충제로만 사용되지 않는다.[17] 아버멕틴은 개미 구제용 먹이의 성분으로 사용되고 있다.
참조
[1]
논문
Discovery, chemistry, and chemical biology of microbial products
[2]
서적
Modern Crop Protection Compounds
https://onlinelibrar[...]
Wiley‐VCH
2019-01-25
[3]
논문
Avermectins, New Family of Potent Anthelmintic Agents: Producing Organism and Fermentation
[4]
논문
"''Streptomyces avermectinius'' sp. nov., an avermectin-producing strain"
[5]
논문
The avermectins: A new family of antiparasitic agents
[6]
논문
Cloning of an avermectin-sensitive glutamate-gated chloride channel from Caenorhabditis elegans
[7]
논문
Ion Channels as Targets for Insecticides
[8]
논문
Chloride channels as tools for developing selective insecticides
[9]
논문
Toxicology, mode of action and target site-mediated resistance to insecticides acting on chloride channels
[10]
논문
Insecticide resistance management and industry: the origins and evolution of the I nsecticide R esistance A ction C ommittee (IRAC) and the mode of action classification scheme
2021
[11]
논문
Toxicity evaluation of prophylactic treatments for mites and pinworms in mice
[12]
논문
Effect of ivermectin on function of liver macrophages
[13]
논문
Acute Human Toxicity of Macrocyclic Lactones
[14]
뉴스
Ivermectin
https://www.firstmed[...]
[15]
논문
Organization of the biosynthetic gene cluster for the polyketide anthelmintic macrolide avermectin in Streptomyces avermitilis
[16]
논문
Avermectin: Biochemical and molecular basis of its biosynthesis and regulation
[17]
논문
Ivermectin, 'wonder drug' from Japan: the human use perspective.
[18]
웹사이트
日本化学物質辞書 “Avermectin”検索結果
http://nikkajiweb.js[...]
""
null
[19]
논문
Discovery, chemistry, and chemical biology of microbial products
[20]
논문
New ventures in the chemistry of avermectins
[21]
웹사이트
노벨 의학생리학상, 오무라 사토시 씨 등 3 씨에게 감염증의 신 치료법 발견
https://www.afpbb.co[...]
AFPBB
2015-10-05
[22]
논문
Avermectins, New Family of Potent Anthelmintic Agents: Producing Organism and Fermentation
[23]
논문
"''Streptomyces avermectinius'' sp. nov., an avermectin-producing strain"
[24]
논문
The avermectins: A new family of antiparasitic agents
[25]
논문
Cloning of an avermectin-sensitive glutamate-gated chloride channel from Caenorhabditis elegans
[26]
논문
Ion Channels as Targets for Insecticides
[27]
논문
Chloride channels as tools for developing selective insecticides
[28]
논문
Toxicology, mode of action and target site-mediated resistance to insecticides acting on chloride channels
[29]
웹사이트
Abamectin 71751-41-2 wiki
https://www.guideche[...]
2023-09-22
[30]
논문
Resistance to Avermectins: Extent, Mechanisms, and Management Implications
[31]
논문
Toxicity evaluation of prophylactic treatments for mites and pinworms in mice
[32]
논문
Effect of ivermectin on function of liver macrophages
[33]
논문
Acute Human Toxicity of Macrocyclic Lactones
[34]
논문
Organization of the biosynthetic gene cluster for the polyketide anthelmintic macrolide avermectin in Streptomyces avermitilis
[35]
논문
Avermectin: Biochemical and molecular basis of its biosynthesis and regulation
[36]
논문
The in Vitro Characterization of the Iterative Avermectin Glycosyltransferase AveBI Reveals Reaction Reversibility and Sugar Nucleotide Flexibility
[37]
웹사이트
The Nobel Prize in Physiology or Medicine 2015 - Satoshi Ōmura - Facts
http://www.nobelpriz[...]
[38]
간행물
Philosophy of New Drug Discovery
1986-09
[39]
논문
Ivermectin: A Potent New Antiparasitic Agent
[40]
논문
Ivermectin and River Blindness
[41]
논문
An ivermectin-sensitive glutamate-gated chloride channel subunit from Dirofilaria immitis
2004-08
[42]
서적
Goodman and Gilman's Pharmacological Basis of Therapeutics
[43]
보고서
Lymphatic filariasis:progress reort on mass drug administration,2009
WHO
[44]
논문
Lymphatic filariasis: A view at pathological diversity
2014-07
[45]
웹사이트
Status of onchocerciasis in APOC countries
World Health Organization
2010-04-26
[46]
웹사이트
Epidemiology
Stanford University
[47]
간행물
Onchocerciasis
2008-02
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com