헴 A
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
헴 A는 1951년 오토 바르부르크에 의해 처음 분리되었으며, 사이토크롬 c 산화효소의 활성 성분으로 밝혀진 물질이다. 헴 B와 유사하지만, 8번 위치의 메틸기가 폼일기로 산화되고, 2번 위치에 하이드록시에틸파르네실기가 부착된 구조적 특징을 갖는다. 사이토크롬 c 산화효소와 같은 금속단백질에서 중요한 역할을 하며, 폼일기와 아이소프레노이드 곁사슬은 산소 환원의 에너지 보존에 기여한다.
헴 A는 1951년에 독일의 생화학자 오토 바르부르크에 의해 처음으로 분리되었으며, 사이토크롬 c 산화효소의 활성 성분으로 밝혀졌다.[10][3] 사이토크롬 c 산화효소는 내재성 막 단백질로 금속단백질의 일종이다.
헴 A는 고리의 8번 위치에 있는 메틸기 곁사슬이 폼일기로 산화되고, 아이소프레노이드 사슬인 하이드록시에틸파르네실기가 철 테트라피롤 헴의 고리의 2번 위치에 있는 비닐기 곁사슬에 부착된다는 점에서 헴 B와 다르다. 헴 A는 헴 O와 유사한데, 둘 다 2번 위치에 파르네실기가 첨가되어 있지만 헴 O는 8번 위치에 폼일기가 없고 여전히 메틸기를 가지고 있다. 헴 A의 정확한 구조는 1975년에 핵자기 공명(NMR) 및 적외선(IR) 실험을 기반으로 발표되었고,[8] 철이 없는 형태의 다이메틸 에스터의 합성을 통해 확인되었다.[9] 헴 A는 헴 B와 마찬가지로 헴 철과 보존된 아미노산 곁사슬 사이의 배위 결합을 통해 아포단백질에 부착된다. 헴 A를 포함하는 금속단백질의 예로는 사이토크롬 c 산화효소가 있다.
헴 A는 헴 B와 마찬가지로 헴 철과 보존된 아미노산 곁사슬 사이의 배위 결합을 통해 아포단백질에 부착된다. 중요한 호흡 단백질인 사이토크롬 c 산화효소(CCO)에서 산소 반응 중심의 헴 A에 대한 리간드는 히스티딘기이다.[12] 히스티딘은 헤모글로빈과 미오글로빈을 포함한 많은 헴단백질의 일반적인 리간드이다.
2. 역사
3. 구조 및 다른 헴과의 관계
3. 1. 입체화학
하이드록실기와 결합한 탄소인 고리 I의 3번 위치에 있는 첫 번째 탄소에 대한 정확한 기하학적 입체배치는 카이랄 ''S'' 입체배치인 것으로 나타났다.[11]
헴 B와 마찬가지로 헴 A는 종종 헴 철과 보존된 아미노산 곁사슬 사이의 배위 결합을 통해 아포단백질에 부착된다. 중요한 호흡 단백질인 사이토크롬 c 산화효소(CCO)에서 산소 반응 중심의 헴 A에 대한 이 리간드는 히스티딘기이다.[12] 히스티딘은 헤모글로빈과 미오글로빈을 포함한 많은 헴단백질의 일반적인 리간드이다.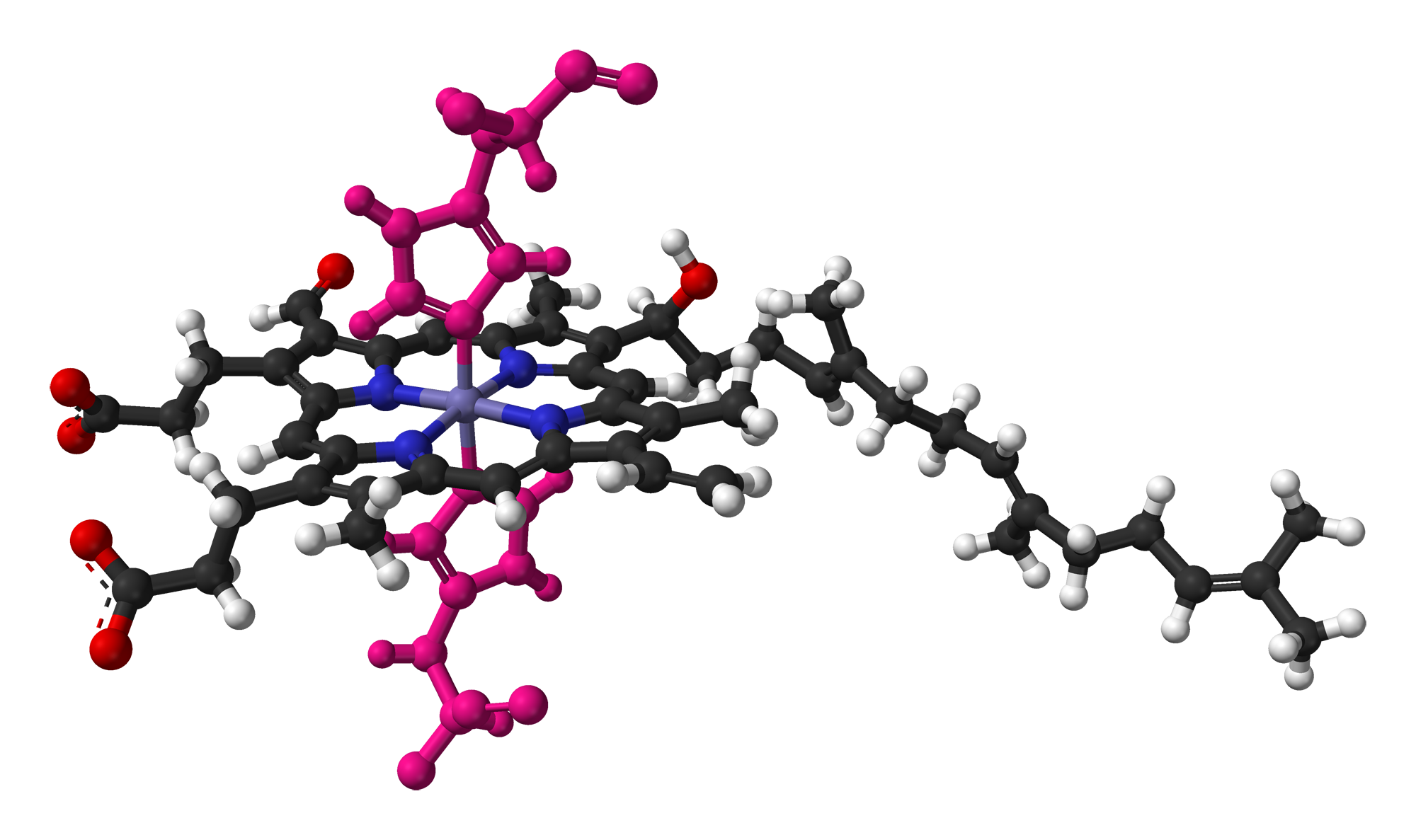
사이토크롬 c 산화효소의 일부인 사이토크롬 a의 헴 A는 두 개의 히스티딘 잔기(분홍색으로 표시)와 결합되어 있다.[13]
헴 A를 포함하는 금속단백질의 예로는 사이토크롬 c 산화효소가 있다. 이 매우 복잡한 단백질은 각각 다른 기능을 하는 두 개의 서로 다른 부위에 헴 A를 포함하고 있다. 사이토크롬 a의 헴 A의 철은 6개의 다른 원자와 결합하여 6배위된다. 사이토크롬 a3의 헴의 철은 때때로 5개의 다른 원자와 결합되어 있으며 6번째 부위는 이산소(산소 분자, O2)와 결합할 수 있다.[13] 또한 이 효소는 3개의 구리, 마그네슘, 아연, 여러 칼륨 이온 및 나트륨 이온과 결합한다. 사이토크롬 c 산화효소에 있는 두 개의 헴 A기는 서로, 즉 구리 이온과 밀접하게 연관된 단백질인 사이토크롬 c 사이에서 쉽게 전자를 교환하는 것으로 생각된다.
폼일기와 아이소프레노이드 곁사슬은 모두 사이토크롬 c 산화효소에 의한 산소 환원의 에너지 보존에 중요한 역할을 하는 것으로 생각된다. 사이토크롬 c 산화효소는 미토콘드리아의 막 사이 공간으로 양성자를 펌핑하여 에너지를 보존하는 역할을 하는 것으로 생각된다. S. 요시카와(S. Yoshikawa)의 영향력 있는 그룹이 발표한 바와 같이 헴 A의 폼일기 및 하이드록시에틸파르네실기는 모두 이 중요한 과정에서 중요한 역할을 하는 것으로 생각된다.[14]
4. 생화학적 기능
사이토크롬 c 산화효소의 일부인 사이토크롬 a의 헴 A는 두 개의 히스티딘 잔기로 결합되어 있다.[13] 헴 A를 포함하는 금속단백질의 예로는 사이토크롬 c 산화효소가 있다. 이 매우 복잡한 단백질은 각각 다른 기능을 하는 두 개의 서로 다른 부위에 헴 A를 포함하고 있다. 사이토크롬 a의 헴 A의 철은 6개의 다른 원자와 결합하여 6배위된다. 사이토크롬 a3의 헴의 철은 때때로 5개의 다른 원자와 결합되어 있으며 6번째 부위는 이산소(산소 분자, O2)와 결합할 수 있다.[13] 또한 이 효소는 3개의 구리, 마그네슘, 아연, 여러 칼륨 이온 및 나트륨 이온과 결합한다. 사이토크롬 c 산화효소에 있는 두 개의 헴 A기는 서로, 즉 구리 이온과 밀접하게 연관된 단백질인 사이토크롬 c 사이에서 쉽게 전자를 교환하는 것으로 생각된다.
폼일기와 아이소프레노이드 곁사슬은 모두 사이토크롬 c 산화효소에 의한 산소 환원의 에너지 보존에 중요한 역할을 하는 것으로 생각된다. 사이토크롬 c 산화효소는 미토콘드리아의 막 사이 공간으로 양성자를 펌핑하여 에너지를 보존하는 역할을 하는 것으로 생각된다. S. 요시카와(S. Yoshikawa)의 영향력 있는 그룹이 발표한 바와 같이 헴 A의 폼일기 및 하이드록시에틸파르네실기는 모두 이 중요한 과정에서 중요한 역할을 하는 것으로 생각된다.[14]
4. 1. 사이토크롬 c 산화효소 (COX)
헴 A는 헴 B와 마찬가지로 헴 철과 보존된 아미노산 곁사슬 사이의 배위 결합을 통해 아포단백질에 부착된다. 중요한 호흡 단백질인 사이토크롬 c 산화효소(CCO)에서 산소 반응 중심의 헴 A에 대한 이 리간드는 히스티딘기이다.[12] 히스티딘은 헤모글로빈과 미오글로빈을 포함한 많은 헴단백질의 일반적인 리간드이다.
사이토크롬 c 산화효소의 일부인 사이토크롬 a의 헴 A는 두 개의 히스티딘 잔기로 결합되어 있다(분홍색으로 표시).[13]
헴 A를 포함하는 금속단백질의 예로는 사이토크롬 c 산화효소가 있다. 이 매우 복잡한 단백질은 각각 다른 기능을 하는 두 개의 서로 다른 부위에 헴 A를 포함하고 있다. 사이토크롬 a의 헴 A의 철은 6개의 다른 원자와 결합하여 6배위된다. 사이토크롬 a3의 헴의 철은 때때로 5개의 다른 원자와 결합되어 있으며 6번째 부위는 이산소(산소 분자, O2)와 결합할 수 있다.[13] 또한 이 효소는 3개의 구리, 마그네슘, 아연, 여러 칼륨 이온 및 나트륨 이온과 결합한다. 사이토크롬 c 산화효소에 있는 두 개의 헴 A기는 서로, 즉 구리 이온과 밀접하게 연관된 단백질인 사이토크롬 c 사이에서 쉽게 전자를 교환하는 것으로 생각된다.
폼일기와 아이소프레노이드 곁사슬은 모두 사이토크롬 c 산화효소에 의한 산소 환원의 에너지 보존에 중요한 역할을 하는 것으로 생각된다. 사이토크롬 c 산화효소는 미토콘드리아의 막 사이 공간으로 양성자를 펌핑하여 에너지를 보존하는 역할을 하는 것으로 생각된다. S. 요시카와(S. Yoshikawa)의 영향력 있는 그룹이 발표한 바와 같이 헴 A의 폼일기 및 하이드록시에틸파르네실기는 모두 이 중요한 과정에서 중요한 역할을 하는 것으로 생각된다.[14]
4. 2. 헴 A의 역할
헴 B와 마찬가지로 헴 A는 종종 헴 철과 보존된 아미노산 곁사슬 사이의 배위 결합을 통해 아포단백질에 부착된다. 중요한 호흡 단백질인 사이토크롬 c 산화효소(CCO)에서 산소 반응 중심의 헴 A에 대한 이 리간드는 히스티딘기이다.[12] 히스티딘은 헤모글로빈과 미오글로빈을 포함한 많은 헴단백질의 일반적인 리간드이다.
사이토크롬 c 산화효소의 일부인 사이토크롬 a의 헴 A는 두 개의 히스티딘 잔기로 결합되어 있다.[13]
헴 A를 포함하는 금속단백질의 예로는 사이토크롬 c 산화효소가 있다. 이 매우 복잡한 단백질은 각각 다른 기능을 하는 두 개의 서로 다른 부위에 헴 A를 포함하고 있다. 사이토크롬 a의 헴 A의 철은 6개의 다른 원자와 결합하여 6배위된다. 사이토크롬 a3의 헴의 철은 때때로 5개의 다른 원자와 결합되어 있으며 6번째 부위는 이산소(산소 분자, O2)와 결합할 수 있다.[13] 또한 이 효소는 3개의 구리, 마그네슘, 아연, 여러 칼륨 이온 및 나트륨 이온과 결합한다. 사이토크롬 c 산화효소에 있는 두 개의 헴 A기는 서로, 즉 구리 이온과 밀접하게 연관된 단백질인 사이토크롬 c 사이에서 쉽게 전자를 교환하는 것으로 생각된다.
폼일기와 아이소프레노이드 곁사슬은 모두 사이토크롬 c 산화효소에 의한 산소 환원의 에너지 보존에 중요한 역할을 하는 것으로 생각된다. 사이토크롬 c 산화효소는 미토콘드리아의 막 사이 공간으로 양성자를 펌핑하여 에너지를 보존하는 역할을 하는 것으로 생각된다. S. 요시카와(S. Yoshikawa)의 영향력 있는 그룹이 발표한 바와 같이 헴 A의 폼일기 및 하이드록시에틸파르네실기는 모두 이 중요한 과정에서 중요한 역할을 하는 것으로 생각된다.[14]
참조
[1]
논문
Heme A of Cytochrome c Oxidase
[2]
논문
Isolation, crystallisation, and synthesis of the dimethyl ester of porphyrin a, the iron-free prosthetic group of cytochrome c oxidase
[3]
논문
Cytohämin aus Herzmuskel
[4]
논문
Absolute configuration of the hydroxyfarnesylethyl group of heme A, determined by X-ray structural analysis of bovine heart cytochrome c oxidase using methods applicable at 2.8 Angstrom resolution
[5]
논문
The low-spin heme of cytochrome c oxidase as the driving element of the proton-pumping process
[6]
논문
Redox-Coupled Crystal Structural Changes in Bovine Heart Cytochrome c Oxidase
[7]
논문
The proton pumping pathway of bovine heart cytochrome c oxidase
[8]
논문
Heme A of Cytochrome c Oxidase
[9]
논문
Isolation, crystallisation, and synthesis of the dimethyl ester of porphyrin a, the iron-free prosthetic group of cytochrome c oxidase
[10]
논문
Cytohämin aus Herzmuskel
[11]
논문
Absolute configuration of the hydroxyfarnesylethyl group of heme A, determined by X-ray structural analysis of bovine heart cytochrome c oxidase using methods applicable at 2.8 Angstrom resolution
[12]
논문
The low-spin heme of cytochrome c oxidase as the driving element of the proton-pumping process
[13]
논문
Redox-Coupled Crystal Structural Changes in Bovine Heart Cytochrome c Oxidase
[14]
논문
The proton pumping pathway of bovine heart cytochrome c oxidase
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com