세포 주기
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
세포 주기는 세포의 성장, DNA 복제, 분열 과정을 포함하는 일련의 사건으로, 세포의 생애를 나타낸다. 세포 주기는 크게 세포 분열을 준비하는 간기(G1기, S기, G2기)와 세포 분열기(M기)로 나뉘며, M기는 핵 분열(유사 분열)과 세포질 분열로 구성된다. 세포 주기는 사이클린과 사이클린 의존성 키나아제(CDK)에 의해 조절되며, G1/S, G2/M, 중기 검문점과 같은 세포 주기 검문점을 통해 진행이 감시된다. 세포 주기 조절의 이상은 암 발생과 관련이 있으며, 세포 주기를 표적으로 하는 항암 치료가 개발되어 사용되고 있다. 세포 주기는 진화 과정에서 RNA 기반의 초기 세포에서 DNA 기반의 세포로 전환되면서 핵심적인 조절 기작이 진화해왔다.
더 읽어볼만한 페이지
- 세포 노화 - 헬라 세포
헬라 세포는 1951년 헨리에타 랙스라는 자궁경부암 환자의 종양에서 유래된 최초의 인간 불멸 세포주로, 의학 연구에 큰 기여를 했지만 환자의 동의 없이 채취 및 사용되어 윤리적 논란을 야기했다. - 세포 노화 - 세포예정사
세포예정사(PCD)는 다세포 생물에서 일어나는 프로그램된 세포 사멸 과정으로, 아폽토시스, 자가포식, 괴사 등 여러 유형으로 분류되며, 신경계 발달, 미토콘드리아 진화, 암 발생 등 다양한 생물학적 과정에 중요한 역할을 한다. - 세포 주기 - 감수분열
감수분열은 유성생식을 하는 생물에서 배우자를 형성하는 세포분열 과정으로, 염색체 수를 줄여 유전적 다양성을 확보하며, 감수분열 I과 II 두 단계로 구성되어 상동염색체 및 자매염색분체 분리, 독립적 분리 및 교차를 통해 유전적 다양성을 증가시키지만, 염색체 비분리 오류는 염색체 이상 질환을 유발할 수 있고 진핵생물 유성생식과 진화에 필수적인 과정이다. - 세포 주기 - 사이클린
사이클린은 세포 주기 조절에 중요한 단백질로, 사이클린 의존성 키나아제(Cdk)와 결합하여 세포 주기 단계에 따라 농도가 변하며 Cdk의 활성을 조절하고, 2001년 발견자들이 노벨 생리학·의학상을 수상했다. - 세포 과정 - 감수분열
감수분열은 유성생식을 하는 생물에서 배우자를 형성하는 세포분열 과정으로, 염색체 수를 줄여 유전적 다양성을 확보하며, 감수분열 I과 II 두 단계로 구성되어 상동염색체 및 자매염색분체 분리, 독립적 분리 및 교차를 통해 유전적 다양성을 증가시키지만, 염색체 비분리 오류는 염색체 이상 질환을 유발할 수 있고 진핵생물 유성생식과 진화에 필수적인 과정이다. - 세포 과정 - 괴사
괴사는 세포 손상으로 인해 생체 내에서 조절 없이 일어나는 세포 사멸의 한 형태로, 응고괴사, 액화괴사 등 다양한 유형으로 분류되며 허혈, 감염 등 여러 원인에 의해 발생하고 벌거숭이두더지쥐처럼 세포자멸사 대체 기전으로 활용되기도 한다.
| 세포 주기 | |
|---|---|
| 세포 주기 개요 | |
 | |
| 정의 | |
| 정의 | 세포 분열을 초래하는 일련의 사건과 단계 |
| 진핵세포 주기 단계 | |
| 단계 목록 | G1기 S기 G2기 M기 |
| G1기 설명 | 세포 성장 및 기능 수행 |
| S기 설명 | DNA 복제 |
| G2기 설명 | 분열 준비 |
| M기 설명 | 핵분열(Mitosis) 및 세포질 분열(Cytokinesis) |
| 조절 | |
| 주요 조절 인자 | 사이클린 의존성 인산화효소(Cdks) 사이클린(Cyclins) |
| 검문 지점 | G1 검문 지점 G2 검문 지점 M 검문 지점 |
| 세균 세포 주기 | |
| 특징 | 유사분열 없음 염색체 분리 메커니즘이 덜 명확함 |
| 복제 시작 | 세포 크기와 복제 시작 사이의 연관성 |
| 추가 정보 | |
| 관련 과정 | 세포 분열 |
| 관련 주제 | 암 |
2. 세포 주기의 단계
세포 주기는 크게 간기와 분열기(M기)로 나뉜다. 간기는 세포 주기의 대부분을 차지하며, G1기, S기, G2기로 구성된다. 분열기는 다시 핵분열과 세포질 분열로 나뉜다.[3] 일시적으로 또는 가역적으로 분열을 멈춘 세포는 G0기라고 불리는 정지 상태에 들어간다.
| 상태 | 단계 | 약어 | 설명 |
|---|---|---|---|
| 휴지 | 갭 0 | G0 | 세포가 주기를 벗어나 분열을 멈춘 단계. |
| 간기 | 갭 1 | G1 | 세포 성장. G1 검문점은 모든 것이 DNA 합성을 위해 준비되었는지 확인한다. |
| 합성 | S | DNA 복제. | |
| 갭 2 | G2 | 성장 및 분열 준비. G2 검문점은 모든 것이 M (분열) 단계에 들어가 분열할 준비가 되었는지 확인한다. | |
| 세포 분열 | 분열 | M | 세포 분열이 일어난다. 중기 검문점은 세포가 세포 분열을 완료할 준비가 되었는지 확인한다. |
- G0기: 세포가 세포 주기를 벗어나 분열을 멈춘 휴지기이다.
- 간기: 세포 분열을 준비하는 기간으로, G1기, S기, G2기로 나뉜다.
- G1기: 세포가 성장하고, DNA 합성을 준비한다. G1 검문점에서 DNA 합성 준비 여부를 확인한다.
- S기: DNA 복제가 일어나는 시기이다.
- G2기: 세포가 계속 성장하며 분열을 준비한다. G2 검문점에서 분열 준비 여부를 확인한다.
- 분열기(M기): 핵분열과 세포질 분열이 일어나 세포가 둘로 나뉜다.
- '''핵분열''': 염색체가 두 개의 동일한 세트로 분리되어 두 개의 핵이 형성된다. 전기, 전중기, 중기, 후기, 말기의 5단계로 구분된다.[8]
- '''세포질 분열''': 핵, 세포질, 세포 소기관, 세포막이 대략 동일하게 분할되어 두 개의 딸세포가 형성된다.
2. 1. 간기 (Interphase)
세포가 분열하여 생성된 딸세포가 다시 유사 분열을 시작하기까지, 즉 M기와 다음 M기 사이를 간기(interphase)라고 부른다. 세포의 성장, 물질 흡수, 생합성, 유전 정보와 모든 세포 소기관의 복제, 그리고 대사 등 세포로서의 기능은 이 시기에 수행된다. 진핵 세포는 대부분의 시간을 간기에 할애하며, 다음 세포 분열(M기)에 대비한다. 간기에는 크로마틴이 핵막으로 둘러싸인 세포핵 안에 분산되어 있으며, 개별 염색체를 식별할 수 없다. 핵소체는 핵 내 구조 중 하나로 확인된다. 방추사는 아직 관찰되지 않지만, 중심체는 세포핵 주변에서 관찰된다.방사성 동위 원소(RI, radio isotope)를 사용하여 동조 세포의 DNA 합성을 경과 시간별로 추적함으로써, 간기는 G1기, S기, G2기의 세 단계로 나눌 수 있다는 것이 밝혀졌다.[3] 각 기는 세포 주기 체크포인트에서 완료가 확인된 후 다음 기간으로 진행된다. 각 기간과 간기 전체에 걸리는 시간은 세포의 종류와 생물의 종류에 따라 다양하다. 일반적으로 포유류 성체 세포에서 간기는 20시간 정도이며, 세포 분열 전체 시간의 약 90%를 차지한다.
| 상태 | 기간 | 약칭 | 설명 |
|---|---|---|---|
| 정지/ 노화 | Gap 0 | G0 | 세포가 주기에서 벗어나거나 분열을 멈추는 휴지기. |
| 간기 | Gap 1 | G1 | Gap 1에서는 세포가 커진다. G1/S 체크포인트에서 다음 DNA 합성에 대한 준비가 되었는지 확인한다. |
| 합성(Synthesis) | S | 이 기간에 DNA의 복제가 일어난다. | |
| Gap 2 | G2 | DNA 합성에서 유사 분열이 일어나기까지 세포는 계속 성장한다. G2/M 체크포인트에서 다음 M기(유사 분열과 세포질 분열)에 대한 준비가 되었는지 확인한다. | |
| 세포 분열 | 분열(Mitosis and cytokinesis) | M | 이 단계에서 세포의 성장은 멈추고, 활동 에너지는 분열에 집중된다. 유사 분열 도중 M기 체크포인트에서 완전한 분열에 대한 준비가 되었는지 확인한다. |
2. 1. 1. G1기 (Gap 1)
세포 분열은 세포, 개체의 발생, 성장, 생명 유지 등에 중요한 기능을 하지만, 세포 전체의 일생, 즉 세포 주기에서는 상대적으로 매우 짧은 기간을 차지한다. 세포 주기는 세포분열기와 세포분열을 준비하는 기간인 간기(interphase)로 나뉘며, 간기는 G1기, S기, G2기로 구성된다.
DNA 합성이 일어나기 전의 기간을 G1기(Gap 1)라고 한다. 이 시기의 세포는 DNA를 복제하여 분열하기에 알맞은 상태로 성장하는 다음 주기를 시작하거나, 증식을 멈추고 휴지기에 들어가는 것을 결정한다. G1기 세포의 증식과 휴식 여부는 세포주기 조절 시스템에 의해 조절된다.[4] 세포가 계속 증식하기로 결정되면, 분열기에 늦춰진 생합성 속도를 끌어올려 매우 활발한 대사 활동이 진행된다. 세포의 성장에 필요한 효소와 세포 소기관의 수를 늘리며 세포의 크기가 커진다.
G1기는 간기 내의 첫 번째 단계로, 이전 세포 분열(M기)이 끝난 후부터 DNA 복제가 시작되기 전까지의 기간이다. G1기는 성장 단계라고도 불린다.
G1기에서 세포는 다음 세 가지 중 한 가지를 선택한다.
- 세포 주기를 계속 진행하여 S기로 진입.
- 세포 주기를 멈추고 세포 분화를 위해 G0기로 진입.
- G1기에 정지하여 G0기로 진입하거나 세포 주기를 다시 시작.
이러한 결정을 내리는 지점을 검문점(제한점)이라고 한다. 이 검문점은 제한점 또는 START라고 하며, G1/S 사이클린에 의해 조절되어 G1기에서 S기로의 전환을 유발한다. G1 검문점을 통과하면 세포는 분열을 하게 된다.
G1기는 다음과 같이 4개의 하위 단계로 나뉜다.[81][82]
1. 컴피턴스(g1a)
2. 엔트리(g1b)
3. 프로그래션(g1c)
4. 어셈블리(g1d)
이러한 하위 단계는 성장 인자, 영양 공급, 온도, 기타 저해 인자에 의해 영향을 받을 수 있다. S기에 들어가기 전에 G1기를 중단하고 휴면 상태인 G0기에 들어가는 세포도 있다. G1기의 길이는 다양하며, 같은 종류의 생물이라도 세포에 따라 다르다.[81] 24시간마다 분열을 반복하는 활발한 사람의 세포에서는 G1기에 약 9시간이 걸린다.[82] G1기의 끝에는 세포 주기 체크포인트가 있는데, DNA에 결함이 없고 세포의 기능이 정상임을 확인하는 일련의 안전 장치이다. 기능적으로는 사이클린 의존성 키나아제(Cyclin Dependent Kinase; CDK)가 이 역할을 수행하고 있다. G1기 CDK 단백질은 다양한 유전자에 대해 전사 인자를 활성화한다. 이 유전자 중에는 DNA 합성 단백질이나 S기 CDK 단백질에 대응하는 것도 포함되어 있다.[82]
2. 1. 2. S기 (Synthesis)
S기(Synthesis phase)는 G1기에 이어지는 시기로, 염색체의 DNA가 복제되는 시기이다. S기 동안 DNA 헬리케이즈가 DNA 이중 나선을 열어 단일 가닥을 만들고, 이어서 DNA 중합효소가 상보적인 염기쌍을 결합시켜 2개의 이중 나선 DNA를 생성한다. DNA 합성이 완료되어 모든 염색체가 복제되면 S기가 종료된다. S기 동안 세포 내 DNA 양은 실질적으로 2배가 된다. S기에는 RNA 전사와 단백질 합성이 매우 낮은 속도로 이루어진다. 그러나 히스톤은 예외적으로, 대부분 S기에 만들어진다.[83][84][85] 중심체도 S기에 복제된다. DNA 복제와 중심체 복제는 독립적으로 진행되지만, 그 진행에는 많은 공통적인 인자들이 관여한다. 결과적으로 세포 분열에 필요한 세포 내 유전 물질 복제는 S기에 완료된다.[86]S기에는 DNA 손상이 자주 일어나지만, 복제가 완료됨과 동시에 DNA 복구가 시작된다. 복구가 불완전하면 세포 주기 검문점 기작에 의해 감지되어 세포 주기가 정지된다. 이 단계를 통과하면 대부분 세포는 세포 주기를 도중에 멈추지 않는다.
2. 1. 3. G0기 (Gap 0)
G1기에서 증식 신호가 발생하지 않으면, 세포는 G0기라 불리는 특수한 휴지기에 들어선다.[3] G0기 세포는 더 이상 분열하지 않지만, 성장 인자 등 다른 신호로 다시 분열하는 정상적인 세포 주기를 진행할 수 있다.[3] 인체 세포 대부분은 G0기에 있으며, 특히 다세포 진핵생물의 근육 세포나 신경 세포처럼 완전히 분화된 세포는 G0기에 머무르며 분열하지 않는다.G0기는 세포가 세포 주기를 벗어나 분열을 멈춘 휴지기이다. 다세포 진핵생물의 비증식성(비분열성) 세포는 일반적으로 G1기에서 G0기로 진입하여 장기간, 때로는 무기한(주로 뉴런) 휴지 상태를 유지한다. 이는 완전히 세포 분화된 세포에서 매우 흔하다. 일부 세포는 반영구적으로 G0기에 들어가 분열 후 세포로 간주된다(예: 간, 신장, 위 세포). 많은 세포는 G0기에 들어가지 않고 생명체 전체 수명 동안 계속 분열한다(예: 상피 세포).
G0기는 세포 분열이나 분열 준비가 이루어지지 않는 G1기가 연장된 상태이자, 세포 주기에서 벗어난 활동 정지 상태로 여겨진다. 신경 세포나 심근 세포 등은 세포 분화 শেষে 유사 분열 후 분열을 멈추고 성숙하여 남은 수명 동안 본래 기능을 수행한다. 이런 세포에게 G0기는 세포 주기 밖 비분열 상태이므로 "유사 분열 후"라고도 불린다. 세포질 분열을 하지 않는 다핵근세포도 G0기에 있다고 표현된다.
2. 1. 4. G2기 (Gap 2)
G2기는 DNA 합성이 종료된 후 분열을 준비하는 마지막 단계이다. 분열 과정에 필요한 미세소관을 합성하며 RNA와 기타 단백질을 합성하는 시기이다.[3] G2기는 DNA 복제 이후에 일어나며, 세포가 분열(세포 분열)을 준비하기 위해 단백질 합성과 급격한 세포 성장이 일어나는 기간이다. 이 단계 동안 미세소관은 방추체를 형성하기 위해 재정비되기 시작한다(전전기). 분열기로 진행하기 전에, 세포는 G2 검문점에서 염색체 내의 DNA 손상을 확인해야 한다. G2 검문점은 주로 종양 단백질 p53에 의해 조절된다. DNA가 손상되면 p53은 DNA를 복구하거나 세포의 세포 사멸을 유발한다. p53이 제대로 기능하지 않거나 변이되면, 손상된 DNA를 가진 세포가 세포 주기를 계속 진행하여 암 발생으로 이어질 수 있다.2. 2. 분열기 (M Phase)
M기(Mitotic phase)는 세포 주기의 비교적 짧은 기간으로, 핵분열과 세포질분열로 구성된다. M기는 복잡하고 정교하게 조절되며, 한 단계의 활동 완료와 다음 단계의 시작에 따라 순차적으로 진행된다.[3]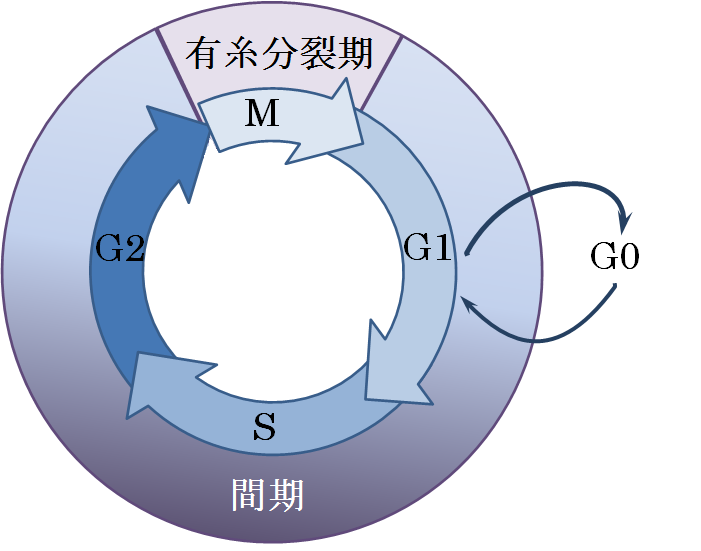
세포 주기는 광학 현미경 관찰에 기초하여, 간기(interphase)와 M기(M phase)로 나뉜다. 간기는 다시 G1기, S기, G2기로 나뉜다. M기는 유사 분열과 세포질 분열로 구성된다.
| 상태 | 기간 | 약칭 | 설명 |
|---|---|---|---|
| 정지/ 노화 | Gap 0 | G0 | 세포가 주기에서 벗어나거나 분열을 멈추는 휴지기. |
| 간기 | Gap 1 | G1 | 세포가 커진다. G1/S 체크포인트에서 다음 DNA 합성에 대한 준비가 되었는지 확인한다. |
| 합성(Synthesis) | S | DNA의 복제가 일어난다. | |
| Gap 2 | G2 | DNA 합성에서 유사 분열이 일어나기까지 세포는 계속 성장한다. G2/M 체크포인트에서 다음 M기(유사 분열과 세포질 분열)에 대한 준비가 되었는지 확인한다. | |
| 세포 분열 | 분열(Mitosis and cytokinesis) | M | 세포의 성장은 멈추고, 활동 에너지는 분열에 집중된다. 유사 분열 도중 M기 체크포인트에서 완전한 분열에 대한 준비가 되었는지 확인한다. |
2. 2. 1. 핵분열 (Mitosis)
체세포분열 중 핵분열 과정은 보통 전기, 전중기, 중기, 후기, 말기의 5단계로 나뉜다. 각 단계는 염색체와 핵의 모양에 따라 구분되며, 전중기를 전기에 포함시키기도 한다.핵분열은 진핵생물 세포가 세포핵 내의 염색체를 두 개의 동일한 세트로 분리하여 두 개의 핵으로 만드는 과정이다.[8] 핵분열 과정 동안 염색체 쌍은 응축되어 세포의 반대쪽으로 자매 염색 분체를 당기는 미세 소관에 부착된다.[9]
핵분열은 진핵생물 세포에서만 발생하지만, 종에 따라 다른 방식으로 일어난다. 예를 들어 동물 세포는 염색체가 분리되기 전에 핵막이 파괴되는 "개방형" 핵분열을 겪는 반면, ''Aspergillus nidulans''와 ''Saccharomyces cerevisiae'' (효모) 같은 균류는 염색체가 손상되지 않은 세포핵 내에서 분열되는 "폐쇄형" 핵분열을 겪는다.[10]
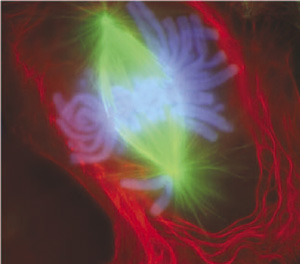
M기(Mitotic phase의 약자[87])에는 유사분열(mitosis)과 세포질 분열(cytokinesis)이 일어난다. 유사분열은 대부분의 세포에서 약 1시간 정도에 종료된다. 유사분열은 염색체의 동태를 광학 현미경으로 관찰한 것에 기초하여, 전기, 전중기, 중기, 후기, 말기로 나뉜다. 전기에 염색체의 응축(염색체 응축)이 일어나며, 이 시기에 염색체가 현미경으로 관찰할 수 있게 된다. 중기에 들어가면 핵막이 사라지고, 염색체가 적도면에 정렬된다. 방추사도 이 시기에 완성된다. 후기에는 동원체 부근에서 결합했던 자매 염색 분체가 방추사에 의해 끌려가는 형태로 분리되어 극 방향으로 이동하기 시작한다. 말기에는 분리를 마친 염색체가 탈응축되고, 그 주위에 핵막이 재형성된다. 또한, 이 시기부터 세포질 분열이 시작되어 세포 분열이 종료된다.
유사분열은 생물 종에 따라 다른 양상을 보인다. 예를 들어, 위에서 언급한 것처럼 동물 세포에서는 핵막이 일시적으로 소실되는 "열린" 유사분열(open mitosis)을 수행한다. 반면, 출아 효모(Saccharomyces cerevisiae)와 같은 균류에서는 M기를 통해 핵막이 붕괴되지 않고 세포핵 안에서 염색체가 분리되는 "닫힌" 유사분열(closed mitosis)을 수행한다.[88]
일반적으로 유사분열과 세포질 분열은 연속적으로 일어난다. 그러나 하나의 세포에 여러 개의 핵이 존재하는 상태를 거치는 생물도 많이 알려져 있다. 균류, 변형균이 대표적인 예시이며, 다른 생물에서도 나타나는 현상이다. 동물에서도 예를 들어 초파리의 특정 배 발생 단계에서는 유사분열과 세포질 분열이 연속적으로 일어나지 않는 것으로 알려져 있다.[89]
2. 2. 2. 세포질분열 (Cytokinesis)
세포 분열이 끝나면 즉시 세포질 분열이 일어나 핵, 세포질, 세포 소기관 및 세포막을 대략적으로 동일한 비율로 분할하여 두 개의 세포를 형성한다. 세포질 분열은 식물 세포와 동물 세포에서 다르게 일어난다. 동물 세포에서는 세포막이 홈을 형성하여 점차 깊어져 세포질을 분리하는 반면, 식물 세포에서는 세포판이 형성되어 세포질을 분리한다. 세포판의 위치는 미세소관과 액틴 필라멘트의 전전기 띠의 위치에 의해 결정된다. 세포 분열과 세포질 분열은 함께 모세포를 유전적으로 동일한 두 개의 딸세포로 나누는 세포 분열을 정의한다. 이는 세포 주기의 약 10%를 차지한다.[3]세포질 분열은 일반적으로 세포 분열과 함께 일어나기 때문에 "세포 분열"은 종종 "M기"와 같은 의미로 사용된다. 그러나 세포 분열과 세포질 분열이 별도로 일어나 내핵 형성이라는 과정을 통해 여러 개의 핵을 가진 단일 세포를 형성하는 많은 세포가 있다. 이는 균류와 점균류에서 가장 두드러지게 나타나지만 다양한 그룹에서도 발견된다. 심지어 동물에서도 세포질 분열과 세포 분열은 독립적으로 일어날 수 있는데, 예를 들어 초파리 배아 발달의 특정 단계에서 그렇다.[11] 세포 분열의 오류는 세포자멸사를 통해 세포 사멸을 초래하거나 암으로 이어질 수 있는 돌연변이를 일으킬 수 있다.
M기(Mitotic phase의 약자[87])에는 유사분열(mitosis)과 세포질 분열이 일어난다. 일반적으로 유사분열과 세포질 분열은 연속적으로 일어난다. 그러나 하나의 세포에 여러 개의 핵이 존재하는 상태를 거치는 생물도 많이 알려져 있다. 균류, 변형균이 대표적인 예시이며, 다른 생물에서도 나타나는 현상이다. 동물에서도 예를 들어 초파리의 특정 배 발생 단계에서는 유사분열과 세포질 분열이 연속적으로 일어나지 않는 것으로 알려져 있다.[89]
세포 분열 말기에 동물 세포는 세포막에 존재하는 액틴 미세섬유와 미오신으로 이루어진 수축환이라는 단백질 복합체의 상호작용으로 세포막이 바깥쪽에서 안쪽으로 밀려들어가면서 세포질이 분열된다. 식물 세포는 각 세포의 골지체에서 분비된 소낭이 세포의 중앙에서 서로 만나면서 세포판이 형성되기 시작한다.
3. 세포 주기의 조절
세포 주기의 조절은 세포 생존에 필수적인 과정으로, 유전적 손상 감지 및 복구, 통제되지 않는 세포 분열 방지 등을 포함한다. 이 과정은 순차적이고 방향성이 있어, 각 단계가 순서대로 발생하며 "역전"될 수 없다.
세포 주기 조절에는 사이클린과 사이클린 의존성 키나아제(CDK)라는 두 가지 주요 분자 부류가 핵심적인 역할을 한다.[12] 리랜드 하트웰, R. 티머시 헌트, 폴 너스는 이러한 분자들을 발견한 공로로 2001년 노벨 생리학·의학상을 수상했다.[13]
세포 주기 진행은 '''세포 주기 검문점'''(Checkpoint)에 의해 조절된다. 세포 주기 검문점은 DNA 미복제, 방추사 집합, 염색체 분리, DNA 손상 등의 문제를 감시한다.
- '''DNA 미복제 체크포인트''': DNA 복제가 완료되었는지 확인한다. 미완료 시 ATR-Chk1 경로를 통해 세포 주기를 정지시킨다.
- '''방추사 집합 체크포인트''': 방추사 형성이 정상인지 확인한다. Mad2가 활성화되어 Cdc20을 억제하고 염색체 분열을 막는다.
- '''염색체 분리 체크포인트''': 염색체 분배가 정상인지 확인한다. 실패 시 Cdc2/Cyclin B 복합체가 활성을 유지하여 세포질 분열을 막는다.
- '''DNA 손상 체크포인트''': DNA 손상을 감지하고 ATM/ATR, Chk1/2, p53, Bax 등을 활성화하여 DNA 수복, 세포 자멸사, 노화 등을 유도한다.
세포 주기 억제 단백질은 크게 ''cip/kip'' 집단과 INK4a/ARF 집단으로 나뉜다.
- '''cip/kip 집단''': p21, p27, p57 등을 포함하며, 사이클린-CDK 복합체를 억제하여 G1기에서 세포 주기를 중단시킨다.
- '''INK4a/ARF 집단''': p16INK4a와 p14ARF를 포함하며, 각각 CDK4 억제 및 p53 분해 억제 기능을 한다.
Cdc25 합성 억제제는 항암제로 활용될 수 있다.[29]
많은 암에서 Cdk 4/6 활성이 과도하게 나타난다.[30] Cdk4/6 억제제인 팔보시클립, 리보시클립, 아베마시클립은 전이성 유방암 치료에 사용된다.[31][32]
3. 1. 사이클린-CDK 복합체
세포 주기의 조절은 유전적 손상의 감지 및 복구, 통제되지 않은 세포 분열 방지를 포함하여 세포 생존에 필수적인 과정이다. 세포 주기를 제어하는 분자적 사건은 순차적이고 방향성이 있다. 즉, 각 과정은 순차적으로 발생하며 주기를 "역전"하는 것은 불가능하다.사이클린과 사이클린 의존성 키나아제(CDK)라는 두 가지 주요 조절 분자 부류는 세포가 세포 주기를 거쳐 진행되는 것을 결정한다.[12] 리랜드 하트웰, R. 티머시 헌트, 폴 너스는 이러한 핵심 분자를 발견하여 2001년 노벨 생리학·의학상을 수상했다.[13]
사이클린과 CDK를 암호화하는 많은 유전자는 모든 진핵생물에서 보존되지만, 일반적으로 더 복잡한 유기체는 더 많은 개별 구성 요소를 통합하는 더 정교한 세포 주기 제어 시스템을 가지고 있다. 관련 유전자 중 다수는 효모, 특히 ''사카로미세스 세레비지애''를 연구하여 처음으로 확인되었다.[14] 효모의 유전적 명명법은 이러한 유전자 중 다수에 식별 번호가 뒤따르는 ''cdc''( "세포 분열 주기"의 약자)를 붙인다. 예를 들어 ''cdc25'' 또는 ''cdc20''이 있다.
사이클린은 조절 서브유닛을 형성하고 CDK는 활성화된 이종이량체의 촉매 서브유닛을 형성한다. 사이클린은 촉매 활성이 없고 CDK는 파트너 사이클린이 없으면 비활성화된다. 결합된 사이클린에 의해 활성화되면 CDK는 인산화라고 하는 일반적인 생화학 반응을 수행하여 표적 단백질을 활성화 또는 비활성화하여 세포 주기의 다음 단계로의 조정된 진입을 조율한다. 서로 다른 사이클린-CDK 조합은 표적화되는 다운스트림 단백질을 결정한다. CDK는 세포에서 구성적으로 발현되는 반면, 사이클린은 다양한 분자 신호에 반응하여 세포 주기의 특정 단계에서 합성된다.[15]
세포 분열 촉진 세포 외부 신호를 받으면 G1 사이클린-CDK 복합체가 활성화되어 세포를 S기에 대비시키고, S 사이클린과 DNA 복제에 필요한 효소의 발현을 촉진하는 전사 인자의 발현을 촉진한다. G1 사이클린-CDK 복합체는 또한 S기 억제제 역할을 하는 분자를 유비퀴틴화하여 분해를 촉진한다. 단백질이 유비퀴틴화되면 프로테아좀에 의해 단백질 분해를 하도록 표적이 된다. 그러나 단일 세포 수준에서 E2F 전사 역학에 대한 최근 연구 결과에 따르면 G1 사이클린-CDK 활성, 특히 사이클린 D-CDK4/6의 역할은 세포 주기의 진입을 약속하기보다는 시기를 조절하는 것이다.[16]
활성 S 사이클린-CDK 복합체는 G1기에 DNA 복제 기점에 조립된 전복제 복합체를 구성하는 단백질을 인산화한다. 인산화는 두 가지 목적을 수행한다. 이미 조립된 각 전복제 복합체를 활성화하고 새로운 복합체의 형성을 방지하는 것이다. 이를 통해 세포의 모든 게놈 부분이 한 번만 복제되도록 보장한다. 복제에 틈이 생기는 것을 방지하는 이유는 매우 명확하다. 중요한 유전자의 전부 또는 일부가 없는 딸세포는 죽기 때문이다. 그러나 유전자 복제수 효과와 관련된 이유로, 특정 유전자의 여분의 복사본을 갖는 것 또한 딸세포에 해롭다.
S기 및 G2기 동안 합성되지만 비활성화되는 유사 분열 사이클린-CDK 복합체는 염색체 응축 및 분열 방추체 조립과 관련된 하위 단백질을 자극하여 유사 분열의 개시를 촉진한다. 이 과정에서 활성화되는 중요한 복합체는 염색체 동원체와 관련된 구조 단백질의 분해를 촉진하는 후기 촉진 복합체(APC)로 알려진 유비퀴틴 연결 효소이다. APC는 또한 유사 분열 사이클린을 분해하도록 표적으로 삼아 말기 및 세포질 분열이 진행되도록 한다.[17]
사이클린 D는 세포 주기에 진입하는 세포에서 세포 외부 신호(예: 성장 인자)에 반응하여 생성되는 첫 번째 사이클린이다. 사이클린 D의 수준은 증식하지 않는 휴지 상태의 세포에서는 낮게 유지된다. 또한, CDK4/6 및 CDK2도 CDK4/6이 INK4 계열 구성원(예: p16)에 의해 결합되어 키나아제 활성을 제한하기 때문에 비활성화된다. 한편, CDK2 복합체는 p21 및 p27과 같은 CIP/KIP 단백질에 의해 억제된다.[18] 세포가 세포 주기에 진입할 때(유사 분열 자극에 의해 유발됨) 사이클린 D의 수준이 증가한다. 이 자극에 반응하여 사이클린 D는 기존의 CDK4/6에 결합하여 활성 사이클린 D-CDK4/6 복합체를 형성한다. 사이클린 D-CDK4/6 복합체는 차례로 망막 모세포종 감수성 단백질(Rb)을 pRb로 단일 인산화한다. 비인산화된 Rb 종양 억제 단백질은 세포 주기 종료를 유도하고 G0 정지(노화)를 유지하는 기능을 한다.[19]
지난 수십 년 동안 pRB 단백질이 사이클린 D-Cdk4/6 매개 인산화에 의해 비활성화된다는 모델이 널리 받아들여졌다. Rb에는 14개 이상의 잠재적인 인산화 부위가 있다. 사이클린 D-Cdk 4/6는 Rb를 점진적으로 인산화하여 과인산화 상태로 만들며, 이는 pRB–E2F 복합체의 해리를 유발하여 G1/S 세포 주기 유전자 발현을 유도하고 S 단계로 진행한다.[20]
그러나 최근 연구의 과학적 관찰에 따르면 Rb는 세 가지 유형의 동형체로 존재한다. (1) G0 상태의 비인산화 Rb, (2) 초기 G1 상태에서 "부분적으로" 인산화된 Rb라고도 하는 단일 인산화 Rb, (3) 후기 G1 상태의 비활성 과인산화 Rb이다.[21][22][23] 초기 G1 세포에서 단일 인산화 Rb는 각각 고유한 E2F 결합 친화성을 가진 14개의 서로 다른 동형체로 존재한다.[23] Rb는 수백 개의 서로 다른 단백질과 연관된 것으로 밝혀졌으며[24] 다양한 단일 인산화 Rb 동형체가 서로 다른 단백질 파트너를 갖는다는 아이디어가 매우 매력적이었다.[25] 최근 보고서에 따르면 단일 인산화는 Rb의 다른 단백질과의 연관성을 제어하고 기능적으로 구별되는 형태의 Rb를 생성하는 것으로 확인되었다.[26] 모든 다른 단일 인산화 Rb 동형체는 E2F 전사 프로그램을 억제하고 G1 단계에서 세포를 정지시킬 수 있다. 중요하게도, Rb의 서로 다른 단일 인산화 형태는 E2F 조절을 넘어 확장되는 고유한 전사 출력을 갖는다.[26]
일반적으로 pRb가 E2F에 결합하면 E형 사이클린을 포함한 특정 G1/S 및 S 전이 유전자의 E2F 표적 유전자 발현이 억제된다. Rb의 부분적인 인산화는 E2F 표적 유전자 발현에 대한 Rb 매개 억제를 해제하고 사이클린 E의 발현을 시작한다. 세포가 사이클린 E 활성화로 전환되는 분자 메커니즘은 현재 알려져 있지 않지만, 사이클린 E 수준이 증가함에 따라 활성 사이클린 E-CDK2 복합체가 형성되어 Rb가 과인산화에 의해 비활성화된다.[23] 과인산화된 Rb는 E2F로부터 완전히 해리되어 세포가 S 단계로 진행하는 데 필요한 광범위한 E2F 표적 유전자의 추가 발현을 가능하게 한다. 최근에, 사이클린 D-Cdk4/6가 다른 사이클린, 사이클린 E, A 및 B가 아닌 사이클린 D에만 구별되는 Rb의 C-말단 알파 나선 영역에 결합하는 것이 확인되었다.[27] Rb 인산화의 구조 분석을 기반으로 한 이 관찰은 Rb가 여러 사이클린-Cdk 복합체를 통해 다른 수준으로 인산화된다는 것을 뒷받침한다. 또한 이것은 단일 유형의 Rb 과인산화 메커니즘을 통해 모든 단일 인산화 Rb 동형체의 동시 스위치형 비활성화에 대한 현재 모델을 가능하게 한다. 또한 사이클린 D-Cdk 4/6 특이적 Rb C-말단 나선의 돌연변이 분석 결과, Rb에 대한 사이클린 D-Cdk 4/6 결합의 중단은 Rb 인산화를 방지하고, G1에서 세포를 정지시키고, 종양 억제에서 Rb의 기능을 강화하는 것으로 나타났다.[27] 이 사이클린-Cdk 구동 세포 주기 전이 메커니즘은 세포 증식을 허용하는 세포 주기에 전념하는 세포를 관리한다. 암세포 성장은 종종 사이클린 D-Cdk 4/6 활성의 조절 장애를 동반한다.
과인산화된 Rb는 E2F/DP1/Rb 복합체(E2F 반응 유전자에 결합되어 효과적으로 전사를 "차단"함)로부터 해리되어 E2F를 활성화한다. E2F의 활성화는 사이클린 E, 사이클린 A, DNA 중합 효소, 티미딘 키나아제 등과 같은 다양한 유전자의 전사를 초래한다. 따라서 생성된 사이클린 E는 CDK2에 결합하여 사이클린 E-CDK2 복합체를 형성하며, 이는 세포를 G1에서 S 단계로 이동시킨다(G1/S, 이는 G2/M 전이를 시작한다).[28] 사이클린 B-cdk1 복합체 활성화는 핵막의 파괴와 전기 시작을 유발하고, 그 후 비활성화는 세포가 유사 분열을 종료하게 한다.[15] 엔지니어링된 형광 리포터 세포를 사용하여 단일 세포 수준에서 E2F 전사 역학에 대한 정량적 연구는 세포 주기 진입의 제어 논리를 이해하기 위한 정량적 프레임워크를 제공하여 표준 교과서 모델에 도전했다. Myc와 같이 E2F 축적의 진폭을 조절하는 유전자는 세포 주기 및 S 단계 진입에 대한 헌신을 결정한다. G1 사이클린-CDK 활성은 세포 주기 진입의 동인이 아니다. 대신, 주로 E2F 증가의 시기를 조정하여 세포 주기 진행 속도를 조절한다.[16]
세포 주기의 진행은 '''Cdk'''(cyclin-dependent kinase, 사이클린 의존성 키나아제)와 '''사이클린'''(cyclin) 복합체에 의해 제어된다. Cdk/사이클린 복합체는 세포 주기를 앞으로 진행시키므로, '''세포 주기 엔진'''(cell cycle engine)이라고 불린다. 동물 세포에서는 여러 Cdk/사이클린 복합체가 세포 주기 진행에 관여한다.
| 단계 | 복합체 |
|---|---|
| G1기에서 S기로 진행 | Cdk2/사이클린 E 복합체 |
| S기에서 G2기로 진행 | Cdk2/사이클린 A 복합체 |
| G2기에서 M기로 이행 | Cdk1/사이클린 B 복합체 (Cdk1은 Cdc2라고도 불린다) |
세포 내에서는 각 사이클린의 전사 제어 및 유비퀴틴 의존적인 분해, Cdk는 인산화・탈인산화 등의 수식을 통한 활성 제어가 이루어져 필요한 때에 필요한 복합체만 활성화되도록 한다.
3. 2. 세포 주기 검문점 (Checkpoint)
세포 주기의 조절은 유전적 손상의 감지 및 복구, 통제되지 않은 세포 분열 방지를 포함하여 세포 생존에 필수적인 과정이다. 세포 주기를 제어하는 분자적 사건은 순차적이고 방향성이 있다. 즉, 각 과정은 순차적으로 발생하며 주기를 "역전"하는 것은 불가능하다.[47]세포 주기 검문점은 세포 주기의 진행을 감시하고 조절하는 데 사용된다.[47] 검문점은 특정 지점에서 세포 주기 진행을 막아 필요한 단계의 과정을 확인하고 DNA 손상을 복구할 수 있도록 한다. 검문점 요구 사항이 충족될 때까지 세포는 다음 단계로 진행할 수 없다. 검문점은 일반적으로 세포 주기의 다양한 단계를 통해 세포의 진행을 감시하고 지시하는 조절 단백질 네트워크로 구성된다.
손상되거나 불완전한 DNA가 딸세포로 전달되지 않도록 하는 여러 검문점이 있다. 세 가지 주요 검문점은 G1/S 검문점, G2/M 검문점 및 중기(분열) 검문점이 있다. 또 다른 검문점은 세포의 성숙도를 확인하는 G0 검문점이다. 세포가 아직 준비되지 않아 이 검문점을 통과하지 못하면 분열에서 제외된다.
G1/S 전환은 세포 주기의 속도 제한 단계이며 제한점이라고도 한다.[15] 이는 세포가 DNA를 완전히 복제하기에 충분한 원자재(뉴클레오티드 염기, DNA 합성효소, 염색질 등)를 가지고 있는지 확인하는 곳이다. 건강하지 않거나 영양 부족인 세포는 이 검문점에 갇히게 된다.
G2/M 검문점은 세포가 두 개의 딸세포에 충분한 세포질과 인지질을 가지고 있는지 확인하는 곳이다. 그러나 때로는 더 중요한 것은 복제할 적절한 시기인지 확인하는 것이다. 많은 세포가 동시에 모두 복제해야 하는 상황이 있다(예: 성장하는 배아는 중간 배반포 전환에 도달할 때까지 대칭적인 세포 분포를 가져야 한다). 이는 G2/M 검문점을 제어하여 수행된다.
중기 검문점은 세포가 중기에 들어가면 유사 분열을 겪기로 결정했기 때문에 비교적 사소한 검문점이다. 그러나 이것이 중요하지 않다는 것을 의미하는 것은 아니다. 이 검문점에서 세포는 방추사가 형성되었는지, 그리고 아나파스(후기)가 시작되기 전에 모든 염색체가 방추사 적도에 정렬되었는지 확인한다.[49]
모든 세포가 복제하기 위해 이 순서대로 각 검문점을 통과해야 하는 것은 아니다. 많은 유형의 암은 세포가 다양한 검문점을 빠르게 통과하거나 건너뛰도록 하는 돌연변이에 의해 발생한다. S에서 M, S 단계로 거의 연속적으로 진행된다. 이러한 세포는 검문점을 잃었기 때문에 발생했을 수 있는 모든 DNA 돌연변이가 무시되고 딸세포로 전달된다. 이것이 암세포가 기하급수적으로 돌연변이를 획득하는 경향이 있는 한 가지 이유이다. 암세포 외에도, 완전히 분화된 많은 세포 유형은 더 이상 복제되지 않으므로 세포 주기를 떠나 사망할 때까지 G0에 머문다. 따라서 세포 검문점의 필요성이 제거된다. DNA 손상에 대한 세포 주기 반응의 대안적 모델인 복제 후 검문점도 제안되었다.
검문점 조절은 유기체의 발달에 중요한 역할을 한다. 유성 생식에서 난자 수정이 발생할 때 정자가 난자에 결합하면 수정되었음을 난자에게 알리는 신호 전달 인자를 방출한다. 무엇보다도 이것은 현재 수정된 난모세포가 이전에 휴면 상태인 G0에서 세포 주기로 돌아가 유사 분열 복제 및 분열을 시작하도록 유도한다.
p53은 G1/S 및 G2/M 검문점에서 제어 메커니즘을 유발하는 데 중요한 역할을 한다. p53 외에도, 검문점 조절 인자는 암 성장 및 증식에서의 역할에 대해 집중적으로 연구되고 있다.
정상적인 세포 분열을 보장하기 위해 G1/S기 등 중요한 시점에서 세포 주기의 진행이 정상적으로 이루어지는지 감시하는 지점이 있으며, 이를 '''세포 주기 체크포인트 기구'''라고 한다. 세포 주기 체크포인트는 '''DNA 미복제 체크포인트''', '''방추사 집합 체크포인트''', '''염색체 분리 체크포인트''', '''DNA 손상 체크포인트'''로 구성된다.
- '''DNA 미복제 체크포인트'''
- : DNA 미복제 체크포인트는 DNA 복제가 완료되어 분열기로 진행될 준비가 되었는지 감시한다. DNA 복제가 미완료되면, '''ATR-Chk1''' 의존적으로 M기로의 이동에 필요한 Cdk/사이클린 복합체의 활성화를 억제하여 세포 주기를 정지시킨다.
- '''방추사 집합 체크포인트'''
- : 방추사 집합 체크포인트는 M기 후기에 방추사의 형성이 정상적이고 분열기 후기로 이동할 수 있는 상황인지 확인한다. 방추사 형성에 실패하면, '''Mad2'''가 미세 소관과 결합하지 않은 동원체 의존적으로 활성화되어, 분열 후기 시작에 필요한 '''Cdc20'''의 활성을 억제하고, 염색체의 분열을 정지시킨다.
- '''염색체 분리 체크포인트'''
- : 염색체 분리 체크포인트는 M기 말기에 정상적인 염색체 분배가 이루어졌는지 확인한다. 염색체 분배에 실패하면 Cdc2/Cyclin B 복합체가 활성을 잃지 않고 세포질 분열로 넘어가지 못한다.
- '''DNA 손상 체크포인트'''
- : DNA 손상 체크포인트는 G1기, G1/S기, S기, G2/M기에서 작용하여, DNA에 손상이나 변이가 없는 정상적인 DNA 합성을 보장한다. 이 기구는 '''ATM/ATR'''이 자체적으로 또는 다른 인자에 의해 DNA 손상을 인식함으로써 활성화되며, 이것이 하위의 '''Chk1/2'''나 '''p53''', '''Bax''' 등을 활성화함으로써 DNA 수복이나 세포 자멸사, 노화 등을 통해 원치 않는 유전 정보의 손실이나 세포의 암화를 방지한다.
3. 3. 세포 주기 억제 단백질
세포 주기 억제 단백질에는 크게 두 가지 유전자 집단이 있다. ''cip/kip'' (''CDK interacting protein/Kinase inhibitory protein'', 사이클린 의존성 키나아제 상호작용 단백질/키나아제 억제 단백질) 집단과 INK4a/ARF (''In''hibitor of ''K''inase 4/''A''lternative ''R''eading ''F''rame, 키나아제 4 억제제/대체 판독 프레임) 집단은 세포 주기의 진행을 막는다. 이 유전자들은 종양 형성을 예방하는 데 중요한 역할을 하기 때문에 종양 억제 유전자로 알려져 있다.'''cip/kip 집단'''에는 p21, p27, p57 유전자가 포함된다. 이들은 사이클린-CDK 복합체에 결합하여 비활성화함으로써 G1기에서 세포 주기를 중단시킨다. p21은 p53에 의해 활성화되며, p53은 방사선 조사와 같이 DNA 손상에 의해 트리거된다. p27은 성장 억제제인 형질전환 성장 인자 β (TGF β)에 의해 활성화된다.
'''INK4a/ARF 집단'''에는 CDK4에 결합하여 G1기에서 세포 주기를 멈추는 p16INK4a와 p53 분해를 막는 p14ARF가 포함된다.
Cdc25의 합성 억제제는 세포 주기를 멈추는 데 유용할 수 있으며, 따라서 항종양 및 항암제로 유용할 수 있다.[29]
많은 인간 암은 과활성화된 Cdk 4/6 활성을 가지고 있다.[30] 사이클린 D-Cdk 4/6 기능에 대한 관찰을 고려할 때, Cdk 4/6의 억제는 악성 종양의 증식을 막는 결과를 가져와야 한다. 결과적으로, 과학자들은 항종양 효과를 위한 치료 목표로 Cdk4/6가 특징지어졌기 때문에 합성 Cdk4/6 억제제를 개발하려고 시도했다. 세 가지 Cdk4/6 억제제인 팔보시클립, 리보시클립, 아베마시클립은 현재 진행성 또는 전이성 유방암, 호르몬 수용체 양성 유방 종양 (HR-양성, HR+), HER2 음성 유방암 (HER2-) 유방암을 치료하기 위해 임상 사용에 대해 FDA 승인을 받았다.[31][32] 예를 들어, 팔보시클립은 경구 투여가 가능한 CDK4/6 억제제이며, ER 양성/HER2 음성 진행성 유방암에 대해 개선된 결과를 보여주었다. 주요 부작용은 용량 감소로 관리할 수 있는 호중구 감소증이다.[33]
Cdk4/6 표적 치료는 Rb가 발현되는 암 유형만 치료할 것이다. Rb 상실을 가진 암세포는 Cdk4/6 억제제에 대한 1차 내성을 갖는다.
4. 세포 주기와 암
세포 주기의 조절 장애는 종양 형성을 유발할 수 있으며, 이는 암 발생의 주요 기전 중 하나이다.[53] 특히, RB, p53 등의 세포 주기 억제 유전자가 변이되면 세포의 무제한 증식을 유도하여 종양을 형성한다.
세포 주기를 활발하게 진행 중인 세포는 약물이나 방사선에 취약하므로, 암 치료의 표적이 된다. 벌크 감소술로 종양을 제거한 후, 방사선이나 화학 요법을 사용하면 세포 주기에 새로 진입한 세포들을 효과적으로 제거할 수 있다.[15]
세포 주기의 길이는 세포 종류에 따라 다르다. 장 상피의 음와 세포는 9~10시간으로 매우 짧은 주기를 가지는 반면, 휴지기 상태의 마우스 피부 줄기 세포는 200시간 이상으로 긴 주기를 가진다. 이러한 차이는 주로 G1기의 길이에 기인한다.
세포는 세포 주기의 특정 단계에서 방사선에 대한 민감도가 다르다. 일반적으로 후기 M 및 G2기에서 가장 민감하고, 후기 S기에서 가장 저항적이다. 세포 내 설프히드릴 화합물 수준은 방사선 민감도와 관련이 있다.
DNA 이중 가닥 절단 복구 과정인 상동 재조합(HR)은 S기에서 가장 활발하며, G1기에서는 거의 존재하지 않는다. 반면, 비상동 말단 결합은 세포 주기 전반에 걸쳐 활성화된다.[55]
4. 1. 암 발생 기전
세포 주기 구성 요소의 조절 장애는 종양 형성을 유발할 수 있다.[53] RB, p53 등과 같은 일부 세포 주기 억제 유전자가 변이되면 세포가 제어할 수 없이 증식하여 종양을 형성할 수 있다. 종양 세포의 세포 주기 기간은 정상 세포 주기의 기간과 같거나 더 길지만, 종양에서 활성 세포 분열 상태인 세포의 비율(G0기에 있는 휴지기 세포에 비해)은 정상 조직보다 훨씬 높다.[54] 따라서 세포 사멸이나 노화로 죽는 세포의 수와 동일하게 유지되면서 세포 수가 순증가한다.세포 주기를 활발하게 거치는 세포는 암 치료의 표적이 되는데, 이는 세포 분열 동안 DNA가 비교적 노출되어 약물 또는 방사선에 의해 손상되기 쉽기 때문이다. 이러한 사실은 암 치료에 활용된다. 벌크 감소술이라고 알려진 과정을 통해 종양의 상당 부분이 제거되어 남은 종양 세포의 상당수가 G0에서 G1 단계로 이동하게 된다(영양분, 산소, 성장 인자 등의 가용성 증가로 인해). 벌크 감소술 이후의 방사선 또는 화학 요법은 세포 주기에 새로 진입한 이 세포들을 죽인다.[15]
배양된 포유류 세포 중 가장 빠르게 주기하는 세포인 장 상피의 음와 세포는 9~10시간의 짧은 주기 시간을 갖는다. 휴지기 상태의 마우스 피부의 줄기 세포는 200시간 이상의 주기 시간을 가질 수 있다. 이러한 차이의 대부분은 주기에서 가장 가변적인 단계인 G1의 가변적인 길이에 기인한다. M과 S는 크게 변하지 않는다.
일반적으로, 세포는 후기 M 및 G2 단계에서 방사선에 가장 민감하고, 후기 S 단계에서 가장 저항적이다. 세포 주기 시간이 더 길고 G1 단계가 상당히 긴 세포의 경우, G1 후반에 두 번째 저항 피크가 나타난다. 저항 및 민감도의 패턴은 세포 내의 설프히드릴 화합물 수준과 상관관계가 있다. 설프히드릴은 방사선 손상으로부터 세포를 보호하는 자연 물질이며, S 단계에서 가장 높은 수준을 보이고 유사 분열 근처에서 가장 낮은 수준을 보이는 경향이 있다.
상동 재조합 (HR)은 DNA 이중 가닥 절단을 복구하는 정확한 과정이다. HR은 G1기에서 거의 존재하지 않으며, S기에서 가장 활발하고, G2/M에서 감소한다.[55] 이중 가닥 절단을 복구하는 덜 정확하고 더 돌연변이적인 과정인 비상동 말단 결합은 세포 주기 전반에 걸쳐 활성화된다.
4. 2. 암 치료제 개발
Cdc25의 합성 억제제는 세포 주기를 멈추는 데 유용할 수 있으며, 따라서 항종양 및 항암제로 유용할 수 있다.[29]많은 인간 암은 과활성화된 Cdk 4/6 활성을 가지고 있다.[30] 사이클린 D-Cdk 4/6 기능에 대한 관찰을 고려할 때, Cdk 4/6의 억제는 악성 종양의 증식을 막는 결과를 가져와야 한다. 결과적으로, 과학자들은 항종양 효과를 위한 치료 목표로 Cdk4/6가 특징지어졌기 때문에 합성 Cdk4/6 억제제를 개발하려고 시도했다. 팔보시클립, 리보시클립, 아베마시클립의 세 가지 Cdk4/6 억제제는 현재 진행성 또는 전이성 유방암, 호르몬 수용체 양성 유방 종양 (HR-양성, HR+), HER2 음성 유방암 (HER2-) 유방암을 치료하기 위해 임상 사용에 대해 FDA 승인을 받았다.[31][32] 예를 들어, 팔보시클립은 경구 투여가 가능한 CDK4/6 억제제이며, ER 양성/HER2 음성 진행성 유방암에 대해 개선된 결과를 보여주었다. 주요 부작용은 용량 감소로 관리할 수 있는 호중구 감소증이다.[33]
Cdk4/6 표적 치료는 Rb가 발현되는 암 유형만 치료할 것이다. Rb 상실을 가진 암세포는 Cdk4/6 억제제에 대한 1차 내성을 갖는다.
5. 세포 주기의 진화
세포 주기는 모든 세포 구성 요소를 복제하여 두 개의 딸세포로 나누는 과정이다. 리보솜과 같은 구성 요소는 지속적으로 생성되지만, 염색체와 MTOC는 세포 주기 동안 한 번만 복제된다. 세포 주기의 핵심은 게놈 형성으로 진화한, 다양한 세포 요소의 복제를 조율하는 능력이다.[56]
세포 이전 환경에는 기능적이고 자기 복제하는 RNA가 존재했다.[56] 이 환경에서 성장은 RNA의 지속적인 생산이었다. 그러나 기생 RNA, 유전 문제, 복제 수 조절 등의 문제가 발생했다.[56][57]
"게놈" RNA를 "기능적" RNA로부터 분리하는 것은 이러한 문제를 해결하는 데 도움이 되었다.[58] 게놈 RNA의 복제 수를 제어하고, 기능적 RNA 생성과 분리하면 복제 충실도를 높일 수 있었다. 이후 더 안정적인 분자인 DNA로 게놈 RNA를 대체하면서 더 큰 게놈을 가질 수 있게 되었다. 자기 촉매 효소 합성에서 게놈 지향 효소 합성으로의 전환은 세포 진화의 중요한 단계였으며, 기능적 합성과 게놈 복제를 매우 다른 방식으로 조절해야 하는 세포 주기에 지속적인 영향을 미쳤다.[56]
세포 주기 진행은 사이클린 농도 변화와 사이클린 의존성 키나아제(CDK)의 상호작용으로 제어된다. 효모에서는 하나의 CDK가 세포 주기를 제어하지만,[59] 동물에서는 CDK 계열 전체가 진화했다.[60][61] Cdk1은 유사분열 진입을, Cdk2, Cdk4, Cdk6은 S기 진입을 조절한다. 동물의 CDK 계열 진화에도 불구하고, 이 단백질들은 중복되는 기능을 가지고 있다.[62][63][64]
애기장대는 Cdk1 상동체를 가지고 있지만, ''cdka;1'' 돌연변이는 생존 가능하여,[66] 후생동물 패턴에 반한다.[67] 식물은 B형 CDK의 독특한 그룹을 가지며, 기능은 발달 특이적 기능에서 유사분열 조절까지 다양하다.[68][69]
G1/S 검문소는 세포 분열을 시작하는 지점이다. 복잡한 조절 네트워크가 G1/S 전환 결정을 유도한다. 후생동물에서는 매우 분화된 단백질 서열과 놀랍도록 유사한 네트워크 토폴로지가 모두 존재한다.[67][70]
효모와 동물의 S기 진입은 두 개의 반대되는 조절 인자 수준에 의해 제어된다.[67] 이러한 전사 인자를 조절하는 네트워크는 효모와 동물 모두에서 이중 음성 피드백 루프와 양성 피드백 루프이다.[67][70][71] CDK-사이클린 복합체의 인산화/탈인산화도 조절에 관여한다. 이러한 조절 네트워크의 총합은 특정 단백질이 매우 분화되었음에도 불구하고 히스테리시스적이고 양안정적인 체계를 생성한다.[72][73] 효모의 경우 SBF가 발현되려면 Whi5가 Cln3 인산화에 의해 억제되어야 하는 반면,[74] 동물의 경우 E2F가 발현되려면 Rb가 Cdk4/6-사이클린 D 복합체에 의해 억제되어야 한다.[75] Rb와 Whi5는 모두 히스톤 탈아세틸화 효소 단백질을 프로모터로 모집하여 전사를 억제한다.[76][77] 두 단백질 모두 추가적으로 억제되는 여러 CDK 인산화 부위를 가지고 있다.[78][75] 그러나 이러한 단백질은 서열 유사성을 공유하지 않는다.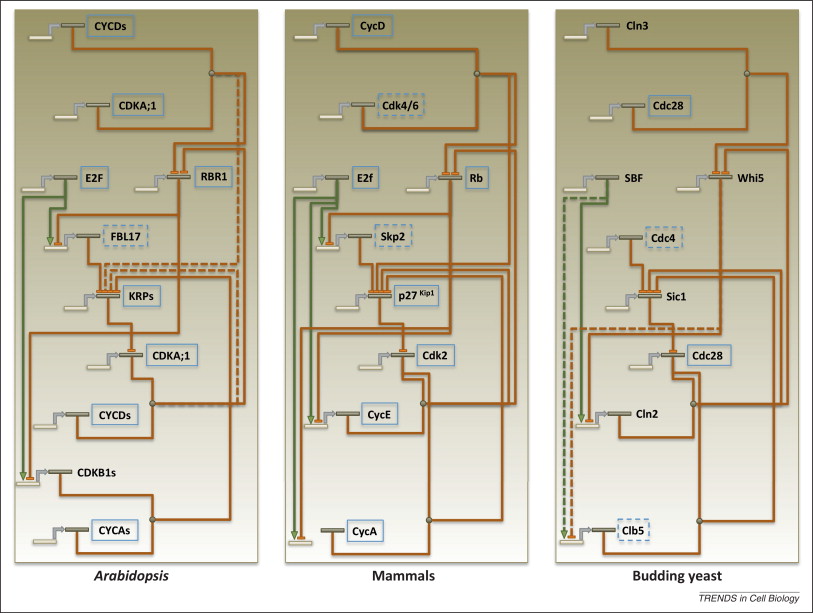
애기장대 연구는 전체 진핵생물에 걸쳐 G1/S 전환에 대한 지식을 확장한다. 식물은 또한 후생동물과 여러 보존된 네트워크 특징을 공유하며, 많은 식물 조절 인자는 직접적인 동물 상동체를 가지고 있다.[79] 예를 들어, 식물은 또한 네트워크에서 E2F 전사를 위해 Rb를 억제해야 한다.[80] 식물과 동물의 세포 주기의 이러한 보존된 요소는 진핵생물에서 조상일 수 있다. 효모는 식물 및 동물과 보존된 네트워크 토폴로지를 공유하지만, 효모 조절 인자의 매우 분화된 특성은 효모 계통에서 가능한 빠른 진화를 시사한다.[67]
5. 1. 초기 세포 주기
세포 주기를 조절하기 위해 CDK-사이클린 기계와 함께 반자율적 전사 네트워크가 작용한다는 증거가 제시되고 있다. 사카로마이세스 세레비시에에서 수행된 여러 유전자 발현 연구에서 세포 주기 동안 발현이 변화하는 800~1200개의 유전자가 확인되었다.[14][34][35] 이 유전자들은 세포 주기의 특정 시점에서 높은 수준으로 전사되며, 나머지 주기 동안 낮은 수준으로 유지된다. 확인된 유전자 세트는 유전자들을 식별하는 데 사용된 계산 방법과 기준에 따라 연구마다 다르지만, 각 연구는 효모 유전자의 상당 부분이 시간적으로 조절된다는 것을 나타낸다.[36]주기적으로 발현되는 많은 유전자들은 또한 주기적으로 발현되는 전사 인자에 의해 조절된다. 단일 유전자 녹아웃 검사에서 세포 주기 진행 결함을 보이는 48개의 전사 인자(모든 필수적이지 않은 전사 인자의 약 20%)가 확인되었다.[37] 고처리량 기술을 사용한 게놈 전체 연구를 통해 효모 유전자의 프로모터에 결합하는 전사 인자를 확인했으며, 이러한 결과를 시간적 발현 패턴과 관련시켜 위상별 유전자 발현을 조절하는 전사 인자를 식별할 수 있었다.[34][38] 이러한 전사 인자의 발현 프로파일은 이전 위상에서 최고조에 달하는 전사 인자에 의해 조절되며, 계산 모델은 이러한 전사 인자의 CDK 자율적 네트워크가 유전자 발현에서 정상 상태 진동을 생성하기에 충분하다는 것을 보여주었다.[35][39]
실험적 증거는 유전자 발현이 CDK 기계와 독립적으로 야생형 세포에서 분열 시 나타나는 주기와 함께 진동할 수 있음을 시사한다. Orlando ''et al.''은 마이크로어레이를 사용하여 야생형 세포와 모든 S기 및 유사분열 사이클린(''clb1,2,3,4,5,6'')이 없는 세포에서 주기적으로 나타나는 것으로 확인된 1,271개의 유전자의 발현을 측정했다. 분석된 1,271개의 유전자 중 882개는 사이클린 결핍 세포가 G1과 S기 사이의 경계에서 멈추는 상황에서도 야생형 세포와 동시에 사이클린 결핍 세포에서 발현이 계속되었다. 그러나 분석된 유전자 중 833개는 야생형 세포와 돌연변이 세포 사이에서 행동이 변화하여 이러한 유전자가 CDK-사이클린 기계에 의해 직접 또는 간접적으로 조절될 가능성이 있음을 나타낸다. 돌연변이 세포에서 제때 발현이 계속된 일부 유전자는 돌연변이 세포와 야생형 세포에서 다른 수준으로 발현되기도 했다. 이러한 연구 결과는 전사 네트워크가 CDK-사이클린 발진기와 독립적으로 진동할 수 있지만, 세포 주기 사건의 적절한 시기를 보장하기 위해 둘 다 필요로 하는 방식으로 연결되어 있음을 시사한다.[35] 다른 연구에서는 인산화, 즉 Cdk1에 의한 세포 주기 전사 인자의 번역 후 변형이 표적 유전자의 타이밍을 엄격하게 제어하기 위해 전사 인자의 위치나 활성을 변경할 수 있음을 나타낸다.[37][40][41]
진동하는 전사는 효모 세포 주기의 진행에 중요한 역할을 하는 반면, CDK-사이클린 기계는 초기 배아 세포 주기에서 독립적으로 작동한다. 중기배반포기 전환 전에는 접합자 전사가 일어나지 않으며 B형 사이클린과 같은 모든 필요한 단백질은 모체에 적재된 mRNA로부터 번역된다.[42]
5. 2. 사이클린-CDK 시스템의 진화
세포 주기 진행은 다양한 사이클린의 농도 진동과 그 결과로 발생하는 여러 사이클린 의존성 키나아제(CDK)의 분자적 상호 작용에 의해 제어된다. 효모에서 단 하나의 CDK(''S. cerevisiae''의 Cdc28과 ''S. pombe''의 Cdc2)가 세포 주기를 제어한다.[59] 그러나 동물에서는 CDK 계열 전체가 진화했다.[60][61] Cdk1은 유사분열 진입을 제어하고 Cdk2, Cdk4, Cdk6은 S기 진입을 조절한다. 동물에서 CDK 계열의 진화에도 불구하고, 이 단백질들은 관련되거나 중복되는 기능을 가지고 있다.[62][63][64] 예를 들어, ''cdk2 cdk4 cdk6'' 삼중 결손 마우스 세포는 여전히 기본적인 세포 주기를 진행할 수 있다.[65] ''cdk1'' 결손은 치명적이어서 조상 CDK1형 키나아제가 궁극적으로 세포 주기를 제어한다는 것을 시사한다.[65]''애기장대''는 CDKA;1이라는 Cdk1 상동체를 가지고 있지만, ''cdka;1'' ''A. thaliana'' 돌연변이는 여전히 생존 가능하며,[66] 세포 주기를 제어하는 필수 조절자로서 CDK1형 키나아제의 후생동물 패턴에 반한다.[67] 식물은 또한 B형 CDK의 독특한 그룹을 가지고 있으며, 그 기능은 발달 특이적 기능에서 유사분열 조절의 주요 역할까지 다양할 수 있다.[68][69]
5. 3. G1/S 검문점의 진화
G1/S 검문소는 세포가 세포 주기를 통해 분열을 시작하는 지점이다. 복잡한 조절 네트워크가 G1/S 전환 결정으로 이어진다. 후생동물에서는 매우 분화된 단백질 서열과 놀랍도록 유사한 네트워크 토폴로지가 모두 존재한다.[67][70]
효모와 동물의 S기 진입은 두 개의 반대되는 조절 인자의 수준에 의해 제어된다.[67] 이러한 전사 인자를 조절하는 네트워크는 효모와 동물 모두에서 이중 음성 피드백 루프와 양성 피드백 루프이다.[67][70][71] 효모와 동물의 G1/S 검문소에 대한 조절 네트워크의 추가적인 조절에는 CDK-사이클린 복합체의 인산화/탈인산화가 포함된다. 이러한 조절 네트워크의 합은 특정 단백질이 매우 분화되었음에도 불구하고 히스테리시스적이고 양안정적인 체계를 생성한다.[72][73] 효모의 경우 SBF가 발현되려면 Whi5가 Cln3 인산화에 의해 억제되어야 하는 반면,[74] 동물의 경우 E2F가 발현되려면 Rb가 Cdk4/6-사이클린 D 복합체에 의해 억제되어야 한다.[75] Rb와 Whi5는 모두 히스톤 탈아세틸화 효소 단백질을 프로모터로 모집하여 전사를 억제한다.[76][77] 두 단백질 모두 추가적으로 억제되는 여러 CDK 인산화 부위를 가지고 있다.[78][75] 그러나 이러한 단백질은 서열 유사성을 공유하지 않는다.
''애기장대''(A. thaliana)에 대한 연구는 전체 진핵생물에 걸쳐 G1/S 전환에 대한 우리의 지식을 확장한다. 식물은 또한 후생동물과 여러 보존된 네트워크 특징을 공유하며, 많은 식물 조절 인자는 직접적인 동물 상동체(homologs)를 가지고 있다.[79] 예를 들어, 식물은 또한 네트워크에서 E2F 전사를 위해 Rb를 억제해야 한다.[80] 식물과 동물의 세포 주기의 이러한 보존된 요소는 진핵생물에서 조상일 수 있다. 효모는 식물 및 동물과 보존된 네트워크 토폴로지를 공유하지만, 효모 조절 인자의 매우 분화된 특성은 효모 계통에서 가능한 빠른 진화를 시사한다.[67]
참조
[1]
서적
Essential cell biology
W. W. Norton & Company
2019
[2]
논문
Metabolism, cell growth and the bacterial cell cycle
2009-11
[3]
서적
The cell: a molecular approach
https://archive.org/[...]
ASM Press
[4]
논문
Do cells cycle?
1973-04
[5]
논문
Separation of basal histone synthesis from S-phase histone synthesis in dividing cells
1981-12
[6]
논문
Coupling of DNA synthesis and histone synthesis in S phase independent of cyclin/cdk2 activity
2002-11
[7]
논문
Evidence for an essentially constant duration of DNA synthesis in renewing epithelia of the adult mouse
1963-07
[8]
웹사이트
Cell
http://www.worldbook[...]
2008
[9]
서적
Cells: Building Blocks of Life
https://archive.org/[...]
Prentice Hall
[10]
논문
Mitosis, not just open or closed
2007-09
[11]
논문
New insights into cell cycle control from the Drosophila endocycle
2005-04
[12]
논문
Cyclin-dependent protein kinases: key regulators of the eukaryotic cell cycle
1995-06
[13]
웹사이트
The Nobel Prize in Physiology or Medicine 2001 – Press release
http://nobelprize.or[...]
Nobelprize.org
[14]
논문
Comprehensive identification of cell cycle-regulated genes of the yeast Saccharomyces cerevisiae by microarray hybridization
1998-12
[15]
서적
Pathological Basis of Disease
Elsevier
[16]
논문
Division of labour between Myc and G1 cyclins in cell cycle commitment and pace control
2014-09
[17]
논문
Effect of nanoparticles on the cell life cycle
2011-05
[18]
논문
CDK4/6 Inhibition in Cancer: Beyond Cell Cycle Arrest
2018-11
[19]
논문
Cellular mechanisms of tumour suppression by the retinoblastoma gene
2008-09
[20]
서적
The cell cycle : principles of control
New Science Press
2007
[21]
논문
Rb inactivation in cell cycle and cancer: the puzzle of highly regulated activating phosphorylation of CDK4 versus constitutively active CDK-activating kinase
2010-02
[22]
논문
The retinoblastoma family of proteins and their regulatory functions in the mammalian cell division cycle
2012-03
[23]
논문
Cyclin D activates the Rb tumor suppressor by mono-phosphorylation
2014-06
[24]
서적
Retinoblastoma protein partners
https://archive.org/[...]
Academic Press
2001-01-01
[25]
논문
RB1: a prototype tumor suppressor and an enigma
2016-07
[26]
논문
A Code of Mono-phosphorylation Modulates the Function of RB
2019-03
[27]
논문
Cyclin D-Cdk4,6 Drives Cell-Cycle Progression via the Retinoblastoma Protein's C-Terminal Helix
2019-05
[28]
서적
Protein kinase factsBook
Academic Press
[29]
웹사이트
Presentation on CDC25 PHOSPHATASES: A Potential Target for Novel Anticancer Agents
http://pharmaxchange[...]
2010-03-11
[30]
논문
Targeting CDK4 and CDK6: From Discovery to Therapy
2016-04
[31]
논문
Treating cancer with selective CDK4/6 inhibitors
2016-07
[32]
논문
A current and comprehensive review of cyclin-dependent kinase inhibitors for the treatment of metastatic breast cancer
2017-09
[33]
서적
Small Molecules in Oncology
2018-08
[34]
논문
The Forkhead transcription factor Hcm1 regulates chromosome segregation genes and fills the S-phase gap in the transcriptional circuitry of the cell cycle
2006-08
[35]
논문
Global control of cell-cycle transcription by coupled CDK and network oscillators
2008-06
[36]
논문
Comparison of computational methods for the identification of cell cycle-regulated genes
2005-04
[37]
논문
A systematic screen for transcriptional regulators of the yeast cell cycle
2009-02
[38]
논문
Transcriptional regulatory networks in Saccharomyces cerevisiae
2002-10
[39]
논문
Serial regulation of transcriptional regulators in the yeast cell cycle
2001-09
[40]
논문
Cell cycle-regulated phosphorylation of Swi6 controls its nuclear localization
1995-12
[41]
논문
Targets of the cyclin-dependent kinase Cdk1
2003-10
[42]
서적
The Cell Cycle: Principles of Control
New Science Press
[43]
논문
Global effects of DNA replication and DNA replication origin activity on eukaryotic gene expression
2009-10
[44]
간행물
Novel Genome-Scale Correlation between DNA Replication and RNA Transcription During the Cell Cycle in Yeast is Predicted by Data-Driven Models
http://www.med.miami[...]
University of Miami School of Medicine
2014-02-07
[45]
논문
Integrative analysis of genome-scale data by using pseudoinverse projection predicts novel correlation between DNA replication and RNA transcription
2004-11
[46]
논문
A tensor higher-order singular value decomposition for integrative analysis of DNA microarray data from different studies
2007-11
[47]
논문
Cell cycle checkpoints: preventing an identity crisis
1996-12
[48]
논문
Endogenous DNA double-strand breaks: production, fidelity of repair, and induction of cancer
2003-10
[49]
논문
Lack of checkpoint control at the metaphase/anaphase transition: a mechanism of meiotic nondisjunction in mammalian females
1997-12
[50]
논문
Visualizing spatiotemporal dynamics of multicellular cell-cycle progression
2008-02
[51]
논문
A far-red fluorescent protein evolved from a cyanobacterial phycobiliprotein
2016-09
[52]
논문
Cell cycle visualization tools to study cardiomyocyte proliferation in real-time
2024-10
[53]
논문
Licensing of DNA replication, cancer, pluripotency and differentiation: an interlinked world?
2014-06
[54]
논문
The Relationship of the Cell Cycle to Tumor Growth and Control of Cell Division: A Review
1965-06
[55]
논문
DNA repair by nonhomologous end joining and homologous recombination during cell cycle in human cells
2008-09
[56]
논문
Evolution of the cell cycle
1995-09
[57]
논문
The origin of eukaryotic and archaebacterial cells
1987-07
[58]
논문
Phylogeny from function: evidence from the molecular fossil record that tRNA originated in replication, not translation
1994-07
[59]
논문
Cyclin-dependent kinases: engines, clocks, and microprocessors
1997-11
[60]
논문
Cyclin-dependent kinases: a family portrait
2009-11
[61]
논문
Mammalian cell-cycle regulation: several Cdks, numerous cyclins and diverse compensatory mechanisms
2009-08
[62]
논문
Mice thrive without Cdk4 and Cdk2
2007-06
[63]
논문
Cyclin-dependent kinase 2 is essential for meiosis but not for mitotic cell division in mice
2003-09
[64]
논문
Cdc2-cyclin E complexes regulate the G1/S phase transition
2005-08
[65]
논문
Cdk1 is sufficient to drive the mammalian cell cycle
2007-08
[66]
논문
Genetic framework of cyclin-dependent kinase function in Arabidopsis
2012-05
[67]
논문
Cell cycle control across the eukaryotic kingdom
2013-07
[68]
논문
B1-type cyclin-dependent kinases are essential for the formation of stomatal complexes in Arabidopsis thaliana
2004-04
[69]
논문
Requirement of B2-type cyclin-dependent kinases for meristem integrity in Arabidopsis thaliana
2008-01
[70]
논문
Evolution of networks and sequences in eukaryotic cell cycle control
2011-12
[71]
논문
Positive feedback of G1 cyclins ensures coherent cell cycle entry
2008-07
[72]
논문
Self-perpetuating states in signal transduction: positive feedback, double-negative feedback and bistability
2002-04
[73]
논문
Double-negative feedback between S-phase cyclin-CDK and CKI generates abruptness in the G1/S switch
2012
[74]
논문
Commitment to a cellular transition precedes genome-wide transcriptional change
2011-08
[75]
논문
Cyclin D activates the Rb tumor suppressor by mono-phosphorylation
2014-06
[76]
논문
Cdk phosphorylation triggers sequential intramolecular interactions that progressively block Rb functions as cells move through G1
1999-09
[77]
논문
The E2F functional analogue SBF recruits the Rpd3(L) HDAC, via Whi5 and Stb1, and the FACT chromatin reorganizer, to yeast G1 cyclin promoters
2009-11
[78]
논문
Cln3 activates G1-specific transcription via phosphorylation of the SBF bound repressor Whi5
2004-06
[79]
논문
A general G1/S-phase cell-cycle control module in the flowering plant Arabidopsis thaliana
2012-08-02
[80]
논문
Retinoblastoma related1 regulates asymmetric cell divisions in Arabidopsis
2012-10
[81]
논문
Do cells cycle?
1973-04
[82]
서적
분자세포생물학
東京化学同人
[83]
논문
Coupling of DNA synthesis and histone synthesis in S phase independent of cyclin/cdk2 activity
2002-11
[84]
논문
Separation of basal histone synthesis from S-phase histone synthesis in dividing cells
1981-12
[85]
논문
Evidence for an essentially constant duration of DNA synthesis in renewing epithelia of the adult mouse
1963-07
[86]
논문
Activity of the APC Cdh1 form of the anaphase-promoting complex persists until S phase and prevents the premature expression of Cdc20p
http://biosupport.li[...]
2001-07
[87]
문서
Mitosis(有糸分裂)に由来するが、M期は有糸分裂と続く細胞質分裂を含めた1個の母細胞が2個の娘細胞に分かれる分裂過程全体を示す。
[88]
논문
Mitosis, not just open or closed
[89]
논문
New insights into cell cycle control from the Drosophila endocycle
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com




