종양억제유전자
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
종양억제유전자는 세포의 증식과 생존을 억제하는 단백질을 암호화하며, 이러한 유전자의 불활성화는 종양 발생으로 이어진다. 1969년 헨리 해리스의 체세포 융합 실험을 통해 종양 억제 유전자 개념이 확립되었으며, 알프레드 G. 크누드슨은 망막모세포종 연구를 통해 두 번 타격 가설을 제시하여 Rb 유전자를 최초의 종양 억제 유전자로 확인했다. 이후 p53 유전자, MSH2 유전자 등이 발견되었으며, 이들은 DNA 손상 감지 및 복구, 세포자멸사 유도 등의 기능을 수행한다. 종양 억제 유전자는 세포 주기 조절, 세포 증식 억제 신호 전달, DNA 손상 감지 및 복구, 세포 사멸 유도, 세포 부착 조절, 전사 조절 등 다양한 기능을 하며, 유전자 치료를 통해 돌연변이된 종양 억제 유전자의 기능을 회복시키려는 연구가 진행되고 있다.
더 읽어볼만한 페이지
- 암 억제 유전자 - BRCA1
BRCA1은 DNA 복구, 전사 조절, 세포 주기 조절 등 다양한 기능을 수행하며 유방암 및 난소암과 관련되어, 이 유전자의 돌연변이는 유전성 유방-난소암 증후군을 유발하여 암 위험을 증가시킨다. - 암 억제 유전자 - PTEN (유전자)
- 발암 - 발암물질
발암물질은 유전적 손상이나 세포 성장 촉진을 통해 암을 유발하는 물질로, 유전독성 및 비유전독성 기전을 가지며, 담배 연기, 석면, 방사선, 특정 화학물질, 바이러스 등 다양한 종류가 존재하고, 여러 기관에서 각기 다른 기준으로 분류되며, 다양한 시험 방법을 통해 발암성을 평가한다. - 발암 - 암유전자
암유전자는 원암유전자의 돌연변이 또는 과발현으로 인해 세포의 무절제한 증식과 암 발생을 유발하는 유전자로, 다양한 종류가 있으며 돌연변이, 유전자 발현 증가, 염색체 전좌 등의 기전을 통해 활성화되고, 암 치료 및 예방에 중요한 역할을 하지만 윤리적 문제에 대한 고려가 필요하다.
| 종양억제유전자 | |
|---|---|
| 기본 정보 | |
 | |
| 별칭 | 항암 유전자 보호 유전자 |
| 위치 | 세포핵 |
| 기능 | 세포 분열 억제, DNA 복구, 세포 자멸사 유도 |
| 관련 질병 | 암 |
| 상세 정보 | |
| 설명 | 종양 형성 형질의 발현을 억제하는 유전자 |
| 작용 방식 | 세포 성장 조절 세포 분열 조절 DNA 손상 복구 세포 자살 유도 |
| 비활성화 메커니즘 | 유전자 돌연변이 유전자 발현 억제 염색체 이상 |
| 예시 | TP53 RB1 PTEN BRCA1 BRCA2 VHL APC |
2. 역사
암 유전자의 발견으로 세포 증식 및 발달과 관련된 세포 과정의 조절 이상이 밝혀졌는데, 이는 종양 억제 유전자 개념과는 달리 문헌에 처음 등장한 것이었다.[5] 그러나 유전자 돌연변이가 종양 성장을 유도한다는 개념은 세포의 성장과 발달을 억제하는 유전자에 대한 또 다른 가능성을 제시했다.
2. 1. 종양 억제 유전자 개념의 확립
헨리 해리스는 1969년 체세포 융합 실험을 통해 종양 세포와 정상 체세포를 융합한 잡종 세포에서 종양 형성능이 억제되는 것을 발견했다.[6] 이는 정상 체세포 내에 종양 성장을 억제하는 유전자가 존재한다는 가설을 제시하는 계기가 되었다.[6]알프레드 크누드슨은 망막모세포종 연구를 통해 두 번 타격 가설(two-hit hypothesis)을 제시했다.[6] 이 가설은 종양 억제 유전자의 두 대립 유전자 모두에 돌연변이가 발생해야 암이 발생한다는 것을 설명한다.[7] 크누드슨은 망막모세포종이 어린 환자의 경우 양쪽 눈에서 일찍 발생하는 반면, 드물게는 나중에 발생하고 한쪽 눈에만 발생하는 경우가 있음을 관찰했다.[5] 이러한 패턴을 통해 RB 생식세포계열 유전자(germ-line gene)의 기능 상실 돌연변이 하나를 유전으로 물려받고, 이후에 기능성 Rb 유전자 대립 유전자에 새로운 돌연변이(de novo mutation)가 발생하면 조기에 망막모세포종이 발생한다는 가설을 세웠다.[5] 망막모세포종이 산발적으로 한쪽 눈에만 발생하는 경우는 두 개의 새로운 돌연변이로 인해 훨씬 늦게 발생한다고 추정했다.[5]
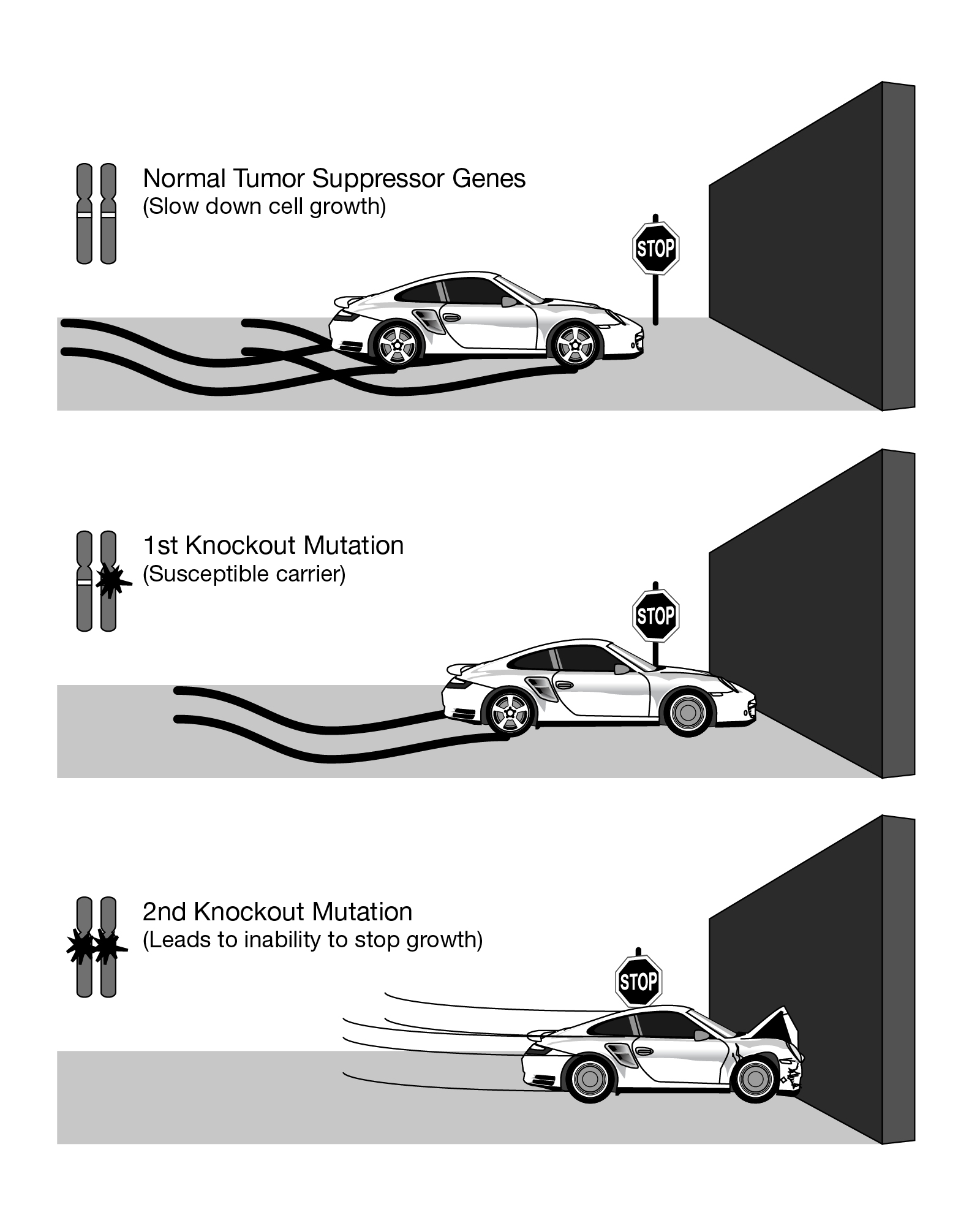
크누드슨의 연구 결과와 13번 염색체 13q14 영역의 삽입 삭제 실험을 통해 Rb 유전자가 최초의 종양 억제 유전자로 확인되었다.[6] Rb 유전자의 자리를 삭제하면 레티노블라스토마에서 종양 성장이 증가했는데, 이는 종양 억제 유전자의 기능 상실 또는 불활성화가 종양 형성능을 증가시킬 수 있음을 보여준다.[6]
1986년에는 망막모세포종 발생에 관여하는 유전자로 RB 유전자(''Rb-1'')가 분리되었다.[35] Rb는 한쪽 대립 유전자가 손상되어도 다른 한쪽의 정상적인 대립 유전자에서 Rb 단백질을 만들 수 있지만, 남은 정상 유전자에도 손상이 발생하면(헤테로접합성의 상실: Loss of heterozygosity) Rb 단백질의 기능이 상실되어 망막모세포종이 발생한다. 알프레드 조지 크누드손 Jr이 제창한 2히트 이론은 유전학적으로 증명되었고, Rb 유전자는 최초로 동정된 암 억제 유전자가 되었다.[36]
암 유전자와 달리, 종양 억제 유전자는 일반적으로 두 번 타격 가설을 따른다. 즉, 특정 단백질을 암호화하는 두 개의 대립 유전자 모두에 영향이 있어야 효과가 나타난다.[7] 하나의 대립 유전자만 손상되면 다른 하나가 정상 단백질을 생성하여 기능을 유지할 수 있다. 돌연변이 종양 억제 유전자는 일반적으로 열성인 반면, 돌연변이 암 유전자는 일반적으로 우성이다.[7]

하지만, 종양 억제 유전자에 대한 두 번 타격 규칙에는 예외가 있다. p53 유전자 산물의 특정 돌연변이는 우성 음성으로 기능할 수 있는데, 이는 돌연변이 p53 단백질이 비돌연변이 대립 유전자에서 생성된 천연 단백질의 기능을 방해할 수 있음을 의미한다.[9] 반수불충분성을 나타내는 유전자도 예외인데, 수모세포종의 PTCH와 신경섬유종의 NF1이 이에 해당한다. 또 다른 예로 세포주기 억제제인 p27은 하나의 대립 유전자가 돌연변이되면 발암 물질에 대한 감수성이 증가한다.[10]
2. 2. p53 유전자의 발견
p53 유전자는 1979년에 분리된 이후 종양유전자로 생각되었지만, 종양유전자로 기능하는 것은 변이를 일으킨 p53이며, 원래 p53 유전자는 종양억제유전자임이 밝혀졌다.[37] p53 유전자의 기능을 상실시킨 녹아웃 마우스는 거의 정상적으로 발생하는데도 불구하고, 성장 후 많은 조직에서 암이 발생하는 것이 확인되어 종양억제유전자가 발암에서 중요함이 확인되었다.[38] 또한, 인간 종양의 약 50%에서 p53 유전자의 변이가 확인된다[39]는 점에서, p53은 현재까지 확인된 것 중 가장 중요시되는 종양억제유전자이다.2. 3. DNA 불일치 복구 단백질
MSH2(MutS homologue 2영어) 단백질은 DNA 불일치 수복 과정에서 DNA 불일치를 검출하는 단백질이며, 대장균(Escherichia coli)의 MutS(Mutator Small subunit)와 상동성이 있다. MSH2 단백질은 DNA 불일치에 의존하여 세포 주기를 조절하기도 한다.[1] *대장균*에 이르기까지 생물종을 초월하여 보존된 단백질이라는 점에서 주목할 만하다. MSH2 유전자를 파괴한 녹아웃 마우스가 암을 발병하는 것으로부터 MSH2는 종양억제유전자임이 확인되었다.[1] MSH2 종양억제유전자는 인간의 암이 DNA 수복 기구 또는 세포 주기 조절의 이상으로 발생할 수 있음을 시사하며, 암 발생의 분자 기전 이해에 중요한 단서를 제공하였다. DNA가 손상되어 수복되지 않으면 세포 증식을 조절하는 유전자가 손상되어 세포 증식을 조절할 수 없게 될 수 있다. 현재 암은 세포의 DNA 손상과 그 유전적 고착(체세포만 또는 생식세포 포함)에 의해 발생한다는 견해가 주류이지만, 그 견해의 기본은 불일치 수복 단백질군이 종양억제유전자라는 발견에도 기인한다.[1]2. 4. 최근 연구 동향
대규모 뇌종양 분석에 따르면, 많은 변이가 기존에 알려진 종양억제유전자와 암유전자에서 발견된다는 것이 밝혀졌다.[40] 이는 미지의 종양억제유전자의 존재를 부정하는 연구는 아니지만, 각 기존 유전자의 암에서의 중요성 정도를 시사한다. 또한, 종양억제유전자 연구의 초기 단계가 종료되었을 가능성을 상당히 간접적으로 시사한다.3. 주요 기능
종양 억제 유전자는 세포 주기 조절, 세포 증식 억제, DNA 손상 감지 및 복구, 세포 사멸 유도, 세포 부착 조절, 전사 조절 등 다양한 기능을 통해 암 발생을 억제한다.
종양 억제 유전자는 주요 기능은 같지만, 전사된 생성물이 수행하는 다양한 작용 메커니즘을 가지고 있다.[12]
일부 유전자는 종양 억제 유전자와 암 유전자 모두로 작용할 수 있는데, 이를 종양 억제 기능을 가진 원암유전자라고 부르며 전사를 양성 및 음성으로 조절하는 “이중 작용제” 역할을 한다. (예: NOTCH 수용체, TP53, FAS)[21]
3. 1. 세포 주기 조절
세포 주기의 유전자 발현을 조절하는 세포 내 단백질이 발현되지 않으면 세포 주기가 계속되지 않아 세포 분열이 효과적으로 억제된다. 이러한 단백질의 예시로는 pRB 및 p16이 있다.[13]3. 2. 세포 증식 억제 신호 전달
대부분의 종양억제유전자가 암호화하는 단백질은 세포 증식 또는 생존을 억제한다. 종양억제유전자가 불활성화되면 음성 조절 단백질이 제거되어 종양이 발생한다. 대부분의 경우, 종양억제단백질은 암 유전자 생성물에 의해 자극되는 것과 동일한 세포 조절 경로를 억제한다.[11]형질전환 성장 인자(TGF)-β 및 선종성 용종증(APC)와 같이 세포 증식을 억제하는 분비된 호르몬 또는 발생 신호에 대한 수용체 또는 신호 전달체 역할을 하는 경우도 있다.[14]
3. 3. DNA 손상 감지 및 복구
DNA 손상이나 염색체 결함에 대한 반응으로 세포 주기 정지를 유발하는 체크포인트 제어 단백질에는 유방암 1형 감수성 단백질(BRCA1), p16, p14 등이 있다.[15] 손상을 복구할 수 없을 때 세포자멸사를 유도하는 단백질에는 p53이 있다.[16]DNA의 실수를 복구하는 데 관여하는 단백질을 암호화하는 유전자에는 p53 및 DNA 불일치 복구 단백질 2(MSH2) 등이 있다.[20] 이러한 DNA 복구 기능 감소는 다른 종양 억제제의 불활성화 증가와 암 유전자의 활성화로 이어진다.[19]
p53 유전자는 Rb에 이어 확인된 종양억제유전자이다. p53은 1979년에 분리된 이후 종양유전자로 생각되었지만, 돌연변이를 일으킨 p53이 종양유전자로 기능하며, 원래 p53 유전자는 종양억제유전자임이 밝혀졌다.[37] p53 유전자의 기능을 상실시킨 녹아웃 마우스는 거의 정상적으로 발생하지만, 성장 후 많은 조직에서 암이 발생하는 것이 확인되어, 종양억제유전자가 발암에서 중요함을 알 수 있다.[38] 인간 종양의 약 50%에서 p53 유전자의 변이가 확인된다[39]는 점에서, p53은 현재까지 확인된 것 중 가장 중요한 종양억제유전자이다. p53의 기능은 매우 다양하지만, G1/S 세포주기 체크포인트 조절 기능, 아포토시스 유도 기능, 전사 인자로서의 기능이 잘 알려져 있다.
MSH2(MutS homologue 2) 단백질은 DNA 불일치 수복 과정에서 DNA 불일치를 검출하는 단백질이며, *대장균*(Escherichia coli)의 MutS(Mutator Small subunit)와 상동성이 있다. MSH2 단백질은 DNA 불일치에 의존하여 세포 주기를 조절하기도 한다. *대장균*에 이르기까지 생물종을 초월하여 보존된 단백질이라는 점에서 주목할 만하다. MSH2 유전자를 파괴한 녹아웃 마우스가 암을 발병하는 것으로부터 MSH2는 종양억제유전자임이 확인되었다. MSH2 종양억제유전자는 인간의 암이 DNA 수복 기구 또는 세포 주기 조절의 이상으로 발생할 수 있음을 시사하며, 암 발생의 분자 기전 이해에 중요한 단서를 제공하였다. DNA가 손상되어 수복되지 않으면 세포 증식을 조절하는 유전자가 손상되어 세포 증식을 조절할 수 없게 될 수 있다. 현재 암은 세포의 DNA 손상과 그 유전적 고착(체세포만 또는 생식세포 포함)에 의해 발생한다는 견해가 주류이지만, 그 견해의 기본은 불일치 수복 단백질군이 종양억제유전자라는 발견에도 기인한다.
3. 4. 세포 사멸 유도
p53은 손상을 복구할 수 없을 때 세포가 스스로 파괴되도록(세포자멸사) 유도하여, 전체 유기체에 대한 위협을 제거함으로써 암 발생을 억제한다.[16] p53의 기능은 G1/S 세포주기 체크포인트 조절, 아포토시스 유도, 전사 인자 등 매우 다양하다.3. 5. 세포 부착 조절
세포 부착에 관여하는 일부 단백질은 종양 세포가 분산되는 것을 방지하고, 접촉 억제의 상실을 차단하며, 전이를 억제한다. 이러한 단백질은 전이 억제제로 알려져 있다. (예: CADM1)[17][18]3. 6. 전사 조절
p53 유전자는 1979년에 분리된 이후 종양유전자로 생각되었지만, 종양유전자로 기능하는 것은 변이를 일으킨 p53이며, 원래 p53 유전자는 종양억제유전자임이 밝혀졌다.[37] p53은 전사 인자로서의 기능도 잘 알려져 있다.4. 두 번 타격 가설 (Two-hit hypothesis)
종양 억제 유전자는 일반적으로 두 번 타격 가설(two-hit hypothesis)을 따른다. 이 가설은 특정 단백질을 암호화하는 두 개의 대립 유전자 모두에 돌연변이가 발생해야 암 발생 위험이 증가한다는 것을 의미한다.[7] 한쪽 대립 유전자만 손상되면 다른 쪽 대립 유전자가 여전히 충분한 정상 단백질을 생성하여 적절한 기능을 유지할 수 있기 때문이다. 즉, 돌연변이 종양 억제 유전자 대립 유전자는 일반적으로 열성(recessive)이다.[7]
알프레드 G. 크누드슨(Alfred G. Knudson)은 망막모세포종의 경우를 연구하여 이 가설을 제안했다.[7] 그는 미국 망막모세포종 사례의 40%가 생식세포계열(germ-line)의 돌연변이로 인한 것임을 관찰했다. 그러나 질병이 있는 부모가 질병이 없는 자녀를 가질 수 있었지만, 질병이 없는 자녀는 망막모세포종이 있는 자녀를 낳는 경우가 있었다.[8] 이는 돌연변이 생식세포계열을 물려받더라도 질병이 나타나지 않을 수 있음을 나타낸다. 크누드슨은 망막모세포종 발병 연령이 2차 반응속도론(2nd order kinetics)을 따른다는 것을 관찰하여 두 개의 독립적인 유전적 사건이 필요함을 시사했다. 그는 이것이 단일 유전자를 포함하는 열성 돌연변이와 일치하지만, 이형접합 돌연변이(bi-allelic mutation)를 필요로 한다는 것을 인식했다. 유전성 망막모세포종은 유전된 돌연변이와 정상 대립 유전자의 단일 돌연변이를 포함한다.[8] 반면, 비유전성 망막모세포종은 각 대립 유전자에 하나씩 두 개의 돌연변이를 포함한다.[8] 크누드슨은 또한 유전성 사례는 종종 양측성 종양을 발생시키고, 비유전성 사례에서 개인이 단일 종양에만 영향을 받는 경우와 비교하여 더 어린 나이에 발생한다는 점에 주목했다.[8]
1986년, 망막모세포종 발생에 깊이 관여하는 유전자인 RB 유전자(''Rb-1'')가 분리되었다.[35] Rb는 한쪽 대립 유전자가 손상되어 기능하지 않는 상황에서도, 다른 한쪽의 정상적인 대립 유전자에서 Rb 단백질을 만들 수 있다. 그러나 남은 정상 유전자에도 손상이 발생하면(헤테로접합성의 상실: Loss of heterozygosity), Rb 단백질의 기능이 처음으로 상실되고, 망막모세포종 발생으로 이어진다. 알프레드 조지 크누드손 Jr에 의해 제창된 이 2히트 이론은 유전학적으로 증명되었고, Rb 유전자는 암 억제 유전자로 동정된 최초의 유전자가 되었다.[36]
하지만 종양 억제 유전자에 대한 두 번 타격 규칙에는 예외가 있다. p53 유전자 산물의 특정 돌연변이는 우성 음성(dominant negative)으로 기능할 수 있는데, 이는 돌연변이 p53 단백질이 비돌연변이 대립 유전자에서 생성된 천연 단백질의 기능을 방해할 수 있음을 의미한다.[9] 두 번 타격 규칙을 따르지 않는 다른 종양 억제 유전자는 반수체기능부전(haploinsufficiency)을 나타내는 유전자이다. 여기에는 수모세포종의 PTCH와 신경섬유종의 NF1이 포함된다. 또 다른 예는 세포주기 억제제인 p27인데, 하나의 대립 유전자가 돌연변이되면 발암 물질에 대한 감수성이 증가한다.[10]
5. 후성유전학적 조절
DNA 메틸화는 종양억제유전자를 포함한 유전자의 발현을 변화시키는 생화학적 변화이다.[22] 메틸화는 포유류 유전자의 발현을 조절하는 후성유전적 변형의 한 예이다. 메틸기가 히스톤 꼬리나 DNA에 직접 추가되면 뉴클레오솜이 조밀하게 뭉쳐져 해당 영역의 유전자 전사를 제한한다. 이 과정은 유전자 발현을 억제할 뿐만 아니라 돌연변이 가능성도 높인다. 스티븐 베일린(Stephen Baylin)은 프로모터 영역에서 과메틸화 현상이 발생하면 전사 오류, 종양억제유전자 침묵, 단백질 잘못 접힘, 궁극적으로 암 성장으로 이어질 수 있음을 관찰했다. 베일린 등은 아자시티딘과 데시타빈과 같은 메틸화 억제제를 발견했다. 이러한 화합물은 이전에 침묵했던 유전자의 재발현을 유도하고, 종양 세포의 세포주기를 정지시키며, 세포자멸사를 유도하여 암 성장을 예방하는 데 도움을 줄 수 있다.[23]
과메틸화 치료와 조직 증식증, 종양 발생 또는 종양의 전이 확산 방지를 포함한 대체 종양 억제 치료에 대한 추가 임상 시험이 현재 진행 중이다.[24] 와제드(Wajed)와 함께 연구하는 팀은 종양억제유전자를 침묵시킬 수 있는 유전자 변형에 대한 조기 치료 옵션을 확인하기 위해 종양 조직 메틸화를 연구했다.[28] DNA 메틸화 외에도, 히스톤 탈아세틸화 또는 크로마틴 결합 단백질과 같은 다른 후성유전적 변형은 DNA 중합효소가 종양억제유전자를 포함하는 원하는 서열을 효과적으로 전사하는 것을 방지할 수 있다.
6. 임상적 의의
종양 억제 유전자는 기능 이상이 생기면 암 발생의 주요 원인이 되기 때문에, 유전자 치료의 중요한 표적이 된다.
6. 1. 유전자 치료
유전자 치료는 돌연변이가 발생하거나 삭제된 유전자의 기능을 회복하는 데 사용된다. 종양억제유전자가 변형되어 발현이 감소하거나 없어지면 숙주에게 여러 심각한 문제가 발생할 수 있는데, 이것이 종양억제유전자가 유전자 치료에 대해 일반적으로 연구되고 사용되어 온 이유이다. 현재 세포에 유전 물질을 도입하는 데 사용되는 두 가지 주요 방법은 바이러스성 및 비바이러스성 전달 방법이다.[28]바이러스를 이용한 유전 물질 전달 방법은 바이러스의 능력을 활용한다.[28] 유전 물질 변형에 강한 바이러스를 사용하여 종양억제유전자에 대한 바이러스 유전자 치료법이 성공적인 것으로 나타났다.[25] 이 방법에서는 바이러스의 벡터를 사용한다. 가장 일반적으로 사용되는 두 가지 벡터는 아데노바이러스 벡터와 아데노관련 바이러스 벡터이다. 이러한 유형의 벡터는 시험관 내(in vitro) 유전자 조작이 용이하며, 다른 벡터에 비해 생체 내(in vivo) 적용이 상대적으로 안전하다.[28][26] 벡터를 숙주의 종양에 삽입하기 전에, DNA 복제를 조절하는 게놈 부분을 돌연변이시키거나 삭제하여 준비하는데, 이렇게 하면 삽입이 더 안전해진다.[25] 그런 다음, 원하는 유전 물질을 삽입하고 벡터에 연결한다.[25] 종양억제유전자의 경우, p53을 암호화하는 유전 물질이 성공적으로 사용되었으며, 적용 후 종양 성장 또는 세포 증식 감소를 보였다.[26][27]
6. 2. 한계점
유전자 치료는 돌연변이가 발생하거나 삭제된 유전자의 기능을 회복하는 데 사용된다. 종양억제유전자가 변형되어 발현이 감소하거나 없어지면 숙주에게 여러 심각한 문제가 발생할 수 있는데, 이 때문에 종양억제유전자는 유전자 치료 연구에 일반적으로 사용되어 왔다. 현재 세포에 유전 물질을 도입하는 데 사용되는 주요 방법에는 바이러스성 전달 방법과 비바이러스성 전달 방법 두 가지가 있다.[28]7. 주요 종양 억제 유전자 목록
| 유전자 | 원래 기능 | 두 번 타격? | 관련 암종 |
|---|---|---|---|
| Rb | DNA 복제, 세포 분열 및 사멸 | 예 | 망막모세포종[5] |
| p53 | 세포자멸사 | 아니요 | 모든 악성 종양의 절반[5] |
| VHL | 세포 분열, 사멸 및 분화 | 예 | 신장암[28] |
| APC | DNA 손상, 세포 분열, 이동, 부착, 사멸 | 예 | 대장암[28] |
| BRCA2 | 세포 분열 및 사멸, 이중 가닥 DNA 절단 복구 | 예 | 유방암/난소암[5] |
| NF1 | 세포 분화, 분열, 발생, RAS 신호 전달 | 아니오 | 신경종양, 신경모세포종[28] |
| PTCH | 헤지호그 신호 전달 | 아니오 | 수모세포종, 기저세포암[5] |
| 유전자 명 | 주요 기능 | 관련 암·질환의 예 | 참고문헌 |
|---|---|---|---|
| RB | 세포주기 조절 | 망막모세포종 | [41] |
| p53 | 전사인자 | 리-프라우메니 증후군 | [42], [43] |
| APC | β-카테닌 결합 | 가족성 대장용종증 | [44] |
| NF1 | GTPase 활성화 | 신경섬유종증 1형 | [45] |
| NF2 | 세포골격 결합 | 신경섬유종증 2형 | [46] |
| WT1 | 전사인자 | 윌름스 종양 | [47] |
| VHL | 전사 신장 조절 | 폰 히펠 린다우병, 신장암 | [48] |
| BRCA1 | 상동재조합 복구 | 가족성 유방암 | [49] |
| BRCA2 | 상동재조합 복구 | 가족성 유방암 | [49] |
| CHEK2 | 세포주기 조절 | 가족성 유방암 | [50] |
| Maspin | 세린 프로테아제 저해 | 유방암 | [51] |
| p73 | 전사인자 | 유방암, 난소암 | [52] |
| DPC4 (SMAD4) | 전사인자 | 소년성 폴립증, 췌장암 | [53] |
| MSH2 | 불일치 복구 | 유전성 비용종증 대장암 | [54] |
| MLH1 | 불일치 복구 | 유전성 비용종증 대장암 | [55] |
| PMS2 | 불일치 복구 | 유전성 비용종증 대장암 | [56] |
| DCC | N-CAM 유사 단백질 | 대장암 | [57] |
| PTEN | 포스파타제 | Cowden병, 신경교종 | [58] |
| SDHD | 미토콘드리아 막단백질 | 곁신경절종 | [59] |
| p16 | 사이클린 의존성 키나제 저해 | 악성흑색종 | [60] |
| p57KIP2 | 세포주기 조절 | 베크위트-비데만 증후군 | [61] |
| PTC | Shh 수용체 | Gorlin 증후군, 기저세포암 | [62] |
| TSC1 | - | 결절성 경화증 | [63] |
| TSC2 | - | 결절성 경화증 | [64] |
| EXT1 | - | 다발성 골연골성 외골종증 | [65] |
| EXT2 | - | 다발성 골연골성 외골종증 | [66] |
그 외 뉴레굴린 1도 종양 억제 유전자에 해당한다.
참조
[1]
웹사이트
Oncogenes and tumor suppressor genes American Cancer Society
https://www.cancer.o[...]
2019-09-26
[2]
서적
The Biology of Cancer
Garland Science
2014
[3]
웹사이트
Glossary of Cancer Genetics (side-frame)
http://www.cancerind[...]
2019-11-19
[4]
웹사이트
Cancer Genetics - CuboCube
http://www.cubocube.[...]
2019-11-19
[5]
논문
Principles of Tumor Suppression
2004
[6]
서적
The Cell: A Molecular Approach
https://www.ncbi.nlm[...]
2000
[7]
논문
Mutation and cancer: statistical study of retinoblastoma
1971-04
[8]
웹사이트
Tumor Suppressor (TS) Genes and the Two-Hit Hypothesis Learn Science at Scitable
https://www.nature.c[...]
2019-10-06
[9]
논문
Suppression of human colorectal carcinoma cell growth by wild-type p53
1990-08
[10]
논문
The murine gene p27Kip1 is haplo-insufficient for tumour suppression
1998-11
[11]
서적
The Cell: A Molecular Approach
Sinauer Associates
2000
[12]
논문
Loss of Tumor Suppressor Gene Function in Human Cancer: An Overview
2018
[13]
논문
Molecular genetics of RB1--the retinoblastoma gene
2007
[14]
논문
Molecular pathways: targeting the TGF-β pathway for cancer therapy
2012-09
[15]
논문
BRCA1, a 'complex' protein involved in the maintenance of genomic stability
2015-02
[16]
논문
p53-Induced apoptosis and inhibitors of p53
2009
[17]
논문
Metastasis-suppressor genes: a review and perspective on an emerging field
2000-11
[18]
논문
Cell adhesion system and human cancer morphogenesis
2003-07
[19]
논문
DNA repair defects inactivate tumor suppressor genes and induce hereditary and sporadic colon cancers
2000-11
[20]
논문
Cancer genes associated with phenotypes in monoallelic and biallelic mutation carriers: new lessons from old players
2007-04
[21]
논문
Double agents: genes with both oncogenic and tumor-suppressor functions
2018-03
[22]
논문
DNA methylation: an alternative pathway to cancer
2001-07
[23]
논문
DNA methylation and gene silencing in cancer
2005-12
[24]
논문
The role of the apoptotic machinery in tumor suppression
2012-11
[25]
논문
Viral and nonviral delivery systems for gene delivery
2012-07-06
[26]
논문
Targeting tumor suppressor networks for cancer therapeutics
2014-01
[27]
논문
Therapeutic targeting of tumor suppressor genes
2015-05
[28]
웹사이트
Tumor Suppressor (TS) Genes and the Two-Hit Hypothesis Learn Science at Scitable
https://www.nature.c[...]
2020-10-27
[29]
웹사이트
RETINOBLASTOMA: Protein
http://dpuadweb.depa[...]
2019-11-21
[30]
논문
Structure and function of the p53 tumor suppressor gene: clues for rational cancer therapeutic strategies
1996-10
[31]
웹사이트
BCL2 (B-Cell Leukemia/Lymphoma 2)
http://atlasgenetics[...]
2019-11-21
[32]
논문
The molecular perspective: cytochrome C and apoptosis
2004-04-01
[33]
논문
The spectrum of SWI/SNF mutations, ubiquitous in human cancers
2013
[34]
웹사이트
TUMOUR SUPPRESSOR GENES IN CANCER
https://www.letstalk[...]
2019-11-21
[35]
논문
A human DNA segment with properties of the gene that predisposes to retinoblastoma and osteosarcoma
1986
[36]
논문
Chasing the cancer demon
[37]
논문
Cancer, p53, guardian of the genome
[38]
논문
Mice deficient for p53 are developmentally normal but susceptible to spontaneous tumours
[39]
논문
p53: puzzle and paradigm
[40]
논문
Comprehensive genomic characterization defines human glioblastoma genes and core pathways
[41]
논문
The retinoblastoma tumour suppressor in development and cancer
[42]
논문
Live or let die: the cell's response to p53
[43]
논문
P53 and prognosis: new insights and further complexity
[44]
논문
The ABC of APC
[45]
논문
Molecular genetics of neurofibromatosis type 1 (NF1)
[46]
논문
Alteration in a new gene encoding a putative membrane-organizing protein causes neuro-fibromatosis type 2
[47]
논문
WT1: a novel tumor suppressor gene inactivated in Wilms' tumor
[48]
논문
Molecular basis of the VHL hereditary cancer syndrome
[49]
논문
Cancer susceptibility and the functions of BRCA1 and BRCA2
[50]
논문
The CHEK2 gene and inherited breast cancer susceptibility
[51]
논문
Maspin: the new frontier
[52]
논문
p73
[53]
논문
Role of Smad4 (DPC4) inactivation in human cancer
[54]
논문
The human mutator gene homolog MSH2 and its association with hereditary nonpolyposis colon cancer
[55]
논문
Microsatellite instability and MLH1 promoter hypermethylation in colorectal cancer
[56]
논문
Mutations of two PMS homologues in hereditary nonpolyposis colon cancer
[57]
논문
Netrin-1 and its receptors in tumorigenesis
[58]
논문
PTEN: life as a tumor suppressor
[59]
논문
Mitochondrial tumour suppressors: a genetic and biochemical update
[60]
논문
CDKN2A (p16INK4A) somatic and germline mutations
[61]
논문
p57KIP2, a structurally distinct member of the p21CIP1 Cdk inhibitor family, is a candidate tumor suppressor gene
[62]
논문
Mutations of the human homolog of Drosophila patched in the nevoid basal cell carcinoma syndrome
[63]
논문
Identification of the tuberous sclerosis gene TSC1 on chromosome 9q34
[64]
논문
Molecular genetic and phenotypic analysis reveals differences between TSC1 and TSC2 associated familial and sporadic tuberous sclerosis
[65]
논문
Cloning of the putative tumour suppressor gene for hereditary multiple exostoses (EXT1)
[66]
논문
The EXT2 multiple exostoses gene defines a family of putative tumour suppressor genes
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com