케톤
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
케톤은 카르보닐기(C=O)가 탄소 골격 내 두 탄소에 결합된 유기 화합물로, IUPAC 명명법에 따라 알케인의 접미사 '-ane'을 '-anone'으로 변경하여 이름을 붙인다. 케톤은 알데하이드, 카르복실산 등과 구별되며, 극성을 띠어 친핵성 및 친전자성 반응을 보인다. 케톤은 대칭 및 비대칭 케톤, 다이케톤, 불포화 케톤, 고리형 케톤 등으로 분류되며, 다양한 합성법을 통해 제조된다. 케톤은 친핵성 첨가 반응, 케토-에놀 토토머화 반응 등을 하며, 산화, 환원, 축합 등 다양한 화학 반응에 참여한다. 생화학에서 케톤은 케톤체 형태로 에너지 대사에 관여하며, 산업적으로 용매, 중합체 전구체, 의약품 등으로 사용된다. 일반적으로 독성이 낮지만, 불포화 케톤은 독성이 강할 수 있다.
"케톤"이라는 단어는 "아세톤"을 뜻하는 옛 독일어 "Aketon"에서 유래되었다.[2][3]
케톤의 탄소는 sp2 혼성화를 가지며, 삼각 평면 구조를 가진다. C-C-O 및 C-C-C 결합각은 약 120°이다. 케톤은 카르보닐기(C=O)가 탄소 골격 내의 두 개의 탄소에 결합되어 있다는 점에서 알데하이드와 다르다. 알데하이드에서는 카르보닐기가 하나의 탄소와 하나의 수소에 결합되어 탄소 사슬의 끝에 위치한다. 케톤은 카르복실산, 에스터, 아마이드와 같은 다른 카르보닐기 포함 작용기와도 구별된다.[5]
케톤은 알데하이드와 달리 카르보닐기에 수소 원자가 결합되어 있지 않아 산화에 더 강하다. 탄소-탄소 결합을 절단할 수 있는 강력한 산화제에 의해서만 산화된다.[6]
이차 알코올을 크롬산 산화나 스워른 산화 등으로 산화시키면 케톤이 얻어진다.[8]
2. 명명법 및 어원
IUPAC 명명법 규칙에 따르면, 케톤의 이름은 모체 알케인의 접미사 "-ane"을 "-anone"으로 바꾸어 만든다. 일반적으로 카르보닐기의 위치는 번호로 표시하지만, 아세톤과 벤조페논과 같은 가장 중요한 케톤의 경우에는 여전히 전통적인 비체계적 이름이 일반적으로 사용된다. 이러한 비체계적 이름은 유지된 IUPAC 명칭으로 간주된다.[4] 다만, 일부 기초 화학 교과서에서는 가장 간단한 케톤(CH3C(=O)CH3)에 대해 "아세톤" 대신 "2-프로파논" 또는 "프로판-2-온"과 같은 체계적인 이름을 사용한다.
케톤의 유도체 이름은 카르보닐기에 결합된 두 개의 알킬기의 이름을 따로 적고, 그 뒤에 "케톤"이라는 단어를 별도로 붙여서 얻는다. 전통적으로 알킬기의 이름은 복잡한 정도에 따라 순서대로 적었는데, 예를 들어 메틸 에틸 케톤과 같다. 그러나 IUPAC 명명법 규칙에 따르면 알킬기는 알파벳 순서대로 적는다. 예를 들어 에틸 메틸 케톤과 같다. 두 알킬기가 동일한 경우에는 알킬기 이름 앞에 접두사 "di-"를 추가한다. 다른 기의 위치는 그리스 문자로 표시하며, α-탄소는 카르보닐기에 인접한 원자이다.
드물게 사용되지만, "oxo"는 산소기(=O)의 IUPAC 명명법이며, 케톤이 최우선순위가 아닌 경우 접두사로 사용된다. 그러나 다른 접두사도 사용된다. 일부 일반적인 화학 물질(주로 생화학에서)에서는 "keto"가 케톤 작용기를 가리킨다.
케톤을 명명할 때는, 카르보닐기의 위치를 나타내는 숫자와 함께, 대응하는 알케인의 어미에 "-온"을 붙이거나, 접두사 "oxo"를 사용한다.
예: 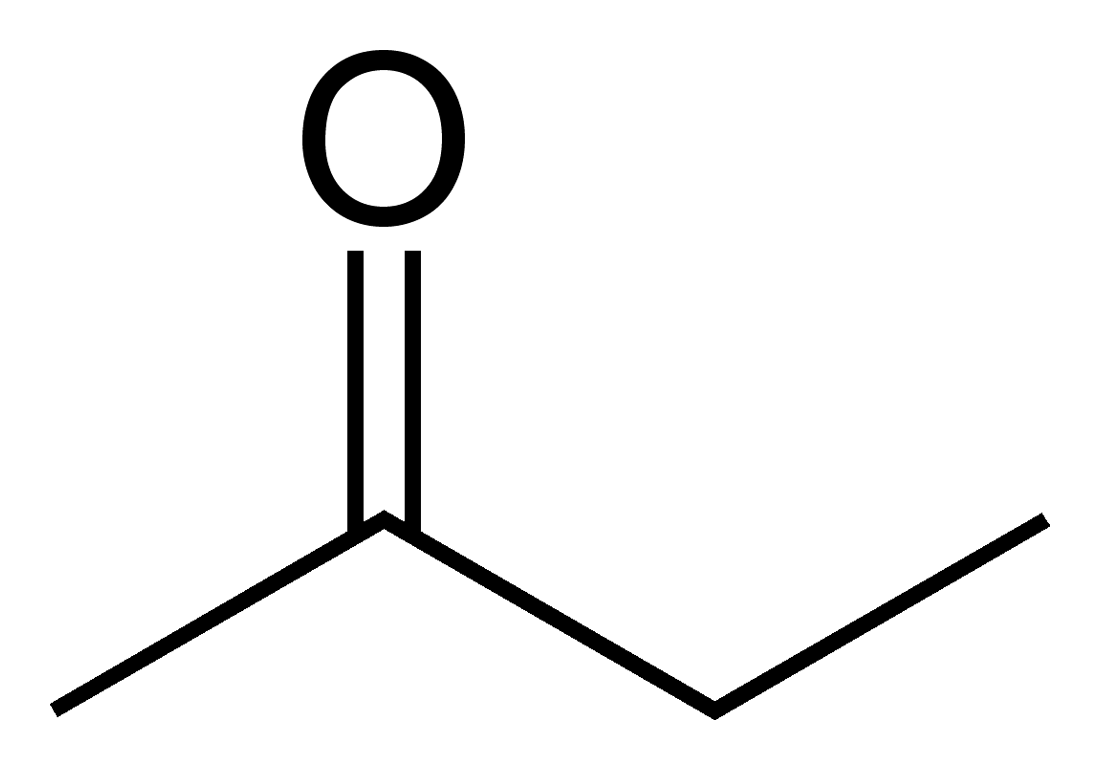
3. 구조 및 특성
카르보닐기는 산소의 전기음성도가 탄소보다 커서 극성을 띤다. 따라서 케톤은 산소에서 친핵성이고 탄소에서 친전자성이다. 카르보닐기는 수소 결합을 통해 물과 상호 작용하기 때문에 케톤은 일반적으로 관련 메틸렌 화합물보다 물에 더 잘 용해된다. 케톤은 수소 결합 수용체이지만, 일반적으로 수소 결합 주개가 아니며 스스로 수소 결합을 할 수 없다. 수소 결합 주개와 수용체 역할을 모두 할 수 없어 "자기 회합"을 하지 않는 경향이 있으며, 비슷한 분자량의 알코올과 카르복실산보다 휘발성이 높다. 이러한 특성으로 인해 케톤은 향수 및 용매로 널리 사용된다. 카르보닐기의 극성 때문에 저분자량 케톤은 극성 용매와 비극성 용매 모두에서 용해도가 좋다.
3. 1. 케톤의 종류
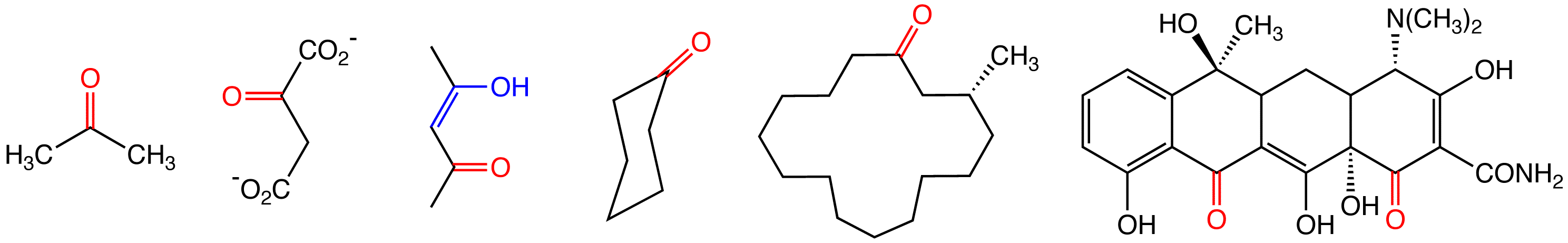
케톤은 치환기에 따라 분류된다. 카르보닐 중심에 결합된 두 유기 치환기의 동일성 여부에 따라 대칭 및 비대칭 케톤으로 나뉜다. 아세톤과 벤조페논은 대칭 케톤이고, 아세토페논은 비대칭 케톤이다.
다양한 종류의 다이케톤이 알려져 있으며, 그중 일부는 특이한 성질을 가지고 있다. 가장 간단한 예는 다이아세틸이며, 한때 팝콘의 버터 향으로 사용되었다. 아세틸아세톤(펜탄-2,4-다이온)은 사실상 부적절한 이름인데, 이 화합물은 주로 모노엔올 형태로 존재하기 때문이다. 아세틸아세톤의 에놀레이트는 배위화학에서 흔히 사용되는 리간드이다.
알켄과 알킨 단위를 포함하는 케톤은 불포화 케톤이라고 부르는 경우가 많다. 이 종류의 화합물에서 널리 사용되는 것은 메틸 비닐 케톤으로, α,β-불포화 카르보닐 화합물이다.
많은 케톤은 고리형이다. 가장 간단한 고리형 케톤은 (CH2)''n''CO의 화학식을 가지는데, 여기서 ''n''은 시클로프로판온(n=2)부터 10 이상까지 다양하다. 사이클로헥사논은 대칭적인 고리형 케톤으로, 나일론 생산에 중요한 중간체이다. 아세톤에서 유도된 이소포론은 불포화 비대칭 케톤으로 다른 폴리머의 전구체이다. 사향(muscone), 3-메틸펜타데카논은 동물 페로몬이다. 또 다른 고리형 케톤으로는 시클로부타논이 있다.
4. 특성 분석
케톤은 적외선 분광법에서 1750 cm⁻¹ 근처에서 강하게 흡수되며, 이는 카르보닐 신축 진동(νC=O) 때문이다. 아릴 및 불포화 케톤의 경우 피크 에너지가 더 낮다.[6]
¹H NMR 분광법은 케톤의 존재를 확인하는 데 유용하지 않지만, ¹³C NMR 스펙트럼은 구조에 따라 200 ppm보다 약간 저자장 쪽에 신호를 나타낸다. 이러한 신호는 핵 오버하우저 효과가 없기 때문에 일반적으로 약하다. 알데히드와 케톤을 명확하게 구별하기 위해 다중 공명 실험을 사용한다.
케톤은 브래디 시험에서 양성 반응을 나타내는데, 이는 2,4-디니트로페닐히드라진과 반응하여 해당 히드라존을 생성하기 때문이다. 톨렌스 시약 또는 펠링 용액에 대해 음성 반응을 나타내는 것으로 알데히드와 구별할 수 있다. 메틸 케톤은 요오드포름 시험에서 양성 반응을 나타낸다.[7] 묽은 수산화나트륨 존재 하에 ''m''-디니트로벤젠으로 처리하면 보라색으로 변색되어 양성 반응을 나타낸다.
환원성을 갖지 않는 케톤은 은거울 반응이나 펠링 반응을 일으키지 않는다. 하지만 당의 케토스는 케톤 구조를 가지고 있음에도 불구하고 환원성을 가지기 때문에, 이 방법으로 알도스와 구별할 수는 없다. 메틸케톤 구조의 검출을 위해서는 요오드포름 반응을 이용할 수 있다.
박층 크로마토그래피에서는 2,4-디니트로페닐히드라진을 발색 시약으로 사용함으로써 검출할 수 있다.
5. 합성법
:
아실 할라이드와 길만 시약을 반응시키면 커플링에 의해 케톤이 생성된다.[8]
:
아실 할라이드나 에스터 등과 유기리튬 시약이나 그리냐르 시약 등의 친핵제를 반응시킴으로써 케톤이 생성된다.[16]
:
하지만 이 반응에서는 생성된 케톤이 더욱 친핵제와 반응함으로써 알코올로 변환된다. 이 부반응을 막기 위해, 와인레브 아마이드를 중간체로 거치는 '''케톤 합성법'''이 알려져 있다.
프리델-크래프츠 반응에 의한 아실화로 방향족 케톤을 얻을 수 있다.[11]
:
알켄을 오존 분해하면 2분자의 케톤이 얻어진다.[13]
그 외, 케톤을 생성하는 명명 반응으로는 피나콜 전위, 만니히 반응, 클라이젠 전위 등이 있다.
이 외에도 다음과 같은 방법들이 개발되었다.[8]
6. 반응
케톤은 다양한 친핵성 첨가 반응을 보인다. 친핵성 첨가 반응의 일반적인 순서는 다음과 같다.[8]
- 물과의 반응(수화)은 일반적으로는 관찰이 힘들지만, 반응을 통해 젬디올을 생성한다.
- 아세틸리드와의 반응은 α-히드록시알킨을 생성한다.
- 암모니아 또는 1차 아민과의 반응은 이민을 생성한다.
- 2차 아민과의 반응은 에나민을 생성한다.
- 그리냐르 시약 및 유기리튬 시약과의 반응은 수성 후처리 후 3차 알코올을 생성한다.
- 알코올 또는 알콕사이드와의 반응은 헤미케탈 또는 그 짝염기를 생성한다. 다이올과의 반응은 케탈을 생성한다. 이 반응은 케톤을 보호하는 데 사용된다.
- 소듐 아마이드와의 반응은 아마이드 RCONH2와 알칸 또는 아렌 R'H의 생성을 수반하는 C-C 결합 절단을 초래하는데, 이 반응을 할러-바우어 반응이라고 한다.[21]
- 친전자성 첨가 반응에서 친전자체와 반응하여 공명 안정화된 카르보 양이온을 생성한다.
- 비티히 반응에서 포스포늄 일라이드와 반응하여 알켄을 생성한다.
- --
- 티올과 반응하여 티오아세탈을 생성한다.
- 히드라진 또는 히드라진의 1-이치환 유도체와 반응하여 히드라존을 생성한다.
- 금속 수소화물과 반응하여 금속 알콕사이드 염을 생성하고, 이것을 가수분해하면 알코올을 생성하는데, 이는 케톤 환원의 한 예이다.
- 할로젠과 반응하여 α-할로케톤을 형성하는데, 이 반응은 에놀을 통해 진행된다(할로폼 반응 참조).
- 중수와 반응하여 α-중수소화 케톤을 생성한다.
- 광화학적 노리시 반응에서 분해된다.
- 1,4-아미노디케톤이 탈수 반응을 통해 옥사졸을 생성하는 로빈슨-가브리엘 합성 반응.
- 아릴-알킬 케톤의 경우, 황과 아민과 반응하여 윌거로트 반응에 의해 아마이드를 생성한다.
- 하이드록실아민과 반응하여 옥심을 생성한다.
- 환원제와 반응하여 2차 알코올을 형성한다.
강한 산화제와 고온에서 케톤은 분해된다. 케톤의 산화는 탄소-탄소 결합의 절단을 수반하며, 모체 케톤보다 탄소 원자 수가 적은 카르복실산의 혼합물을 생성한다.
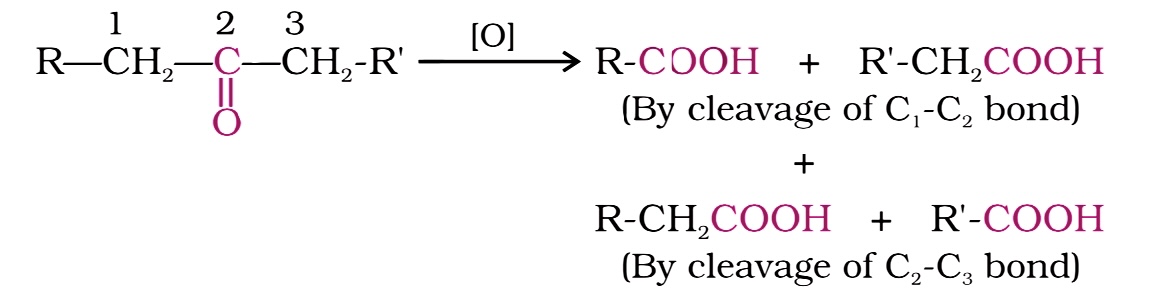
- 과산화산과 반응하여 바이어-빌리거 산화를 통해 에스터를 형성한다.
화학적으로는 비교적 안정적이지만, 그리냐르 시약이나 유기리튬 등 친핵성이 강한 유기금속과는 반응하여, 이어서 산으로 가수분해하면 3차 알코올이 얻어진다.
:R-C(=O)-R' + R''MgBr → RR'R''C-OH (가수분해 후)
또한, 수소화알루미늄리튬이나 보란 등으로 환원하면 2차 알코올이 된다.
:R-C(=O)-R' + LiAlH4 등 → RR'CH-OH
클레멘젠 환원이나 울프-키쉬너 환원에서는 메틸렌 화합물 R-CH2-R'이 된다.
:--
산 촉매 하에 2분자의 알코올과 탈수 축합시키면 아세탈이 얻어지며, 이것은 케톤의 보호법의 하나이다.
:R-C(=O)-R' + 2 R''OH + H+ → RR'C(OR'')2
그 외, 알돌 축합, 바이어-빌리거 산화, 슈미트 반응, 빌게로트 반응 등 케톤을 기질로 하는 화학 반응은 많다.
7. 생화학
케톤은 표준 아미노산, 핵산 또는 지질에는 나타나지 않는다. 광합성에서 유기 화합물의 형성은 케톤 리불로스-1,5-비스포스페이트를 통해 일어난다. 많은 당은 케톤이며, 이들은 총칭하여 케토스로 알려져 있다. 가장 잘 알려진 케토스는 프룩토스이며, 대부분 고리형 헤미케탈로 존재하여 케톤 작용기를 가린다. 지방산 합성은 케톤을 통해 진행된다. 아세토아세테이트는 크렙스 회로의 중간체로서 당과 탄수화물로부터 에너지를 방출한다.[22]
의학에서 아세톤, 아세토아세테이트, 그리고 베타-하이드록시뷰티레이트는 인간을 포함한 대부분의 척추동물에서 탄수화물, 지방산, 그리고 아미노산으로부터 생성되는 케톤체라고 총칭된다. 케톤체는 밤잠을 포함한 단식 후 혈액(케톤혈증)에서 수치가 높아지며, 기아 상태에서는 혈액과 소변 모두에서 수치가 높아진다. 또한 저혈당증(고인슐린혈증 이외의 원인으로 인한 경우), 다양한 선천성 대사 이상, 케토제닉 식단을 통해 의도적으로 유도된 경우, 그리고 케톤산증(보통 당뇨병으로 인한 경우)에서도 수치가 높아진다. 케톤산증은 보상되지 않거나 치료되지 않은 제1형 당뇨병의 특징이지만, 어떤 상황에서는 제2형 당뇨병에서도 케톤혈증 또는 케톤산증이 발생할 수 있다.
가장 단순한 케톤은 아세톤(프로판온)이며, 공업적으로는 쿠멘법으로 생산된다. 당뇨병에 걸렸을 때 배출되는 케톤은 주로 아세톤이다. 이것은 당이나 지방을 대사하는 과정에서 자연적으로 생성되는 것으로, 과도하게 생성되면 혈중에 배출되어 독성을 나타낸다. 이를 예방하려면 대사를 개선하는 것이 필요하다.
8. 응용
케톤은 아세톤, 메틸에틸케톤, 시클로헥사논과 같이 용매, 중합체 전구체, 의약품 등으로 산업에서 대량으로 생산된다.[23] 생화학에서도 일반적인 유기화학보다는 덜하지만 흔하게 나타난다. 탄화수소의 연소는 케톤뿐만 아니라 여러 다른 종류의 화합물을 생성하는 제어되지 않은 산화 과정이다.
9. 독성
단순 케톤은 일반적으로 독성이 높지 않다. 이러한 특징 때문에 케톤은 용매로 널리 사용된다.[23] 그러나 불포화 케톤은 예외인데, 메틸 비닐 케톤과 같은 케톤은 LD50이 7mg/kg (경구)이다.[23]
가장 단순한 케톤은 아세톤(프로판온)이며, 당뇨병에 걸렸을 때 배출되는 케톤은 주로 아세톤이다. 이것은 당이나 지방을 대사하는 과정에서 자연적으로 생성되는 것으로, 과도하게 생성되면 혈중에 배출되어 독성을 나타낸다.
10. 주요 화합물
참조
[1]
서적
General Organic and Biological Chemistry
Wiley
[2]
웹사이트
ketone
[3]
문서
Handbuch der organischen Chemie: Organische Chemie im Allgemeinen
Karl Winter
[4]
웹사이트
List of retained IUPAC names
http://www.acdlabs.c[...]
2023-07-09
[5]
서적
Organic Chemistry
Wadsworth
[6]
학술지
The C=O Bond, Part VIII: Review
https://www.spectros[...]
2018-11-00
[7]
서적
Vogel's Quantitative Chemical Analysis
Prentice Hall
[8]
서적
Advanced Organic Chemistry: Reactions, Mechanisms, and Structure
https://books.google[...]
Wiley-Interscience
2007
[9]
학술지
Benzophenone
1928-00-00
[10]
서적
Vogel's Textbook of Practical Organic Chemistry
https://archive.org/[...]
Longman Science & Technical
[11]
학술지
Desoxybenzoin
1932-00-00
[12]
학술지
Phloroacetophenone
1935-00-00
[13]
학술지
Dialkyl Mesoxalates by Ozonolysis of Dialkyl Benzalmalonates: Dimethyl Mesoxalate
1993-00-00
[14]
학술지
o-Methoxyphenylacetone
1955-00-00
[15]
학술지
3-Acetamido-2-butanone
1953-00-00
[16]
학술지
ω-Methoxyacetophenone
1941-00-00
[17]
학술지
Cyclopentanone
1925-00-00
[18]
학술지
Phenylpyruvic acid
1939-00-00
[19]
웹사이트
Evans pKa table
https://web.archive.[...]
2005-11-04
[20]
서적
March's Advanced Organic Chemistry
Wiley
[21]
웹사이트
Haller–Bauer Reaction
https://web.archive.[...]
[22]
서적
Lehninger, Principles of Biochemistry
Worth Publishing
[23]
서적
Ullmann's Encyclopedia of Industrial Chemistry
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com