내재적인 감광성 망막 신경절 세포
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
내재적인 감광성 망막 신경절 세포(ipRGC)는 망막 전체와 뇌로 투사되는 광수용체 세포로, 빛에 반응하여 탈분극화하여 신경 임펄스 발화 속도를 증가시킨다. 이 세포는 광색소 멜라놉신을 함유하며, 시냅스를 통해 생체 시계 조절, 동공 빛 반사, 멜라토닌 분비 억제 등 다양한 기능을 수행한다. ipRGC는 1923년 발견되었으며, 2002년 멜라놉신 발현 신경절 세포임이 확인되었다. 최근에는 인간 대상 연구를 통해 이 세포가 편두통 발작 중 빛에 의한 두통 악화에도 연루되어 있음이 밝혀졌다.
더 읽어볼만한 페이지
- 인간 눈 해부학 - 무축삭 세포
무축삭 세포는 망막 내부에서 양극 세포와 망막 신경절 세포 간의 시냅스 연결을 조절하며, 연결 영역, 내부 얼기층 위치, 신경 전달 물질 종류에 따라 분류되고, 다양한 기능을 수행한다. - 인간 눈 해부학 - 마이봄샘
마이봄샘은 눈꺼풀에 위치한 피지샘으로, 눈물막의 지질층을 생성하여 눈물막 안정화, 눈물 증발 억제, 눈 표면 윤활 작용 등의 기능을 수행하며, 기능 이상은 안구 건조증과 안검염을 유발하여 다양한 치료법이 사용되고, 사회적 인식 개선과 정책적 지원 노력이 이루어지고 있다. - 활동일 주기 - 시차증
시차증은 여러 시간대 이동으로 생체리듬이 깨지면서 수면 장애, 소화 불량, 두통, 피로 등을 유발하는 현상이며, 빛 노출 조절, 멜라토닌 복용 등으로 관리하고 조울증 재발 및 자살률에도 영향을 미칠 수 있다. - 활동일 주기 - 주행성
주행성은 낮에 활동하고 밤에 휴식을 취하는 생활 방식으로, 빛, 온도, 먹이, 포식자와 같은 요인들의 영향을 받으며, 초기 동물들의 주요 생활 방식이었으나 야행성으로 진화한 종들도 있고, 기술 분야에서도 활용되는 용어이다.
2. 구조
2. 1. ipRGC 수용체
이러한 광수용체 세포는 망막 전체와 뇌로 투사된다. 이들은 세포막을 따라, 시신경 유두까지 이르는 축삭, 세포의 세포체 및 수상돌기를 포함하여 다양한 양의 광색소 멜라놉신을 함유하고 있다.[3] ipRGC는 신경전달물질 글루탐산, 글리신, GABA에 대한 막 수용체를 가지고 있다.[11] 광수용성 신경절 세포는 빛에 반응하여 탈분극화하여 신경 임펄스 발화 속도를 증가시키는데, 이는 빛에 반응하여 과분극화하는 다른 광수용체 세포와 반대이다.[10]
생쥐를 대상으로 한 연구 결과에 따르면 ipRGC의 축삭은 비수초화되어 있다.[3]
2. 2. 멜라놉신
다른 광수용체 색소와 달리, 멜라놉신은 흥분성 광색소이자 광 이성질화 효소로 작용할 수 있다.[11] 간상 세포와 원추 세포의 시각 옵신과는 달리, 멜라놉신은 모든 ''트랜스''-레티날을 감광성 ''11-시스''-레티날로 재충전하기 위해 표준 시각 주기에 의존하는 반면, 다른 광자에 의해 자극을 받으면 ''all-trans-''레티날을 ''11-시스-''레티날로 직접 이성질화할 수 있다.[11] 따라서 내재적인 감광성 망막 신경절 세포(ipRGC)는 이러한 변환을 위해 뮬러 세포 및/또는 망막 색소 상피 세포에 의존하지 않는다.멜라놉신의 두 가지 이소형은 스펙트럼 감도에서 차이를 보이는데, ''11-시스''-레티날 이소형은 짧은 파장의 빛에 더 잘 반응하고 ''all-trans'' 이소형은 긴 파장의 빛에 더 잘 반응한다.[12]
2. 3. 시냅스 입력 및 출력
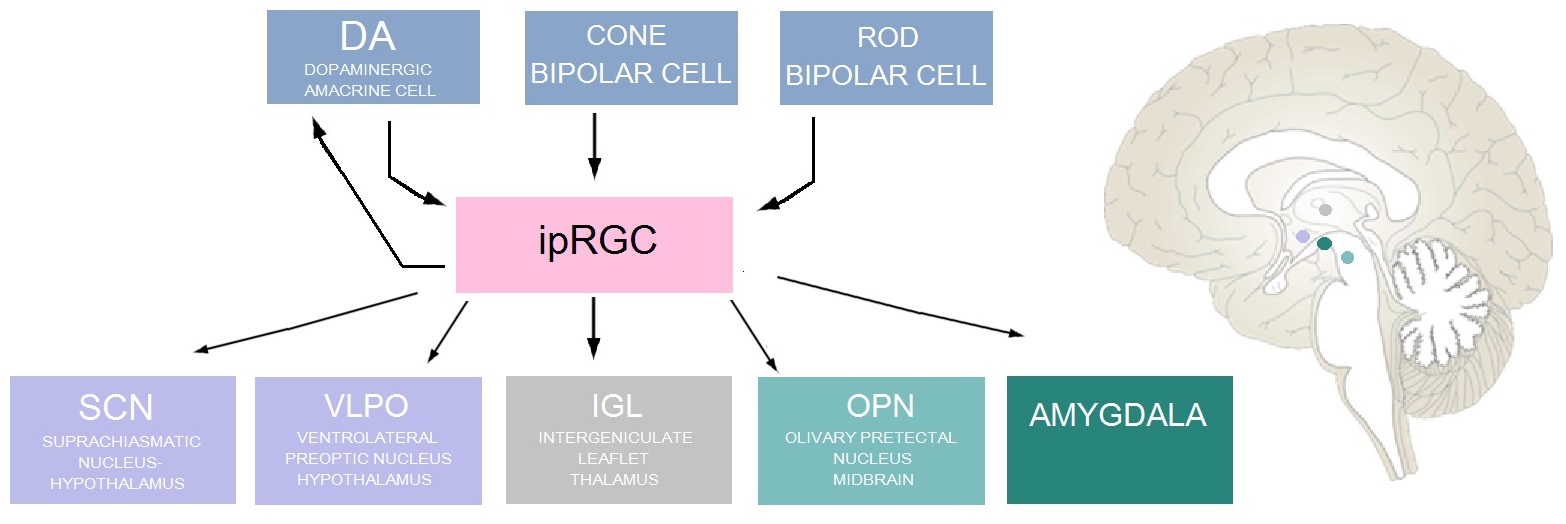
ipRGC는 흥분성 신호를 DA 세포로 보내고, DA 세포는 ipRGC로 억제성 신호를 보내는 상호 시냅스를 통해 도파민성 무축삭 세포 (DA 세포)의 전-및 후 시냅스 둘 다에 해당한다. 이러한 억제 신호는 DA 세포에서 GABA와 도파민이 함께 방출되면서 매개된다. 도파민은 ipRGC에서 멜라놉신 전사를 상향 조절하여 광수용체의 민감도를 증가시킴으로써 빛 적응 과정에서 기능을 수행한다.[3] DA 무축삭 세포 억제와 함께, DA 무축삭 세포에 의해 억제되는 소마토스타틴 방출 무축삭 세포는 ipRGC를 억제한다.[13] ipRGC 수상돌기에 대한 다른 시냅스 입력에는 원추 양극 세포와 간상 양극 세포가 포함된다.[11]
ipRGC의 한 가지 시냅스 후 표적은 유기체의 생체 시계 역할을 하는 시상 하부의 시교차상핵(SCN)이다. ipRGC는 망막시상하부로 (RHT)라고 불리는 단일 시냅스 연결을 통해 뇌하수체 아데닐릴 사이클라제 활성화 단백질(PACAP)과 글루탐산을 SCN에 방출한다.[14] 글루탐산은 SCN 뉴런에 흥분 효과를 미치며, PACAP는 시상 하부에서 글루탐산의 효과를 향상시키는 것으로 보인다.[15]
ipRGC의 다른 시냅스 후 표적에는 다음과 같은 것들이 있다. 시상에 위치한 뉴런 덩어리인 간상핵 엽 (IGL)은 일주기 리듬 동조에 관여한다. 중뇌에 있는 뉴런 덩어리인 올리브전개막핵(OPN)은 동공의 빛 반사를 제어한다. 시상 하부에 위치한 전외측 시상전야핵(VLPO)은 수면의 제어 중심이다. 편도체.[3]
2. 3. 1. 입력
ipRGC는 흥분성 신호를 DA 세포로 보내고, DA 세포는 ipRGC로 억제성 신호를 보내는 상호 시냅스를 통해 도파민성 무축삭 세포 (DA 세포)의 전-및 후 시냅스 둘 다에 해당한다. 이러한 억제 신호는 DA 세포에서 GABA와 도파민이 함께 방출되면서 매개된다. 도파민은 ipRGC에서 멜라놉신 전사를 상향 조절하여 광수용체의 민감도를 증가시킴으로써 빛 적응 과정에서 기능을 수행한다.[3] DA 무축삭 세포 억제와 함께, DA 무축삭 세포에 의해 억제되는 소마토스타틴 방출 무축삭 세포는 ipRGC를 억제한다.[13] ipRGC 수상돌기에 대한 다른 시냅스 입력에는 원추 양극 세포와 간상 양극 세포가 포함된다.[11]2. 3. 2. 출력
ipRGC의 한 가지 시냅스 후 표적은 유기체의 생체 시계 역할을 하는 시상 하부의 시교차상핵(SCN)이다. ipRGC는 망막시상하부로 (RHT)라고 불리는 단일 시냅스 연결을 통해 뇌하수체 아데닐릴 사이클라제 활성화 단백질(PACAP)과 글루탐산을 SCN에 방출한다.[14] 글루탐산은 SCN 뉴런에 흥분 효과를 미치며, PACAP는 시상 하부에서 글루탐산의 효과를 향상시키는 것으로 보인다.[15]ipRGC의 다른 시냅스 후 표적에는 다음과 같은 것들이 있다. 시상에 위치한 뉴런 덩어리인 간상핵 엽 (IGL)은 일주기 리듬 동조에 관여한다. 중뇌에 있는 뉴런 덩어리인 올리브전개막핵(OPN)은 동공의 빛 반사를 제어한다. 시상 하부에 위치한 전외측 시상전야핵(VLPO)은 수면의 제어 중심이다. 편도체.[3]
3. 기능
3. 1. 일주기 리듬 조절
3. 2. 동공 빛 반사
연구자들은 다양한 광수용체 녹아웃 마우스를 사용하여 일시적 및 지속적 동공 빛 반사(PLR) 신호 전달에서 ipRGC의 역할을 확인했다.[16] 일시적인 PLR은 어둡거나 보통 밝기의 빛 강도에서 발생하며, ipRGC에 시냅스 입력을 제공하는 막대 세포에서 발생하는 광변환의 결과이며, 이는 차례로 정보를 중간뇌의 올리브전개측핵으로 전달한다.[17] 일시적 PLR에서 ipRGC에서 중간뇌로 정보를 전달하는 데 관련된 신경 전달 물질은 글루탐산이다. 더 밝은 빛 강도에서는 지속적인 PLR이 발생하며, 이는 ipRGC에 입력을 제공하는 막대 세포의 광변환과 멜라놉신을 통한 ipRGC 자체의 광변환을 모두 포함한다. 연구자들은 멜라놉신이 적응을 보이는 막대 세포와는 대조적으로 빛 자극에 대한 적응이 부족하기 때문에 멜라놉신이 지속적인 PLR에서 역할을 한다고 제안했다. 지속적인 PLR은 ipRGC에서 뇌하수체 아데닐산 시클라제 활성화 펩타이드(PACAP)가 맥동 방식으로 방출되어 유지된다.[16]
3. 3. 멜라토닌 분비 억제
대부분의 연구에서 수용체의 최대 스펙트럼 감도는 460~484 nm 사이에 있는 것으로 나타났다. 2003년 Lockley 등의 연구[18]에서는 460 nm(파란색) 파장의 빛이 555 nm(녹색) 빛보다 멜라토닌을 두 배 더 억제하는 것으로 나타났는데, 이는 명소시 시각 시스템의 최대 감도에 해당한다. 막대세포와 원뿔세포가 없는 인간을 대상으로 한 Zaidi, Lockley 등의 연구에서는 매우 강렬한 481 nm 자극이 약간의 의식적인 빛 인지로 이어져 기본적인 시각이 실현되었다.[8]3. 4. 이미지 형성 시각 (가능성)
2007년, 파란색 빛에 주로 반응하는 내재적인 감광성 망막 신경절 세포(ipRGCs)가 인간의 망막 신경절 세포 광수용체가 의식적인 시각뿐만 아니라, 일주기 리듬, 행동, 동공 반응과 같은 비영상 형성 기능에도 기여한다는 연구 결과가 발표되었다.[8] 이는 중간 시각에 대한 기존 이론이 단순하다는 것을 시사한다. 자이디(Zaidi)와 동료들의 막대 없는, 원뿔 없는 인간 피험자들에 대한 연구는 신경절 세포 광수용체의 영상 형성(시각) 역할에 대한 가능성을 제시했다.[8]시각에 대한 병렬 경로, 즉 외측 망막에서 발생하는 고전적인 막대 및 원뿔 기반 경로와 내측 망막에서 발생하는 기본적인 시각적 밝기 감지기가 존재한다는 것이 밝혀졌다. 기본적인 시각 밝기 감지기는 고전 경로보다 먼저 빛에 의해 활성화되는 것으로 보인다.[8] 고전적인 광수용체는 새로운 광수용체 시스템에 정보를 제공하며, 색상 항상성에 중요한 역할을 할 수 있다.
막대와 원뿔이 없는 인간 모델 연구 저자들은 이 수용체가 녹내장과 같이 전 세계적으로 실명의 주요 원인이 되는 질병을 이해하는 데 기여할 수 있다고 제안했다.
다른 포유류에서 광감성 신경절은 의식적인 시각에서 역할을 하는 것으로 입증되었다. 제니퍼 에커(Jennifer Ecker) 등의 실험에서 막대와 원뿔이 없는 쥐가 동일하게 발광하는 회색 화면 대신 일련의 수직 막대 쪽으로 헤엄치는 법을 배울 수 있다는 것을 발견했다.[7]
4. 발견
1923년, 클라이드 E. 킬러는 시각 장애가 있는 쥐의 눈동자가 빛에 반응하는 것을 관찰했다.[2] 막대 세포와 원뿔 세포가 없는 쥐가 동공 반사를 유지하는 것은 추가적인 광수용체 세포가 있음을 시사했다.[11]
1980년대에는 막대 세포와 원뿔 세포가 결핍된 쥐에 대한 연구를 통해 망막에서 도파민 조절이 밝혀졌는데, 이는 빛 적응과 광주기 조절에 알려진 신경 조절 물질이다.[3]
1991년, 러셀 G. 포스터와 이그나시오 프로벤시오를 포함한 연구진은 막대 세포와 원뿔 세포가 광주기 조절, 즉 일주기 리듬의 시각적 동인이나, 막대 세포와 원뿔 세포가 제거된 쥐를 통해 송과체에서 멜라토닌 분비를 조절하는 데 필요하지 않다는 것을 보여주었다.[19][11] 이후 프로벤시오와 동료들의 연구는 이러한 광 반응이 망막의 신경절 세포층에 존재하는 광색소 멜라놉신에 의해 매개된다는 것을 보여주었다.[20]
2002년, 사머 하타르, 데이비드 버슨과 동료들에 의해 광수용체가 확인되었는데, 이들은 고유의 빛 반응을 가지고 있으며 비 이미지 형성 시각과 관련된 여러 뇌 영역으로 투사되는 멜라놉신 발현 신경절 세포임이 밝혀졌다.[21][22]
2005년, 판다, 멜리안, 큐 및 동료들은 멜라놉신 광색소가 신경절 세포의 광변환 색소임을 입증했다.[23][24] 데니스 데이시와 동료들은 구세계 원숭이의 한 종에서 멜라놉신을 발현하는 거대 신경절 세포가 외측 슬상핵(LGN)으로 투사된다는 것을 보여주었다.[25][26] 이전에는 중뇌(전개막 핵) 및 시상 하부(시교차상핵, SCN)로의 투사만 밝혀졌었다.
5. 연구 동향
5. 1. 인간 대상 연구
인간은 다른 동물과 달리, 연구자들이 윤리적으로 간상체와 원추 세포의 손실을 유발하여 신경절 세포를 직접 연구할 수 없었기 때문에, 수용체를 찾으려는 시도는 특별한 어려움을 제시했고 새로운 모델을 요구했다. 수년 동안, 인간의 수용체에 대한 추론만 가능했다.[8][27]2007년, 자이디와 동료들은 간상체와 원추 세포가 없는 인간에 대한 연구 결과를 발표하여, 이들이 빛의 비시각적 효과에 대한 정상적인 반응을 유지한다는 것을 보여주었다.[8][27] 인간의 비간상체, 비원추 세포 광수용체의 정체는 일부 다른 포유류의 간상체와 원추 세포가 없는 모델에서 이전에 보여진 바와 같이, 내측 망막의 신경절 세포로 밝혀졌다. 이 연구는 일반적인 간상체와 원추 세포 광수용체의 기능을 파괴했지만 신경절 세포의 기능은 보존된 희귀 질환을 가진 환자를 대상으로 수행되었다.[8][27] 간상체나 원추 세포가 없음에도 불구하고, 환자들은 멜라놉신 광색소와 일치하는 환경적, 실험적 빛에 대한 최대 스펙트럼 감도를 가지면서, 일주기 광동조화, 일주기 행동 패턴, 멜라토닌 억제, 그리고 동공 반응을 계속해서 나타냈다. 또한, 그들의 뇌는 이러한 주파수의 빛과 시각을 연관시킬 수 있었다. 임상의와 과학자들은 이제 새로운 수용체가 인간 질병과 실명에 미치는 역할을 이해하려 노력하고 있다.
내재적인 감광성 망막 신경절 세포는 편두통 발작 중 빛에 의한 두통 악화에도 연루되어 있다.[28]
5. 2. 질병 연관성 연구
5. 3. 한국의 연구 동향
참조
[1]
논문
Iris movements in blind mice
1927
[2]
논문
Blind Mice
1928-10
[3]
논문
Intrinsically photosensitive retinal ganglion cells
2010-10
[4]
논문
Effects of light on human circadian rhythms, sleep and mood.
[5]
논문
Photoreceptor adaptation in intrinsically photosensitive retinal ganglion cells
2005-12
[6]
논문
External light activates hair follicle stem cells through eyes via an ipRGC-SCN-sympathetic neural pathway
2018-07
[7]
논문
Melanopsin-expressing retinal ganglion-cell photoreceptors: cellular diversity and role in pattern vision
2010-07
[8]
논문
Short-wavelength light sensitivity of circadian, pupillary, and visual awareness in humans lacking an outer retina
2007-12
[9]
논문
Phototransduction in ganglion-cell photoreceptors
2007-08
[10]
논문
Photon capture and signalling by melanopsin retinal ganglion cells
2009-01
[11]
서적
Webvision: The Organization of the Retina and Visual System
https://www.ncbi.nlm[...]
University of Utah Health Sciences Center
1995-01-01
[12]
논문
Photic memory for executive brain responses
2014-04
[13]
논문
Parallel Inhibition of Dopamine Amacrine Cells and Intrinsically Photosensitive Retinal Ganglion Cells in a Non-Image-Forming Visual Circuit of the Mouse Retina
2015-12
[14]
논문
Selective deficits in the circadian light response in mice lacking PACAP
2004-11
[15]
논문
Light stimulates MSK1 activation in the suprachiasmatic nucleus via a PACAP-ERK/MAP kinase-dependent mechanism
2005-06
[16]
논문
A visual circuit uses complementary mechanisms to support transient and sustained pupil constriction
2016-09
[17]
논문
Human and macaque pupil responses driven by melanopsin-containing retinal ganglion cells
2007-03
[18]
논문
High sensitivity of the human circadian melatonin rhythm to resetting by short wavelength light
2003-09
[19]
논문
Circadian photoreception in the retinally degenerate mouse (rd/rd)
1991-07
[20]
논문
A novel human opsin in the inner retina
2000-01
[21]
논문
Phototransduction by retinal ganglion cells that set the circadian clock
2002-02
[22]
논문
Melanopsin-containing retinal ganglion cells: architecture, projections, and intrinsic photosensitivity
2002-02
[23]
논문
Illumination of the melanopsin signaling pathway
2005-01
[24]
논문
Induction of photosensitivity by heterologous expression of melanopsin
2005-02
[25]
논문
Melanopsin-expressing ganglion cells in primate retina signal colour and irradiance and project to the LGN
2005-02
[26]
논문
Strange vision: ganglion cells as circadian photoreceptors
2003-06
[27]
논문
How blind people see sunrise and sunset
https://www.newscien[...]
[28]
논문
A neural mechanism for exacerbation of headache by light
[29]
논문
Iris movements in blind mice
https://archive.org/[...]
1927
[30]
논문
Blind Mice
1928-10
[31]
논문
Intrinsically photosensitive retinal ganglion cells
2010-10
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
