고리형 구아노신 일인산
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
고리형 구아노신 일인산(cGMP)은 세포 조절에 관여하는 물질로, 1960년대에 합성된 이후 연구가 진행되었다. cGMP는 구아닐산 시클라제에 의해 합성되며, 일산화 질소(NO)에 의해 활성화되는 가용성 구아닐산 시클라제(sGC)와 심방성 나트륨 이뇨 펩타이드에 의해 활성화되는 막 결합형 구아닐산 시클라제가 관여한다. cGMP는 이온 채널 전도, 글리코겐 분해, 세포 자멸사, 혈소판 억제 등 다양한 기능을 조절하며, 혈관 확장, 시각 광수용 과정, 신경 발생, 장기 기억 강화에도 관여한다. cGMP 신호 전달 경로는 심혈관 질환, 주요 우울 장애, 감염성 질환 등 다양한 병리학적 상태와 관련이 있으며, PDE(포스포다이에스터레이스)에 의해 분해된다. PDE 억제제는 cGMP의 효과를 향상시키며, 단백질 키나아제 G(PKG)를 활성화하여 세포 과정에 기여한다.
더 읽어볼만한 페이지
- 고리형 뉴클레오타이드 - 고리형 아데노신 일인산
고리형 아데노신 일인산(cAMP)은 2차 신호전달자로서 세포 외부 신호를 세포 내부로 전달하며, 아데닐산 고리화효소에 의해 ATP로부터 합성되고 포스포다이에스터레이스에 의해 AMP로 분해되며, 단백질 인산화 효소 A(PKA)를 활성화하여 다양한 생화학적 과정, 특히 글리코겐, 당, 지질 대사를 조절한다. - 고리형 뉴클레오타이드 - 고리형 다이-아데노신 일인산
고리형 다이-아데노신 일인산(c-di-AMP)은 세균과 진핵 세포에서 발견되는 신호 분자로, 세균에서는 세포벽 전구체 생합성 조절, 세포 용해 조절, RNA 합성 억제, 알람 호르몬 생성 자극 등 다양한 기능에 관여하며, 진핵 세포에서는 STING 경로를 활성화하여 면역 반응을 조절하고, CdaA 효소에 의해 합성되고 GImM 효소에 의해 분해되어 농도가 조절된다. - 인산 에스터 - 아데노신 삼인산
아데노신 삼인산(ATP)은 아데닌, 리보스, 세 개의 인산기로 구성된 뉴클레오티드로서, 고에너지 인산 결합의 가수분해를 통해 에너지를 방출하여 세포 과정에 사용되는 생명체의 주요 에너지 저장 및 전달 분자이며, 다양한 대사 경로를 통해 생성 및 재생될 뿐만 아니라 세포 신호 전달과 DNA 및 RNA 합성에도 필수적인 역할을 한다. - 인산 에스터 - 글리세르알데하이드 3-인산
글리세르알데하이드 3-인산(G3P)은 해당과정, 광합성, 오탄당 인산 경로와 같은 여러 대사 과정에서 중요한 역할을 하는 삼탄당 인산으로, 과당 1,6-이중인산 등으로부터 생성되거나 캘빈 회로에서 리불로스 1,5-이중인산 등으로부터 생성되며 트립토판 및 티아민 생합성에도 관여하고 당뇨병과도 관련이 있다. - 뉴클레오타이드 - 아데노신 삼인산
아데노신 삼인산(ATP)은 아데닌, 리보스, 세 개의 인산기로 구성된 뉴클레오티드로서, 고에너지 인산 결합의 가수분해를 통해 에너지를 방출하여 세포 과정에 사용되는 생명체의 주요 에너지 저장 및 전달 분자이며, 다양한 대사 경로를 통해 생성 및 재생될 뿐만 아니라 세포 신호 전달과 DNA 및 RNA 합성에도 필수적인 역할을 한다. - 뉴클레오타이드 - 폴리뉴클레오타이드
폴리뉴클레오타이드는 DNA와 RNA를 구성하는 뉴클레오타이드가 연결된 고분자이며, 생물체의 게놈을 구성하고 생화학 실험, 의학 및 미용 분야에서 활용된다.
| 고리형 구아노신 일인산 - [화학 물질]에 관한 문서 | |
|---|---|
| 일반 정보 | |
 | |
 | |
| IUPAC 이름 | 구아노신 3',5'-(수소 인산) |
| 계통 이름 | 2-아미노-9-[(4aR,6R,7R,7aS)-2,7-다이하이드록시-2-옥소테트라하이드로-2H,4H-2λ5-푸로[3,2-d][1,3,2]다이옥사포스폴-6-일]-3,9-다이하이드로-6H-퓨린-6-온 |
| 다른 이름 | cGMP 3',5'-고리형 GMP 3':5'-고리형 GMP 구아노신 고리형 일인산 고리형 3',5'-GMP 구아노신 3',5'-고리형 인산 |
| 식별 정보 | |
| ChemSpider ID | 22734 |
| InChI | 1/C10H12N5O7P/c11-10-13-7-4(8(17)14-10)12-2-15(7)9-5(16)6-3(21-9)1-20-23(18,19)22-6/h2-3,5-6,9,16H,1H2,(H,18,19)(H3,11,13,14,17)/t3-,5-,6-,9-/m1/s1 |
| InChIKey | ZOOGRGPOEVQQDX-UUOKFMHZBB |
| ChEMBL | 395336 |
| 표준 InChI | 1S/C10H12N5O7P/c11-10-13-7-4(8(17)14-10)12-2-15(7)9-5(16)6-3(21-9)1-20-23(18,19)22-6/h2-3,5-6,9,16H,1H2,(H,18,19)(H3,11,13,14,17)/t3-,5-,6-,9-/m1/s1 |
| 표준 InChIKey | ZOOGRGPOEVQQDX-UUOKFMHZSA-N |
| CAS 등록번호 | 7665-99-8 |
| UNII | H2D2X058MU |
| PubChem | 24316 |
| IUPHAR 리간드 | 2347 |
| ChEBI | 16356 |
| SMILES | O=C4/N=C(/N)Nc1c4ncn1[C@@H]2O[C@@H]3COP(=O)(O[C@H]3[C@H]2O)O |
| MeSH 이름 | 고리형+GMP |
| 속성 | |
| 분자식 | C10H12N5O7P |
| 원소 조성 | C=10 H=12 N=5 O=7 P=1 |
| 위험성 | |
2. 역사
고리형 아데노신 일인산(cAMP)과 고리형 구아노신 일인산(cGMP)이 세포 구성 성분이며 세포 조절과 관련이 있을 수 있다는 사실이 밝혀진 후 cGMP에 대한 연구가 시작되었다.[4] 1960년에 cGMP가 합성된 후,[4] cGMP의 조절과 영향에 대한 이해가 빠르게 확산되었다. 얼 W. 서덜랜드는 cAMP와 2차 전달자 연구로 1971년 노벨 생리의학상을 수상했다. 이 상은 cAMP 연구에 대한 광범위한 연구를 촉발시켰지만, cGMP는 1980년대까지 생물학적 기능이 제대로 알려지지 않아 상대적으로 주목을 덜 받았다.[5]
구아닐산 시클라제(GC)는 cGMP 합성을 촉매한다. 이 효소는 GTP를 cGMP로 전환한다. 심방 나트륨 이뇨 펩타이드와 같은 펩타이드 호르몬은 막 결합형 GC를 활성화하고, 가용성 GC(sGC)는 일반적으로 일산화 질소에 의해 활성화되어 cGMP 합성을 자극한다. sGC는 ODQ(1H-[1,2,4]옥사디아졸로[4,3-a]퀴녹살린-1-온)에 의해 억제될 수 있다.[6]
cGMP는 이온 채널 전도, 글리코젠 분해, 세포 아폽토시스 및 혈소판 억제를 조절한다.[7] cGMP는 혈관 확장을 유도하여 혈류를 증가시키는 평활근 조직을 이완시킨다. cGMP는 신경 발생 및 신경 가소성과 관련되어 있으며, 선조체의 시냅스 전 종말에서 신경 전달 물질 방출의 효능을 제어한다.[7]
일산화 질소(NO)-고리형 구아노신 일인산(cGMP)-포스포다이에스터레이스(PDE) 경로는 심부전 치료법 개발의 표적이 되고 있다. cGMP 수치의 부족은 심근 섬유증, 혈관 수축, 염증과 같은 요인을 촉진하여 심혈관 질환을 악화시킨다.[11] 일부 가용성 구아닐산 사이클레이스(sGC) 자극제는 심혈관 질환 감소에 긍정적인 결과를 보였다.[11]
이 기간 동안, 두 가지 획기적인 발견을 통해 cGMP가 세포 신호 전달에서 중요한 역할을 한다는 사실이 밝혀졌다. 심방성 나트륨 이뇨 펩타이드(ANP)가 입자성 구아닐산 사이클레이스(pGC) 수용체를 통해 cGMP 합성을 자극한다는 사실과, 일산화 질소(NO)가 내피 유래 이완 인자로 확인되었으며, 가용성 구아닐산 사이클레이스(sGC)를 활성화하여 평활근 세포에서 혈관 확장을 매개하는 cGMP를 생성한다는 사실이 밝혀졌다.[5] 또한 cGMP를 분해하는 포스포다이에스터레이스(PDE) 및 cGMP 결합 단백질과 같은 cGMP와 관련된 추가적인 구성 요소들도 확인되었다.[5] 로버트 F. 퍼치고트, 루이스 J. 이그나로, 페리드 무라드가 NO-cGMP 경로에서 발견한 업적으로 1998년 노벨상을 수상하면서 cGMP 연구에 대한 관심이 다시 높아졌고, 2003년에는 제1회 cGMP 국제 컨퍼런스가 개최되었다.[5]
3. 합성
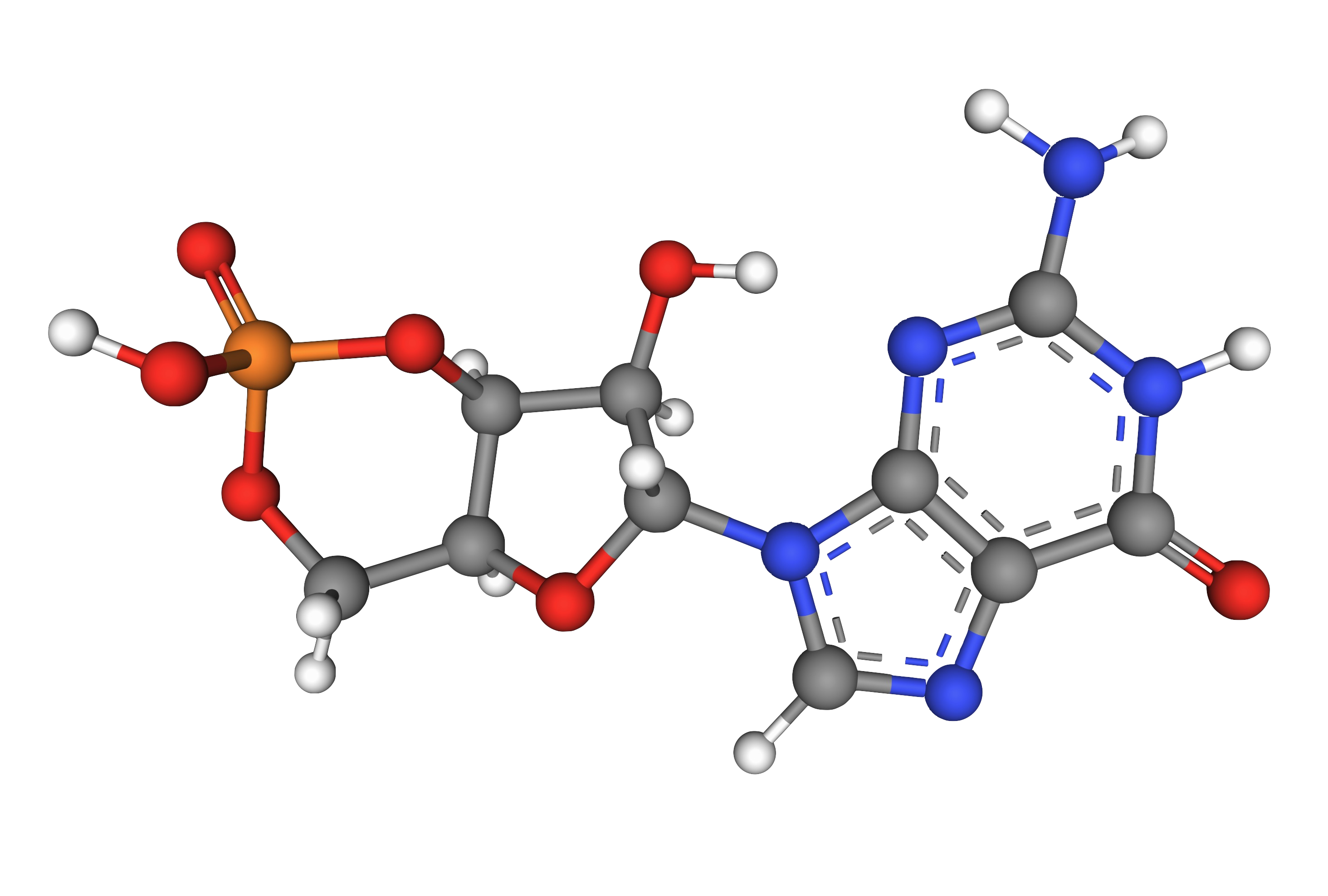
4. 기능
cGMP는 눈에서의 광전환 과정에서 이차 전달자로 작용한다. 포유류 눈의 광수용체에서 빛이 존재하면 포스포디에스터레이스가 활성화되어 cGMP를 분해한다. 광수용체의 나트륨 이온 채널은 cGMP에 의해 제어되므로 cGMP의 분해는 나트륨 채널이 닫히게 하여 광수용체의 세포막을 과분극시키고 궁극적으로 시각 정보가 뇌로 전달되게 한다.[8]
cGMP는 대뇌 피질 V층의 피라미드 세포 첨단 수상돌기가 세마포린-3A (Sema3a)로의 끌림을 매개한다.[9] 피라미드 세포의 축삭은 Sema3a에 의해 반발하지만, 첨단 수상돌기는 그것에 끌린다. 이러한 끌림은 첨단 수상돌기에 존재하는 가용성 구아닐산 시클라제 (sGC)의 증가된 수준에 의해 매개된다. sGC는 cGMP를 생성하여 Sema3a로의 끌림을 유발하는 일련의 화학적 활성화를 초래한다. 축삭에 sGC가 없으면 Sema3a로부터 반발하게 된다.
cGMP는 장기 기억 강화와 같은 냄새 자극에 대한 장기적인 세포 반응에 관여한다. 후각에서 cGMP는 막 구아닐릴 시클라제(mGC)와 가용성 구아닐릴 시클라제(sGC)에 의해 합성된다. 연구에 따르면 후각에서의 cGMP 합성은 신경 전달 물질인 일산화 질소에 의한 sGC 활성화 때문이다. cGMP는 또한 cAMP의 세포 내 수준 증가를 필요로 하며, 두 이차 전달자 사이의 연관성은 세포 내 칼슘 수준 상승 때문인 것으로 보인다.[10]
5. 병리학적 의의
cGMP 신호 전달 경로는 신경 가소성 조절에 중요한 역할을 하며, 이는 주요 우울 장애의 병태생리를 이해하는 데 있어 중요한 연구 분야이다.[13]
장독성 대장균(ETEC)과 같은 특정 병원체는 숙주 면역 방어를 회피하고 감염을 일으키기 위해 고리형 구아노신 일인산(cGMP)을 증가시킨다.[14]
5. 1. 심혈관 질환
일산화 질소(NO)-고리형 구아노신 일인산(cGMP)-포스포다이에스터레이스(PDE) 경로는 심부전 치료법 개발의 표적이 되었다. cGMP 수치의 부족은 심근 섬유증, 혈관 수축, 염증과 같은 요인을 촉진하여 심혈관 질환을 악화시킨다.[11] 일부 가용성 구아닐산 사이클레이스(sGC) 자극제는 심혈관 사건 감소에 긍정적인 결과를 보였다.[11]
주로 나트륨 이뇨 펩타이드(NP)가 아닌 일산화 질소(NO)에 의해 조절되는 상승된 혈장 cGMP 수치는 심부전, 죽상 동맥 경화성 심혈관 질환 및 관상 동맥 질환의 더 높은 위험과 상관관계가 있는 것으로 밝혀졌다.[12]
5. 2. 주요 우울 장애
cGMP 신호 전달 경로는 신경 가소성 조절에 중요한 역할을 하며, 이는 주요 우울 장애의 병태생리를 이해하는 데 있어 중요한 연구 분야이다.[13] 뇌 내 cGMP 신호 전달 경로는 세컨드 메신저 시스템으로 작동하여 신경전달물질 신호를 증폭시키고 유전자 발현과 신경 기능을 변화시킨다. 뉴런 내에서 cGMP 수치는 cGMP를 합성하는 구아닐산 사이클라제 효소와 cGMP를 분해하는 PDE에 의해 조절된다.[13]
구아닐산 사이클라제를 자극하거나 PDE를 억제하여 cGMP 수치를 높이면 신경 발생과 시냅스 신경 가소성이 촉진되는데, 특히 해마 및 전전두피질과 같이 주요 우울 장애와 관련된 뇌 영역에서 두드러진다.[13] 동물 연구에서도 만성적인 항우울제 치료가 이러한 영역에서 cGMP 수치를 증가시킬 수 있다는 것을 보여준다.[13] 유전학 연구는 또한 주요 우울 장애 감수성 및 치료 반응과 관련된 PDE 유전자의 특정 다형성을 강조해왔다.[13]
5. 3. 감염성 질환
장독성 대장균(ETEC)과 같은 특정 병원체는 숙주 면역 방어를 회피하고 감염을 확립하기 위해 고리형 구아노신 일인산(cGMP)을 증가시킨다.[14] 장독성 대장균의 내열성 독소는 장 상피 세포 내에서 상당한 고리형 구아노신 일인산 생산을 유도하며, 이 고리형 구아노신 일인산은 종종 세포 외 공간으로 분비되어 신호 분자 역할을 한다.[14] 세포 외 고리형 구아노신 일인산은 차례로 IL-33|인터류킨-33영어 방출을 유발하여 염증을 조절하고 효과적인 반응을 할 수 있는 면역 체계의 능력에 영향을 미쳐 선천성 및 적응 면역을 모두 약화시킨다.[14][15]
6. 분해
다수의 고리형 뉴클레오티드 포스포다이에스터레이스(PDE)는 cGMP를 가수분해하여 5'-GMP로 만든다. PDE 5, -6 및 -9는 cGMP 특이적이며, PDE1, -2, -3, -10 및 -11은 cAMP와 cGMP를 모두 가수분해할 수 있다. 포스포다이에스터레이스 억제제는 cGMP의 분해를 막아 그 효과를 향상시키거나 연장시킨다. 예를 들어, 실데나필(비아그라) 및 유사 약물은 PDE 5를 억제하여 음경 해면체 내에서 cGMP의 혈관 확장 효과를 향상시킨다.[16] 이는 발기 부전 치료에 사용된다. 그러나 이 약물은 망막에서 PDE6을 억제할 수 있다(PDE5보다 친화성이 낮지만). 이는 시각적 민감도의 손실을 초래하는 것으로 나타났지만, 물체가 이미 시각적 역치에 가까운 상태에서 가시성이 감소하는 경우를 제외하고는 일반적인 시각적 작업에 지장을 줄 가능성은 낮다.[16] 이러한 효과는 타다라필과 같은 다른 PDE5 억제제에 의해 대부분 회피된다.[17]
7. 단백질 키나아제 활성화
구아닐산 고리화 효소에 의해 고리형 구아노신 일인산(cGMP)이 생성되면서 cGMP 의존성 단백질 키나아제(PKG) 활성화 경로가 시작되며, 이는 산화 질소(NO) 또는 나트륨 이뇨 펩타이드와 같은 신호 분자에 의해 활성화될 수 있다. 증가된 cGMP 수치는 PKG(단백질 키나아제 G)와 같은 일부 단백질 의존성 키나아제의 활성화를 유도한다.[5] PKG는 하나의 촉매와 하나의 조절 단위로 구성된 단백질 이합체이며, 조절 단위는 촉매 단위의 활성 부위를 차단한다.
cGMP는 PKG의 조절 단위에 결합하여 촉매 단위를 활성화하여 기질을 인산화할 수 있게 한다. PKA를 포함한 다른 단백질 키나아제의 활성화와 달리, PKG는 활성화되어도 촉매 단위와 조절 단위는 분리되지 않는다.
PKG가 활성화되면 다양한 표적 단백질을 인산화하여 기능을 변경하고, 평활근 이완, 이온 채널 조절 및 혈소판 응집 억제와 같은 세포 과정에 기여한다. 이 경로는 또한 혈관 톤 및 혈압을 유지하는 데 도움이 되는 심혈관 생리학에서도 중요하다.[11]
참조
[1]
논문
Cyclic nucleotide-dependent protein kinases: intracellular receptors for cAMP and cGMP action
1999-08
[2]
논문
Molecular mechanism of cGMP-mediated smooth muscle relaxation
2000-09
[3]
논문
Urinary cGMP predicts major adverse renal events in patients with mild renal impairment and/or diabetes mellitus before exposure to contrast medium
2018-04-12
[4]
서적
A Short History of cGMP, Guanylyl Cyclases, and cGMP-Dependent Protein Kinases
http://link.springer[...]
Springer Berlin Heidelberg
2024-11-27
[5]
논문
cGMP signalling: from bench to bedside: Conference on cGMP Generators, Effectors and Therapeutic Implications
2006-02
[6]
논문
Potent and selective inhibition of nitric oxide-sensitive guanylyl cyclase by 1H-[1,2,4]oxadiazolo[4,3-a]quinoxalin-1-one
https://molpharm.asp[...]
1995-08
[7]
논문
Presynaptic cGMP sets synaptic strength in the striatum and is important for motor learning
2022-08
[8]
논문
The pharmacology of cyclic nucleotide-gated channels: emerging from the darkness
[9]
논문
Semaphorin 3A is a chemoattractant for cortical apical dendrites
2000-04
[10]
논문
Interplay among cGMP, cAMP, and Ca2+ in living olfactory sensory neurons in vitro and in vivo
2011-06
[11]
논문
Targeting Cyclic Guanosine Monophosphate to Treat Heart Failure: JACC Review Topic of the Week
https://linkinghub.e[...]
2020-10-13
[12]
논문
Cyclic Guanosine Monophosphate and Risk of Incident Heart Failure and Other Cardiovascular Events: the ARIC Study
2020-01-21
[13]
논문
cGMP Signaling, Phosphodiesterases and Major Depressive Disorder
http://www.eurekasel[...]
2011-12-01
[14]
논문
Elevated Extracellular cGMP Produced after Exposure to Enterotoxigenic Escherichia coli Heat-Stable Toxin Induces Epithelial IL-33 Release and Alters Intestinal Immunity
https://journals.asm[...]
2021-03-17
[15]
논문
Heat-Stable Enterotoxins of Enterotoxigenic Escherichia coli and Their Impact on Host Immunity
2019-01-08
[16]
논문
The effect of sildenafil citrate (Viagra) on visual sensitivity
2007-06
[17]
논문
The discovery of tadalafil: a novel and highly selective PDE5 inhibitor. 2: 2,3,6,7,12,12a-hexahydropyrazino[1',2':1,6]pyrido[3,4-b]indole-1,4-dione analogues
2003-10
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com